Instruções de Uso
Componente Femoral Cimentado
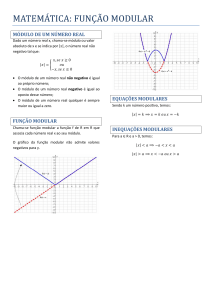
Legendas dos símbolos utilizados nas embalagens
Material
CrCo
Estéril R
Código do Produto
Evitar exposição direta à luz solar
Número de Lote
Manter Protegido de Umidade
Ler as Instruções de Uso
Cuidado - Frágil
ASTM F-75
Não utilizar se a embalagem estiver
violada
Data de Fabricação
Data de Validade
Esterilizado por Radiação Gama
Produto de Uso Único
Descrição
O Componente Femoral Cimentado é um produto implantável, invasivo cirurgicamente de
utilização em longo prazo que compõe a prótese modular utilizada para cirurgias de artroplastia do
joelho.
O implante destina-se a, em conjunto com os demais componentes, substituir a superfície articular
do fêmur distal, tíbia proximal e superfície patelar durante o procedimento cirúrgico de substituição
articular total do joelho, realizado nas circunstâncias em que esta articulação, em indivíduos
esqueleticamente maduros, apresente-se comprometida em conseqüência de patologias como a doença
degenerativa articular não inflamatória (osteo-artrose), artrite traumática, anquilose de origem não
infecciosa e artrodese do joelho.
O Componente Femoral Cimentado é dotado de uma de extensão metálica que se ajusta ao canal
femoral em ângulo valgo de 9 graus com a superfície articular, tanto para o lado direito como para o lado
esquerdo no caso do sistema Modular II de revisão e em versões para o lado direito e esquerdo para o
sistema Modular III primário e revisão, e ainda com a opção para substituição com preservação do
ligamento cruzado posterior, sistema Modular III/PL.
O Componente Femoral Cimentado é fabricado a partir da liga fundida de cromo-cobalto ASTM F75 e desenvolvido para a fixação cirúrgica ao osso adjacente por meio de cimento acrílico.
A seguir imagens ilustrativas dos modelos de Componente Femoral Cimentado disponíveis:
Componente Femoral Primário Modular II
Componente Femoral Revisão Modular II
Componente Femoral Primário Modular III
Componente Femoral Revisão – Modular III
Componente Femoral Primário - Modular III/PL
São partes integrantes (acessórios) do Componente Femoral Cimentado, o calço femoral e o pino
extensor, essas partes são utilizadas opcionalmente para os casos em que o cirurgião não encontra um
bom leito ósseo para fixação das próteses. Também fabricados a partir de liga fundida de Cromo
Cobalto, o calço femoral, bem como o pino extensor são mais comumente utilizados nos casos de
revisão, ou seja, nos casos em que faz-se necessária a troca de um componente de fêmur primário por
um de revisão.
A seguir imagens ilustrativas dos acessórios (partes integrantes):
Calço Femoral Parcial – Modular II
Calço Femoral Total – Modular II
Pino Extensor – Modular II
Calço Femoral Anterior – Modular
III
Calço Femoral Posterior –
Modular III
Calço Femoral Distal – Modular III
Pino Extensor Reto – Modular III
Pino Extensor Angulado – Modular III
Composição
O Componente Femoral Cimentado, bem como seus acessórios - o calço femoral e o pino
extensor - são produzidos a partir da liga fundida de CrCo. A escolha dessa liga é baseada em critérios
de similaridade (resultados largamente descritos na literatura) e por suas características de
biocompatibilidade e resistência mecânica.
A liga de Cromo Cobalto utilizada para a fabricação do Componente Femoral Cimentado e seus
acessórios atende aos requisitos especificados pela ASTM F-75 - Especificação para Cobalto-28 –
Cromo-6 – Molibdênio para Implantes Cirúrgicos (ASTM F-75 Specification for Cobalt-28 Chromium-6
Molybdenum Alloy Castings and Casting Alloy for Surgical Implants (UNS R30075))
A escolha dessa liga deve-se à sua caracterização mecânica e metalúrgica bem definidas, assim como
aos resultados em serviço - amplamente descritos na literatura mundial – que confirmam que essas ligas
são biocompatíveis e possuem resistência mecânica adequada aos fins propostos.
Indicação e Finalidade
O Componente Femoral compõe o sistema para artroplastia total de joelho e destina-se a
substituir a superfície articular do fêmur distal durante o procedimento cirúrgico de substituição articular
total do joelho, realizado nas circunstâncias em que esta articulação, em indivíduos esqueleticamente
maduros, apresente-se comprometida em conseqüência de patologias como a doença degenerativa
articular não inflamatória (osteo-artrose), artrite traumática, anquilose de origem não infecciosa,
artrodese do joelho.
Em quaisquer circunstâncias o Componente Femoral Cimentado deverá ser fixado ao osso
adjacente por meio de cimento acrílico de uso ortopédico (Polimetil-metacrilato – PMMA).
Contra-Indicações
Como no que se refere ao tratamento médico de maneira geral, toda técnica cirúrgica, mesmo
quando bem aplicada, pode apresentar problemas, complicações e situações em que o objetivo final do
tratamento não é atingido total ou parcialmente e sendo assim, as suas contra-indicações relativas
dependem sempre do caso, desde a anatomia, biologia local e sistêmica, o cuidado do planejamento e
preparo pré-operatório, a execução e aplicação de técnica perfeita no intra-operatório e até mesmo o
perfil sócio-econômico e cultural no sentido de que haja respeito e colaboração, por parte do paciente, às
recomendações e seguimento pós-operatório.
Contra indicações específicas incluem: infecção ativa seja no sítio a ser operado ou em outras
regiões, articulação neuropática, ausência ou paresia da musculatura que controla o joelho, doença
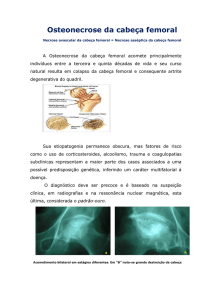
neurológica progressiva, doenças ósseas rapidamente destrutivas, ou osteonecrose pós-irradiação.
Contra-indicações relativas incluem ausência de suporte ósseo que permita uma fixação
adequada do implante ao remanescente ósseo. O sistema para artroplastia cimentada do joelho não
deve ser utilizado caso não se consiga um suporte ósseo adequado que garanta a estabilidade do
implante. Nestas circunstâncias, métodos suplementares de enxertia óssea devem ser utilizados em
conjunto, seja com enxerto autólogo, ou homólogo, ou ainda com o auxílio de telas e acessórios.
A necrose óssea induzida por irradiação em conseqüência de radioterapia para o tratamento de
câncer, é contra-indicação relativa à substituição articular do joelho, uma vez que a falta de suporte
ósseo pode levar ao afrouxamento precoce do implante. Neste caso, outras técnicas e sistemas de
implantes devem ser utilizados.
Constituem ainda contra-indicações específicas, as doenças neurológicas que possam trazer
alterações na resistência óssea, ou atividade neuro-muscular que possa sobrecarregar o implante,
Doenças ósseas rapidamente destrutivas (por exemplo: artropatia de Charcot, tumores ósseos, etc.),
osteonecroses, especialmente pós-irradiação podem trazer problemas de infecções e deiscências,
doenças circulatórias locais, insuficiências tanto arteriais como venosas, doenças sistêmicas, que por
diminuição das defesas locais ou gerais ou de condições circulatórias possam predispor a complicações
e a presença sabida ou informada de condições particulares do paciente que possa trazer alguma bioincompatibilidade com a liga metálica usada na fabricação do implante.
O Componente Femoral Cimentado também é contra-indicada para pacientes:
Jovens ou que praticam atividades esportivas;
Com alto peso corporal;
Com patologia infecciosa prévia ou atual;
Com quadro demencial ou com alterações neurológicas dos membros inferiores.
A utilização, nos casos acima, pode provocar desgaste ou afrouxamento precoce do componente
por excesso de solicitação mecânica, infecção ou luxação protética.
Os produtos aqui descritos foram desenvolvidos para utilização nas circunstâncias acima
descritas, de modo que quaisquer outras utilizações são consideradas contra-indicadas ou sem substrato
científico.
Formas de Apresentação
O Componente Femoral Cimentado apresenta-se nos seguintes modelos, sendo que cada um
desses, bem como seus acessórios (partes integrantes) são disponibilizados para comercialização nas
seguintes dimensões:
Componente Femoral Modular II - Primária
Código
04.15.01.000XX
Descrição
Tamanhos Disponíveis
Componente Femoral Modular II - Primário
54, 59, 64, 69 mm
04.15.02.000XX
Componente Femoral Modular II Revisão Direito
54, 59, 64, 69 mm
04.15.03.000XX
Componente Femoral Modular II Revisão Esquerdo
54, 59, 64, 69 mm
04.15.04.000XX
Componente Femoral Modular III Direito – Primário
Peq., Médio, Gde e Extra Gde
04.15.05.000XX
Componente Femoral Modular III Esquerdo – Primário
Peq., Médio, Gde e Extra Gde
04.15.08.000XX
Componente Femoral Modular III Revisão Direito
Peq., Médio, Gde e Extra Gde
04.15.09.000XX
Componente Femoral Modular III Revisão Esquerdo
Peq., Médio, Gde e Extra Gde
04.15.06.000XX
Componente Femoral Modular III - P/L Direito
Peq., Médio, Gde e Extra Gde
04.15.07.000XX
Componente Femoral Modular III - P/L Esquerdo
Peq., Médio, Gde e Extra Gde
Acessórios – Calço Femoral e Pino Extensor - Modular II
Código
Descrição
Tamanhos Disponíveis
04.05.01.54XXX
Calço Femoral Parcial 54
05 e 10 mm
04.05.01.59XXX
Calço Femoral Parcial 59
05 e 10 mm
04.05.01.64XXX
Calço Femoral Parcial 64
05 e 10 mm
04.05.01.69XXX
Calço Femoral Parcial 69
05 e 10 mm
04.05.02.54XXX
Calço Femoral Total 54
05 e 10 mm
04.05.02.59XXX
Calço Femoral Total 59
05 e 10 mm
04.05.02.64XXX
Calço Femoral Total 64
05 e 10 mm
04.05.02.69XXX
Calço Femoral Total 69
05 e 10 mm
04.25.00.XX077
Pino Extensor Ø 10 mm
Ø 10, 11, 12, 13, 14, 15 e 16 mm
Acessórios – Calço Femoral e Pino Extensor – Modular III
Código
Descrição
Tamanhos Disponíveis
04.05.10.000XX
Calço Femoral Modular III Anterior
Peq., Médio, Gde e Extra Gde
04.05.11.050XX
Calço Femoral Modular III Posterior - 5 mm
Peq., Médio, Gde e Extra Gde
04.05.11.100XX
Calço Femoral Modular III Posterior - 10 mm
Peq., Médio, Gde e Extra Gde
04.05.12.050XX
Calço Femoral Modular III Distal - 5 mm
Peq., Médio, Gde e Extra Gde
04.05.12.100XX
Calço Femoral Modular III Distal - 10 mm
Peq., Médio, Gde e Extra Gde
04.25.02.XX070
Pino Extensor Reto Modular III - 70 mm
Ø 09, 10, 11, 12, 13, 14, 15 mm
04.25.02.XX100
Pino Extensor Reto Modular III - 100 mm
Ø 09, 10, 11, 12, 13, 14, 15 mm
04.25.03.XX070
Pino Extensor Angulado Modular - 70 mm
Ø 09, 10, 11, 12, 13, 14, 15 mm
04.25.03.XX100
Pino Extensor Angulado Modular III - 100 mm
Ø 09, 10, 11, 12, 13, 14, 15 mm
Relação dos Ancilares
Os implantes ancilares ao Componente Femoral Cimentado são:
Componente Base Cimentado;
Componente Platô Tibial;
Componente Patelar;
O Com ponente Femoral é fabricado a partir da liga de Cromo Cobalto Molibdênio (CrCo) F-75
que atende aos requisitos especificados pela norma ASTM F-75.
O Componente Platô e o Componente Patelar são fabricados a partir do Polietileno UWMH, que
atende aos requisitos especificados na norma NBR ISO 5834-2.
A correta seleção dos modelos e medidas do Componente Femoral Cimentado, bem como de
seus ancilares a serem implantados é responsabilidade do cirurgião que também é responsável pela
técnica adotada, devendo esse estar familiarizado com o material, o método de aplicação e o
procedimento cirúrgico a ser adotado.
O êxito da consolidação está ligado à correta seleção, posicionamento, seleção e fixação dos
implantes, que é de responsabilidade do médico que avalia o paciente e decide quais os implantes a
serem utilizados, está vinculado também ao rigoroso cumprimento dos cuidados pós-operatórios
recomendados pelo médico responsável.
Os implantes ancilares relacionados abaixo não são objetos desse processo de registro, devendo,
portanto ser adquiridos separadamente e sempre do mesmo fabricante do implante ou por fabricante
indicado por esse.
Seguem abaixo relações com as medidas dos implantes ancilares ao Componente Femoral
Cimentado:
Relação de Ancilares - Componente Base Cimentado
Código
Descrição
Tamanhos Disponíveis
04.14.01.000XX
Base Tibial Modular II - Primária
54, 59, 64, 69 mm
04.14.02.000XX
Base Tibial Modular II Revisão - Revisão
54, 59, 64, 69 mm
04.14.03.000XX
Base Tibial Modular III - Primária
Peq., Média, Gde e Extra Gde
04.14.04.000XX
Base Tibial Modular III - Primária
Peq., Média, Gde e Extra Gde
04.14.05.000XX
Base Tibial Modular III - Revisão
Peq., Média, Gde e Extra Gde
04.14.06.000XX
Base Tibial Modular III - Primária - CrCo
Peq., Média, Gde e Extra Gde
04.14.07.000XX
Base Tibial Modular III - Revisão - CrCo
Peq., Média, Gde e Extra Gde
Relação de Ancilares - Componente Platô Tibial
Código
Descrição
Tamanhos Disponíveis
04.17.01.540XX
Platô Tibial Modular II 54
08, 10, 12, 15, 18, 21, 25 mm
04.17.01.590XX
Platô Tibial Modular II 59
08, 10, 12, 15, 18, 21, 25 mm
04.17.01.640XX
Platô Tibial Modular II 64
08, 10, 12, 15, 18, 21, 25 mm
04.17.01.690XX
Platô Tibial Modular II 69
08, 10, 12, 15, 18, 21, 25 mm
04.17.03.541XX
Platô Tibial Combinado II/III 54
08, 10, 12, 14, 15, 18 mm
04.17.03.591XX
Platô Tibial Combinado II/III 59
08, 10, 12, 14, 15, 18 mm
04.17.03.592XX
Platô Tibial Combinado II/III 59 F
08, 10, 12, 14, 15, 18 mm
04.17.03.641XX
Platô Tibial Combinado II/III 64
08, 10, 12, 14, 15, 18 mm
04.17.03.642XX
Platô Tibial Combinado II/III 64 F
08, 10, 12, 14, 15, 18 mm
04.17.03.643XX
Platô Tibial Combinado II/III 64 F
08, 10, 12, 14, 15, 18 mm
04.17.03.691XX
Platô Tibial Combinado II/III 69
08, 10, 12, 14, 15, 18 mm
04.17.03.693XX
Platô Tibial Combinado II/III 69 F
08, 10, 12, 14, 15, 18 mm
04.17.03.694XX
Platô Tibial Combinado II/III 69 F
08, 10, 12, 14, 15, 18 mm
04.17.02.010XX
Platô Tibial Modular III Pequeno - Primário
08, 10, 12, 15, 18, 21, 25 mm
04.17.02.020XX
Platô Tibial Modular III Médio - Primário
08, 10, 12, 15, 18, 21, 25 mm
04.17.02.030XX
Platô Tibial Modular III Grande - Primário
08, 10, 12, 15, 18, 21, 25 mm
04.17.02.040XX
Platô Tibial Modular IIl Extra Grande - Primário
08, 10, 12, 15, 18, 21, 25 mm
04.17.06.010XX
Platô Tibial Modular III de Revisão Pequeno
10, 12, 15, 18, 21, 25 mm
04.17.06.020XX
Platô Tibial Modular III de Revisão Médio
10, 12, 15, 18, 21, 25 mm
04.17.06.030XX
Platô Tibial Modular III de Revisão Grande
10, 12, 15, 18, 21, 25 mm
04.17.06.040XX
Platô Tibial Modular III de Revisão Extra-Grande
10, 12, 15, 18, 21, 25 mm
04.17.04.010XX
Platô Tibial Modular III - P/L Pequeno - Primário
08, 10, 12, 15 mm
04.17.04.020XX
Platô Tibial Modular III - P/L Médio - Primário
08, 10, 12, 15 mm
04.17.04.030XX
Platô Tibial Modular III - P/L Grande - Primário
08, 10, 12, 15 mm
04.17.04.040XX
Platô Tibial Modular III - P/L Extra-Grande - Primário
08, 10, 12, 15 mm
Relação Ancilares - Componente Patelar
Código
Descrição
Tamanhos Disponíveis
04.16.01.000XX
Componente Patelar Biconvexo Modular III
26, 28, 30, 32, 34, 36, 38 mm
04.16.02.000XX
Componente Patelar Standard
26, 28, 30, 32, 34, 36, 38 mm
04.16.02.000XX
Patela de Tripla Fixação – Ø 26 mm
26, 28, 30, 32, 34, 36, 38 mm
Relação dos materiais de apoio
Os materiais de apoio são os instrumentais designados unicamente para implantação dos
sistemas de prótese total Modular III e Modular III PL, dos quais o Componente Femoral Cimentado faz
parte.
Esses instrumentais são fabricados em aço inoxidável que atende aos requisitos especificados
pela norma ASTM F899-02 - Especificação Padrão para Aço Inoxidável para Instrumentos Cirúrgicos
(Standard Specification for Stainless Steel for Surgical Instruments), que lhes fornecem alta resistência e
durabilidade.
Os instrumentais abaixo não são objetos desse processo de registro, devendo, portanto ser
adquiridos separadamente e sempre do mesmo fabricante do implante ou por fabricante indicado por
esse.
Os instrumentais disponibilizados pela MDT ou por fabricante indicado por essa para realização de
cirurgias para implantação do Componente Femoral Cimentado e seus acessórios são:
Instrumental Modular II;
Instrumental Modular III – Primário;
Instrumental Modular III – Revisão;
Instrumental Modular III/PL
Os instrumentais são fornecidos descontaminados, porém não esterilizados. Os instrumentos
cirúrgicos estão sujeitos a desgaste durante a sua utilização normal, podendo, portanto quebrar-se.
Os instrumentais devem ser utilizados somente para os fins a que se destinam, devendo ser
inspecionados regularmente para verificação de possíveis desgastes e danos.
Para mais informações acerca do instrumental, consulte o representante MDT.
Efeitos Adversos
Em adição ao fato de que riscos óbvios podem ocorrer na presença de implantes ortopédicos,
como a falha, afrouxamento e fratura, quaisquer riscos e incertezas que se referem aos efeitos a longo
prazo podem ser passíveis de causar ocorrência de dano tissular crônico.
Ainda que nenhuma associação cientificamente comprovada entre a utilização de implantes
ortopédicos, com as características dos materiais utilizados para fabricação do Componente Femoral
Cimentado e a ocorrência de câncer, quaisquer riscos e incerteza que se referem aos efeitos em longo
prazo de substituições articulares, devem ser discutidos com o paciente anteriormente ao ato cirúrgico.
O paciente deve também ser informado de que quaisquer circunstâncias que levam ao dano
tissular crônico podem ser oncogênicas. Tecidos cancerosos encontrados nas vizinhanças de implantes
podem estar relacionados a fatores não ligados diretamente ao implante como: metástases de tumores
primários de pulmão, mama, sistema digestivo e outros, ou ainda devido à implantação de células
cancerosas que podem ocorrer durante procedimentos operatórios ou diagnósticos como a biópsia ou
ainda resultante da progressão de doença de Paget.
A implantação de material estranho em tecidos orgânicos pode eliciar respostas inflamatórias, que
podem ocorrer, por exemplo, em resposta a presença de debris oriundos de implantes (como debris
metálicos ou de polietileno), que podem ocasionar resposta histiocítica tipo granuloma de corpo estranho
e assim ocasionando destruição óssea, associada ou não ao afrouxamento do implante.
Precauções e Advertências
O Componente Femoral Cimentado só deve ser utilizado em conjunto com o cimento ósseo
acrílico. A não utilização acarretará em falência do dispositivo e perda progressiva do estoque
ósseo;
A utilização em conjunto com dispositivos de outros fabricantes pode resultar em incongruência
entre os componentes;
É aconselhável o uso de antibioticoterapia profilática em pacientes portadores de substituições
articulares que se submetam a procedimentos que ocasionem bacteremia transitória (procedimentos
odontológicos, sondagens vesicais, exames endoscópicos, cateterização de grandes vasos nos
membros inferiores e outros procedimentos cirúrgicos menores);
O Componente Femoral Cimentado foi concebido para ser implantado mediante a utilização
dos instrumentos desenvolvidos especificamente para este fim e, portanto, necessários para a
inserção e posicionamento adequado do implante, sendo que quaisquer improvisações com
diferentes instrumentais ou técnica cirúrgica imprecisa podem comprometer a qualidade da
fixação e/ou o posicionamento do implante;
Aconselha-se, previamente à inserção do cimento ósseo e do componente, a obtenção de um
leito ósseo viável. Em algumas ocasiões reforços sob a forma de enxertos ósseos ou
dispositivos de contenção e suporte podem ser indicados para restabelecer o estoque ósseo e
garantir uma boa estabilidade do implante;
A implantação sobre leito ósseo inadequado pode causar afrouxamento prematuro e perda
progressiva do estoque ósseo;
Pacientes submetidos à reconstrução articular protética do joelho devem ser submetidos a
avaliações médicas periódicas para se observarem possíveis alterações do estado do implante
e do osso adjacente.
Descartar e não utilizar dispositivos abertos ou danificados. Utilizar apenas dispositivos que se
encontrem em embalagens fechadas e não danificadas;
Esterilização inadequada do instrumental cirúrgico pode causar infecção protética;
Não utilize o produto se estiver com a validade vencida ou com a embalagem violada;
A abertura da embalagem para utilização cirúrgica deverá ser feita pelo pessoal de
enfermagem, habilitado para este procedimento;
Nunca reutilize um implante, pois mesmo sem aparência externa de danos, esforços prévios
podem reduzir sua vida útil;
Os resultados clínicos e a durabilidade dos implantes na artroplastia total de fêmur são
extremamente dependentes do alinhamento tridimensional dos componentes, sendo, portando,
indispensável uma técnica cirúrgica precisa;
O Componente Femoral Cimentado é fornecido estéril, portanto, utilizar imediatamente após a
abertura do selo de esterilização e não utilizar em caso de perda de esterilidade do dispositivo;
Não reesterilizar;
Data de fabricação, prazo de validade e nº do lote: vide rótulo.
O paciente deverá ser informado sobre:
Todas as restrições pós-operatórias, sobretudo às relacionadas às atividades esportivas e
ocupacionais.
O fato de que as complicações ou falhas da artroplastia total do joelho são mais prontas a ocorrer
em:
Pacientes com expectativas funcionais além do que pode ser promovida pela substituição
articular;
Pacientes com alto peso corporal;
Pacientes jovens e/ou ativos;
Pacientes com ossatura pequena.
As complicações relativas aos procedimentos de artroplastia do joelho, bem como as informações
listadas nos tópicos Indicações, Contra-Indicações, Efeitos Adversos, Precauções e Advertências.
A necessidade de acompanhamento médico periódico, para se observar possíveis alterações do
estado do implante e do osso adjacente. Só o acompanhamento pode detectar possível soltura de
componentes ou a ocorrência de osteólise.
A não realização de cirurgia de revisão quando da soltura de componentes pode resultar em perda
progressiva do estoque ósseo periprotético.
A necessidade de informar, quando da realização de exames de ressonância magnética, sobre o
fato de ser portador de prótese.
Deve-se fazer o paciente compreender que o produto não substitui e não possui o mesmo
desempenho do osso normal e que, portanto pode-se quebrar, deformar-se ou soltar-se em decorrência
de esforços ou atividades excessivos, de carga precoce, etc.
Nas crianças, pacientes idosos, com problemas mentais, dependentes químicos, podem
representar um risco maior para o aparelho falhar, pois estes pacientes podem ignorar as instruções e
restrições.
Deve-se instruir o paciente, a critério médico, para que utilize suportes externos, auxilio para
perambular e aparelhos ortopédicos projetados para imobilizar a área da fratura e limitar a carga.
Instruções de Uso
As técnicas de cirurgia variam de acordo com a escolha do médico cirurgião, cabendo ao cirurgião
a escolha final do método, tipo e dimensão dos produtos a serem empregados, bem como os critérios de
avaliação dos resultados da cirurgia. Para a utilização do produto devem ser seguidas as seguintes
instruções:
Efetuar a esterilização dos instrumentais de acordo com as instruções recomendadas
adiante;
Manipular os implantes Componente Femoral Cimentado exclusivamente em ambientes
adequados (ambulatórios ou salas cirúrgicas) com os devidos cuidados (somente deverão
ser manipuladas com luvas esterilizadas). Somente profissionais capacitados devem
manipular e implantar os componentes;
O Componente Femoral Cimentado deverá ser aplicado de acordo com as exigências e
técnicas cirúrgicas adequadas;
O Componente Femoral Cimentado somente deve ser utilizado com os seus respectivos
instrumentais cirúrgicos, quaisquer improvisações com diferentes instrumentais ou técnica
cirúrgica imprecisa podem comprometer a qualidade da fixação e/ou o posicionamento do
implante.
Para a aplicação é indispensável a utilização dos demais componentes do sistema de
prótese total de joelho correspondentes produzidos pela MDT e/ou fabricantes indicados por
essa.
Esterilização
O Componente Femoral Cimentado e seus acessórios (partes integrantes) são fornecidos na
condição de produto estéril. O método de esterilização adotado é a esterilização por Radiação Gama.
A produção do Componente Femoral Cimentado é realizada com grande cuidado para garantir ao
cirurgião a segurança e a qualidade do resultado operatório. O pessoal médico também deverá contribuir
para alcançar esperado resultado operatório, dando a devida atenção à manipulação e utilização dos
dispositivos, principalmente no que se refere a esterilização para sejam minimizados ao máximo os
riscos de infecção protética.
No que se refere aos instrumentais cirúrgicos utilizados para a implantação do Componente
Femoral Cimentado, o método de esterilização recomendado é a esterilização por vapor em auto clave,
conforme parâmetros especificados pela norma NBR 14332:1999 (Instrumentais cirúrgicos e
odontológicos -Orientações sobre manuseio, limpeza e esterilização).
Durante os procedimentos de limpeza e esterilização, os instrumentos devem ser examinados
cuidadosamente antes do seu uso, sendo que instrumentos de impacto com mostras visíveis de uso e
desgaste, bem como instrumentos de corte sem fio não devem ser utilizados.
Limpeza, esterilização e conservação dos instrumentais
Quando os instrumentos são usados pela primeira vez, eles devem ser removidos de suas
embalagens e limpos com álcool para fins médicos a 70% + água destilada 30%.
Após a limpeza, os produtos devem ser enxaguados com água destilada estéril e secos com pano
de limpeza que não libere fibras. Detergentes com cloro livre ou hidróxido de sódio não devem ser
usados.
Antes do uso cirúrgico, os instrumentais devem ser limpos como descrito acima e esterilizados por
autoclave. A esterilização não substitui a limpeza, e nunca será atingida com o material sujo.
A autoclavagem é um processo seguro para esterilização, entretanto se não houver controle nos
parâmetros operacionais, pode acarretar danos ao instrumental:
Umidade+Alta temperatura+Oxigênio=Corrosão=Micro-fissura=Trinca=Quebra
O processo de esterilização selecionado, em qualquer caso, deverá atender à norma EN556, que
estabelece que a probabilidade teórica da presença de microorganismos vitais seja no máximo igual a 1
6
-6
sobre 10 (S.A.L. [Sterility Assurance Level] nível de garantia de esterilidade = 10 ).
Para limpeza e esterilização, observe os procedimentos adequados. Como sugestão, utilize a
norma ASTM F1744:1996.
O ciclo de esterilização recomendado é:
Método
Ciclo
Temperatura
Tempo de exposição
Vapor
Pré-vácuo
132º - 135º C
[270º - 275º F]
Mínimo
10 minutos
Para conservação dos instrumentais, os seguintes cuidados devem ser adotados:
Inspecionar se os instrumentos apresentam sinais de danos e desgaste em todos os estágios
de manuseio;
Se for detectado algum dano, consultar o representante da MDT Indústria e Comércio de
Implantes Ortopédicos Ltda para assistência técnica do instrumental.
Risco de Contaminação
Considerando que o Componente Femoral Cimentado, por ser um material implantável, entra em
contato com tecidos e fluídos corporais, existe o risco de contaminação biológica e transmissão de
doenças virais, tais como hepatite e HIV etc.
Portanto, as bases explantadas devem ser tratadas como material potencialmente contaminantes.
Descarte do Produto
Quedas ou esmagamento do produto sobre superfícies duras podem causar danos ao produto. Ao
abrir a embalagem, inspecionar a sua integridade e não utiliza-lo se for observada alguma anormalidade.
Depois de removidas as bases devem ser descartadas e em hipótese alguma reutilizadas.
Os implantes explantados ou considerados inadequados para o uso devem ser inutilizados antes
do descarte, para tanto recomenda-se que as peças sejam cortadas, entortadas ou limadas.
Para descarte das bases explantadas, recomenda-se seguir os procedimentos legais locais do
país para descarte de produtos potencialmente contaminantes.
Rastreabilidade
Para garantir a rastreabilidade do produto implantado, e cumprir com os requisitos de vigilância
sanitária, recomenda-se que o cirurgião responsável ou sua equipe notifique ao distribuidor do implante
os seguintes dados referentes ao produto implantado, paciente e cirurgia:
Nome do cirurgião;
Data da cirurgia;
Nome do paciente que recebeu o implante;
Código do produto;
Número de lote;
As peças possuem gravação de:
Logotipo da empresa;
Lote de fabricação;
Código da peça.
Recomenda-se que o cirurgião ou sua equipe faça uso das etiquetas fornecidas em 5 vias dentro
da embalagem do produto, colando-as no prontuário do paciente como forma de manter a rastreabilidade
do material, além disso, recomenda-se também que uma dessas etiquetas seja fornecida ao paciente
para que esse tenha informações a respeito do material implantado.
Nas etiquetas constam os dados do produto como código, descrição e lote do mesmo entre outras
informações.
Armazenamento
Recomenda-se local seco e arejado, longe da incidência de raio solar direto.
Os implantes não podem ser armazenados diretamente no chão (altura mínima = 20 cm), não
podem ficar em prateleiras altas, próximas de lâmpadas (para não ressecar a embalagem ou apagar o
rótulo), não podem ser armazenados em áreas onde sejam utilizadas substâncias contaminantes como
inseticidas, pesticidas ou materiais de limpeza.
Transporte
Os implantes devem ser transportados com cuidado, evitando-se quedas e atritos para que se
evite defeitos no acabamento da superfície da peça.
Manter os implantes sempre nas embalagens originais, até o momento de sua utilização, sob a
responsabilidade da equipe médico/hospitalar designada para este fim, lembrando-se que essa deve
sempre se atentar para a integridade da embalagem.
Data de fabricação, prazo de validade e nº do lote: vide rótulo. Não utilizar o produto além do
prazo de validade.
Outras informações
Fabricado e distribuído por:
MDT – Indústria Comércio Importação e Exportação de Implantes SA
Endereço: Av. Brasil, nº. 2983 – Distrito Industrial – Rio Claro/SP – Brasil
CEP: 13.505-600
Fone/Fax: (55-19) 2111-6500
CNPJ: 01.025.974/0001-92
Responsável Técnico: Miguel Lopes Monte Júnior – CREA: 0601150192
Registro ANVISA nº.: 10417940046
Revisão: 02
Emissão: 24/09/2007
ALERTA
INSTRUÇÃO DE USO
Estas INSTRUÇÕES DE USO são disponibilizadas em formato não impresso, através do
endereço eletrônico do fabricante www.mdt.com.br.
As INSTRUÇÕES DE USO estão indexadas no site através do NÚMERO REGISTRO/
CADASTRO ANVISA e respectivo NOME COMERCIAL do produto, informados no rótulo do produto
adquirido.
Todas AS INSTRUÇÕES DE USO disponibilizadas no website possuem a identificação da revisão
e data de emissão do documento. Sendo que o usuário deve atentar-se para a correta versão (revisão e
data de emissão) do documento em relação à DATA DE FABRICAÇÃO informada no rótulo do produto
adquirido.
Caso seja de interesse do usuário, as INSTRUÇÕES DE USO poderão ser fornecidas em formato
impresso, sem custo adicional. Sendo que a solicitação das mesmas deverá ser realizada junto ao SAC
(Serviço de Atendimento ao Cliente) do fabricante, informado a seguir:
Serviço de Atendimento ao Cliente
Telefone: +55 19 2111.6500
FAX: +55 19 2111.6500
http://www.mdt.com.br
Avenida Brasil, 2983 – Distrito Industrial CEP: 13505-600 | Rio Claro – São Paulo – Brasil
Horário de atendimento: 8hs às 17hs, de segunda à sexta-feira, exceto feriados.