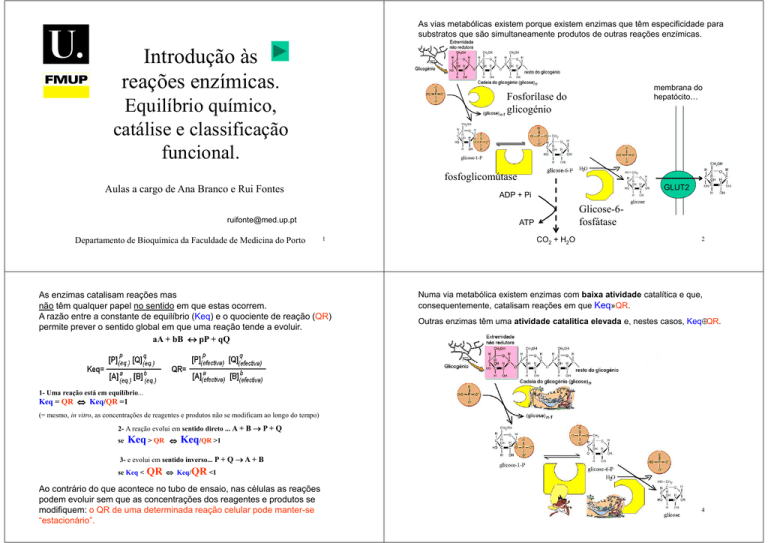
As vias metabólicas existem porque existem enzimas que têm especificidade para
substratos que são simultaneamente produtos de outras reações enzímicas.
Introdução às
reações enzímicas.
membrana do
hepatócito…
Fosforílase do
glicogénio
Equilíbrio químico,
catálise e classificação
funcional.
fosfoglicomútase
GLUT2
Aulas a cargo de Ana Branco e Rui Fontes
ADP + Pi
[email protected]
Departamento de Bioquímica da Faculdade de Medicina do Porto
Glicose-6fosfátase
ATP
1
As enzimas catalisam reações mas
não têm qualquer papel no sentido em que estas ocorrem.
A razão entre a constante de equilíbrio (Keq) e o quociente de reação (QR)
permite prever o sentido global em que uma reação tende a evoluir.
aA + bB ↔ pP + qQ
CO2 + H2O
2
Numa via metabólica existem enzimas com baixa atividade catalítica e que,
consequentemente, catalisam reações em que Keq»QR.
Outras enzimas têm uma atividade catalítica elevada e, nestes casos, Keq≈QR.
1- Uma reação está em equilíbrio...
Keq = QR ⇔ Keq/QR =1
(= mesmo, in vitro, as concentrações de reagentes e produtos não se modificam ao longo do tempo)
2- A reação evolui em sentido direto ... A + B → P + Q
se
Keq > QR
⇔
Keq/QR >1
3- e evolui em sentido inverso... P + Q → A + B
se Keq <
QR
⇔ Keq/QR <1
Ao contrário do que acontece no tubo de ensaio, nas células as reações
podem evoluir sem que as concentrações dos reagentes e produtos se
modifiquem: o QR de uma determinada reação celular pode manter-se 3
“estacionário”.
4
Na reação catalisada pela fosforílase do glicogénio estima-se que a Keq
≈0,3.
As concentrações estacionárias da glicose-1-P ( 0,00004 mM) e do fosfato inorgânico
(Pi ≈ 0,4 mM) nas células permitem estimar o QR ≈ 0,0001
⇒Keq»QR (qualquer QR fisiológico) e a reação é fisiologicamente irreversível.
Glicogénio (n) + Pi
⇒Keq ≈ QR e a reação é fisiologicamente reversível.
Glicogénio (n-1) + Glicose-1-P
[Glicogénio]equi × [Glicose-1-P]equi
Keq =
Na reação catalisada pela fosfoglicomútase estima-se que a Keq ≈17;
as concentrações estacionárias da glicose-1-P (≈ 20-40 nM)
e da glicose-6-P (≈ 400-800 nM) permitem estimar o QR ≈ 10 a 40
[Glicogénio]equi × [Pi]equi
≈ 0,3
[Glicose-6-P]equi
Keq =
≈ 17
[Glicose-1-P]equi
Em determinadas condições metabólicas
[Glicose-1-P]real
QR =
≈
[Pi]real
0,00004 mM
0,4 mM
≈ 0,0001
5
Numa via metabólica na ausência de “ramificações e entroncamentos”
a velocidade efetiva de conversão (velocidade macroscópica = vel_diretavel_inversa), ou seja, a velocidade de fluxo da via metabólica (J) é igual quer
nas reações de “equilíbrio” quer nas de “desequilíbrio”.
J=10
10,01
Pi
0,01 = 10
1010
Glicose-1-P
Glicose-6-P
1000
(17< [G6P](real)/[G1P] (real))
....e a reação evolui no sentido Glicose-6-P → Glicose-1-P
O valor da razão Keq/QR é uma
medida do “grau de desequilíbrio” da
reação;
que pode exprimir-se de outra
maneira; quanto maior é o valor da
razão Keq/QR
mais negativo é o valor da “energia
de Gibbs”.
A energia de Gibbs = 0 se Keq = QR;
ln 1 = 0.
A energia de Gibbs é positiva se QR > Keq;
ln número < 1 é um número negativo mas
na equação de Gibbs
vel. efetiva =
vel_direta – vel_inversa
= 10,01 –
Noutras condições metabólicas Keq < QR
∆G
kJ/
mol
Keq/
QR
≈
106
-36
103
-18
1
0
6
Se a
razão
Keq/
QR
...então
a
energia
>1
Negat.
ea
reação
A→P
de Gibbs
tende a
prosseguir no
sentido
direto
A equação de Gibbs relaciona a “energia de
∆G) com a razão Keq/QR
Gibbs” (∆
Glicose-1-P
0,01
Keq > QR
(17 > [G6P](real)/[G1P] (real))
....e a reação evolui no sentido Glicose-1-P → Glicose-6-P
=1
Nula
Aparentemente
parada
10-3
18
10-6
36
<1
Posit.
tende a
prosseguir no
sentido
inverso
vel. efetiva =
vel_direta – vel_inversa
= 1010 -
1000 = 10
7
8
∆G (kJ/mol) ≈ - log decimal (Keq/QR)
×6
Outra forma de exprimir Keq de uma reação é referir o ∆Gº.
∆Gº = - RT ln Keq = energia de Gibbs padrão ( ∆G quando QR =1)
O valor de ∆Gº é apenas um equivalente da Keq e, em geral,
não nos diz nada acerca do sentido em que a reação tende a evoluir
nem da reversibilidade ou irreversibilidade do processo.
As reações tendem a evoluir no sentido em que o valor do QR se aproxima do
valor de Keq.
Pensando na reação A→
→B com Keq = 1
Se QR=1…
B B B A A A
Se QR=1/5…
B A A A A A
… ∆G=0 ⇔ reação em equilíbrio
Na reação A → B (que pode ocorrer)
Keq>QR ⇔ ∆G é negativo:
a reação A → B é exergónica (ou
espontânea).
∆Gº = -RT ln 0,3 = + 3 kJ mol-1
A reação de fosforólise do
glicogénio diz-se
exergónica porque
o ∆G é negativo
9
As reações nunca evoluem no sentido em que são endergónicas mas os
processos anabólicos são endergónicos...
H2O
∆G = + 35 kJ
glutamato
glutamina
NH4+
ATP
∆G = -50 kJ
ADP + Pi
H2O
glutamina
NH4+
glutamato
Na reação B → A (não pode ocorrer)
porque QR>Keq ⇔ ∆G é positivo:
a reação B → A seria chamada de endergónica (ou
não espontânea).
Keq > QR ⇔ reação exergónica = reação que pode ceder energia para que 10
um processo endergónico (reativo ou de transporte) possa ocorrer.
As reações endergónicas não existem mas podem ocorrer se acopladas a
reações exergónicas.
Muitas reações podem ser entendidas como o somatório de duas reações em que uma
semirreação é endergónica e a outra semirreação é exergónica; se o somatório dos ∆G
das duas semirreações for negativo a reação soma é exergónica e tem tendência
termodinâmica para ocorrer.
glicose-6-P + ADP ∆G = -32 kJ; Keq/QR= 4x105
glicose + ATP
glicose + Pi
glicose-6-P + H2O ∆G = + 18 kJ; Keq/QR= 7x10-4
ATP + H2O
ADP + Pi
(∆
∆G=-50kJ)
∆G=-50 kJ; Keq/QR= 0,7x109
ATP
glicose-6-P
∆G soma =
-15 kJ
exergónico
B A A A A A
cínase da glicose
sintétase da glutamina
ATP
endergónico
(∆
∆G= +35 kJ)
A A A A A A
As reações evoluem sempre no sentido em que são exergónicas
(podendo ser exotérmicas ou endotérmicas);
as reações endergónicas são uma abstração e não existem.
∆G = -RT ln (0,3/0,0001) = - 20 kJ mol-1
∆G = -RT ln (Keq/QR)
Se pensar na reação inversa (B → A), QR=5…
ADP + Pi
As enzimas são as máquinas que acoplando processos endergónicos com exergónicos
possibilitam a ocorrência dos processos endergónicos.
11
A sintétase da glutamina é um exemplo.
glicose
endergónico
(∆
∆G= +18 kJ)
ADP
exergónico
(∆
∆G=-50kJ)
A cínase da glicose é uma “máquina química” que acopla um processo endergónico
12 (a
formação de glicose-6-P) com outro exergónico (a hidrólise do ATP).
Quando a reação ocorre em meio aquoso e um dos reagentes (ou produtos) é
a água, a sua concentração não entra no cálculo da Keq (nem do QR).
AB + H2O → A + B
[A]equil × [B] equil
Keq* =
[AB]equil × [H2O]
H2O → H+ + OH-
Keq* × [H2O]= Keq =
[A]equil × [B] equil
Quando em Bioquímica se escreve a equação da glicólise anaeróbia
omite-se o sinal do lactato para expressar a ideia que nos estamos a
referir à mistura do ácido láctico com o lactato.
glicose → 2 lactato … quer dizer: glicose → 2 (ácido láctico + lactato-)
Keq’ =
[AB]equil
Kw= [H+] × [OH-]= 10-14 M2
Em Bioquímica mesmo quando não é explicitamente referido a Keq pode ter um
significado diferente do que é usado em Química.
Em Bioquímica a constante de equilíbrio é uma Keq’ em que pressupõe que o
pH do meio é 7. Se um reagente (ou um produto) é um ácido fraco vai estar em duas
formas: a forma ácida (não dissociada) e a forma básica (dissociada do protão).
[glicose]
A razão [lactato-] / [ácido láctico] vai depender do pKa do ác. láctico e
do pH do meio. Em Bioquímica o valor de Keq’ presume que o pH = 7.
A pH 7 a razão [lactato-] / [ácido láctico] é ≈ 1000/1 e…
Keq’ ≈ Keq definida como [lactato-]2/[glicose], mas nem sempre é assim.
glicose-6-P + H2O → Pi + glicose
[Prod1] × [Prod2]
Keq =
[Reag1] × [Reag2]
Keq’ =
([Prod1a] + [Prod1b]) × [Prod2]
([Reag1a] + [Reag1b]) × [Reag2]
À Keq corresponde ∆Gº e à razão Keq/QR corresponde ∆G.
À Keq’ corresponde ∆G’º e à razão Keq’/QR’ corresponde ∆G’ e são
estes últimos valores que são, habitualmente, apresentados nos livros
de Bioquímica.
Quando, em Bioquímica, se diz que na reação de hidrólise do ATP em
ADP + Pi o ∆G’º é -31 kJ/mol quer-se dizer que a reação está em
equilíbrio (∆G’º = -31 kJ/mol ⇔ Keq’ = 1,8 x 105 M) quando
2[MgADP-] + [ADP3-] + [HADP2-] [H2PO4 ] + [HPO4 ] + [MgHPO4]
×
[ADP]
[Pi]
= 1,8 x 105 M
[ATP]
Keq’ =
([fosfato2-] + [fosfato-])
(
[glicose-6-P2-]
+
× [glicose]
)
= 2,7 x 105 M
[glicose-6-P-]
A pH 7, os fosfato com carga -2 e -1 têm concentrações parecidas…
Nos sistemas biológicos existem membranas que separam compartimentos,
mas muitas substâncias podem atravessar essas membranas.
Algumas moléculas pequenas e sem carga
(como o O2 e o CO2) podem atravessar
membranas por processos em que não
intervêm proteínas da membrana; o processo
de transporte diz-se não mediado.
Mas no transporte transmembranar da
maioria das substâncias intervêm
proteínas da membrana: o processo de
transporte diz-se mediado.
O transporte não mediado é sempre
estritamente exergónico (= passivo); o
transporte mediado pode ser passivo
ou ativo.
Existe transporte passivo ( = difusão) de
uma determinada substância quando ela se
move a favor do seu gradiente químico
(ou electroquímico): o processo é
estritamente exergónico.
[MgATP2-] + [ATP4-] + [HATP3-]
…em que as concentrações de ADP, Pi e ATP são somatórios das
concentrações das formas ionizadas e não ionizadas e ligadas ou
desligadas do Mg2+.
([ácido láctico] + [lactato-])2
15
Existe transporte ativo de uma determinada substância quando ela se move contra o seu16
gradiente químico (ou electroquímico): o processo contém um componente endergónico.
14
Na maioria das células a glicose (e outras substâncias não iónicas) atravessa
as membranas a favor do seu gradiente de concentrações (difusão ou
transporte passivo).
No plasma sanguíneo e no líquido extracelular a [glicose] ≈ 5 mM
mas no citosol da maioria das células, em resultado da ação da hexocínase, é cerca de 0,1 mM.
Em equilíbrio haveria igual concentração nos 2 lados da membrana
⇒ e a glicose tende a mover-se de fora para dentro.
∆G = - RT ln
Keq
= -RT ln
1
[glicose]dentro
QR
= -RT ln
O transporte transmembranar de substâncias iónicas é passivo (difusão)
quando ocorre a favor do gradiente eletroquímico (gradiente elétrico e de
concentrações) e ocorre através de canais iónicos ou de transportadores.
O gradiente elétrico é uma consequência do facto de as membranas terem cargas
diferentes entre as duas faces exterior e interior; o gradiente químico deve-se à
diferença de concentrações.
No caso do transporte
de
substâncias com carga elétrica
(iões) para além do gradiente
químico temos de ter em conta a
eventual existência de uma
diferença de potencial entre os
dois lados da membrana.
[glicose]fora
[glicose]dentro
[glicose]fora
Na membrana da maioria das células a
glicose move-se a favor de gradiente
[glicose]fora ≈ 5 mM
O lado interno da membrana
citoplasmática
tem
carga
negativa relativamente ao lado
externo que tem carga positiva.
⇔ processo estritamente exergónico
Se a [glicose]fora = 5 mM
e a [glicose]dentro= 0,1 mM
∆G (para o processo de
transporte fora → dentro) ≈
[glicose]dentro ≈ 0,1 mM
- 10 kJ / (mole de 17glicose
transportada)
O valor do ∆G correspondente ao gradiente elétrico de um ião com carga Z
que é transportado do lado da exterior da membrana para o interior é dado
pela expressão:
Carga do ião
Diferença de potencial (Volt);
por convenção o sinal é o do interior da membrana; Ψ = psi
∆G = Z F Ψ
Faraday=
96500 Coulomb mol-1
[Na+]fora
Quais os valores de ∆G (elétrico e químico e o ∆G
soma) correspondentes ao transporte de 1 mol de
ião Na+ de fora para dentro?
∆G(gradiente elétrico) = 1 × 96500 × (- 0,086)
= - 8,3 kJ mol-1
∆G(gradiente químico) = - RT ln (145/10)
Ψ = - 0,086 V
= - 6,6 kJ mol-1
A energia envolvida no transporte de iões Na+ de fora para dentro da célula é o somatório:
energia correspondente ao gradiente químico (∆
∆G negativo)
+
energia correspondente à diferença de potencial (∆
∆G negativo)
Quando o transporte é passivo ⇔ a favor do gradiente electroquímico ⇔ ∆G<0
o processo de transporte da substância em análise é exergónico.
18
Quando o transporte de uma substância ocorre contra o seu gradiente
electroquímico e o processo exergónico acoplado é uma reação química
falamos em transporte ativo primário.
É o caso
1- da ATPase do sódio/potássio
(bomba de sódio/potássio) e dos…
2- dos complexos I, III e IV da cadeia
respiratória. Aqui a componente
exergónica é uma reação redox...e o
endergónico o bombeamento de protões
contra gradiente electroquímico.
= 145 mM
[Na+]fora= 10 mM
∆G(soma) = (- 8,3 - 6,6) = - 14,9 kJ mol-1
-1
19
∆G(gradiente electroquímico) = - 14,9 kJ mol
Transporte de 3 Na+ contra gradiente electroquímico
(∆G ≈ + 44,7 kJ/mol de ATP)
Transporte de 2 K+ (admitindo equilíbrio eletroquímico)
(∆G ≈ 0 kJ/mol de ATP)
Hidrólise de 1 ATP
(∆G ≈ - 50 kJ/mol de ATP)
(∆G ≈ - 5,3 kJ/mol de ATP) 20
Processo global catalisado pela bomba de Na+/K+
...é exergónico.
Quando o transporte de uma substância ocorre contra o seu gradiente
electroquímico e o processo exergónico é o transporte de um ião a favor do
seu gradiente electroquímico (por sua vez criado por um transporte ativo
primário) falamos em transporte ativo secundário.
Aquando da síntese de ATP pela síntase de ATP mitocondrial (complexo V)
ocorre um processo que é o inverso do que corresponde aos processos de
transporte ativo primário: uma reação enzímica endergónica (∆G >0) está
acoplada com um transporte exergónico (∆G <0)
O transporte de glicose
∆G(gradiente elétrico) = 1× 96500 C mol-1 × (- 0,15 V)
= - 14,5 kJ mol-1
+ +
∆G(gradiente químico) = - RT ln (10-7,0/10-7,6)
+ +
+
= - 3,6 kJ mol-1
+
+
- - - ∆G(gradiente eletroquímico) relativo ao
- transporte
de 3 moles protões =
+
[H+] = 10-7,6 M
3
(-14,5
kJ
3,6 kJ) = - 54,1 kJ
ADP + Pi
V
3 H+
3 H+
ATP + H2O
Ψ = - 0,15 V
∆G relativo à síntese de 1 mol
+
- - - de ATP = 50 kJ
+
+ +
∆G relativo ao processo global
+ + + +
+
= - 54,1 kJ + 50 kJ = -4,122kJ
[H+]=10-7 M
no polo apical
dos enterócitos
é um transporte ativo secundário
em que o processo exergónico
é a passagem de iões sódio para dentro das
células a favor do gradiente electroquímico
e o endergónico o transporte de glicose contra
gradiente.
Diz-se que os transportadores de Na+ e glicose existentes no polo apical
dos enterócitos (SGLT1; sodium dependent glucose transporter 1)
é um “simporte” porque só pode funcionar
21
transportando 2 iões Na+ e 1 molécula de glicose
no mesmo sentido.
As palavras “difusão”, “transporte passivo” e “transporte ativo” referemse à termodinâmica do processo de transporte.
As palavras “simples”, “facilitado/a”, “mediado”, “transportador”,
“cotransporte” “uniporte”, “antiporte” e “simporte” referem-se ao
catalisador (ou à sua ausência).
1- Palavras que descrevem a energia envolvida no processo de transporte e estão,
portanto, relacionadas com aspetos relacionadas com termodinâmica do processo:
a) transporte passivo = difusão = transporte a ”favor do gradiente electroquímico”
b) transporte ativo = transporte “contra o gradiente químico ou electroquímico”.
2- Palavras relacionadas com o tipo de
catalisador envolvido no processo de
transporte:
a) simples = não mediado (sem
catalisador).
b) facilitado = mediado por
transportador.
b1) uniporte, simporte e antiporte.
b2) quando há cotransporte está
envolvido um simporte ou um antiporte.
A linha de separação entre transportadores e
enzimas é tão ténue que, em muitos casos, é
impossível dizer se estamos a falar de uma enzima
ou de um transportador.
1- Nos complexos da cadeia respiratória da
mitocôndria as reações de oxi-redução são exergónicas e
o componente endergónico é o transporte de protões
contra gradiente electroquímico.
1’- Um caso semelhante ocorre no caso da bomba de
sódio e potássio.
(hidrólise de ATP exergónica; movimento de iões
endergónico)
2- No caso da síntase do ATP na
mitocôndria nas condições in vivo o
componente exergónico é o movimento de
protões a favor do gradiente electroquímico
e o endergónico é a reação de síntese do
ATP
(ADP+Pi → ATP + H2O ).
23
24
Nota: os transportadores/enzimas são apenas catalisadores...
Conhecer o ∆G (⇔ razão Keq/QR) de um sistema reativo
indica-nos o sentido em que a reação pode evoluir ... mas não nos diz nada
acerca da velocidade em que ela ocorre.
A maioria das reações que ocorrem nos seres vivos só existem porque
existem enzimas que as catalisam. A maioria das enzimas são de natureza
proteica e, relativamente aos outros catalisadores,
têm uma grande especificidade em relação aos substratos e produtos da reação.
1- Algumas reações são muito lentas:
1- A palavra “enzima” (do Grego: en, na + zima, levedura) foi inventada em 1878 por Fredrich
Kühne.
A Keq da reação de oxidação da glicose
(glicose + 6 O2 → 6 CO2 + 6 H2O)
é cerca de 10500 M-1
2- A sua natureza proteica só foi definitivamente aceite na década de 1930.
∆G’º = - 2840 kJ/mol
a reação tem tendência a evoluir até ao consumo total do
reagente limitante (em geral a glicose)
3- Relativamente aos catalisadores não enzímicos as enzimas são, em geral:
a) mais potentes,
...mas, à temperatura ambiente e na ausência de enzimas, posso ter
b) atuam em condições “ pouco agressivas “ (pH ≈ 7, temp. < 100°C, etc.),
glicose em contacto com O2 durante milhares de anos que não
acontece nada.
c) têm uma enorme especificidade relativamente aos substratos e produtos, e
d) a sua atividade pode ser, frequentemente, regulada por substâncias diferentes dos substratos
e dos produtos (as enzimas podem ser sensores do meio ambiente em que estão inseridas...).
2- Outras reações são muito rápidas
As reações de dissociação de protões ou ligação de protões
(ácido-base)
aproximam-se rapidamente do equilíbrio e não necessitam
de catalisadores.
25
4- Sendo as enzimas moléculas proteicas o seu tamanho é, frequentemente, muito grande
relativamente ao tamanho das moléculas dos substratos.
O “sítio ativo” (ou “sítio catalítico”) é um local específico modelado de tal forma que
permite a interação específica com o substrato (ou substratos) e é onde ocorre a reação
26
química.
À rotura hidrolítica das ligações fosfoanidrido do ATP (entre os fosfatos α-β e βγ) estão associados valores de ∆Gº “muito” negativos;
por isso se diz na gíria dos bioquímicos que
estas ligações são “ricas em energia”.
1- Dizemos que a glicose e o etanol
“são substâncias energéticas” porque no seu processo de oxidação libertam enormes quantidades
de energia:
Classificação e nomenclatura das enzimas
Glicose + 6 O2 → 6 CO2 + 6 H2O
∆Gº = - 2840 kJ/mol
Etanol + 2 O2 → 2 CO2 + 2 H2O
∆Gº = - 168 kJ/mol
(nota: estes ∆Gº não se referem aos seres vivos; ∆Gº refere-se sempre a condições padrão)
2- Quando dizemos que o ATP é “uma substância energética” não estamos a falar da reação de
oxidação do ATP mas da sua fosfohidrólise.
ATP + H2O → ADP + Pi
∆Gº = - 31 kJ/mol
ATP + H2O → AMP + PPi
∆Gº = - 46 kJ/mol
∆Gº= -31 kJ
∆Gº= -46 kJ
27
28
As ligações em que o ∆Gº que corresponde à sua rotura hidrolítica (em
condições padrão) tem um valor semelhante ou é ainda mais negativo que o
que corresponde à rotura das ligações fosfoanidrido do ATP (- 31 kJ mol-1 ou 46 kJ mol-1) dizem-se “ricas em energia” e costumam representar-se por
∆Gº= - 43 kJ
As ligações “ricas em energia” podem ser de tipo:
a) anidrido como no ATP
b) fosfamida como na fosfocreatina
Embora o ∆Gº seja apenas uma medida da Keq (e não determine por si só o
sentido em que a reação vai evoluir) o conceito de “ligação rica em energia”
revelou-se útil…
(1) porque, normalmente, quando uma enzima catalisa o acoplamento de duas
semirreações em que uma é a rotura de uma “ligação rica em energia” e a outra a
formação de uma ligação que “não é rica em energia” (como as fosfoéster) a reação é
fisiologicamente irreversível…
Exemplos:
c) enolfosfato como no fosfoenolpiruvato.
∆Gº= -62 kJ
+ glicose → ADP + glicose-6-P
+ frutose-6-P → ADP + frutose-1,6-bisfosfato (cínase da frutose-6-P)
(2) e porque, normalmente, quando nas duas semirreações acopladas, numa se rompe e
na outra se forma uma “ligação rica em energia” a reação é fisiologicamente reversível
+ ADP
∆Gº= -36 kJ
+ Pi ↔ succinato + CoA +
Sintétase de succinil-CoA
Exemplos:
d) tioéster como no succinil-CoA.
+ ADP ↔ creatina +
Cínase da creatina
+ ADP ↔ 3-fosfoglicerato +
30
Cínase do 3-fosfoglicerato
Quando dizemos que o ATP, a fosfocreatina, o fosfoenolpiruvato ou o succinil-CoA
29
“são substâncias energéticas” estamos simplesmente a dizer que a sua fosfohidrólise
tem um valor de ∆Gº muito negativo.
A cínase do 3-fosfoglicerato catalisa uma reação de fosfotransferência que é
fisiologicamente reversível (no sentido da síntese de ATP na glicólise e de
consumo de ATP na gliconeogénese)...
As reações enzímicas que
in vivo geram PPi têm um
∆G (real) muito negativo
porque o produto PPi é
rapidamente hidrolisado
pela ação catalítica de
pirofosfátases que mantém
a sua concentração muito
baixa.
No 1,3-bisfosfoglicerato há
uma ligação anidrido (“rica
em energia”) que não existe
no 3-fosfoglicerato...
Como resultado da ação catalítica
das pirofosfátases celulares
⇒ a concentração de PPi na célula
é muito baixa;
não existe um dos substratos para
que a reação inversa possa ocorrer
…mas nem sempre o acoplamento de semirreações em que há síntese e
rotura de “ligações ricas em energia” corresponde a reações fisiologicamente
reversíveis: por exemplo, a reação catalisada pela cínase do piruvato é
fisiologicamente irreversível.
+ ADP
→ piruvato +
(cínase da glicose)
31
As reações em que um dos produtos é o PPi
são reações exergónicas em todas as condições metabólicas
reações fisiologicamente irreversíveis.
32
nutrientes
ADP
4 H+
Glicose
I love
electrons
O2
I
O2
2 Piruvato
NAD+
enzimas e
enzimas/transportadores
envolvidas no
catabolismo
∆G < 0
2 acetil-CoA
NADH
2 CO2
NAD+
CO2
ATP
NAD+
cyt c IV
O
H2O
10 H+
NAD+
NADH
NADH
NAD+
NADH
2
We hate
electrons
nutrientes
33
Nutrientes ou
intermediários
do
metabolismo
ATP
III
V
Simp.
Pi
2 CO2
H2O
H2O
1 NADH
Q
NADH
2 CO2
∆G > 0
4 H+)
2 ADP
2
Pi
(2 H+ +
2 ADP
2,5 ADP
+ 2,5 Pi
2,5
A oxidação completa de 1 mole de glicose é a componente exergónica num processo
global em que a componente endergónica é a síntese de 30 (envolvimento da 34
lançadeira do glicerol-3-P) a 32 moles (envolvimento do malato) de ATP.
Bibliografia consultada:
H2O
Newsholme, E. A. & Leech, T. (2009) Functional Biochemistry in Health and disease,
Wiley-Blackwell, Oxford.
∆G > 0
∆G < 0
Nelson DL & Cox MM. (2005) Lehninger Principles of Biochemistry. 4th ed. Worth
Publishers. New York.
enzimas e
enzimas/
transportadores
Chang R. (1994) Química 5ª ed. McGrow-Hill de Portugal, Lda
Pi
ADP
proteínas,
glicoproteínas,
lipídeos e glicídeos
complexos, ácidos
nucleicos...
35
36