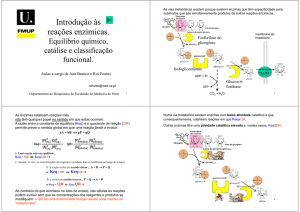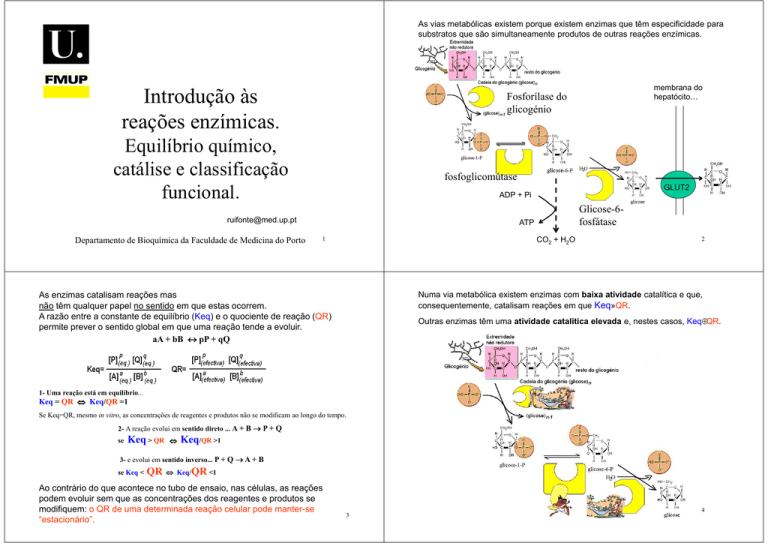
As vias metabólicas existem porque existem enzimas que têm especificidade para
substratos que são simultaneamente produtos de outras reações enzímicas.
Introdução às
reações enzímicas.
Equilíbrio químico,
catálise e classificação
funcional.
fosfoglicomútase
GLUT2
ADP + Pi
[email protected]
Departamento de Bioquímica da Faculdade de Medicina do Porto
membrana do
hepatócito…
Fosforílase do
glicogénio
Glicose-6fosfátase
ATP
CO2 + H2O
1
2
Numa via metabólica existem enzimas com baixa atividade catalítica e que,
consequentemente, catalisam reações em que Keq»QR.
As enzimas catalisam reações mas
não têm qualquer papel no sentido em que estas ocorrem.
A razão entre a constante de equilíbrio (Keq) e o quociente de reação (QR)
permite prever o sentido global em que uma reação tende a evoluir.
aA + bB ↔ pP + qQ
Outras enzimas têm uma atividade catalítica elevada e, nestes casos, Keq≈QR.
1- Uma reação está em equilíbrio...
Keq = QR ⇔ Keq/QR =1
Se Keq=QR, mesmo in vitro, as concentrações de reagentes e produtos não se modificam ao longo do tempo.
2- A reação evolui em sentido direto ... A + B → P + Q
se
Keq > QR
⇔
Keq/QR >1
3- e evolui em sentido inverso... P + Q → A + B
se Keq <
QR
⇔ Keq/QR <1
Ao contrário do que acontece no tubo de ensaio, nas células, as reações
podem evoluir sem que as concentrações dos reagentes e produtos se
modifiquem: o QR de uma determinada reação celular pode manter-se
“estacionário”.
3
4
Na reação catalisada pela fosforílase do glicogénio estima-se que a Keq
≈0,3.
As concentrações estacionárias da glicose-1-P ( 0,00004 mM) e do fosfato inorgânico
(Pi ≈ 0,4 mM) nas células permitem estimar o QR ≈ 0,0001
⇒Keq»QR (qualquer QR fisiológico) e a reação é fisiologicamente irreversível.
Glicogénio (n) + Pi
Na reação catalisada pela fosfoglicomútase estima-se que a Keq ≈17;
as concentrações estacionárias da glicose-1-P (≈ 20-40 nM)
e da glicose-6-P (≈ 400-800 nM) permitem estimar o QR ≈ 10 a 40
⇒Keq ≈ QR e a reação é fisiologicamente reversível.
Glicogénio (n-1) + Glicose-1-P
[Glicogénio]equi * [Glicose-1-P]equi
Keq =
≈ 0,3
[Glicogénio]equi * [Pi]equi
[Glicose-6-P]equi
Keq =
≈ 17
[Glicose-1-P]equi
Em determinadas condições metabólicas
[Glicose-1-P]real
QR =
≈
[Pi]real
0,00004 mM
0,4 mM
≈ 0,0001
5
Numa via metabólica na ausência de “ramificações e entroncamentos”
a velocidade efetiva de conversão (velocidade macroscópica = vel_diretavel_inversa), ou seja, a velocidade de fluxo da via metabólica (J) é igual quer
nas reações de “equilíbrio” quer nas de “desequilíbrio”.
J=10
10,01
Pi
vel. efetiva =
vel_direta – vel_inversa
= 10,01 –
Glicose-6-P
1000
(17< [G6P](real)/[G1P] (real))
....e a reação evolui no sentido Glicose-6-P → Glicose-1-P
O valor da razão Keq/QR é uma
medida do “grau de desequilíbrio” da
reação;
que pode exprimir-se de outra
maneira; quanto maior é o valor da
razão Keq/QR
mais negativo é o valor da “energia
de Gibbs”.
∆G
kJ/
mol
Keq/
QR
≈
106
-36
103
-18
1
0
6
Se a
razão
Keq/
QR
...então
a
energia
>1
Negat.
ea
reação
A→P
de Gibbs
tende a
prosseguir no
sentido
direto
=1
Aparentemente
Nula
parada
0,01 = 10
1010
Glicose-1-P
Noutras condições metabólicas Keq < QR
A equação de Gibbs relaciona a “energia de
∆G) com a razão Keq/QR
Gibbs” (∆
Glicose-1-P
0,01
Keq > QR
(17 > [G6P](real)/[G1P] (real))
....e a reação evolui no sentido Glicose-1-P → Glicose-6-P
10-3
18
10-6
36
<1
tende a
prosseguir no
sentido
inverso
Posit.
vel. efetiva =
vel_direta – vel_inversa
= 1010 -
1000 = 10
7
8
∆G (kJ/mol) ≈ - log decimal (Keq/QR) * 6
Outra forma de exprimir Keq de uma reação é referir o ∆Gº.
As reações tendem a evoluir no sentido em que o valor do QR se aproxima do
valor de Keq.
∆Gº = - RT ln Keq = energia de Gibbs padrão
Pensando na reação A→
→B
O valor de ∆Gº é apenas um equivalente da Keq e, em geral,
não nos diz nada acerca do sentido em que a reação tende a evoluir
nem da reversibilidade ou irreversibilidade do processo.
Se Keq = 1 e QR=1…
B B B A A A
Se QR=1/5…
B A A A A A
∆Gº = -RT ln 0,3 = + 3 kJ mol-1
A reação de fosforólise do
glicogénio diz-se
exergónica porque
o ∆G é negativo
9
As reações endergónicas não existem, mas podem ocorrer se acopladas a
reações exergónicas.
Muitas reações podem ser entendidas como o somatório de duas reações em que uma
semirreação é endergónica e a outra semirreação é exergónica; se o somatório dos ∆G
das duas semirreações for negativo a reação soma é exergónica e tem tendência
termodinâmica para ocorrer.
glicose-6-P + ADP ∆G = -32 kJ; Keq/QR= 4x105
glicose + ATP
glicose + Pi
glicose-6-P + H2O ∆G = + 18 kJ; Keq/QR= 7x10-4
ATP + H2O
ADP + Pi
Se pensar na reação inversa (B → A), QR=5…
Na reação B → A (não pode ocorrer)
porque QR>Keq ⇔ ∆G é positivo:
a reação B → A seria chamada de endergónica (ou
não espontânea).
glicose
B A A A A A
ATP
ADP
exergónico
(∆
∆G=-50kJ)
A cínase da glicose é uma “máquina química” que acopla um processo endergónico (a
11
formação de glicose-6-P) com outro exergónico (a hidrólise do ATP).
10
As reações nunca evoluem no sentido em que são endergónicas, mas os
processos anabólicos são endergónicos...
H2O
∆G = + 35 kJ
glutamato
glutamina
NH4+
ATP
∆G = -50 kJ
ADP + Pi
H2O
cínase da glicose
endergónico
(∆
∆G= +18 kJ)
A A A A A A
Keq > QR ⇔ reação exergónica = reação que pode ceder energia para que
um processo endergónico (reativo ou de transporte) possa ocorrer.
∆G=-50 kJ; Keq/QR= 1,7x 109
glicose-6-P
Na reação A → B (que pode ocorrer)
Keq>QR ⇔ ∆G é negativo:
a reação A → B é exergónica (ou
espontânea).
As reações evoluem sempre no sentido em que são exergónicas
(podendo ser exotérmicas ou endotérmicas);
as reações endergónicas são uma abstração e não existem.
∆G = -RT ln (0,3/0,0001) = - 20 kJ mol-1
∆G = -RT ln (Keq/QR)
… ∆G=0 ⇔ reação em equilíbrio
glutamina
NH4+
glutamato
sintétase da glutamina
ATP
∆G soma =
-15 kJ
endergónico
(∆
∆G= +35 kJ)
exergónico
(∆
∆G=-50kJ)
ADP + Pi
As enzimas são as máquinas que acoplando processos endergónicos com exergónicos
possibilitam a ocorrência dos processos endergónicos.
12
A sintétase da glutamina é um exemplo.
Nos sistemas biológicos existem membranas que separam compartimentos
mas muitas substâncias podem atravessar essas membranas.
Algumas moléculas pequenas e sem carga
(como o O2 e o CO2) podem atravessar
membranas por processos em que não
intervêm proteínas da membrana; o processo
de transporte diz-se não mediado.
Na maioria das células a glicose (e outras substâncias não iónicas) atravessa
as membranas a favor do seu gradiente de concentrações (difusão ou
transporte passivo).
No plasma sanguíneo e no líquido extracelular a [glicose] ≈ 5 mM
mas no citosol da maioria das células, em resultado da ação da hexocínase, é cerca de 0,1 mM.
Em equilíbrio haveria igual concentração nos 2 lados da membrana
⇒ e a glicose tende a mover-se de fora para dentro.
Mas no transporte transmembranar da
maioria das substâncias intervêm
proteínas da membrana: o processo de
transporte diz-se mediado.
∆G = - RT ln
Keq
= -RT ln
1
[glicose]dentro
QR
= -RT ln
[glicose]fora
[glicose]dentro
[glicose]fora
O transporte não mediado é sempre
estritamente exergónico (= passivo); o
transporte mediado pode ser passivo
ou ativo.
Na membrana da maioria das células a
glicose move-se a favor de gradiente
[glicose]fora ≈ 5 mM
⇔ processo estritamente exergónico
Existe transporte passivo ( = difusão) de
uma determinada substância quando ela se
move a favor do seu gradiente químico
(ou eletroquímico): o processo é
estritamente exergónico.
Se a [glicose]fora = 5 mM
e a [glicose]dentro= 0,1 mM
∆G (para o processo de
transporte fora → dentro) ≈
Existe transporte ativo de uma determinada substância quando ela se move contra o seu13
gradiente químico (ou eletroquímico): o processo contém um componente endergónico.
O transporte transmembranar de substâncias iónicas é passivo (difusão)
quando ocorre a favor do gradiente electroquímico (gradiente elétrico e de
concentrações) e ocorre através de canais iónicos específicos.
O gradiente elétrico é uma consequência do facto de as membranas terem cargas
diferentes nas faces exterior e interior; o gradiente químico deve-se à diferença de
concentrações.
No caso do transporte
de
substâncias com carga elétrica
(iões) para além do gradiente
químico temos de ter em conta a
eventual existência de uma
diferença de potencial entre os
dois lados da membrana.
O lado interno da membrana
citoplasmática
tem
carga
negativa relativamente ao lado
externo que tem carga positiva.
A energia envolvida no transporte de iões Na+ de fora para dentro da célula é o somatório:
[glicose]dentro ≈ 0,1 mM
- 10 kJ / (mole de 14glicose
transportada)
O valor do ∆G correspondente ao gradiente elétrico de um ião com carga Z que
é transportado do lado da exterior da membrana para o interior é dado pela
expressão:
Carga do ião
Diferença de potencial (Volt);
por convenção o sinal é o do interior da membrana; Ψ = psi
∆G = Z F Ψ
Faraday= 96500 C mol-1
[Na+]fora= 145 mM
- 0,086 V
Quais os valores de ∆G (elétrico e químico e o ∆G
soma) correspondentes ao transporte de 1 mol de
ião Na+ de fora para dentro?
∆G(gradiente elétrico) = 1 x 96500 C x (- 0,086 V)
= - 8,3 kJ mol-1
∆G(gradiente químico) = - RT ln (145/10)
= - 6,6 kJ mol-1
energia correspondente ao gradiente químico (∆
∆G negativo)
+
[Na+]fora= 10 mM
energia correspondente à diferença de potencial (∆
∆G negativo)
Quando o transporte é passivo ⇔ a favor do gradiente eletroquímico ⇔ ∆G<0
o processo de transporte da substância em análise é exergónico.
15
∆G(soma) = (- 8,3 – 6,6) = - 14,9 kJ mol-1
16 -1
∆G(gradiente eletroquímico) = - 14,9 kJ mol
Quando o transporte de uma substância ocorre contra o seu gradiente
eletroquímico e o processo exergónico acoplado é uma reação química
falamos em transporte ativo primário.
É o caso da atividade
da ATPase do
sódio/potássio
(bomba de
sódio/potássio).
A atividade dos complexos I, III e IV da cadeia respiratória são outros
exemplos de transporte ativo primário.
O complexo I da cadeia respiratória é, simultaneamente, uma enzima (uma oxiredútase que catalisa um reação exergónica) e um transportador de protões que
são bombeados contragradiente elétrico e de concentração para fora da
mitocôndria:
NADH + H+ + Q + 4 H+ (dentro) → NAD+ + QH2 + 4 H+ (fora)
Complexo I ou
desidrogénase
do NADH
4H+
2 e-
I
NADH
fora da mitocôndria:
potencial elétrico +
[H+] alta
NAD+
Q
membr. mitocondrial interna
ubiquinona ou
coenzima Q
matriz mitocôndrial:
potencial elétrico [H+] baixa
Transporte de 3 Na+ contra gradiente eletroquímico
(∆G ≈ + 44,7 kJ/mol de ATP)
Transporte de 2 K+ (está em equilíbrio)
(∆G ≈ + 0 kJ/mol de ATP)
Hidrólise de 1 ATP
(∆G ≈ - 50 kJ/mol de ATP)
Processo global catalisado pela bomba de Na+/K+
(∆G ≈ - 5,3 kJ/mol de ATP17
)
...é exergónico.
O complexo I catalisa um processo de transporte ativo primário: usa a energia libertada
18
numa reação química para bombear protões contra gradiente eletroquímico.
Quando o transporte de uma substância ocorre contra o seu gradiente
eletroquímico e o processo exergónico é o transporte de um ião a favor do seu
gradiente eletroquímico (por sua vez criado por um transporte ativo primário)
falamos em transporte ativo secundário.
Aquando da síntese de ATP pela síntase de ATP mitocondrial (complexo V)
ocorre um processo que é o inverso do que corresponde aos processos de
transporte ativo primário: uma reação enzímica endergónica (∆G >0) está
acoplada com um transporte exergónico (∆G <0)
Mesmo quando a concentração de glicose é mais
baixa no lúmen do intestino que dentro dos
enterócitos, a glicose continua a entrar para os
enterócitos (transporte ativo).
O transporte é ativo secundário
porque o processo exergónico
é a passagem de iões sódio para dentro das células a
favor do gradiente eletroquímico e esse gradiente foi,
por sua vez, criado por um transporte ativo primário.
∆G(gradiente elétrico) = 1× 96500 C mol-1 × (- 0,15 V)
= - 14,5 kJ mol-1
+ +
∆G(gradiente químico) = - RT ln (10-7,0/10-7,6)
+ +
+
= - 3,6 kJ mol-1
+
+
- - - ∆G(gradiente eletroquímico) relativo ao
- transporte
de 3 moles protões =
+
[H+] = 10-7,6 M
3 (-14,5 kJ - 3,6 kJ) = - 54,1 kJ
ADP + Pi
+
V
3H
3 H+
ATP + H2O
Ψ = - 0,15 V
∆G relativo à síntese de 1 mol
+
- - - de ATP = 50 kJ
+
+ +
∆G relativo ao processo global
+ + + +
+
= - 54,1 kJ + 50 kJ = -4,120kJ
O transportador de Na+ e glicose existente no polo apical dos enterócitos
(SGLT1; sodium dependent glucose transporter 1)
é um “simporte” porque só pode funcionar
19
transportando 2 iões Na+ e 1 molécula de glicose
no mesmo sentido.
4H+
[H+]=10-7 M
Conhecer o ∆G (⇔ razão Keq/QR) de um sistema reativo
indica-nos o sentido em que a reação pode evoluir ... mas não nos diz nada
acerca da velocidade em que ela ocorre.
A maioria das reações que ocorrem nos seres vivos só existem porque
existem enzimas que as catalisam. A maioria das enzimas são de natureza
proteica e, relativamente aos outros catalisadores,
têm uma grande especificidade em relação aos substratos e produtos da reação.
1- Algumas reações são muito lentas:
1- A palavra “enzima” (do Grego: en, na + zima, levedura) foi inventada em 1878 por Fredrich
Kühne.
A Keq da reação de oxidação da glicose
(glicose + 6 O2 → 6 CO2 + 6 H2O)
é cerca de 10500 M-1
2- A esmagadora maioria das enzimas são proteínas… mas também existem ribozimas.
∆G’º = - 2840 kJ/mol
a reação tem tendência a evoluir até ao consumo total do
reagente limitante (em geral a glicose)
3- Relativamente aos catalisadores não enzímicos, as enzimas são, em geral:
a) mais potentes,
...mas, à temperatura ambiente e na ausência de enzimas, posso ter
b) atuam em condições “ pouco agressivas “ (pH ≈ 7, temp. < 100°C, etc.),
glicose em contacto com O2 durante milhares de anos que não
acontece nada.
c) têm uma enorme especificidade relativamente aos substratos e produtos, e
d) a sua atividade pode ser, frequentemente, regulada por substâncias diferentes dos substratos
e dos produtos (as enzimas podem ser sensores do meio ambiente em que estão inseridas...).
2- Outras reações são muito rápidas
As reações de dissociação de protões ou ligação de protões
(ácido-base)
aproximam-se rapidamente do equilíbrio e não necessitam
de catalisadores.
4- Sendo as enzimas moléculas proteicas o seu tamanho é, muitas vezes, muito grande
relativamente ao tamanho das moléculas dos substratos.
O “sítio ativo” (ou “sítio catalítico”) é um local específico modelado de tal forma que
permite a interação específica com o substrato (ou substratos) e onde ocorre a reação
22
química.
21
A Comissão de Enzimas da União Internacional de Bioquímica definiu critérios para
a classificação e denominação das enzimas;
os critérios são de tipo funcional: duas enzimas com estruturas diferentes que
catalisam a mesma reação (isozimas ou isoenzimas) têm o mesmo nome.
As isomérases (EC 5.x.y.z) catalisam a
interconversão de dois isómeros: A↔B
1- A cada enzima foi atribuído um “número EC” (de Enzyme Comission)
que contém 4 números separados por pontos (EC W.X.Y.Z).
Os números W, X e Y referem-se, respetivamente, à classe, subclasse e sub-subclasse e o número
Z é específico de cada enzima.
Em rigor, as isomérases são as únicas enzimas em que se pode falar do substrato da
enzima no singular.
2- No dia 18-09-2013 estavam classificadas 5213 enzimas que podem ser consultadas em
http://enzyme.expasy.org
3- Em geral uma mesma enzima tem vários nomes e a nomenclatura não é isenta de ambiguidade;
a atribuição de um número EC às enzimas é uma tentativa de resolver essa ambiguidade.
Foram definidas 6 classes:
Classe 1: oxi-redútases Classe 2: transférases
Classe 4: líases
Classe 5: isomérases
Classe 3: hidrólases
Classe 6: lígases ou sintétases
4- A classificação é de tipo funcional: diferentes proteínas com a mesma atividade catalítica
(como as isoenzimas) têm o mesmo nome e número EC.
23
Exemplos:
fosfoglicomútase
isomérase das hexoses-fosfato
epimérase das pentoses-fosfato
racemase da serina
(Glicose-1-P ↔ Glicose-6-P)
(Glicose-6-P ↔ Frutose-6-P)
(Ribulose-5-P ↔ Xilulose-5-P)
(serina-L ↔serina-D)
Em geral,
nas reações catalisadas pelas isomérases
as Keq têm valores não muito diferentes de 1 (
e são fisiologicamente reversíveis.
∆Gº não muito diferente de 0)24
As fosfátases são hidrólases em que um dos produtos é o fosfato inorgânico (Pi).
As reações catalisadas pelas fosfátases chamam-se desfosforilações.
Alguns exemplos de fosfátases:
Nas reações catalisadas pelas hidrólases
(EC 3.x.y.z) um dos reagentes é a água e o
substrato rompe-se nas suas partes constituintes:
AB + H2O → A + B
As hidrólases catalisam
a rotura de ligações sendo a água um dos substratos.
Exemplos de ligações que podem sofrer rotura hidrolítica:
Glicose-6-fosfátase
1- éster (produtos = álcool + ácido)
ou tioéster (produtos = tiol + ácido)
(glicose-6-P + H2O → glicose + Pi)
2- lactona (produtos = álcool + ácido; notar que neste caso,
porque a lactona é “um éster interno”: A + H2O → B)
ATPase (ATP + H2O → ADP + Pi)
3- anidrido (produtos = ácido + ácido)
4- amida (produtos = ácido + amina ou ácido + amónio)
5- osídicas (produtos = semi-acetal + álcool ou
semi-acetal + semi-acetal ou semi-acetal + ácido ou o semi-acetal + amina)
Em geral, quando à frente do nome de um composto se coloca o sufixo “ase” a enzima
é uma hidrólase (maltase, amílase, fosfolípase, lípase, ATPase, glutamínase ...).
25
Quase sempre catalisam reações fisiologicamente irreversíveis.
As lígases (ou sintétases) (EC 6.x.y.z) catalisam reações que podem ser lidas
como sendo o somatório de duas reações: uma de hidrólise do ATP e outra
de combinação de duas substâncias.
H2O
pirofosfátase inorgânica
(PPi + H2O → 2 Pi)
2
26
H2O
Nalgumas lígases o nucleosídeo trifosfato envolvido na reação
não é ATP mas o GTP.
ATP + A + B ↔ ADP + Pi + AB ou
ATP + A + B ↔ AMP + PPi + AB
Nas reações catalisadas pelas lígases a
energia libertada no processo de
hidrólise
do ATP permite a
combinação de dois reagentes A e B.
Ou, considerando o sentido inverso,
que a energia libertada na cisão de AB
permite a síntese de ATP.
Sintétase do AB
No ciclo de Krebs a reação catalisada pela sintétase de succinil-CoA (uma das isoenzimas)
evolui no sentido da rotura do succinil-CoA e síntese de GTP:
GDP + Pi + succinil-CoA → succinato + CoA + GTP
Podemos considerar, conceptualmente,
que a sintétase de succinil-CoA faz a acoplagem de duas reações:
Quando a rotura do ATP ocorre
entre os resíduos fosfato β e γ forma-se ADP e Pi
…mas quando ocorre entre os resíduos fosfato α e β
27
forma-se AMP e PPi.
Succinil-CoA + H2O → Succinato + CoA (reação exergónica)
∆G1<0
GDP + Pi → GTP + H2O
(reação endergónica)
∆G2>0
28
∆G(1,2)=∆G1+∆G2
GDP + Pi + Succinil-CoA ↔ GTP + Succinato + CoA
As cínases são fosfotransférases que catalisam reações do tipo:
ATP + Y → ADP + Y-P.
As reações catalisadas pelas cínases chamam-se fosforilações.
Nas reações catalisadas pelas transférases (EC 2.x.y.z)
um substrato dador cede um grupo químico ou um resíduo
a um outro substrato (o substrato aceitador) que o aceita:
XT + Y → X + YT
Nas reações catalisadas por cínases o resíduo transferido é um fosfato e, em geral,
o dador de fosfato é o ATP (ou o GTP) que cede o fosfato γ (o terceiro) a um aceitador.
Numa reação enzímica do tipo: ATP + Y ↔ ADP + Y-P
a enzima denominar-se-ia cínase do Y sendo Y o substrato que aceita o fosfato γ do ATP.
Exemplos de cínases:
Uma transférase catalisa uma reação em que um resíduo T é transferido de XT para Y
(ou, tendo em conta a reação inversa, de YT para X).
São exemplos de transférases:
1- cínases
(ATP + Aceitador → ADP + Aceitador-P)
2- fosforílases
(Dador-T + Pi → Dador + T-P)
3- pirofosforílases
(Dador-T + PPi → Dador + T-PP)
3’- transférases de nucleotidato (NTP + aceitador → NMP-aceitador + PPi)
29
Numa reação enzímica do tipo: ATP + Y ↔ ADP + Y-P
a enzima denominar-se-ia cínase do Y
e a regra mantém-se mesmo quando o aceitador é outra enzima.
cínase da glicose
cínase da frutose-6-P
cínase do piruvato
A denominação das cínases
não tem em linha de conta o sentido em que a reação ocorre nos seres vivos:
(1) a cínase do piruvato catalisa in vivo a fosforilação do ADP pelo fosfoenolpiruvato.
(2) a cínase do adenilato (=AMP) catalisa a fosforilação do AMP pelo ATP (mas30
também a reação inversa; é fisiologicamente reversível): ATP + AMP ↔ 2 ADP
Alguns fármacos e hormonas exercem os seus
efeitos ligando-se a recetores celulares que têm
atividade catalítica intrínseca e que são,
portanto, enzimas.
Alguns recetores celulares são enzimas.
Exemplo:
a cínase da desidrogénase do piruvato
catalisa a fosforilação da desidrogénase do piruvato pelo ATP
O recetor da insulina é uma
cínase que,
quando a insulina está
ligada,
catalisa a fosforilação de
uma proteína citoplasmática
chamada “substrato do
recetor da insulina”.
Algumas cínases (como a PKA; cínase de proteínas dependente do AMP cíclico)
são relativamente inespecíficas catalisando a fosforilação de muitas enzimas e
essa fosforilação pode ativar ou inibir essas enzimas.
Em geral,
quando existe uma cínase
que catalisa a fosforilação de um substrato A
existe também uma fosfátase (hidrólase)
que catalisa a desfosforilação do substrato A fosforilado
… e ambas as reações são (quase sempre)
fisiologicamente irreversíveis
31
ATP + síntase do
glicogénio
(ativa)
PKA (ligada
ao AMPc)
ADP + síntase do
glicogénio fosforilada
32
(inativa)
As fosforílases são transférases em que o substrato aceitador
é o fosfato inorgânico (Pi): XT + Pi ↔ X + T-P.
As reações catalisadas pelas fosforílases denominam-se fosforólises.
As pirofosforílases são enzimas em que o substrato aceitador do resíduo
transferido é o pirofosfato inorgânico (PPi): XT + PPi ↔ X + T-P-P.
As reações catalisadas pelas pirofosforílases denominam-se pirofosforólises.
Numa reação do tipo XT + PPi ↔ X + T-P-P
Numa reação do tipo XT + Pi ↔ X + T-P
a enzima denominar-se-ia fosforílase do XT (T é o resíduo transferido)
...e XT sofre uma fosforólise: XT rompe-se (lise) por ação do fosfato inorgânico (Pi).
a enzima denominar-se-ia pirofosforílase do XT
...e XT sofre pirofosforólise: rompe-se (lise) por ação do pirofosfato inorgânico (PPi).
Exemplo de fosforílase:
A fosforílase do glicogénio
catalisa
a fosforólise do glicogénio
Exemplo de pirofosforílase:
Pirofosforílase do UDPGlicose
Glicose-glicose-glicose...+ Pi →
glicose-glicose...+ Glicose-1-P
Para compreender porque se denomina pirofosforílase do uridino-difosfato de glicose
(UDP-glicose) à enzima que catalisa a reação Glicose-1-P + UTP → UDP-glicose +
PPi, temos de pensar na reação inversa aquela que de facto ocorre nas células dos
seres
34
vivos. A reação inversa é a pirofosforólise do UDP-glicose.
33
As polimérases de ácidos nucleicos são transférases de nucleotidato em que o
resíduo transferido é um nucleosídeo monofosfato, o substrato dador um
nucleosídeo trifosfato e o substrato aceitador a cadeia (de ácido nucleico) que está
a crescer:
NTP + ácido nucleico (n resíduos) → ácido nucleico (n+1 resíduos) + PPi
Nas reações catalisadas pelas
líases (EC 4.x.y.z) um dos
reagentes que contém uma
dupla ligação combina-se com
um segundo reagente de tal
maneira que o produto já não
contém a dupla ligação:
A=B + C ↔ ABC
Ou, pensando na reação inversa:
são líases as enzimas que catalisam reações
em que um composto se rompe dando
origem a dois produtos sendo que um destes
produtos contém uma dupla ligação que não
existia no composto que lhe deu origem:
ABC ↔A=B + C
Frequentemente o composto C é a
água mas aqui, ao contrário do
caso das hidrólases, a reação de C
com A=B não resulta na lise de A=B.
35
36
As oxi-redútases (EC 1.x.y.z)
catalisam reações de oxiredução
1) As desidrogénases são oxi-redútases que catalisam reações do tipo:
NAD+
NADP+
FAD
FMN
AH2 +
A+
desidrogénase de AH2
NADH
NADPH
FADH2
FMNH2
Exemplos de nomes associados a oxi-redútases:
Desidrogénases
Redútases
Oxídases
Oxigénases
Peroxídases
Catálase
Dismútases
dinucleotídeos são substratos
O2 é o oxidante direto
o H2O2 é reduzido a água...
catalisam reações de dismutação
37
38
A desidrogénase do piruvato catalisa uma reação complexa em que,
para além da oxidação da piruvato a CO2 e acetato,
também há formação de uma ligação (tioéster) entre o grupo tiol da coenzima A
e o grupo carboxílico do acetato.
As desidrogénases são muito comuns no metabolismo e às vezes catalisam
reações muito complexas. Exemplos de desidrogénases:
etanol
NAD+
acetaldeído
Desidrogénase do etanol
NADH
Com a perda de
hidrogénios
fiquei mais
oxidado que o
etanol
NAD+
lactato
NAD+
NADH
Ubiquinona (Q)
CO2
Coenzima A
NADH
piruvato
Piruvato
Acetil-CoA
Desidrogénase do lactato
NADH
NAD+
Ubiquinol (QH2)
NAD+
Desidrogénase do NADH
(não se chama desidrogénase
do ubiquinol)
NADH
Desidrogénase do piruvato
39
40
2) As redútases também são oxi-redútases. A maioria das redútases
catalisa reações do mesmo tipo das desidrogénases
mas o redutor é o NADPH...
NAD+
NADH
A+
3) As oxídases também são oxi-redútases. Catalisam reações em que o
O2 é um dos reagentes que se reduz
a H2O, a peróxido de hidrogénio (H2O2) ou a ião superóxido (O2• -).
redútase do A
NADPH
FADH2
FMNH2
AH2 +
NADP+
NADPH + dissulfureto de glutatião (GSSG) →
NADPH + 2 O2
+ 2 glutatião (2GSH)
NADP+
NADPH
2 e-
2 cyt. c (Fe3+) + H2O
oxídase do citocromo c
FAD
FMN
Exemplo: redútase do glutatião;
NADP+
2 cyt. c (Fe2+) + ½ O2
oxídase da NADPH
NADP+ + 2 O2• -
4) As mono-oxigénases (também chamadas oxigénases de função mista)
também são oxi-redútases. Catalisam reações em que o O2 é o oxidante direto,
sendo que um dos átomos de oxigénio se vai incorporar num composto
orgânico que é oxidado e o outro vai formar água.
São frequentemente chamadas hidroxílases; neste caso seria hidroxílase do VH
(no exemplo está a reação catalisada pela hidroxílase da fenilalanina)
H+
41
H+
VH
VOH
O2
H2O
WH2
W
fenilalanina
tirosina
H2O
O2
tetrahidrobiopterina
dihidrobiopterina
42
5) As peroxídases também são oxi-redútases. Catalisam reações em que o
H2O2 é o agente oxidante direto de um composto orgânico.
Exemplo: a hidroxílase da fenilalanina
Exemplo: a peroxídase do glutatião é a mais conhecida
2 Glutatião (2 GSH) + H2O2 → dissulfureto de glutatião (GSSG) + 2 H2O
tirosina
fenilalanina
2 etetrahidrobiopterina
2H+
dihidrobiopterina
A fenilalanina oxidou-se ganhando um átomo de oxigénio.
A tetrahidrobiopterina também se oxidou perdendo dois átomos de43
hidrogénio.
H2O2
2 H 2O
44
6) A catálase catalisa a dismutação do
peróxido de hidrogénio: 2 H2O2 → O2 + 2 H2O
H2O2
A palavra síntase (não confundir com sintétase) está popularmente associado
a algumas enzimas e as síntases podem pertencer a diferentes classes.
n.o. = 0
O2
2 e-
n.o. = - 1
2H+
H2O2
n.o. = - 2
2 H2O
“Uma das moléculas de peróxido de hidrogénio oxida-se perdendo dois
átomos de hidrogénio que são aceites pela outra.”
7) A dismútase do superóxido catalisa a dismutação do
superóxido: 2 O2• - → O2 + H2O2
O2• n.o. = - ½
e-
O2• -
H2O2
1- A síntase do glicogénio
é de facto uma transférase.
2 - A síntase do ATP
é de facto uma hidrólase (e, simultaneamente um
transportador de protões).
n.o. = 0
O2
Algumas vezes o nome que foi
originalmente atribuído a uma
enzima (síntase do composto X),
embora fora da nomenclatura
sistemática, manteve-se o mais
popular ao longo dos anos.
n.o. = - 1
ADP + Pi → ATP + H2O
2H+
“Uma das moléculas de superóxido perde um eletrão que é aceite pela
45
outra.”
A componente exergónica do processo é o transporte de protões
através de um componente da enzima que está mergulhado na
membrana interna da mitocôndria. Os protões deslocam-se a
favor do seu gradiente eletroquímico.
À rotura hidrolítica das ligações fosfoanidrido do ATP (entre os fosfatos α-β e βγ) estão associados valores de ∆Gº (delta G zero) “muito” negativos;
por isso se diz na gíria dos bioquímicos que
estas ligações são “ricas em energia”.
As ligações em que o ∆Gº que corresponde à sua rotura hidrolítica (em
condições padrão) tem um valor semelhante ou é ainda mais negativo que o
que corresponde à rotura das ligações fosfoanidrido do ATP (- 31 kJ mol-1 ou 46 kJ mol-1) dizem-se “ricas em energia” e costumam representar-se por
46
∆Gº= - 43 kJ
1- Dizemos que a glicose e o etanol
“são substâncias energéticas” porque no seu processo de oxidação libertam enormes quantidades
de energia:
As ligações “ricas em energia” podem ser de tipo:
a) fosfoanidrido como no ATP
Glicose + 6 O2 → 6 CO2 + 6 H2O
∆Gº = - 2840 kJ/mol
b) fosfamida como na fosfocreatina
Etanol + 2 O2 → 2 CO2 + 2 H2O
∆Gº = - 168 kJ/mol
c) enolfosfato como no fosfoenolpiruvato.
Os ∆Gº não se referem às condições nos seres vivos; os ∆Gº referem-se sempre a condições padrão.
∆Gº= -62 kJ
2- Quando dizemos que o ATP é “uma substância energética” não estamos a falar da reação de
oxidação do ATP mas da sua fosfohidrólise.
ATP + H2O → ADP + Pi
∆Gº = - 31 kJ/mol
ATP + H2O → AMP + PPi
∆Gº = - 46 kJ/mol
∆Gº= -36 kJ
∆Gº= -31 kJ
d) tioéster como no succinil-CoA.
∆Gº= -46 kJ
47
Quando dizemos que o ATP, a fosfocreatina, o fosfoenolpiruvato ou o succinil-CoA
48
“são substâncias energéticas” estamos simplesmente a dizer que a sua fosfohidrólise
tem um valor de ∆Gº muito negativo.
Embora o ∆Gº seja apenas uma medida da Keq (e não determine por si só o
sentido em que a reação vai evoluir) o conceito de “ligação rica em energia”
revelou-se útil…
(1) porque, normalmente, quando uma enzima catalisa o acoplamento de duas
semirreações em que uma é a rotura de uma “ligação rica em energia” e a outra a
formação de uma ligação que “não é rica em energia” (como as fosfoéster) a reação é
fisiologicamente irreversível…
Exemplos:
+ glicose → ADP + glicose-6-P
As acil-transférases catalisam reações fisiologicamente
irreversíveis. Rompe-se uma ligação tioéster (“rica em energia”)
formando-se uma ligação éster.
Acil-CoA
(cínase da glicose)
+ frutose-6-P → ADP + frutose-1,6-bisfosfato (cínase da frutose-6-P)
2-monoacil-glicerol
(2) e porque, normalmente, quando nas duas semirreações acopladas, numa se rompe e
na outra se forma uma “ligação rica em energia” a reação é fisiologicamente reversível
+ ADP ↔ succinato + CoA +
Síntétase de succinil-CoA
Exemplos:
+ ADP ↔ creatina +
Cínase da creatina
+ ADP
↔ 3-fosfoglicerato +
CoASH
49
Cínase do 3-fosfoglicerato
A cínase do 3-fosfoglicerato catalisa uma reação de fosfotransferência que é
fisiologicamente reversível
1,2-diacil-glicerol
As reações enzímicas que
in vivo geram PPi têm um
∆G (real) muito negativo
porque o produto PPi é
rapidamente hidrolisado
pela ação catalítica de
pirofosfátases que mantém
a sua concentração muito
baixa.
No 1,3-bisfosfoglicerato há, no
carbono 1, uma ligação
anidrido (“rica em energia”)
que não existe no 3fosfoglicerato...
Como resultado da ação catalítica
das pirofosfátases celulares
⇒ a concentração de PPi na célula
é muito baixa;
não existe um dos substratos para
que a reação inversa possa ocorrer
…mas nem sempre o acoplamento de semirreações em que há formação e
rotura de “ligações ricas em energia” corresponde a reações fisiologicamente
reversíveis: por exemplo, a reação catalisada pela cínase do piruvato é
fisiologicamente irreversível.
+ ADP
→ piruvato +
51
50
As reações em que um dos produtos é o PPi
são reações exergónicas em todas as condições metabólicas
reações fisiologicamente irreversíveis.
52
nutrientes
ADP
Pi
As vias metabólicas catabólicas são aquelas em que
(1) polímeros sofrem hidrólise (ou fosforólise) libertando os seus
monómeros
I love
electrons
O2
Fosforólise do glicogénio
O2
Exemplos:
∆G > 0
enzimas e
enzimas/transportadores
envolvidas no
catabolismo
Hidrólise das proteínas e ácidos nucleicos
∆G < 0
NAD+
CO2
ATP
ou (2) em que substratos se cindem ou se oxidam em processos
exergónicos que estão, frequentemente acoplados a processos
endergónicos de síntese de ATP ou de outros nucleosídeos
trifosfato.
NADH
H2O
H2O
We hate
electrons
nutrientes
Glicólise e oxidação da glicose
Exemplos:
Oxidação das gorduras
Oxidação dos aminoácidos
53
54
As vias metabólicas anabólicas são aquelas em que (1) se sintetizam
polímeros a partir de precursores dos monómeros constituintes desses
polímeros ou (2) em que se sintetizam esses precursores.
Nutrientes ou
intermediários
do
metabolismo
ATP
Hidrólise dos triacilgliceróis
Síntese de glicogénio a partir de glicose
H2O
Síntese de glicose a partir de lactato ou alanina
∆G > 0
∆G < 0
Exemplos:
enzimas e
enzimas/
transportadores
Síntese de triacilgliceróis e outros lipídeos
Síntese de aminoácidos e de proteínas
Pi
ADP
proteínas,
glicoproteínas,
lipídeos e glicídeos
complexos, ácidos
nucleicos...
Síntese de palmitato a partir de acetil-CoA
Síntese de nucleotídeos e de ácidos nucleicos
55
Os processos anabólicos são a componente endergónica de processos
metabólicos em que a componente exergónica (que permite que eles ocorram)
56
são a hidrólise de ATP (e, em última análise, a oxidação de nutrientes.)
Bibliografia aconselhada:
Nelson DL & Cox MM. (2005) Lehninger Principles of Biochemistry. 4th ed. Worth
Publishers. New York.
Chang R. (1994) Química 5ª ed. McGrow-Hill de Portugal, Lda
Fontes R (2008) Notas sobre Introdução às reacções enzímicas. Equilíbrio químico, catálise
e classificação funcional.
Fontes R (2003) Notas de termodinâmica química e calorimetria (A energia como um
conceito menos intuitivo que o que parece).
57