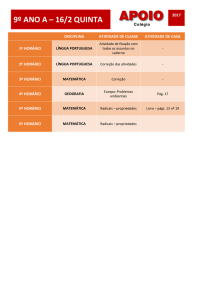
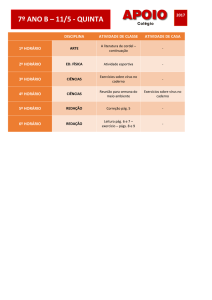
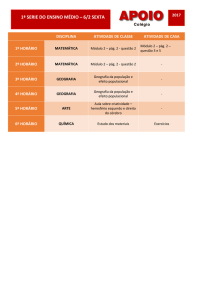
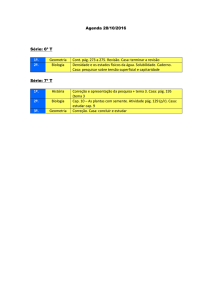
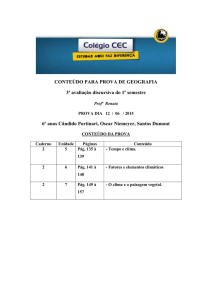
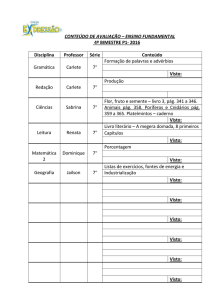
Exercícios: Cap. 11 (Equilíbrio Químico)
1) Escreva a expressão da constante de equilíbrio para (a) H 2(g) + I2(g)
2HI(g); (b) Cd2+(aq) + 4Br-(aq) CdBr42-(aq). pág. 538.
2) A constante de equilíbrio para a reação H2(g) + I2(g) 2HI(g) varia com a
temperatura como segue: Keq = 794 a 298 K; Keq= 54 a 700 K. A formação de
HI é mais favorecida a temperatura mais alta ou mais baixa?. pág. 538.
3) Para a formação de NH3 a partir de N2 e H2, N2(g) + 3H2(g) 2NH3(g), Keq=
4,34 x10-3 a 300 C. Qual é o valor de Keq para a reação inversa?. pág. 539.
4) Dada a seguintes informações: pág. 540.
HF(aq) H+(aq) + F-(aq)
Keq=6,8 x 10-4
H2C2O4(aq) 2H+(aq) + C2O42-(aq) Keq=3,8 x 10-6
Determine o valor da constante de equilíbrio para a seguinte reação:
2HF(aq) + C2O42- 2F-(aq) + H2C2O4(aq)
5) Escreva a expressão da constante de equilíbrio para cada uma das
seguintes reações: pág. 543.
(a) CO2(g) + H2(g) CO2(g) + H2O(l)
(b) SnO2(s) + 2CO(g) Sn(s) + 2CO2(g)
(c) Sn(s) + 2H+(aq) Sn2+(aq) + H2(g)
6) Cada uma das seguintes misturas foi colocada em um recipiente fechado e
deixada em repouso. Qual(is) das seguintes misturas é(são) capaz(es) de
atingir o equilíbrio expresso pela equação a seguir:
CaCO3(s) CaO(s) + CO2(g) (ver pág. 542)
a) CaCO3 puro, b) CaO e uma pressão maior de CO2 maior que o valor de Keq;
c) um pouco de CaCO3 e uma pressão de CO2 maior que o valor de Keq; d)
CaCO3 e CaO?.
7) Dissolve-se uma quantidade de amônia suficiente em 5,00 L de água a 25
C para produzir uma solução de 0,0124 mol L -1 de amônia. A solução é
mantida até que atinja o equilíbrio. A análise da mistura em equilíbrio mostra
que a concentração de OH- é de 4,64 x10-4 mol L-1. Calcule a Keq a 25 C para
essa reação. pág. 545.
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
8) A 448 C a constante de equilíbrio, Keq, para a reação é 51.
H2(g) + I2(s) 2HI (g)
Determine como a reação prosseguirá para atingir o equilíbrio a 448 C se
começarmos com 2,0 x10-2 mol de HI, 1,0 x10-2 mol de H2 e 3,0 x10-2 mol de I2
em um recipiente de 2,00 L. pág 546.
9) Um frasco de 1,00 L é preenchido com 1,00 mol de H 2 e 2,00 mols de I2 a
448 C. O valor da constante de equilíbrio, Keq, para a reação:
H2(g) + I2(g) 2HI(g)
A 448 C é 50,5. Quais são as pressões parciais de H2, I2 e HI no frasco no
equilíbrio?. pág. 548.
10) Considere o seguinte equilíbrio:
N2O4(g) 2NO2(g)
Em qual sentido o equilíbrio se deslocará quando cada uma das seguintes
variações for feita ao sistema no equilíbrio: (a) adição de N 2O4; (b) remoção de
NO2; (c) aumento da pressão total pela adição de N2; (d) aumento do volume;
(e) diminuição da temperatura. pág 554.
11) Quando as seguintes reações chegam ao equilíbrio, a mistura em equilíbrio
contém mais reagentes ou mais produtos?. 15.9; pág. 559.
a) N2(g) + O2(g) 2NO(g); Keq=1,5x10-10
b) 2SO2(g) + O2(g) 2SO3(g); Keq=2,5x10-9
12) Uma mistura de 0,10 mol de NO, 0,50 mol de H2 e 0,10 mol de H2O é
colocada em um recipiente de 1,0 L a 300 K. O seguinte equilíbrio é
estabelecido:
2NO(g) + 2H2(g) N2(g) + 2HN2O(g)
No equilíbrio, PNO=1,53 atm. (a) calcule as pressões parciais de H2, N2 e H2O.
(b) Calcule a Keq. 15.23, pág. 560.
13) A 2000 C a constante de equilíbrio para a reação. (15.33; pág. 560).
Br2(g) 2Br(g); Keq=0,133
Um recipiente de 0,200 L contendo uma mistura em equilíbrio dos gases tem
0,245 g de Br2(g). Qual é a massa de Br(g) no recipiente?.
Para a reação:
H2(g) + I2(g) 2HI(g); Keq=55,3 a 700 K.
Em um frasco de 0,200 L contendo uma mistura em equilíbrio dos três gases,
existem 0,056 g de H2 e 4,36 g de I2. Qual é a massa de HI no frasco?.