PROTOCOLO
HEMORRAGIA
PUERPERAL
protocolo
Pré Natal e Puerpério
Instituições participantes
Associação Brasileira de Enfermeiras obstétricas
Escola de Enfermagem UFMG
Faculdade de Medicina da UFMG
Hospital das Clínicas - UFMG
Hospital Julia Kubitschek - FHEMIG
Hospital Municipal Odilon Behrens
Hospital Risoleta Tolentino Neves
Hospital Sofia Feldman
Maternidade Odete Valadares - FHEMIG
Santa Casa de Saúde de Belo Horizonte
Sociedade de Anestesiologia de Minas Gerais - SAMG
Sociedade de Obstetrícia e Ginecologia de Minas Gerais - SOGIMIG
Coordenação editorial
Patrícia Pereira Rodrigues Magalhães
Sônia Lansky
Elaboração
Caroline Reis Gonçalves
Gabriel Costa Osanan
Sérgio Monteiro Delfino
Colaboradores
Eliane Soares
Felipe José Melo
Francisco Lírio Ramos
João Batista Marinho de Castro Lima
Lucas Barbosa da Silva
Mário Dias Corrêa Júnior
Nayara Figueiredo Vieira
Nelci Muller Xavier Faria
Paulo Carreiro
Quésia Tamara Mirante Ferreira Villamil
Regina Amélia Lopes Pessoa de Aguiar
Simone de Castro e Santos
Projeto Gráfico
Produção Visual - Gerência de Comunicação Social
Secretaria Municipal de Saúde
Belo Horizonte
2016
Sumário
Introdução............................................................................................................................................................................4
1 Conceito...........................................................................................................................................................................4
2 Classificação....................................................................................................................................................................5
3 Avaliação dos fatores de risco...................................................................................................................................5
3.1 Classificação de risco e medidas preventivas.................................................................................................5
4 Prevenção da hemorragia...........................................................................................................................................6
4.1 Manejo ativo do 3º estágio.................................................................................................................................7
4.1.1 Profilaxia medicamentosa com a ocitocina.................................................................................................7
4.1.2 Clampeamento oportuno do cordão umbilical..........................................................................................9
4.1.3 Tração controlada do cordão e manobra de Brandt-Andrews...............................................................9
4.2 Massagem uterina periódica no 4º estágio (período de observação)................................................. 10
4.3 Outras medidas de prevenção da HPP.......................................................................................................... 10
5 Reconhecimento da hemorragia............................................................................................................................ 10
5.1 Estimativa visual da perda volêmica.............................................................................................................. 10
5.2 Estimativa da perda volêmica através da pesagem das compressas.................................................... 11
5.3 Estimativa da perda volêmica através do uso de dispositivos coletores............................................. 12
5.4 Avaliação dos sinais vitais.................................................................................................................................. 12
5.5 Índice de choque................................................................................................................................................. 13
5.6 Atrasos no manejo da hemorragia e a “Hora de Ouro”............................................................................ 14
5.7 Hora de ouro na hemorragia obstétrica ...................................................................................................... 15
6 Estágios de manejo da hemorragia....................................................................................................................... 16
6.1 Estágio I.................................................................................................................................................................. 16
6.1.1 Conceito.............................................................................................................................................................. 16
6.1.2 Comunicação/mobilização............................................................................................................................ 17
6.1.3 Monitoração/investigação/diagnóstico..................................................................................................... 17
6.1.4 Tratamento medicamentoso da atonia uterina....................................................................................... 18
6.1.5 Tratamento de acordo com a causa do sangramento........................................................................... 19
6.2 Estágio II................................................................................................................................................................. 21
6.2.1 Conceito.............................................................................................................................................................. 21
6.2.2 Comunicação/mobilização............................................................................................................................ 21
6.2.3 Ressuscitação..................................................................................................................................................... 21
6.2.4 Monitoração/investigação/diagnóstico..................................................................................................... 22
6.2.5 Tratamento/interrupção do sangramento de acordo com a causa................................................... 22
6.3 Estágio III................................................................................................................................................................ 25
6.3.1 Conceito.............................................................................................................................................................. 25
6.3.2 Comunicação/mobilização............................................................................................................................ 25
6.3.3 Ressuscitação..................................................................................................................................................... 25
6.3.4 Monitoração/investigação/diagnóstico..................................................................................................... 27
6.3.5 Tratamento/interrupção do sangramento................................................................................................ 27
Anexos
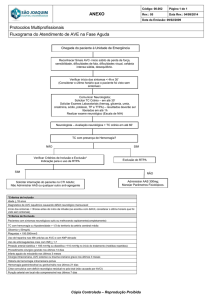
Anexo I - Algoritmo para assistência à HPP........................................................................................................ 35
Anexo II - Check-list da HPP.................................................................................................................................... 36
Anexo III - Kit HPP...................................................................................................................................................... 37
Anexo IV - Transfusão de hemoderivados........................................................................................................... 38
Anexo V - Abordagem cirúrgica da placenta increta/percreta..................................................................... 40
Anexo VI - Traje anti-choque não-pneumático em obstetrícia..................................................................... 41
Referência bibliográfica................................................................................................................................................. 45
Protocolo de Hemorragia puerperal
Introdução
A Comissão Perinatal da Secretaria Municipal de Saúde de Belo Horizonte apresenta o protocolo de hemorragia puerperal, mais uma iniciativa para a proteção e promoção da saúde da mulher
com impacto imediato na prevenção da morbi-mortalidade materna no município.
Esta nova edição do Protocolo de Hemorragia puerperal (HPP) é resultado da construção coletiva a partir da parceria com as maternidades públicas de Belo Horizonte, as entidades profissionais
Associação Mineira de Ginecologia e Obstetrícia (SOGIMIG), Associação Brasileira de Enfermagem Obstétrica –MG (ABENFO), Sociedade Mineira de Anestesiologia (SAMG) e a Faculdade de
Medicina da Universidade Federal de Minas Gerais. O objetivo é prevenir e reduzir a mortalidade
materna em Belo Horizonte, humanizar a assistência e facilitar o acesso da gestante e puérpera
aos serviços de saúde, além de melhorar o processo de trabalho nas maternidades, impactando
sobre a principal causa evitável de morte materna. Trata-se de trabalho construído de forma responsável e participativa, com a elaboração conjunta, discussão e socialização por meio de oficinas
de trabalho envolvendo as maternidades, a atenção básica de saúde, os conselhos de saúde,
entidades profissionais e o movimento social organizado, que pode influenciar de maneira positiva
no cuidado em saúde para os usuários e profissionais da assistência.
Os profissionais da rede de assistência terão à sua disposição para consulta material técnico baseado
na melhor evidência disponível na literatura mundial, organizado em forma de protocolo, contendo um
guia prático com recomendações para avaliação e condutas imediatas. As mulheres terão acesso em
qualquer maternidade a assistência de excelência, atendendo aos preceitos da segurança do paciente.
Em Belo Horizonte, foi realizado um grande esforço conjunto para alcançar a Meta 5 do Objetivo
do Milênio, definida pela Organização das Nações Unidas (ONU), de redução da mortalidade materna em 75% até 2015, atingindo 31,6/100.000 mortes por nascidos vivos. Predominam os óbitos
maternos por causas obstétricas diretas, relacionadas à atenção de saúde, e a hemorragia como
a causa mais frequente de óbito. A prevenção primária e o tratamento das hemorragias obstétricas deve ser prioridade na abordagem dos profissionais e instituições envolvidas na assistência
obstétrica. As recentes publicações da SMSA, Protocolo de Assistência ao Parto e Nascimento e
Protocolo de Pré Natal, vêm de encontro a este propósito.
Acreditamos assim, que Belo Horizonte avança mais um passo na direção da qualificação e
humanização da assistência, com o aprimoramento do trabalho e oferta do melhor cuidado em
saúde, promovendo o direito à vida das mulheres e bebês da cidade.
1
Conceito
HPP Significativa
Qualquer perda de sangue pelo trato genital capaz de causar instabilidade hemodinâmica.
ou
Perda sanguínea acima de 500 mL pelo trato genital nas primeiras 24 horas
após parto vaginal ou acima de 1000mL após parto cesariana.
HPP Grave/Maciça
Sangramento nas primeiras 24 horas após o parto (por qualquer via) superior a 2000mL ou
que necessite da transfusão mínima de 1200mL (4 unidades) de concentrado de hemácias ou
que resulte na queda de hemoglobina ≥ 4g/dL ou em distúrbio de coagulação.
4
2 Classificação
Primária
É aquela que ocorre dentro das primeiras 24 horas pós-parto, causada especialmente pela
atonia uterina (80%), retenção placentária (acretismo), distúrbio de coagulação, inversão uterina,
lacerações e hematomas no trajeto do canal do parto. Acontece em 4 a 6% de todas as gestações.
Secundária
É aquela que ocorre após 24 horas até 6 a 12 semanas após o parto, causada por retenção de restos
placentários, erros de coagulação hereditários, infecção puerperal ou doença trofoblástica gestacional.
3 Avaliação dos fatores de risco
É importante que seja feita a identificação dos fatores de risco anteparto e intraparto por meio
de anamnese detalhada, incluindo história gineco-obstétrica e pregressa da paciente (Quadro 1).
Quadro 1 - Fatores de risco para HPP
Anteparto
História pregressa de HPP
Distensão uterina (Gemelar, polidrâmnio, macrossomia)
Distúrbios de coagulação
Uso de anticoagulantes
Placentação anormal (acreta, prévia)
Grande multípara (> 4 partos vaginais ou ≥ 3 partos cesarianas)
(grande multípara tem várias definições, uma comum é ≥ 5 partos)
Pré-eclâmpsia
Anemia prévia
Primeiro filho após os 40 anos
Intraparto
Trabalho de parto prolongado
Trabalho de parto taquitócico
Laceração vaginal de 3º/4º graus
Prolongamento de episiotomia
Placentação anormal (acreta, prévia)
Descolamento Prematuro de Placenta
Parto induzido
Corioamnionite
Parada de progressão do polo cefálico
Parto instrumentado (fórceps, vácuo)
3.1 Classificação de risco e medidas preventivas
As gestantes e puérperas devem ser submetidas a um processo de classificação de risco no início
do atendimento, e para cada perfil de classificação deve ser tomada uma medida específica (Quadro 2).
Quadro 2 - Avaliação do fator de risco para HPP na admissão
Baixo risco
Médio Risco
Ausência de cicatriz uterina
Gravidez única
≤ 4 partos vaginais prévios
(os estudos em geral relatam
risco com ≥ 4 filhos)
Ausência de distúrbio de
coagulação
Ausência de história de
HPP
Cesariana ou cirurgia uterina prévia
Pré-eclâmpsia leve
Distensão uterina (Gemelar, polidrâmnio, macrossomia)
> 4 partos vaginais (os estudos em geral
relatam risco com ≥ 4 filhos)
Corioamnionite
Grandes miomas uterinos
Varizes pélvicas
História prévia de atonia uterina ou hemorragia obstétrica
Obesidade materna (IMC > 35kg/m2)
Alto risco
Placenta prévia ou de inserção baixa
Pré-eclâmpsia grave
Hematócrito < 30%
Plaquetometria < 100.000/mm3
Sangramento ativo anormal à admissão
Doenças da coagulação
Uso de anticoagulantes
Descolamento prematuro de placenta
Anormalidades de implantação da placenta
Presença de ≥ 2 fatores de médio risco
HPP: hemorragia puerperal
5
Protocolo de Hemorragia puerperal
O fator de maior gravidade determina a classificação de risco da gestante. Assim define-se:
1.Gestante de baixo risco: aquelas pacientes com ausência de fatores de risco. A maioria
dos casos de HPP ocorre neste grupo;
2.Gestante de médio risco: aquelas pacientes com apenas 1 fator de médio risco e nenhum de alto risco;
3.Gestante de alto risco: pacientes com ≥ 1 fatores de alto risco ou ainda aquelas com ≥ 2
fatores de médio risco.
Tal classificação é importante para definir cuidados rotineiros para cada perfil de gestante\puérpera. Por exemplo, as gestantes de médio ou alto risco deverão ter amostra de sangue colhida
para tipagem sanguínea, com hemograma e prova cruzada à admissão. Deve-se avaliar um acesso venoso. Sugere-se que todas tenham uma etiqueta de identificação de risco no prontuário para
sinalizar para toda a equipe.
No grupo de alto risco, a reserva de 2 bolsas de concentrado de hemácias (CH) já deverá ser feita à admissão e o banco de sangue deve estar ciente da possibilidade de hemotransfusão maciça.
As pacientes com um ou mais fatores de risco para HPP deverão ser mantidas em observação
com monitorização não invasiva por 1 a 2 horas na Sala de Recuperação Pós-anestésica. Após
este período, devem ser encaminhadas para enfermaria com observação rigorosa.
Deve-se lembrar que o sangramento habitual em um parto vaginal é de 400 a 500mL e, na cesariana, de 800 a 1000mL. As pacientes anêmicas, brevilíneas e portadoras de pré-eclâmpsia grave
geralmente toleram menos as perdas volêmicas, apresentando uma piora mais rápida do estado hemodinâmico nessas situações e desenvolvendo um quadro de choque hipovolêmico mais refratário.
As principais recomendações estão resumidas na Quadro 3:
Quadro 3 - Classificação de risco e condutas preventivas
Baixo risco
Médio Risco
Alto risco
-
Etiqueta identificadora
Etiqueta identificadora
Acesso venoso periférico cateter 16G
-
Tipagem sanguínea
Tipagem sanguínea e prova cruzada
-
-
Reserva de sangue (2 bolsas de CH)
Manejo ativo do 3º estágio
Manejo ativo do 3º estágio
Manejo ativo do 3º estágio
Observação conforme protocolo da
instituição
Observação rigorosa por 1-2 horas
em local adequado*
Observação rigorosa por 1-2 horas
em local adequado*
Estimular presença do acompanhante Estimular presença do acompanhante Estimular presença do acompanhante
para ajudar a detectar sinais de alerta para ajudar a detectar sinais de alerta para ajudar a detectar sinais de alerta
*Local adequado para observação do 4º período pode variar de acordo com a estrutura da instituição e da gravidade do caso (sala de recuperação; Leitos de pré-parto; sala de pré-parto, parto e pós-parto- PPP; sala de cuidados intermediários-CTI). No entanto, para essas pacientes,
tal observação não deverá ser realizada no alojamento conjunto.
4 Prevenção da hemorragia
As principais estratégias propostas, atualmente, para se prevenir uma HPP são:
• 4.1-Manejo ativo do 3º estágio do trabalho de parto;
• 4.2-Massagem uterina periódica: a cada 15 minutos nas primeiras 2 horas após o parto.
6
4.1 Manejo ativo do 3º estágio
O manejo ativo do 3º período do trabalho de parto reduz significativamente o risco de perdas
sanguíneas no pós-parto imediato.
• 4.1.1 - Profilaxia medicamentosa com ocitocina;
• 4.1.2 - Clampeamento oportuno do cordão umbilical (entre 1 e 3 minutos);
• 4.1.3 - Tração controlada do cordão umbilical associada a Manobra de Brandt-Andrews.
4.1.1 Profilaxia medicamentosa com a ocitocina
A ocitocina é a droga de primeira escolha para a profilaxia medicamentosa da hemorragia pós
parto. Assim, recomenda-se que todas as puérperas devem receber uma dose profilática de ocitocina logo após o nascimento do concepto. A posologia e a via de administração podem variar.
Parto Normal
Esquema intramuscular: 10 UI ocitocina, por via intramuscular(IM). Administrar ocitocina após
desprendimento das espáduas fetais ou imediatamente após o nascimento.
Ela atua 2 a 3 minutos após a injeção, tem efeitos colaterais mínimos, pode ser utilizada em todas
as mulheres e é mais efetiva que as outras opções disponíveis. Em gestantes sob analgesia neuroaxial para o trabalho de parto, administrar preferencialmente em um área indolor, como o no músculo
vasto lateral da coxa (para menor desconforto). Sua grande vantagem é a facilidade de administração e a não necessidade de acesso venoso para realizar a profilaxia medicamentosa da HPP.
Observação
Nas pacientes com acesso venoso, pode-se avaliar a utilização de esquemas endovenosos de
profilaxia contra a HPPà semelhança daqueles utilizados para as pacientes submetidas a cesariana
(vide item a seguir). A desvantagem dos esquemas venosos relaciona-se a posologia mais complexa, que exige doses de ataque e de manutenção (em bomba de infusão contínua) de ocitocina.
Cesarianas
Encontram-se na literatura recomendações de esquemas de ocitocina intramuscular ou endovenosos. Os esquemas endovenosos são preferidos em relação ao intramuscular, embora este
último também possa ser realizado.
Esquema intramuscular
• 10 UI IM imediatamente após a extração fetal.
Esquemas endovenosos (mais de uma opção)
• Opção: 5UI de ocitocina por via endovensa lenta (em 1 a 3 minutos), seguido de 20UI
de ocitocina diluídos em 500ml de SF 0,9% e infundidoa 125mL/h em Bomba de infusão
contínua (BIC), emtrês esquemas de 500mL (5UI/hora);
ou
7
Protocolo de Hemorragia puerperal
• Opção: “Regra dos Três” (Figura 1).
Administrar 3 UI de ocitocina por via endovenosa em bolus lento (mínimo de 30 segundos). Após 3 minutos, observar resposta uterina e, em caso de hipotonia/atonia, aplicar
mais 3 UI de ocitocina por via endovenosa em bolus lento (mínimo de 30 segundo) e
aguardar outros 3 minutos. Se ainda assim a resposta inadequada for mantida, fazer
terceira dose de ocitocina (3UI em bolus lento). A Figura 1 resume este protocolo.
Caso haja resposta com tônus uterino adequado após qualquer uma das doses de ocitocina, iniciar o esquema de manutenção com infusão de 3 UI ocitocina/hora por 4 horas.
Uma sugestão para a manutenção é a diluição de 15 UI de ocitocina (3 ampolas) em
500mL de soro fisiológico 0,9% e infusão a de 100ml/h em bomba de infusão contínua.
Caso não haja resposta após a terceira dose de ocitócito,é fundamental iniciar o protocolo de abordagem à atonia uterina com a administração imediata de uterotônicos de
segunda linha (Vide item “Tratamento medicamentoso da atonia uterina”).
A regra dos três apresenta importantes vantagens em relação às demais posologias por permitir:
1. A determinação do tempo máximo que se deve esperar pela resposta da ocitocina
após cada infusão;
2.A restrição das doses de ocitocina utilizadas, considerando que a exposição prolongada dos receptores uterinos a altas doses de ocitocina leva a uma dessensibilização das células miometriais ao seu efeito;
3.Início precoce de uterotônicos de segunda linha nos casos de hipotonia/atonia uterina.
O esquema da “Regra dos 3” tem sido muito estudado recentemente e os resultados tem
demonstrado sua eficiência na profilaxia de HPP nos casos de cesariana.
Figura 1 - Dose de ocitocina na cesariana – “Regra dos 3”
Fonte: Adaptado a partir de Balki & Tsen . 2014.
8
4.1.2 Clampeamento oportuno do cordão umbilical
Clampear o cordão umbilical 1 a 3 minutos após o desprendimento fetal.
4.1.3 Tração controlada do cordão e manobra de Brandt-Andrews
Clampear o cordão umbilical próximo ao períneo usando uma pinça. Segurar o cordão clampeado ao final da pinça com uma das mãos e realizar concomitantemente a manobra de Brandt-Andrewscom a outra mão (Vide Figura 2).
A tração do cordão umbilical deve ser controlada, ou seja, “o suficiente para manter uma gentil
tensão no cordão, mas incapaz de desconectar o cordão umbilical da placenta”. Essa manobra
deve ser realizada apenas por profissional treinado, devido às possíveis complicações, como rompimento do cordão umbilical e inversão uterina.
Manter gentilmente a tensão sobre o cordão umbilical e esperar uma contração uterina forte
(2-3 minutos), enquanto se realiza simultaneamente a manobra de Brandt-Andrews.
Quando o útero se tornar arredondado ou o cordão se alongar, tracionar a pinça muito gentilmente para baixo para retirar a placenta.
Figura 2 - Manobra de Brandt-Andrews para manejo ativo da dequitação
Técnica da manobra de Brandt-Andrews
Colocar uma das mãos imediatamente acima do osso púbico e estabilizar o útero. Aplicar
contra tração para ajudar a prevenir a inversão uterina.
9
Protocolo de Hemorragia puerperal
4.2 Massagem uterina periódica no 4º estágio (período de observação)
A massagem uterina periódica deve ser iniciada imediatamente após a dequitação e repetida a
cada 15 minutos nas primeiras 2 horas em todas as puérperas.
Deve-se massagear o fundo uterino através do abdome até que o útero esteja contraído e
assegurar-se que o útero não se torne relaxado (amolecido) após terminar a massagem. Caso o
útero se mantenha hipotônico, é necessário abrir o protocolo de HPP.
4.3 Outras medidas de prevenção da HPP
Dentre outras medidas de prevenção, recomenda-se evitar a episiotomia de rotina e nunca realizar a manobra de Kristeller.
5 Reconhecimento da hemorragia
Um dos grandes desafios no manejo da HPP é a estimativa oportuna e correta do sangramento.
Na prática diária, usualmente, observa-se que a maior parte dos profissionais utiliza a estimativa
visual da perda volêmica e a monitorização dos dados vitais das pacientes (que refletem a repercussão hemodinâmica do sangramento moderado e grave). A literatura mostra, no entanto, que a
estimativa visual normalmente subestima a quantidade de sangue perdida, mesmo quando realizada por profissionais experientes. Da mesma forma, em gestantes saudáveis, a repercussão hemodinâmica secundária à hemorragia só se manifesta tardiamente e usualmente em um momento
no qual diversas ações importantes já deveriam ter sido tomadas.
Por estas razões, outras importantes formas de se avaliar a perda volêmica devem ser estimuladas, em especial a pesagem das compressas embebidas de sangue e o uso de bolsas coletoras
do sangue perdido. Além disso, atualmente têm-se proposto o uso rotineiro do índice de choque,
com o intuito de estimar a gravidade do choque e a necessidade de medidas tais como transferência, ressuscitações volêmicas agressivas e transfusões maciças.
5.1 Estimativa visual da perda volêmica
Sempre que visualmente houver suspeita de HPP, a abordagem terapêutica deve ser imediata.
Não se deve esperar os sinais clássicos de instabilidade hemodinâmica para o início da abordagem.
A identificação visual de uma perda sanguínea aumentada alerta para o risco de um choque
hemorrágico iminente. Tal estratégia de estimativa é subjetiva e, como descrito, frequentemente
subestima a perda sanguínea. Contudo, é uma metodologia simples, rápida, sem custo, e essencial para se mobilizar a equipe e ativar o protocolo de HPP.
A figura 3 e o quadro 4 podem auxiliar profissionais de saúde a estimar a perda volêmica através
da identificação visual do sangramento:
10
Figura 3 - Estimativa visual de perda sanguínea
Poça de 100cm de diametro
Cama com poça sobre lençol
Hemorragia vaginal com
sangue fluindo para o chão
Quadro 4 - Guia para estimativa visual de perda sanguínea
Estimativa visual
Poça de 50cm de diâmetro
Volume de perda sanguínea
140ml
500ml
Poça de 75cm de diâmetro
1000ml
Poça com 100cm de diâmetro
Cama com poça de sangue sobre o lençol
Hemorragia vaginal com sangue fluindo para o chão
1500ml
Provavelmente menos de 1000ml
Provavelmente excede 1000ml
Compressa média (30x30cm) ensopada
Fonte: Adaptado a partir de Bose, Regan & Paterson-Brown, 2006
Figura 4 - Estimativa visual da perda sanguínea baseada na avaliação da sujidade por sangue de compressas
utilizadas no procedimento.
50% = 25mL
75% = 50mL
100% = 75mL
Pingando = 100mL
Fonte: Adaptado a partir de Dildy III et al, 2004
Alguns sangramentos, contudo, podem ocorrer de forma oculta e irão se manifestar através
de sinais de instabilidade hemodinâmica. Nesses casos, a estimativa visual da perda volêmica é
ineficiente e outros métodos de estimativa devem ser utilizados.
5.2 Estimativa da perda volêmica através da pesagem das compressas
A estimativa da perda volêmica através da pesagem das compressas com sangue pode ser de
grande valia. Os serviços devem ser estimulados a incorporar, na prática rotineira, a contagem de
11
Protocolo de Hemorragia puerperal
compressas utilizadas nos procedimentos obstétricos. Nos casos de sangramento aumentado a
sua pesagem deve ser realizada.
Para se definir a perda volêmica através da pesagem das compressas sujas de sangue, deve-se inicialmente recordar que a densidade do sangue é de 1.04 a 1,06 g\cm3, uma densidade
muito próxima à da água. Assim, do ponto de vista prático, pode-se dizer que 1 mL de sangue
equivale à aproximadamente 1 grama de peso.
Desta forma, para se definir a perda volêmica basta pesar as compressas sujas de sangue e
subtrair pelo peso estimado das compressas secas. A diferença entre esses pesos, em gramas,
equivale, aproximadamente, ao volume em mililitros de sangue perdido até o momento.
Estimativa do volume de sangue perdido (mililitros) =
Peso das compressas sujas de sangue (gramas) – Peso estimado das compressas secas (gramas)
5.3 Estimativa da perda volêmica através do uso de dispositivos
coletores
Outra opção de estimativa de perdas volêmicas é o uso dos dispositivos coletores, também
conhecidos como bolsas ou fraldas coletoras de sangue. Usualmente são utilizados para estimar
perdas volêmicas após partos vaginais.
Modo de uso: O dispositivo coletor deve ser posicionado logo após o nascimento. A parte proximal do dispositivo é colocada embaixo da região glútea da paciente e amarrada à sua cintura (à
semelhança de uma fralda). Tal posicionamento direciona o sangue perdido pelos genitais para
a bolsa coletora, onde se mensura o volume perdido. É importante ressaltar que a bolsa coletora
deve estar posicionada em um nível abaixo da paciente e não deve sofrer compressões extrínsecas para evitar transbordamento do sangue. (Figura 5b).
Figura 5 - 5a: dispositivos coletores com indicador de volume. 5b:dispositivo posicionado na mesa de parto.
5c e 5d: ilustram o acúmulo de sangue no dispositivo.
5a
5b
5c
5d
Fonte: Gabel & Webeer, 2012; Deganius S.
5.4 Avaliação dos sinais vitais
A avaliação clínica da paciente com sangramento é um aspecto essencial no manejo da HPP,
tanto para o seu diagnóstico, quanto para a sua definição de gravidade e avaliação da resposta
terapêutica instituída.
12
Devido ao estado hipervolêmico fisiológico (aumento de 40-50% da volemia da grávida), as
gestantes apresentam os primeiros sinais hemodinâmicos de hemorragia apenas após perdas
em torno de 1500 ml a 2000ml de sangue. Quando se define a gravidade do sangramento pelos
dados vitais (Tabela 5), o pior critério clínico identificado é o parâmetro que define a gravidade do
choque. Por exemplo, se uma puérpera com quadro de hemorragia apresentar-se com frequência
cardíaca de 130bpm (que é sugestivo de quadro grave) e uma pressão sistólica (PAS) de 90mmHg
(que é sugestivo de quadro leve), ela ainda assim deve ser classificada como portadora de choque
hipovolêmico grave, já que o seu pior parâmetro clínico, nesse caso a frequência cardíaca, definiu
a gravidade do quadro materno (Vide quadro 5).
Deve-se lembrar que os sinais clínicos são importantes na definição da necessidade de transfusão de hemocomponentes, haja vista que os exames laboratoriais geralmente não refletem, com
fidedignidade, a perda sanguínea aguda da puérpera.
Deve-se ressaltar que, após a resolução de um quadro de HPP, a persistência de sinais de
instabilidade hemodinâmica pode indicar a presença de um sítio ativo de sangramento (oculto ou
não) ou a necessidade de hemotransfusão. Assim, é importante pesquisar e revisar os focos de
sangramento e se preparar para hemotransfusões. Sangramentos no retroperitônio devem ser
pesquisados especificamente nas suspeitas de laceração. Reavaliar os “4 T”.
Importante
o pior critério clínico é o que define o grau do choque.
Quadro 5 - Graus de choque e sinais clínicos na hemorragia obstétrica.
Grau de
choque
Compensado
Leve
Moderado
Grave
(%)perda e volume
Nível de
PAS
Transfusão
em ml para mulher
Perfusão
Pulso
consciência
(mmHg)
entre 50-70Kg
Usualmente não
10-15%
Normal
Normal
60-90
> 90
500-1000ml
necessária
16-25%
Normal e/ou
Palidez, frieza 91-100
80-90
Possível
1000-1500ml
agitada
Palidez, frieza,
Usualmente
26-35%
Agitada
101-120 70-79
1500-2000ml
sudorese
exigida
Palidez, frieza,
Provavelmente
> 35%
Letárgica ou
sudorese
> 120
< 70
Transfusão
> 2000ml
inconsciente
Perfusão
maciça
capilar > 3”
5.5 Índice de choque
O índice de choque (IC) é um parâmetro clínico que tem sido utilizado de forma crescente
para ajudar a estimar o impacto da perda volêmica obstétrica e auxiliar a tomada de decisão da
equipe assistencial.
O IC reflete o estado hemodinâmico da paciente, podendo ser útil para prever a necessidade
de transfusão maciça. Para calcular o índice de choque, basta dividir a frequência cardíaca pela
pressão arterial sistólica da paciente.
Tem-se proposto que um valor do IC > 0.9 sugere uma relevante perda sanguínea, com possibilidades reais de necessitar de uma transfusão maciça durante o manejo da paciente. Dessa
13
Protocolo de Hemorragia puerperal
forma, em locais com escassez de recursos, tal achado indica a necessidade de transferência da
paciente (desde que feita de forma responsável e segura).
Do ponto de vista prático, nas situações em que a frequência cardíaca da paciente for superior
ou igual à sua pressão arterial sistólica (IC ≥ 1), a equipe deve-se preparar para manejo agressivo
do quadro hemorrágico, incluindo a possibilidade real de transfusão maciça.
ÍNDICE DE CHOQUE = Frequência cardíaca materna
Pressão arterial sistólica
Se IC > 0,9: risco de transfusão maciça.
5.6 Atrasos no manejo da hemorragia e a “Hora de Ouro”
Um dos problemas mais comuns nos casos de “near miss” ou morte materna por HPP é o atraso
no seu manejo. O quesito tempo é uma variável importante nessas situações. Daí a adoção da
Hora de Ouro em obstetrícia.
Quando se avalia o tratamento da HPP, observa-se três importantes problemas: os de acesso, os de manejo e os de ambiência, que podem ou não coexistir.
Problemas de acesso: relacionam-se às dificuldades e ao intervalo de tempo demandado para
uma paciente obter cuidado médico adequado.
Problemas de manejo: configuram-se as dificuldades das equipes assistenciais em tomar decisões adequadas, em momento oportuno, com trabalho em equipe interdisciplinar. Para esse tipo
de problema, o ideal é a realização de cursos de atualização para as equipes multidisciplinares e
a implantação de protocolos de HPP para a instituição (com a inclusão de check list e fluxograma
de ações a serem tomadas) independente da complexidade da maternidade. Além disso, a equipe
deve discutir os problemas de ambiência do seu serviço.
Problemas de Ambiência: relacionam-se à falta de estrutura\preparação hospitalar para atender uma puérpera com sangramento vultuoso.
Nessas situações, frequentemente ou a maternidade não tem insumos necessários para o manejo de tais situações (como medicamentos específicos, balões de tamponamento intrauterino e hemoderivados) ou, quando os possui, não consegue disponibilizá-los, em tempo hábil, aos profissionais assistentes (seja por desorganização dos fluxos assistenciais, seja por questões burocráticas).
O primeiro passo para minimizar tais dificuldades é disponibilizar um kit de emergências para
HPP (conforme exemplificado no ANEXO III). Inicialmente o kit deve ser organizado com os materiais já disponíveis no hospital (não precisa estar completo) associado a um protocolo assistencial
multidisciplinar (disponível dentro do kit). A equipe multidisciplinar deve ser apresentada ao kit disponível e um treinamento de como utilizá-lo deve ser realizado. Uma lista de material necessário
para se completar o kit de HPP deve ser organizada e deve-se discutir com o laboratório formas
de diminuir os atrasos nessas intercorrências. Pode-se ainda afixar banners com o fluxograma
do atendimento da HPP em locais da maternidade onde os profissionais de saúde circulam com
frequência, tais como estar médico, vestiários, salas de prescrição, salas de parto, bloco cirúrgico,
dentre outros.
O passo seguinte (que pode ser realizado concomitantemente ao primeiro) é melhorar a capacitação das equipes no manejo da HPP, através da promoção de aulas e discussões sobre o tema,
além de estimular a participação de todos em cursos ou eventos que discutam a HPP.
Nesse momento seria interessante implementar a discussão dos casos de hemorragia e realizar
14
reuniões para uma conversa sobre a atuação das equipes em cada evento (conhecido como “debriefing”). Em relação a estas reuniões, é importante lembrar que os comentários e ações devem
ser feitos e propostos de forma construtiva (com caráter de aprendizado e objetivo de melhorar a
assistência), e por uma comissão ou equipe que consiga realizá-lo de forma madura. Caso contrário, a equipe pode ficar desestimulada, acuada e sem desejo de avançar nas melhorias propostas
pelo seu serviço.
Esses passos anteriores não dependem de investimentos financeiros importantes, apenas de
motivação da equipe para implementar medidas que organizem, sistematizem, avaliem e melhorem o manejo da HPP na instituição.
Em uma fase seguinte de implantação das melhorias na unidade, deve-se buscar otimizar os
fluxos assistenciais e viabilizar a obtenção de itens ainda não disponíveis no seu kit de HPP.
Nessa fase é necessário solicitar formalmente a padronização de medicamentos e materiais
essenciais que ainda não estejam disponíveis. Deve-se envolver os gestores, sensibilizando-os da
importância e do impacto positivo da obtenção desses insumos. No que se refere a melhoria dos
fluxos assistenciais na maternidade, deve-se fazer esforços para organizar um CÓDIGO VERMELHO, especialmente nos serviços de grande porte. Deve-se criar fluxos eficientes para viabilizar
a transfusão de hemocomponentes sem atrasos (mesmo naquelas instituições menores e sem
Agência Transfusional). Deve-se tentar disponibilizar trajes anti-choque, para permitir ganho de
tempo extra para realizar uma transfusão ou mesmo uma transferência segura, especialmente nas
maternidades com recursos limitados. Deve-se ainda confeccionar um protocolo de transferência
responsável e segura.
5.7 Hora de ouro na hemorragia obstétrica
Nesse contexto, em que se observa frequentemente atrasos no manejo da HPP, a Federação
Internacional de Ginecologia e Obstetrícia (FIGO) tem recomendado atenção ao tempo de manejo
da HPP, incorporando o conceito de Hora de Ouro para a Hemorragia Obstétrica.
O conceito de Hora de Ouro consiste na recomendação do controle do sítio de sangramento
puerperal, sempre que possível, dentro da primeira hora a partir do seu diagnóstico; ou pelo menos estar em fase avançada do tratamento ao final desse período.
Tal proposta visa reduzir a morbimortalidade relacionada ao choque hipovolêmico, uma vez que
existe uma relação direta entre um desfecho desfavorável materno e o tempo decorrido para se
controlar o foco sangrante. (Vide gráfico 1).
Contudo, deve-se ressaltar que algumas hemorragias puerperais maciças podem gerar perdas
sanguíneas que chegam a 250ml\minuto e, portanto, a abordagem deve ser ainda mais agressiva
e rápida. Por isso, frequentemente, discute-se o limite de tempo ideal para se controlar um foco
hemorrágico, ainda que de forma temporária. Alguns especialistas propõem o controle do sangramento em no máximo30 minutos, ou até mesmo em períodos inferiores a15 minutos na dependência da etiologia e da gravidade da hemorragia.
Por fim vale ressaltar que a “HPP é uma emergência obstétrica e não uma situação de desespero obstétrico”. Focar apenas no tempo de controle do sangramento sem se preocupar com a qualidade das ações também pode ser motivo de insucesso. Assim, a execução das ações de controle
do sangramento, de forma sequenciada, consciente, correta e sem perda de tempo, é o essencial.
Mas para se tratar adequadamente um quadro de HPP são necessários intensivos trabalhos de
capacitação. Dessa forma, esforços devem ser feitos para habilitar as equipes multidisciplinares e
as maternidades, públicas e privadas, para manejar a HPP de maneira qualificada e em tempo hábil.
15
Protocolo de Hemorragia puerperal
Gráfico 1 - Correlação entre sobrevida e tempo após o início da hemorragia
pós-parto MMX.
% sobrevida
100
80
60
40
20
0
0
10
20
30
40
Minutos
50
60
90
6 Estágios de manejo da hemorragia
Logo que a hemorragia pós-parto for reconhecida as medidas iniciais de manejo devem ser
adotadas, imediatamente, independente do profissional que a identifica. A mobilização da equipe
na HPP deve envolver quatro componentes: Comunicação/Mobilização, Ressuscitação, Monitoração/Investigação e Interrupção do sangramento. As ações devem ser executadas simultaneamente e em sequência, pela equipe multiprofissional, e de acordo com o estágio\gravidade do quadro
clínico da paciente.
O trabalho em equipe é fundamental para o sucesso no manejo da hemorragia pós-parto em
qualquer um dos estágios da hemorragia. Todos os membros da equipe multidisciplinar devem
estar treinados para manejar inicialmente uma HPP. Delegar funções a profissionais capacitados,
quando realizada de forma responsável e monitorada, melhora a eficiência da equipe e sucesso
no manejo de situações críticas.
Para o manejo da hemorragia propõe-se o manejo utilizando-se check-list e os kits de HPP
(ANEXOS I, II, III) e considerando os quatro estágios de intervenção. Para redução da morbimortalidade materna, as medidas de ressuscitação, monitoração, investigação e interrupção do
sangramento, devem ser TODAS instituídas na primeira hora após início da hemorragia, ou seja,
durante a HORA de OURO.
O objetivo do manejo da HPP é combater a tríade letal do choque hipovolêmico,
que consiste na presença da hipotermia, acidose metabólica e coagulopatia.
6.1 Estágio I
6.1.1 Conceito
Sangramento contínuo e perda sanguínea de 16%-25% (1000-1500 ml).
Parâmetros clínicos sem alterações.
O Estágio I objetiva ativar o protocolo de hemorragia, avaliar rapidamente a causa e iniciar o tratamento.
16
6.1.2 Comunicação/mobilização
•Chamar imediatamente equipe assistencial (enfermeira obstetra, obstetra e anestesista)
responsável que devem estar presentes em no máximo 5 minutos;
•Ativar o protocolo de hemorragia;
•Providenciar o kit de HPP;
•Iniciar imediatamente sequência do check list;
•Ressuscitar: Iniciar imediatamente medidas de ressuscitação utilizando o “CAB” (C =
Circulação; A = vias Aéreas; B = Breath = respiração);
•Providenciar dois acessos venosos de grosso calibre (14- 16G), colher sangue para
exames (hemograma, coagulograma, prova cruzada, fibrinogênio, gasometria, lactato).
Deve01 acesso para ressuscitação volêmica, outro para ocitocina);
•Coletar exames laboratoriais no momento da punção do acesso venoso;
•Iniciar pesagem de compressas e estimativa visual de sangramento;
•Iniciar ressuscitação volêmica com a infusão livre de 1000ml de soro fisiológico ou ringer lactato morno. Avaliar resposta hemodinâmica da paciente, cada 500ml de qualquer
fluido infundido (baseando-se nos sinais vitais - PA, FC, perfusão periférica/saturação de
O2, diurese e estado de consciência);
•Atentar para o risco de coagulopatia dilucional a partir de 1500-2000ml de cristaloide
infundidos sem a associação com hemotransfusão;
•Avaliar vias aéreas e respiração. Iniciar oxigênio por máscara (se possível com reservatório) em
alta concentração (8-15L/min) independente da concentração/saturação de oxigênio materna;
•Alertar agência transfusional e reservar 2 unidades de concentrado de hemácias e 2 de
plasma fresco congelado;
•Medir temperatura corporal a cada 15 minutos. Prevenir a hipotermia.
6.1.3 Monitoração/investigação/diagnóstico
•Monitorar dados vitais (pulso, PA, SatO2, nível de consciência) a cada 10 minutos ou de
forma contínua (especialmente nos casos graves);
•Estimar perda sanguínea acumulada a cada 5-15 minutos;
•Realizar teste do coágulo (Teste de Weiner): coletar sangue em um tubo de ensaio sem
anticoagulante (tampa vermelha) e aguardar entre sete e dez minutos. A formação de um
coágulo firme e estável após esse tempo, sugere ausência de coagulopatia por hipofibrinogenemia; se o exame estiver alterado, solicitar coagulograma e dosagem de fibrinogênio
com urgência para confirmar coagulopatia e providenciar Plasma Fresco e crioprecipitado;
•Combater a hipotermia: manter paciente aquecida e medir temperatura a cada 15 minutos,
estimular uso de cobertores mantas térmicas ou outros dispositivos de aquecimento seguros;
•Definir a causa do sangramento (4Ts) imediatamente após diagnóstico de hemorragia
(Vide Quadro 6): 1. Avaliar o tônus uterino; 2. Revisar o canal do parto (para avaliar lacerações ou hematomas); 3. Revisar a cavidade uterina; 4. Checar histórico de Coagulopatias congênitas ou risco de Coagulopatias adquiridas.
Observações: Reavalie as causas de hemorragia (4T) mesmo nos casos em que as
durante a assistência ao parto as revisões foram realizadas e estavam normais.
Deve-se ressaltar que mais de uma causa pode ocorrer ao mesmo tempo. Por exemplo,
é possível a associação de um quadro de hipotonia uterina com o de lacerações de trajeto após uso do fórceps ou mesmo em uma cesariana intraparto em que houve laceração
do colo durante a extração fetal.
17
Protocolo de Hemorragia puerperal
Quadro 6 - Mnemônico para as causas específicas de HPP – os “Quatro T”
4T
Causa específica
Tônus
Trauma
Tecido
Trombina
Atonia uterina
Lacerações, hematomas, inversão e rotura uterina
Retenção de tecido placentário, coágulos, acretismo placentário
Coagulopatias
Frequência
relativa
70%
20%
10%
1%
É fundamental identificar a causa do sangramento para realizar o tratamento adequado.
6.1.4 Tratamento medicamentoso da atonia uterina
mnemônico MODEM é utilizado para facilitar a abordagem clínica da atonia uterina, ao se referir à sequência de manobras e drogas a serem utilizados:
Figura 6 - Manobra de Hamilton
Mneumônico para atonia uterina
Massagem Uterina
Ocitocina
Derivado
Ergotínico
Misoprostol
Massagem uterina bimanual (Manobra de Hamilton)
Realizar compressão uterina por 20 minutos ou até obter contração contínua e efetiva. Esvaziar
a bexiga antes da compressão para aumentar a eficácia da manobra. Iniciar monitoramento da
diurese. (Figura 6).
Ocitocina endovenosa (5UI/ampola)
É a droga de eleição pela meia-vida curta (5 min), custo baixo e início de ação rápido (2-3 min).
O uso indiscriminado da ocitocina em casos de atonia uterina, no entanto, foi questionado recentemente e evidências mostram que a ausência de uma resposta adequada às doses de profilaxia
18
(como propostas no item I – Profilaxia medicamentosa) requer o início imediato de uterotônicos de
segunda linha. A exposição do útero a altas doses de ocitocina em um esforço para produzir contração adequada leve à down-regulation dos receptores a este medicamento e a dose efetiva (DE
95) para contração uterina adequada em pacientes já expostas à ocitocina endógena é de 2,99UI.
Deve se lembrar que, pelas mesmas razões, paciente com trabalho de parto prolongado ou que
receberam doses elevadas de ocitocina durante o trabalho de parto são pacientes que possuem
menor responsividade à ocitocina. Nesses casos, deve-se atentar para a resposta ao ocitócito, e
considerar a necessidade do uso precoce dos derivados de ergot.
Derivado Ergotínico (0,2mg/ml – 1 ampola)
Uterotônico de segunda linha, utilizado quando ocorre falha do controle da atonia uterina pelo
ocitócito. Tem meia vida de 30 a 120 min, início de ação em 2 a 3 min.
Posologia: varia de acordo com a gravidade da hemorragia: 2 a 5 doses em 24 horas, não
excedendo 1 mg\dia.
Observação: as pacientes não responsivas a primeira dose de derivados de ergot tendem a
não responder as doses subsequentes. Os derivados de ergot estão contra-indicados nos casos
de doenças hipertensivas.
Posologia dos derivados do ergot (máximo de 5 doses de 0,2 mg, em 24 horas)
•Primeira dose: quando houver falha do ocitócito;
•Segunda dose: 20 minutos após a primeira dose;
•Terceira, quarta e quinta doses: devem ser prescritas apenas nos casos de hemorragias
graves. Cada uma dessas doses deve ser realizada 4 horas após a dose anterior, com
intuito de manter o tônus uterino nas primeiras 24 horas do sangramento.
Exemplo
Se uma paciente apresentou sangramento importante e recebeu a 1ª dose de metilergometrina
(0,2mg\ampola) às 11 horas, a 2ª dose deverá ser administrada às 11:20 horas. Se o sangramento
for muito importante deverá receber doses adicionais de manutenção. Assim, receberia a 3ª dose
ás 15:20, a 4ª dose ás 19:20 e a 5ª dose ás 23:20. Deve-se respeitar a dose máxima de 1 mg do
derivado de ergot em 24 horas.
Misoprostol
Uterotônico de segunda linha no tratamento da atonia e menos eficaz que o ocitócito e derivados de ergot. O uso de misoprostol pode causar náuseas, vômitos e febre. Existem várias
posologias de acordo com a via de administração, mas no contexto da hemorragia uterina estão
indicados 800mcg por via retal (início de ação em 20 a 30 minutos) ou 400 a 600mcgpor via oral
ou sublingual em pacientes estado de vigília preservados (início de ação em 7-11 minutos, porém
com maiores efeitos colaterais).
6.1.5 Tratamento de acordo com a causa do sangramento
Deve-se ressaltar que a indefinição da causa do sangramento é
importante causa de insucesso no manejo de uma HPP
Mais de uma causa podem coexistir nas hemorragias obstétricas
19
Protocolo de Hemorragia puerperal
Abaixo resumiremos as principais condutas de acordo com a etiologia da hemorragia no Estágio I:
Tônus
•Iniciar massagem uterina bimanual imediatamente;
•Ocitocina venosa– Vide Item I – Profilaxia medicamentosa;
Caso o sangramento persista e o útero continue amolecido, sendo afastadas outras causas, administrar 0,2mg de metilergometrina por via intramuscular (vide doses no item
derivados de Ergot) e/ou introduzir 800mcg de misoprostol por via retal e passar para o
Estágio II de manejo. Não existe consenso se estes agentes devem ser administrados
de forma sequencial ou conjunta como segunda linha de tratamento. Nenhum destes
agentes deve ser usado em substituição à ocitocina como primeira linha de tratamento.
•Avaliar necessidade de inserção do balão de tamponamento intrauterino.
Trauma
•Realizar nova revisão do canal de parto nos casos de hemorragia;
•Avaliar presença de lacerações do canal de parto e suturá-las imediatamente;
•Drenar hematomas;
•Investigar rotura uterina, hematoma de ligamento largo ou retroperitoneal, inversão uterina. Se presentes, passar para o Estágio II de manejo.
Tecido
•Realizar cuidadosa revisão da cavidade uterina e evacuar produtos retidos (restos placentários, membranas, coágulos);
•A dequitação placentária usualmente ocorre nos 30 minutos que sucedem o parto. Caso
não ocorra nesse intervalo: avaliar extração manual da placenta.
• Se durante uma extração manual da placenta não for possível identificar plano de clivagem entre útero e massa placentária: suspeite de acretismo. Nesses casos, não tente retirar a placenta, pois o sangramento pode ser volumoso. Prepare-se para a laparotomia;
•Nos casos de suspeita de acretismo: a decisão entre realizar tratamento definitivo no
momento do parto ou optar pela conduta conservadora não é tarefa fácil. Salienta-se que
os procedimentos cirúrgicos para abordagem de uma placenta acreta podem ser complexos, dependendo da gravidade e local de invasão placentária;
•Tratamento definitivo e imediato do acretismo placentário: está indicado quando há
sangramento ativo (frequentemente por dano placentário à manipulação) ou a equipe já
conhece a extensão do acretismo e já se preparou para sua abordagem nesse momento. Nas outras situações em que se depara com uma placenta acreta não sangrante no
intraoperatório, a decisão de abordá-la ou não imediatamente deve ser individualizada e
cautelosa. Nos casos de histerectomia, preferir realizá-la com a placenta in situ, pois a
manipulação da placenta aumenta consideravelmente a perda volêmica. A metroplastia
pode ser uma opção em casos selecionados. O tratamento por hemodinâmica em geral
são programados;
•Conduta conservadora no acretismo: indicada em todos os casos em que não há sangramento ativo e existem dúvidas sobre a gravidade e a extensão da invasão placentária.
Nessa situação clampea-se o cordão umbilical, faz-se a rafia uterina, deixando a placenta em situ sem manipulá-la ou tentar extirpar parte dela. Deve-se, no pós parto imediato,
avaliar a invasão placentária com métodos de imagem (preferencialmente a ressonância
nuclear magnética). Recomenda-se observação rigorosa da paciente pelo risco de hemorragia e infecção, enquanto se define o melhor tratamento. O uso de metotrexate não
tem sido recomendado de rotina;
20
Trombina
•Avaliar histórico de Coagulopatias ou uso de medicamentos anticoagulantes;
•Tratar doenças de base de acordo com a causa e avaliar a coagulação de forma seriada;
•Repor hemocomponentes, fatores de coagulação e volume intravascular;
•Se teste de coágulo positivo iniciar plasma fresco congelado (não aguardar resultados do
laboratório) ou mesmo crioprecipitado;
•Caso o sangramento seja controlado no Estágio I, manter vigilância estrita no pós-parto.
6.2 Estágio II
6.2.1 Conceito
Sangramento contínuo e perda sanguínea 26-35% (1500 - 2000 ml)
ou FC 101-120 bpm;
ou PAS 70-79 mmHg;
ou agitação/sonolência;
ou perfusão comprometida: palidez, frieza e sudorese.
6.2.2 Comunicação/mobilização
•Chamar médico obstetra com habilidades ou treinamento avançados no manejo de hemorragia pós-parto;
•Comunicar médico intensivista ou anestesista com habilidades avançadas;
•Comunicar o Banco de sangue sobre o caso e coletar amostra de sangue para tipagem sanguínea e prova cruzada. Solicitar reserva de hemoderivados e a disponibilização de 2 unidades de concentrado de hemácias Tipo O Rh negativo para uso imediato caso necessário;
•Providenciar equipos para transfusão de sangue e aquecedores de soluções;
•Designar responsáveis pelo transporte de material para exames laboratoriais e hemoderivados;
•Designar um membro da equipe para registrar os eventos, preencher lista de checagem,
administração de fluidos e medicamentos e registro de dados vitais;
•Comunicar de maneira apropriada e sensível com a família;
•Preparar sala de cirurgia e providenciar material para cirurgia;
•Transferir paciente para a sala de cirurgia;
•Preparar para ativar protocolo de hemorragia maciça.
6.2.3 Ressuscitação
•Manter infusão adequada de fluidos (solução salina ou ringer lactato aquecidos) reavaliando a resposta clínica pelo menos a cada 500ml de cristalóide infundido;
•Transfundir 2 unidades de concentrado de hemácias, baseado na resposta e nos sinais
clínicos, sem necessariamente aguardar resultados de laboratório, naquelas situações
de instabilidade hemodinâmica não responsiva à infusão de cristaloides;
21
Protocolo de Hemorragia puerperal
•Avaliar uso do Traje anti-choque nas pacientes com iminência de choque hipovolêmico
ou naquelas que já se encontram hemodinamicamente instáveis;
•Avaliar a possibilidade de utilizar drogas vasoativas para melhora hemodinâmica mais
precocemente para evitar infusão de grandes volumes de soluções;
•Manter paciente aquecida. Avaliar possibilidade de uso de mantas térmicas.
6.2.4 Monitoração/investigação/diagnóstico
•Solicitar exames complementares (hemograma, coagulograma, fibrinogênio, lactato, gasometria, íons);
•Avaliar e comunicar dados vitais a cada 5-10 minutos. Anotar;
•Realizar cateterismo vesical com bolsa medidora de volume. Anotar diurese;
•Calcular perda sanguínea acumulada a cada 5-15 minutos.
Se a paciente não apresentar melhora clínica após infusão de cristalóides e transfusão sanguínea deve-se avaliar necessidade de abordagem invasiva\cirúrgica ou a necessidade de nova hemotransfusão.
6.2.5 Tratamento/interrupção do sangramento de acordo com a causa
Balão de tamponamento intrauterino
Figura 7 - Balão Uterino
O balão de tamponamento intrauterino tem se configurado em um importante arsenal terapêutico no controle temporário ou definitivo da HPP.
Sua principal indicação são os casos de atonia uterina em que o tratamento medicamentoso falhou em conter o sangramento. Tem se mostrado eficiente também nos casos de placenta prévia.
Não se deve posicionar os balões na vigência de neoplasias ou infecções cervicais, vaginais ou
uterinas. Não há evidências que recomendem o uso rotineiro do balão nos casos de Coagulopatias. Algumas anomalias uterinas podem contraindicar o seu uso. Está contra indicado em sangramentos arteriais que requerem abordagem cirúrgica. Existe potencial risco de rotura uterina nos
casos do uso do balão de tamponamento intrauterino nos casos acretismo placentário.
22
Pode ser inserido após um parto vaginal ou uma cesariana. Pode ser utilizado em concomitância com o traje anti-choque e nos casos de laparotomia em associação a ligadura de vasos
pélvicos e sutura de B-Lynch.
A aplicação do balão também representa um teste prognóstico e terapêutico importante. Se
o sangramento não for controlado após o posicionamento do balão, o teste de tamponamento é
considerado “negativo” e a abordagem cirúrgica é mandatória.
Manter uterotônicos enquanto o balão está posicionado.
O uso dos balões de tamponamento intrauterino tem se mostrado eficientes em reduzir a necessidade de abordagem cirúrgica, em especial a histerectomia. Várias séries de casos publicadas
têm revelado uma taxa de sucesso no controle da hemorragia de 70 a 100%, sem necessidade de
tratamento cirúrgico adicional após sua retirada.
Mecanismo de ação
A inserção do balão determina uma aplicação de pressão hidrostática contra a parede uterina,
resultando em redução do sangramento capilar e venoso do endométrio, dos remanescentes placentários e do miométrio.
Tipos de balão
Os modelos de balões são variáveis, podendo-se citar entre vários: o balão de Bakri; BT- CATH;
Belfort-Dildy; Rusch; Cateter de Foley, Cateter-condom artesanal (Vide exemplos Figura 8).
Figura 8 - Tipos de balão de tamponamento intrauterino.
Fonte: Georgious, 2009
Técnica de inserção
•Esvaziamento vesical;
•Antissepsia cervical e vaginal;
•Inspeção rigorosa do cérvice e vagina, para descartar laceração de canal de parto e restos placentários;
•Introdução do cateter intrauterino:
Confirmado o posicionamento correto dentro do útero, encher o balão com solução
salina estéril (SF 0,9% temperatura ambiente) até se obter o controle do sangra-
23
Protocolo de Hemorragia puerperal
mento. A capacidade volumétrica máxima recomendada para os balões mais utilizados são de 500ml, mas pode variar entre modelos. Assim, confira antes de usar.
Não se deve encher o balão com líquidos frios pelo risco de hipotermia. Não utilizar
ar para insuflar o balão pelo risco de embolia gasosa;
•Após posicionado o balão: Introduzir tampão vaginal para garantir que o balão se mantenha dentro da cavidade uterina;
•Fixar o cateter do balão na face interna da perna da paciente;
•Conectar o balão à uma bolsa coletora para estimar a perda volemica.
Recomendações
•Manter uterotônicos (ocitocina, ergometrina, misoprostol);
•Prover analgesia adequada. Nos casos de dor excessiva: 1. Checar o posicionamento do
balão (pode estar atingindo o colo), 2. Avaliar necessidade de retirada de um pouco do
volume (desde que não comprometa a hemostasia) para melhorar conforto da paciente;
•Ao final da enchimento do balão: realize leve tração para acomodá-lo melhor dentro da
cavidade uterina. Cuidado para não causar seu deslocamento do útero para o cérvice;
•Recomenda-se realizar a infusão de líquidos no balão através da seringa e não diretamente pela espremedura de uma bolsa de soro. Motivo: evitar que seja infundido mais
liquido do que a capacidade do balão;
•Em caso de controle do sangramento com o balão seu período de permanência será
variável, podendo permanecer até 24 horas.
Figura 9 - Balão intrauterino artesanal feito com condom e sonda de Foley.
Retirada do balão
•A retirada deve ser realizada em ambiente que tenha possibilidade de tratamento definitivo;
•A retirada do balão deve ser gradual. A cada 50 ml de líquido removido do balão: avaliar
o sangramento;
•Caso ocorra sangramento enquanto se retira o balão: 1. Encher novamente o balão e se
preparar para intervenção cirúrgica. Nos casos do surgimento de sangramento após a
retirada completa do balão não está indicado a inserção de um novo balão, mas sim uma
intervenção cirúrgica.
24
Complicações
São incomuns, mas incluem perfuração uterina e infecção puerperal. Já se descreveu rotura
uterina associado ao posicionamento do balão de Bakri após uma curetagem por HPP secundária.
O mecanismo proposto foi ou a fragilidade da parede uterina após curetagem ou o posicionamento
inadequado do balão de tamponamento intrauterino.
6.3 Estágio III
6.3.1 Conceito
Sangramento contínuo e perda sanguínea > 35% (> 2000 ml)
ou FC > 120 bpm;
ou PAS < 70 mmHg;
ou letargia ou inconsciência;
ou perfusão inadequada: palidez, frieza, sudorese ou perfusão capilar > 3 segundos;
ou dados vitais instáveis;
ou suspeita de coagulação intravascular disseminada (CIVD).
6.3.2 Comunicação/mobilização
•Definir líder da equipe;
•Ativar Código vermelho - Protocolo de Hemorragia Maciça;
•Comunicar agência transfusional que há uma hemorragia maciça em andamento;
•Chamar médico intensivista ou anestesista com habilidades avançadas no manejo de
pacientes graves;
•Reavaliar pessoal disponível e solicitar ajuda se necessário;
•Continuar registro de eventos, preencher lista de checagem, administração de fluidos e
medicamentos e registro de dados vitais;
•Reservar vaga em CTI - Iniciar preparativos para transferência da paciente para UTI.
6.3.3 Ressuscitação
•Manter infusão adequada de fluidos;
•Iniciar suporte avançado: Avaliar necessidade de vasopressores, intubação endotraqueal
e acesso venoso central;
•Prevenir a hipotermia, mantendo a paciente aquecida com dispositivos de aquecimento
por ar forçado e uso de soluções aquecidas para infusão;
•Aplicar meias compressivas nos membros inferiores.
I- Protocolo de transfusão maciça
Realizar transfusão sanguínea agressiva baseada no protocolo de transfusão maciça da instituição.
25
Protocolo de Hemorragia puerperal
Em relação à hemoterapia, são indicados protocolos similares aos de atendimento ao trauma
uma vez que a hemorragia obstétricase assemelha muito às hemorragias do politraumatizado,
tanto em magnitude como em gravidade, exceto pela evolução precoce dos casos obstétricos a
quadros graves de hipofibrinogenemia.
Alguns autores consideram como ideal a transfusão de sangue total fresco e morno nessas pacientes. No entanto, devido ao alto custo e à falta de disponibilidade no nosso meio, utiliza-se protocolos
que combinam hemocomponentes (Figura 10). Diante da deflagração do protocolo de transfusão maciça, é indicado o uso imediato de 2 unidades de concentrado de hemácias tipo O Rh negativo (caso
não haja amostras tipadas reservadas à paciente) e manter a transfusão de sangue não tipado caso o
sangramento e/ou a instabilidade hemodinâmica sejam persistentes e até que o sangue tipado esteja
disponível. A proporção entre os hemocomponentes é motivo de discussão na literatura. Neste contexto, a maioria dos protocolos prevê a administração de concentrados de hemácias, plasma e plaquetas em razões variáveis de, respectivamente, 6:4:1 até 3:3:1. Atualmente, parece adequado o uso
de concentrado de hemácias, plasma e plaquetas na razão 4:4:1 (Figura 10) e é essencial a avaliação
contínua e próxima da paciente como forma de ajustar a reposição da volemia e dos hemoderivados.
Os testes de coagulação sanguínea, em especial a dosagem de fibrinogênio, devem ser solicitados no momento em que a hemorragia obstétrica é identificada. Sabemos que, a despeito da
hemodiluição fisiológica, o fibrinogênio apresenta concentrações plasmáticas crescentes durante
o período gestacional, alcançando a sua concentração máxima no terceiro trimestre. O interesse
na dosagem da concentração plasmática do fibrinogênio vai além da simples identificação de uma
coagulopatia de consumo uma vez que o fibrinogênio foi identificado como o único marcador independente de evolução dos quadros hemorrágicos para hemorragia maciça (com risco 2,63 vezes
maior a cada 100mg/dL de redução deste fator de coagulação e valor preditivo para hemorragia
maciça de 100% com uma concentração plasmática menor ou igual a 200mg/L). Desta forma, o
fibrinogênio parece ser o parâmetro que melhor se correlaciona como intensidade da hemorragia,
sendo o marcador mais útil para a identificação do desenvolvimento de distúrbios da coagulação.
Por conta destas evidências, tem sido sugerida a reposição precoce do fibrinogênio através de
crioprecipitado (cada unidade eleva o fibrinogênio em 5 – 10mg/dL) e do concentrado de fibrinogênio na dose de 4 a 8g (sendo 1g/ampola). O uso deste último agente tem se mostrado tão eficaz
quanto o uso do crioprecipitado para a reposição deste fator de coagulação.
A transfusão de hemocomponentes sem tipagem sanguínea está indicada nos
casos em que não se pode aguardar o resultado do exame da prova cruzada
Figura 10 - Esquema proposto de transfusão
Meta terapêutica
Hb > 8g/dl
Fibrinogênio 150-200 mg/dl
Plaquetas > 50.000
TP (INR) ≤ 1,5
CH - Concentrado de Hemácias,
PFC - Plasma Fresco Congelado,
PQT - Plaquetas
CRIO - Crioprecipitado. Meta Terapêutica
26
Lembrete
2CH O negativo Liberação imediata
Razão 4:4:1
CH : PFC : Plaquetas
Atenção!
A unidade de plaquetas descrita corresponde a 1 pool de plaquetas obtido por aférese (bolsa de
200-300mL) e é equivalente a cerca de 6 a 8UI simples (bolsa de 50mL).
II- Ácido tranexâmico
Agentes antifibrinolíticos sistêmicos são amplamente utilizados em cenário cirúrgico para prevenir a quebra do coágulo e reduzir a perda sanguínea. Uma revisão sistemática recente identificou
apenas dois estudos adequados mostrando que o uso do ácido tranexâmico reduz o sangramento
pós-parto vaginal ou cesárea, sugerindo que estudos adicionais são necessários para embasar
este achado. Atualmente, está em curso um estudo multicêntrico (WOMAN Trial) com o objetivo de
identificar a real eficácia deste medicamento nos quadros de hemorragia pós-parto.
Desta forma, não há até o momento evidências para uso profilático de ácido tranexâmico em pacientes com fatores de risco para hemorragia obstétrica e, mas os estudos já mostram que ele pode
ser empregado na dose de 1000mg nos quadros de hemorragia grave. É necessário diluir o medicamento (usualmente em 250mL de soro fisiológico) e infundir em uma velocidade de 50mg/min.
6.3.4 Monitoração/investigação/diagnóstico
•Repetir exames complementares (hemograma, coagulograma, fibrinogênio, gasometria
arterial, sódio, potássio e cálcio) a cada 30 minutos;
•Manter monitorização contínua. Avaliar e comunicar dados vitais a cada 5-10 minutos;
•Calcular e comunicar perda sanguínea acumulada a cada 5-10 minutos;
•Prevenir hipotermia.
6.3.5 Tratamento/interrupção do sangramento
I- Tratamento cirúrgico
A abordagem cirúrgica está indicada quando o manejo clínico e o tamponamento uterino falharam ou não estão indicados para se controlar a hemorragia.
Devemos sempre lembrar que o útero é um órgão extremamente vascularizado e a sua retirada expolia ainda mais a paciente do ponto de vista volêmico, podendo precipitar um choque e/ou
coagulopatia refratários.
Dispomos atualmente de uma série de técnicas cirúrgicas que nos permite controlar o sangramento uterino sem a necessidade de retirada do mesmo e num tempo cirúrgico menor.
27
Protocolo de Hemorragia puerperal
I.A- Desvascularização uterina progressiva
Artéria uterina é responsável por 90% do suprimento sanguíneo uterino e a sua ligadura com
fio absorvível permite o controle dos sangramentos do corpo uterino em mais de 90% dos casos.
Estudos revelam que essa técnica não altera o padrão menstrual e a fertilidade, demonstrando
recanalização em cesáreas posteriores. A mais simples técnica para desvascularização uterina é
a ligadura bilateral das artérias uterinas pela técnica de O´Leary.
Figura 11 - Ligadura do ramo ascendente da artéria uterina e de ramo da artéria ovariana.
Ligamento útero-ovariano
Ramo da artéria
ovariana
Ligadura
Artéria hipogástrica
Fonte: Belfort, 2015.
Artéria uterina
Ligadura
Técnica de O’Leary
Englobamos na sutura a artéria e veia uterinas a 2-3 cm abaixo e lateralmente da região segmentar da histerotomia após dissecarmos inferiormente a bexiga, utilizando fio absorvível.
Segundo passo da desvascularização uterina é a ligadura das artérias ovarianas ao nível do
ligamento útero-ovariano ou a ligadura das artérias vaginais.
O último passo da desvascularização sistemática pélvica é a ligadura das artérias ilíacas internas, realizada distalmente à origem da divisão posterior, 3-4 cm abaixo da bifurcação. Ela não
altera o fluxo e o doppler nas artérias uterinas e diminui o sangramento uterino por diminuição da
pressão de perfusão arterial em 85%. Tem uma taxa menor de sucesso (42 a 70%) em virtude das
circulações colaterais (artérias lombar e ileolombar, sacral média e lateral, retal média e superior) e
requer maior habilidade cirúrgica, não sendo, na prática diária, superior aos outros procedimentos
cirúrgicos. Está indicada quando falha a desvascularização uterina, quando desejamos desvascularizar a pelve em sangramentos provenientes de lacerações do canal de parto de difícil acesso,
em acretismos graves (placenta increta ou percreta) ou após a histerectomia em pacientes com
coagulopatia e/ou sangramento incontrolável da cúpula vaginal.
28
I.B- Suturas uterinas compressivas
As suturas uterinas compressivas são uma excelente opção cirúrgica no controle da HPP. Podem ser utilizadas associadas à desvascularização uterina (especialmente ligadura bilateral de
artérias uterinas) e/ou ao balão intrauterino.
As técnicas de suturas hemostáticas são variadas. A sua taxa de sucesso é variável e está
diretamente relacionada a facilidade de sua execução, a familiaridade do cirurgião com a
técnica, e principalmente à localização do foco de sangramento uterino.
Recomenda-se associar as suturas hemostáticas à procedimentos de desvascularização pélvica (usualmente ligadura bilateral das artérias uterinas).
Técnica de B-Lynch
Apresenta taxas de sucesso superiores a 90% e atuam controlando o sangramento por meio da
compressão da parede anterior contra a parede posterior do corpo uterino. É procedimento de fácil
execução e muito eficiente para controle de hemorragias no corpo uterino, como ocorre na
atonia uterina. É necessário histerotomia do segmento inferior antes da sutura para garantir que não
fiquem retidos coágulos e restos placentários, por isso também, é particularmente útil após cesariana.
O útero deve ser transfixado em 6 pontos, realiza-se tração nas extremidades dos fios e a sutura é finalizada com nó duplo seguido de dois nós simples e histerorrafia. Por meio dessa sutura,
ocorre o dobramento\compressão das paredes uterinas anterior e posterior em direção ao segmento uterino (Figura 12a). Existem técnicas de B-Lynch modificadas.
Dentre as complicações descritas, podem levar a necrose isquêmica parcial uterina, piométrio/
hematométrio, sinéquias uterinas e rotura uterina em gestação subsequente.
Técnica de Hayman
Assemelha-se a técnica de B-Lynch, com taxa de sucesso e indicações semelhantes. A principal diferença é que a sutura hemostática de Hayman não necessita de histerotomia (Figura 12b).
Técnica de Cho
Técnica da sutura hemostática de múltiplos quadrados. Elimina os espaços dentro da cavidade uterina, unindo as paredes anterior e posterior. É técnica mais complexa que as anteriores. É
especialmente útil em sangramentos localizados nos segmentos inferiores do útero. (Figura 12c).
Figura 12 - Suturas uterinas.
As duas primeiras são mais adequadas para sangramentos oriundos dos dois terços superiores do útero e principalmente nos casos de atonia
uterina, enquanto a sutura de Cho pode contribuir para contenção do sangramento no terço inferior e em casos de acretismo placentário.
12a - Técnica de B-Lynch
12b - Técnica de Hayman
12c - Técnica de Cho
Fonte: Adaptado de Alves, 2014.
29
Protocolo de Hemorragia puerperal
Deve-se sempre certificar da eficácia da sutura hemostática
antes do fechamento da laparotomia.
Para avaliar o sucesso do procedimento basta que um auxiliar
visualize o sangramento vaginal e constate sua redução.
Nos casos de manutenção de um sangramento importante
deve-se avançar para a próxima etapa do tratamento cirúrgico.
I.C- Histerectomia
A histerectomia deve ser realizada em último passo no manejo cirúrgico da HPP, após falha das
técnicas conservadoras. No entanto o procedimento não deve ser adiado quando indicado.
O prognóstico materno piora quando a histerectomia é realizada tardiamente, geralmente em
função da paciente se encontrar instável hemostática e hemodinamicamente.
A técnica de escolha é a histerectomia Subtotal, pela agilidade e menor morbidade. Contudo,
algumas situações exigem histerectomia total para contenção da hemorragia.
Recomenda-se deixar um dreno de sucção contínua na pelve (Porto-Vac 3.2 ou 4.8) por 24
horas nas pacientes que se mostram hipotensas ou utilizando drogas vasoativas durante o procedimento cirúrgico. Não é incomum hemoperitônio e coagulopatia grave por consumo quando
ocorre ressangramento da cúpula vaginal nessas pacientes. O dreno serve como um sinalizador
precoce da formação do hemoperitônio, não retardando a nova laparotomia e tratamento efetivo
do sangramento localizado.
A presença de piora clínica após uma abordagem cirúrgica pode indicar
a presença de foco de sangramento ativo. Avalie exploração cirúrgica.
I.D- Técnica de controle de danos\hemostasia transitória
O termo controle de danos é uma estratégia de tratamento para pacientes críticos, na qual
reduz-se o tempo cirúrgico, sacrificando o reparo definitivo e imediato das lesões. Opta-se por realizar uma hemostasia temporária a fim de permitir a restauração volêmica, correção dos distúrbios
de coagulação e\ou tratamento da disfunção dos órgãos na paciente o mais rápido possível. Uma
das técnicas mais conhecidas de “damage control” é a compressão das múltiplas áreas sangrantes através do empacotamento abdominal com compressas. O tratamento definitivo é realizado
após a estabilização da paciente.
Nas pacientes com evidência clínica de coagulopatia após a histerectomia, tem sido realizado
o empacotamento pélvico com compressas sob pressão (Pelvic Pressure Package) e a laparostomia com bolsa de Bogotá ou com mecanismo à vácuo (Figura 13).
Tem se utilizado pelo menos sete compressas para empacotar a pelve. Trata-se de técnicas
herdadas do controle de danos (damage control) da traumatologia e que tem muito contribuído
para salvar pacientes obstétricas com HPP muito grave e complicada com coagulopatia.
Além do empacotamento abdominal e pélvico, outras técnicas podem ser utilizadas para o
controle temporário do sangramento enquanto se realiza a ressuscitação volêmica, se corrige o
distúrbio de coagulação ou mesmo se aguarda a chegada de equipe capacitada.
A compressão da artéria aorta abdominal é uma técnica de contenção transitória do sangramento, em que se comprime a aorta por um período máximo de 90 minutos. Pode-se realizar
compressão externa e interna
30
Figura 13 - Empacotamento pélvico e laparostomia com mecanismo a vácuo.
Fonte: Imagem cedida pela Dra. Maria Fernanda Vidarte.
Compressão manual externada aorta: consiste em exercer pressão, no nível da cicatriz umbilical (levemente deslocada para esquerda), posicionando as duas mãos contra o abdome e comprimindo-o até se perceber a resistência espinhal (tal força equivale a aproximadamente 45 kg).
Pode-se também ser utilizado dispositivo específico para compressão aórtica externa (Figura 14 e
15). Tal manobra não deve ser utilizada rotineiramente haja vista a sua eficácia limitada (especialmente em serviços terciários) e os riscos de lesão associados a má execução do procedimento.
Assim, reserva-se a compressão externa da aorta para situações extremas em que é necessário
aguardar a chegada de uma equipe médica e não há recursos disponíveis para abordar uma paciente em hemorragia franca de imediato.
Já a compressão interna da aorta é procedimento mais simples, eficaz e que pode ser realizado,
por exemplo, durante uma cesariana. Nesta situação, por necessidade de controle temporário do
sangramento local, realize a compressão interna da aorta. Para tal, inicialmente exteriorize o útero,
a seguir afaste o sigmoide, posicione compressas no local da compressão (para minimizar danos
aos tecidos locais) e então comprima a aorta ao nível do plano ósseo do promontório. Essa manobra pode ser necessária quando se necessita ganho de tempo para ressuscitação hemostática
e/ou chegada de equipe mais experiente. Recomenda-se seu uso em situações críticas de HPP.
Figura 14 - Compressão manual da aorta
abaixo da bifurcação
Fonte: Soltan et al 2009.
Figura 15 - Compressão da aorta por
disposto externo
Fonte: Soltan et al 2009.
31
Protocolo de Hemorragia puerperal
O Enfaixamento uterino de com atadura elástica de Esmarch (Esmarch bandage ou o
torniquete uterino de Esmarch) é um procedimento, simples, barato e adjuvante no controle
transitório do sangramento puerperal em paciente instável. Essa técnica também pode ser útil para
preservar útero em alguns pacientes selecionados.
A faixa de Esmarch é uma atadura com características elásticas que, ao envolver um membro
ou um órgão, determina uma compressão extrínseca, suficientemente intensa, para causar a saída do sangue desse local em direção a circulação sistêmica.
Jaraquemada e Fiorillo, em 2010, descreveram, com sucesso, o uso dessa técnica no tratamento de quadros graves de HPP. Segundo os autores, inicialmente a equipe de cirurgia deve realizar
uma sutura hemostática de B-Lynch. A seguir posiciona-se uma compressa cirúrgica na região
posterior e outra na porção anterior do útero para evitar danos miometriais. Por fim, realiza-se o
enfaixamento do útero com a atadura de Esmarch, sempre, no sentido da região fúndica para a
região cervical (evitando o represamento de sangue no útero). Para que o enfaixamento não afrouxe amarre duas gazes cirúrgicas ao redor da atadura (Figura 16). A bandagem é capaz de reduzir
o volume uterino pela metade, o que evita novo sangramento uterino e permite a estabilização
hemodinâmica e hemostática da paciente. O tempo máximo de permanência dessa faixa é de 6
horas (pois existe risco de isquemia uterina). Portanto, a equipe permanece na sala de cirurgia
aguardando a melhora hemodinâmica da paciente para apenas depois definir a necessidade de
um procedimento adicional e finalizar a cirurgia (fechamento abdominal).
Figura 16 - Torniquete uterino de Esmarch Bandage e sentido do enfaixamento.
Fonte: Palacios-Jaraquema & Fiorillo 2010.
Garroteamento ou torniquete da região cervical: é uma outra técnica que pode ser útil para
se reduzir um sangramento uterino de forma temporária em algumas situações específicas de
sangramento uterino. Deve-se posicionar o garrote (dreno de penrose, sonda de foley) ao redor
da cérvice uterina, através de duas aberturas no ligamento largo, e apertar as extremidades firmemente com uma pinça (para que tenha o efeito de garroteamento), à semelhança da técnica
utilizada para se reduzir o sangramento em miomectomias. Existe risco de isquemia do órgão,
portanto deve ser retirado ao final do procedimento.
32
Figura 17 - Garroteamento uterino.
Fonte: Osada H, 2011.
33
Anexos
Anexo I – Algoritmo para assistência à HPP
Anexo I - Algoritmo para assistência à HPP.
AJUDA
- Chamar obstetra de plantão imediatamente
MANTER E OXIGENAÇÃO\ PERFUSÃO TECIDUAL
- Chamar equipe multidisciplinar
- 02 Acessos venosos calibrosos: 16 ou 14 gauge
Anestesista\Enfermeiro\Técnicos enfermagem
- Elevação de membros inferiores (Trendelemburg)
- Infundir soro fisiológico ou Ringer lactato aquecido
(avaliar resposta materna a cada 500ml infundido)
COLETAR EXAMES
Hemograma\ Prova Cruzada\ Coagulograma
Fibrinogênio\ Ionograma
**Lactato e gasometria nos casos graves
- Oxigênio a 8 l/min em máscara facial
- Esvaziar a bexiga
- Sonda vesical de demora (monitorar diurese)
- Prevenir a hipotermia (Manta térmica - Tax: 15'/15')
DETERMINAR CAUSA DA HEMORRAGIA
4T (Trauma\Tônus\Tecido\Trombina)
Tratamento Específico
AVALIAR GRAVIDADE DA PERDA VOLÊMICA
-Sinais Clínicos(PA, FC, Sat O2, consciência, sangramento, etc)
- Índice de Choque:> 0,9
significa risco de transfusão maciça
TÔNUS
TRATAMENTO DA ATONIA
1o MASSAGEM UTERINA
BIMANUAL (imediato)
+
TECIDO
(REVISÃO CAVIDADE UTERINA)
TRAJETO
(REVISÃO CANAL PARTO)
2o OCITOCINA
RETENÇÃO PLACENTÁRIA
5UI EV lento (3 min) seguido de
SF0,9% - 500 ml com 20UI ocitócito,
150 a 250ml\ h, EV
Dequitação demorada:
SUTURA DAS LACERAÇÕES
(>30-45 min. sem sangramento excessivo)
(revisão colo uterino\ cavidade
vagina)
3o METILERGOMETRINA
01 ampola, 0,2mg, IM
Até 5 doses/24h
Não utilizar em hipertensão
(Se sem plano de clivagem não insistir: risco
de hemorragia grave. PENSAR ACRETISMO)
(toque vaginal/ revisão direta
vagina)
Revisão cavidade uterina
____________
CURETAGEM
(800mcg, via retal)
__________________________________
AVALIAR LAPAROTOMIA
____________
AVALIAR HEMATOMAS
Restos pós-dequitação:
____________________________________________________
4o MISOPROSTOL
5o BALÃO TAMPONAMENTO
INTRAÚTERINO
6o
Extração manual placenta
Acretismo placentário:
Avaliar histerectomia com placenta em
sítio ou conduta conservadora
INVERSÃO UTERINA:
Manobra de Taxe
____________
TROMBINA
(COAGULOPATIA)
COAGULOGRAMA
____________
TRATAMENTO
ESPECÍFICO
+
HEMOCOMPONENTE
____________
ROTURA UTERINA:
CUIDADO COM A
OPÇÃO CIRÚRGICA
LAPAROTOMIA
(sangramento)
(Rever segmento uterino pós-parto com
cesárea prévia)
REAVALIAÇÃO DO TRATAMENTO INICIAL
TRAJE ANTI-CHOQUE NAS PACIENTES COM INSTABILIDADE HEMODINÂMICA
AVALIAR TRANSFUSÃO HEMOCOMPONENTES APÓS 1500-2000ML DE INFUSÃO DE CRISTALÓIDE
38
CONSIDERAR ÁCIDO TRANEXAMICO EM CASOS DE HEMORRAGIAS GRAVES – 1.000mg/250 ml SF > 12 ml/min
COMBATER A HIPOTERMIA: MANTAS TÉRMICAS, COBERTORES, SORO AQUECIDO
AVALIAR TRATAMENTO CIRÚRGICO\LAPAROTOMIA SE FALHA DO TRATAMENTO CONSERVADOR
35
Protocolo de Hemorragia puerperal
Anexo II–Check-list da HPP
Anexo II - Check-list da HPP.
A. AJUDA\AVALIAÇÃO INICIAL
____Verbalização clara do diagnóstico para equipe\comunicar paciente
____Chamar obstetra\anestesista\ enfermeiros imediatamente
____Estimar gravidade da perda inicial (através dos dados vitais e índice de choque)
____Avaliação rápida da causa da hemorragia (tecido, tônus, trajeto, trombina)
B. BÁSICO\MEDIDAS GERAIS INICIAIS
____Cateterização de 02 acessos calibrosos (J 16 ou 14) e iniciar infusão de SF 0,9%
____Exames: hemograma\ionograma\coagulograma\fibrinogênio\prova cruzada. Caso grave: lactato e gasometria
____Oxigenoterapia: (8-10 l\min.) em máscara facial. (Não usar cateter nasal)
____Elevação dos membros inferiores (Posição de Trendelemburg)
____Monitorização materna contínua
____Esvaziar bexiga e Sonda vesical de demora (monitorar diurese)
____Avaliar Antibioticoprofilaxia(medicamento e dose habituais)
C. CONTROLE DA VOLEMIA/ RESSUSCITAÇÃO HEMOSTÁTICA
____Estimar gravidade da perda volêmica (Índice de choque (PAS/FC)>0,9 = risco de transfusão)
____Cristalóide: reavaliar a resposta da paciente a cada 500 ml de soro infundido
____Considerar transfusão de hemocomponentes após 1500-2000ml de cristaloide (coagulopatia)
____Considerar o uso de ácido tranexâmico: 1000mg, em 250mL de SF0,9%,a 50mg/min. (Casos graves)
D. DETERMINAR ETIOLOGIA: (4T- TÔNUS, TECIDO, TRAJETO, TROMBINA):
____Determinar tônus uterino (Palpação uterina)
____Revisão da cavidade uterina (placenta)
____Revisão do canal do parto (canal vaginal, colo, e segmento uterino nos casos de cesariana prévia)
____Avaliar história de coagulopatia (doenças prévias, CIVD, uso AAS, heparina, etc.)
E. ESPECÍFICO TRATAMENTO (TRATAR CAUSA DA HEMORRAGIA-VIDE FLUXOGRAMA)
F. FOCO NA ATONIA: Se atonia confirmada, associada ou enquanto se procura outro foco
____MASSAGEM UTERINA BIMANUAL (iniciar imediatamente, enquanto aguarda medicação)
____OCITOCINA (5UI EV lento + SF0,9% 500 ml com 20UI ocitócito (4 ampolas) a 250ml\h.
____METILERGOMETRINA (1 ampola, 0.2mg, intramuscular)
____MISOPROSTOL(800mcg, via retal)
____BALÃO DE TAMPONAMENTO INTRAUTERINO: se falha do tratamento medicamentoso.
G. GERAL: AVALIAÇÃO PÓS-ABORDAGEM INICIAL
____ REAVALIAÇÃO da hemorragia e do estado hemodinâmico da paciente (índice de choque)
____ TRAJE ANTI-CHOQUE nas pacientes com instabilidade hemodinâmica
____ TRANSFUSÃO DE HEMODERIVADOS caso seja necessário(basear-se na clínica da paciente)
____EVITAR A HIPOTERMIA. TAX 15em 15 minutos na primeira hora. Avaliar uso de Manta Térmica
____Se falha tratamento conservador: avaliar tratamento cirúrgico
H. HORA DE AVALIAR TRATAMENTO CIRÚRGICO\ LAPAROTOMIA
___ Suturas compressivas (Suturas de B – Lynch e outros)
___Ligadura de vasos (uterinas e\ou ovarianas, hipogástrica)
___ Histerectomia
___ “Damage Control” (empacotamento abdominal e medidas de controle transitório do sangramento )
I. INTENSA OBSERVAÇÃO PÓS HEMORRAGIA
___ Monitorização rigorosa no Pré-parto nas primeiras 24 horas
___Monitorizar no CTI os casos mais graves
39
36
Anexo III– Kit
HPP
Anexo III - Kit HPP.
Item
PROTOCOLO\CHECK LIST
Quantidade
01 FLUXOGRAMA E CHECK LIST PLASTIFICADOS NO KIT
SORO FISIOLÓGICO 0,9%
02 FRASCOS DE 500 ml
RINGER LACTATO
02 FRASCOS DE 500 ml
EQUIPO DE SORO
02 UNIDADES
THREE-WAY + EXTENSOR
02 UNIDADES
OCITÓCITO (5UI/1 ML)
08 AMPOLAS DE 1 ml
METILERGOMETRINA (0,2MG\ML)
02 AMPOLAS DE 1 ml (ACESSO RÁPIDO) *
MISOPROSTOL 200MCG/CP
04 COMPRIMIDOS (ACESSO RÁPIDO) *
JELCO 16 OU 14
02 UNIDADES CADA
JELCO 18
SERINGAS
AGULHAS
02 UNIDADES (situações em que não é possível obter
acesso com Jelcos mais calibrosos)
02 UNIDADES 5ml
02 UNIDADES 20ml
4 UNIDADES 40X12mm
4 UNIDADES 25X8mm
MÁSCARA FACIAL OXIGÊNIO
01 UNIDADE
SONDA VESICAL DE DEMORA
02 UNIDADE
TERMÔMETRO
01 UNIDADE
MANTA TÉRMICA *
01 UNIDADE
BALÃO DE TAMPONAMENTO
INTRAUTERINO *
EQUIPO PARA PIA E ACESSO VENOSO
CENTRAL
01 UNIDADE: justificar o uso após procedimento
BOLSA PRESSÓRICA (PARA PIA)
01 UNIDADE
TUBOS DE COLETA DE SANGUE
FACILITADORES
TRAJE ANTI-CHOQUE**
Tubos para coleta de sangue (6 de cada)
Tampa amarela/vermelha, roxa e azul + Seringa para gasometria
Pedidos de exames já preenchidos e pré-aprovados
Medicamentos que não possam estar disponíveis no kit.
01 UNIDADE
Fonte: Adaptado a partir de kit Emergência. Programa de Qualificação da Assistência Perinatal do Estado de Minas Gerais. 2014
* Se disponível no serviço (solicite padronização nesses casos para disponibilizá-lo futuramente)
** Organizar fluxos especiais de urgência com o laboratório, a farmácia e o banco de sangue para que não
ocorra atrasos no manejo da HPP.
***Balão de tamponamento intrauterino: se não disponível, oferecer material para confecção de balão
artesanal (Cateter de Foley, Cateter nasogástrico, Condom, Fios de sutura, Saco coletor).
37
40
Protocolo de Hemorragia puerperal
Anexo IV - Transfusão de hemoderivados.
As bases da ressuscitação na HPP são o reestabelecimento do volume sanguíneo e a capacidade de carreamento de oxigênio.
Na paciente sem resposta clínica à reposição volêmica inicial, deve-se fazer o uso precoce de produtos sanguíneos, como concentrado de hemácias, plasma fresco congelado, crioprecipitado e plaquetas.
Concentrado de hemácias
Realizar transfusão sanguínea agressiva baseado no protocolo de transfusão maciça: O
melhor fluido para restauração volumétrica é o sangue, assim que disponível. O médico assistente
não deve aguardar resultados laboratoriais para indicar uma hemotransfusão, mas sim analisar os
critérios clínicos, perda sanguínea estimada e decidir em equipe a indicação.
Inicialmente, na falha de reposta à reposição volêmica, não se aguarda a prova cruzada e se
transfundem duas bolsas de concentrado de hemácias do Grupo O negativo. Quando possível,
o sangue tipado e com prova cruzada é o produto de eleição. O processo de prova cruzada leva
cerca de 40 minutos, a depender da unidade hospitalar.
Uma unidade de concentrado de hemácias aumenta o hematócrito em aproximadamente 3-4% numa paciente de 70Kg. Esse valor pode ser um pouco mais baixo devido à expansão
volêmica típica da gestante.
Plasma
Mediante a necessidade de uma terceira bolsa de CH, iniciar concomitantemente a infusão de
plasma. O plasma tem papel importante nas coagulopatias, pois ele contém quase todos os fatores de coagulação, e deve ser usado para manter o RNI < 1,5-1,7. Uso concomitante de PFC e CH
é altamente recomendado, em uma proporção 1.5:1 ou 1:1, com melhore taxas de sobrevida após
evento. Se for notado sangramento difuso, ou evidência laboratorial de CIVD, indica-se transfusão
imediata de 4 unidades de Plasma do tipo AB (se não houver tempo para prova cruzada).
Plaquetas
Indicada a transfusão se os níveis de plaqueta estiverem abaixo de 50,000-100,000 u/L. A administração de uma aférese de plaquetas a cada 6-8 unidades de CH também é comumente aceita.
Uma aférese de plaquetas corresponde a 6-8 UI de plaquetas, e pode aumentar a contagem
plaquetária de uma paciente de 70 kg em cerca de 40-50,000/uL. O objetivo é manter os níveis
de plaqueta entre 50,000-100,000/uL.
Crioprecipitado
Serve para reposição de fibrinogênio. Importante realizar monitoramento de fibrinogênio, em caso
de valor < 100-125 mg/dL com sangramento persistente, a transfusão de crioprecipitado é indicada.
Caso o resultado do exame ainda não estiver disponível, pode ser realizado o Teste de Weiner. O
crioprecipitado é liberado pelo banco de sangue em grupos de 6 - 10 unidades. Um pacote de 10UI
aumenta os níveis de fibrinogênio de uma paciente de 70 kg em aproximadamente 75mg/dL.
Metas
Após a estabilização clínica, em linhas gerais, deve-se objetivar os seguintes resultados:
Hemoglobina > 8g/dl
Hematócrito 21-24%
Plaquetas > 50 000
Protrombina < 1.5 x o controle
PTTA < 1.5-1.7 x o controle
Fibrinogênio > 100mg/dl
38
O papel dos exames laboratoriais
A avaliação de hemoglobina, coagulograma e eletrólitos é altamente recomendada, pois pode
ajudar a guiar correções de distúrbios hidroeletrolíticos e de coagulopatia. São comuns a hipercalemia (secundária a altas concentrações de potássio no sangue transfundido) e hipocalcemia
(cálcio quelado pelo citrato presente no plasma fresco congelado).
Tromboelastografia(TEG) e tromboelastometria (ROTEM)
São exames para avaliação da capacidade hemostática do sangue à beira do leito e podem se
mostrar úteis na avaliação e no acompanhamento de gestantes com hemorragia maciça. Vale ressaltar que o surgimento de coagulopatias de consumo e dilucionais não são incomuns nos casos
mais graves. Além disso, a agilidade dos testes laboratoriais convencionais da coagulação pode
não ser adequada a um quadro clínico sujeito a alterações extremamente rápidas e potencialmente
graves (normalmente a dosagem de fibrinogênio e coagulograma são feitos em no mínimo 40 minutos). O grande problema reside no fato de que a padronização dos resultados destes exames em
gestantes não está bem documentada, mesmo naquelas normais e nas puérperas. Assim, observamos debates entre os defensores ou não da disponibilidade deste exame em todas as unidades
obstétricas e aguardamos dados adicionais da literatura para estabelecer a sua utilização rotineira.
39
Protocolo de Hemorragia puerperal
Anexo V - Abordagem cirúrgica da placenta increta/percreta.
É importante pesquisar acretismo placentário em toda a paciente com placenta prévia através
de ultrassonografia e/ou Ressonância magnética.
Programar a cirurgia em torno de 34 a 36 semanas se acretismo grave (Increta ou Percreta)
confirmado com exames de imagem. Essas pacientes não devem entrar em trabalho de parto de
forma nenhuma e a cirurgia deve ser realizada por equipe cirúrgica com experiência oncológica,
urológica e/ou em trauma.
Figura 18 - Exérese de placenta e miométrio seguida de
metroplastia.
Figura 19 - Histerectomia com placenta in situ. Note
histerotomia fúndica para extração fetal.
Fonte: Imagens do arquivo pessoal Dr. Álvaro Alves, Hospital Sofia Feldman.
Procedimento Cirúrgico do Triplo P
•Passo 1: Localização Perioperatória da posição da Placenta e retirada do feto por incisão
transversa acima da borda superior da placenta. Histerorrafia deixando placenta intraútero sem descolar;
•Passo 2: Desvascularização uterina e pélvica (ligadura de artérias uterinas e hipogástricas ou ilíacas internas);
•Passo 3: Excisão miometrial com retirada da placenta sem separação do miométrio (em
bloco) e reconstrução uterina (metroplastia) ou realizar histerectomia total nas pacientes
com prole constituída.
Cirurgia conservadora em único Passo
Cirurgia de Palacios-Jaraquemada
•Incisão Pfannenstiel;
•Dissecção e hemostasia dos vasos neoformados;
•Histerotomia pela técnica de Ward;
•Ressecção completa do tecido invadido com a placenta aderida;
•Reparo tecidual adequado (útero-bexiga)- Cistoplastia e Metroplastia;
•Fechamento miometrial em 2 planos.
40
Anexo VI - Traje anti-choque não-pneumático em obstetrícia.
O traje anti-choque não-pneumático (TAN) consiste de uma veste de neoprene (com fixadores em
velcro), que recobre a paciente do tornozelo ao abdome, de forma segmentada. Não necessita dispositivo pneumático para realizar a compressão dos membros. E não recobre a região perineal, o que
permite a realização de procedimentos obstétricos que envolvem a manipulação do canal do parto.
O TAN age determinado uma pressão circunferencial de 20-40 mmHg nas partes inferiores do
corpo, o que causa um redirecionamento do sangue para as regiões mais superiores do organismo
(tais como cérebro, coração e pulmão) e pode determinar redução do ritmo da perda sanguínea
(por reduzir o aporte sanguíneo para o sítio da lesão).
Em 2015, a FIGO passou a recomendar o uso do TAN como ferramenta auxiliar e temporária
no manejo da HPP, especialmente nas situações em que se necessita de tempo para realizar o
tratamento definitivo (transferência, transfusões, cirurgias, dentre outros).
O TAN deve ser utilizado em caso de Instabilidade hemodinâmica e\ou sangramento vultuoso
com iminência de choque hipovolêmico.
Figura 20 - Traje anti-choque.
Fonte: El Ayadi et al.2013.
Vantagens
•Baixo custo por uso;
•Curto tempo de treinamento para o seu manuseio;
•Pode determinar redução da velocidade de sangramento;
•Pode permitir tempo extra para tratamento definitivo (transferência, transfusões, etc.);
•Pode facilitar a obtenção de acesso venoso na parte superior do corpo;
•Pode facilitar a reversão do choque;
•Pode reduzir a necessidade de transfusão;
•Pode reduzir necessidade de intervenção cirúrgica;
•Pode ser utilizado junto ao balão de tamponamento intrauterino;
•Permite realizar procedimentos obstétricos necessários no manejo da hemorragia.
41
Protocolo de Hemorragia puerperal
Contraindicações para seu uso
•Feto vivo viável;
•Doenças cardíacas graves;
•Hipertensão pulmonar;
•Edema agudo de pulmão;
•Lesão supra- diafragmática.
Tempo de uso
Variável, pode ser usado por horas ou dias. Tem-se relatado uso por 48-72 horas de forma segura. No entanto, a maioria dos casos é removido antes (média de remoção de 6-8 horas), desde
que preencha os critérios para retirada segura do TAN.
Posicionamento do TAN
A aplicação do TAN deve ser realizada SEMPRE de forma sequencial: iniciando-se do Segmento #1 (tornozelo) e terminando no Segmento #5\6 (abdome). (Vide Figura 21 e 22).
Deve-se aplicar o máximo de força\pressão ao se apertar os segmentos. Pode ser aplicado por
uma ou duas pessoas. Deve-se conferir o posicionamento de cada segmento a medida que os aplica.
Figura 21 - Segmentos do Traje anti-choque.
Fonte: Miller S, HB Matin and j Morris, 2008.
42
Sequência de aplicação
1.Abra o TAN e posicione a paciente em decúbito dorsal sobre a veste, de forma que: sua coluna esteja alinhada com a linha tracejada do TAN e borda superior do traje ao nível da última
costela(de modo que a bola de espuma fique posicionada na altura da cicatriz umbilical);
2.Posicione o Segmento # 1 na altura do tornozelo. Aperte e feche com o velcro, bilateralmente;
3.Posicione o Segmento #2 na altura da panturrilha, aperte e feche com o velcro, bilateralmente. Não encobrir o joelho. Nos casos de mulheres de baixa estatura, Segmento # 1
deve ser dobrado e inserido para dentro do Segmento # 2. Nesse caso o Segmento # 2
encobrirá a região destinada para o tornozelo e panturrilha. (Vide Figura 21);
4.Posicione o Segmento # 3 na altura da coxa, aperte e feche com o velcro, bilateralmente. O Segmento # 3 Não deve encobrir o joelho nem a articulação coxofemoral;
5.Segmento # 4 (ou segmento pélvico) deve ser posicionado na altura da sínfise púbica e
a seguir apertado e fixado por um único profissional;
6.Segmento abdominal # 5 (possui bola compressiva de espuma) deve ser posicionado na
altura da cicatriz umbilical e a seguir deve ser fechado juntamente com o Segmento abdominal # 6, por um único profissional. Se a paciente apresentar quadro de dispnéia
após esse posicionamento, afrouxe os Segmentos #5 e #6, mas evite retirar o TAN.
(Se ainda assim não melhorar a respiração avalie o quadro cardiorrespiratório e
avalie sua retirada).
Figura 22 - Paciente de baixa estatura utilizando um traje anti-chqoue.
Observe que o Segmento # 1 não está visível pois foi dobrado e inserido para dentro do Segmento # 2. Nesse caso o Segmento # 2 recobre a região destinada para o tornozelo e panturrilha.
43
Protocolo de Hemorragia puerperal
Remoção do TAN
A retirada do TAN NÃO pode ser realizada em qualquer ambiente e nem tampouco de forma
abrupta e inconsequente, pois a paciente pode evoluir para novo quadro de choque hipovolêmico.
Critérios e cuidados para remoção segura do TAN
1.Perda sanguínea < 50ml\h, por no mínimo 2 horas associado a:
a.Pulso ≤ 100 bpm;
b.Pressão sistólica > 90-100mmHg;
c.Hb >7 g\dL;
2.Monitorização contínua;
3.A retirada do TAN deve ser SEMPRE de forma sequencial: iniciando-se do Segmento #
1 (tornozelo) e terminando no Segmento #5\6 (abdome);
4.NUNCA retirar rapidamente o TAN: avaliar por 15-20 minutos a resposta hemodinâmica da paciente após abertura de cada um dos segmentos. Se ocorrer queda da PAS ≥
20mmHg OU aumento de FC ≥ 20 bpm: reposicionar o TAN imediatamente a partir do
Segmento #1 (assim como na colocação);
5.A equipe deve estar preparada para ressuscitação volêmica e para intervenção definitiva
caso ocorra instabilidade hemodinâmica após retirada do TAN.
Regra dos 20
“20 minutos de Intervalo para retirada de cada segmento”
Reposicionar TAN se:
Queda da PAS ≥ 20mmHg ou
Aumento de FC ≥ 20 bpm
44
Referência bibliográfica
1. ACOG Practice Bulletin. Postpartum Hemorrhage. Clinical Management Guidelines for Obstetrician–
Gynecologists Number 76, October 2006;
2.Aguiar RALP, Barra JS, Reis ZR. Kit de Emergência-HPP - Anexo 2. In: Rego ASR et al. Programa de Qualificação da Assistência Perinatal do Estado de Minas Gerais. Módulo II; Belo Horizonte. 2014; p. 67-72.
3.Ahmed S, Harrity C, Johnson S, Varadkar S, McMorrow S, Fanning R, et al. The efficacy of fibrinogen
concentrate compared with cryoprecipitate in major obstetric haemorrhage--an observational study.
Transfus Med. 2012;22(5):344-9.
4.Ajayi OA, Sant M, Ikhena S, Bako A. Uterine rupture complicating sequential curettage and Bakri balloon tamponade to control secondary PPH. BMJ Case Rep 2013. Acesso: http://www.ncbi.nlm.nih.gov/
pmc/articles/PMC3603833/pdf/bcr-2012-007709.pdf
5.Alves ALL, Silva LB, Melo HV. Uso de suturas uterinas compressivas na hemorragia pós-parto. FEMINA, 2014; 42(6):266-76.
6.Ambardekar S, Shochet T, Bracken H, Coyaji K, Winikoff B. Calibrated delivery drape versus indirect
gravimetric technique for the measurement of blood loss after delivery: a randomized trial. BMC Pregnancy and Childbirth 2014, 14:276.
7.Association of Anaesthetists of Great Britain and Ireland. Blood transfusion and the anaesthetist: management of massive haemorrhage. Anaesthesia 2010; 65: 1153-1161. Acesso: https://www.aagbi.org/
sites/default/files/massive_haemorrhage_2010_0.pdf
8.Bakri YN, Amri A, Abdul Jabbar F. Tamponade-balloon for obstetrical bleeding. Int J Gynaecol Obstet.
2001; 74(2):139-42.
9.Balki M, Tsen L. Oxytocin protocols for cesarean delivery. Int Anesthesiol Clin. 2014; 52(2):48-66.
10. Begley CM, Gyte GM, Devane D, McGuire W, Weeks A. Cochrane Database Syst Rev. Active versus
expectant management for women in the third stage of labour. 2015 Mar 2;3:CD007412.
11.Belfort, Michael A. Management of postpartum hemorrhage at cesarean delivery Uptodate, 2015.
12.Bohlman MK, Rath W. Medical prevention and treatment of postpartum hemorrhage: a comparison of
diferente guidelines. Arch Gynecol Obstet. 2014;289(3):555-67.
13.Bose P, Regan F, Paterson-Brown S. Improving the accuracy of estimated blood loss at obstetric haemorrhage using clinical reconstructions. BJOG. 2006;113(8):919-24.
14.Breen M.Temporary treatment of severe postpartum hemorrhage. Int J Gynaecol Obstet.
2012;118(3):253-4.
15.Burtelow M, Riley E, Druzin M, Fontaine M, Viele M, Goodnough LT. How we treat: management of
life-threatening primary postpartum hemorrhage with a standardized massive transfusion protocol.
Transfusion. 2007;47(9):1564-72. Acesso: https://www.researchgate.net/publication/6114101_How_
we_treat_Management_of_life-threatening_primary_postpartum_hemorrhage_with_a_standardized_
massive_transfusion_protocol
16.Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, et al. The decrease of fibrinogen is
an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost. 2007;5(2):266-73.
17.Chua S, Ho LM, Vanaja K, Nordstrom L, Roy AC, Arulkumaran S. Validation of a laboratory method of
measuring postpartum blood loss. Gynecol Obstet Invest 1998;46:31–3.
18.Clark SL, Hankins GD. Preventing Maternal Death: 10 Cinical Diamonds. Obstet Gynecol.
2012;119(2Pt 1):360-4.
19.Cortet M, Deneux-Tharaux C, Dupont C, Colin C, Rudigoz RC, Bouvier-Colle MH, et al. Association
between fibrinogen level and severity of postpartum haemorrhage: secondary analysis of a prospective trial. Br J Anaesth. 2012;108(6):984-9.
20.Dabelea V, Schultze PM, McDuffie RS Jr. Intrauterine balloon tamponade in the management of postpartum hemorrhage. Am J Perinatol 2007;24(6):359-64.
21.Dahlke JD, Mendez-Figueroa H, Maggio L, Hauspurg AK, Sperling JD, Chauhan SP, et al. Prevention
and management of postpartum hemorrhage: a comparison of 4 national guidelines. Am J Obstet Gynecol. 2015;213(1):76.e1-10.
22.de Lloyd L, Bovington R, Kaye A, Collis RE, Rayment R, Sanders J, et al. Standard haemostatic tests
following major obstetric haemorrhage. Int J Obstet Anesth. 2011;20(2):135-41.
23.Deganus S. Acesso http://slideplayer.com/slide/4526736/
45
Protocolo de Hemorragia puerperal
24.Deneux-Tharaux C, Sentilhes L, Maillard F, Closset E, Vardon D, Lepercq J, et al. Effect of routine
controlled cord traction as part of the active management of the third stage of labour on postpartum
haemorrhage: multicenter randomised controlled trial (TRACOR). BMJ. 2013;346:f1541. Acesso: http://
www.bmj.com/content/bmj/346/bmj.f1541.full.pdf
25.Didly III GA, Paine AR, George NC, Velasco C. Estimating Blood Loss: Can Teaching Significantly
Improve Visual Estimation ? Obstet. Gynecol 2004; 104(3): 601-606.
26.Dildy GA, Paine AR, George NC, Velasco C. Estimating blood loss: Can teaching significantly improve
visual estimation? Obstet Gynecol 2004;104:601–6.
27.Doumouchtsis SK, Papageorghiou AT, Arulkumaran S. Systematic review of conservative management of postpartum hemorrhage: what to do when medical treatment fails. Obstet Gynecol Surv 2007;
62(8):540-7.
28.Duthie SJ, Ven D, Yung GLK, Guang DZ, Chan SYW, Ma HK. Discrepancy between laboratory determination and visual estimation of blood loss during normal delivery. Eur J Obstet Gynecol Reprod Biol
1990;38:119–24.
29.Edelmuth RCL, Buscariolli YS, Ribeiro Jr MAF. Cirurgia para controle de danos: estado atual Damage
control surgery: an update. Rev Col Bras Cir 2013;40(2): 142-151. Acesso: http://www.scielo.br/pdf/
rcbc/v40n2/v40n2a11.pdf
30.El Ayadi AM, Butrick E, Geissler J, Miller S. Combined analysis of the non-pneumatic anti-shock garment on mortality from hypovolemic. BMC Pregnancy and Childbirth 2013, 13:208. http://www.biomedcentral.com/1471-2393/13/208
31.El Ayadi AM, Nathan HL, Seed PT, Butrick EA, Hezelgrave NL, Shennan AH, et al. Vital Sign Prediction of Adverse maternal Outcomes in Women with hypovolemic Shock: the Role of Shock Index.
PLoS One. 2016;;11(2):e0148729.
32.Eller AG, Porter TF, Soisson P, Silver RM. Optimal management strategies for placenta accreta.
BJOG. 2009;116(5):648-54.
33.Main EK, Goffman D, Scavone BM, Low LK, Bingham D, Fontaine PL, et al.. National Partnership
for Maternal Safety: Consensus Bundle on Obstetric Hemorrhage. J Obstet Gynecol Neonatal Nurs.
2015;44(4):462-70. Erratum in: J Obstet Gynecol Neonatal Nurs. 2015;44(6):E28.
34.Main EK, Goffman D, Scavone BM, Low LK, Bingham D, Fontaine PL et al.. Consensus Statement National Partnership for Maternal Safety Consensus Bundle on Obstetric Hemorrhage. Obstet & Gyneco,
2015; 126(1):155-162. Erratum in: Obstet Gynecol. 2015 Nov;126(5):1111.
35.Abdul-Kadir R, McLintock C, Ducloy AS, El-Refaey H, England A, Federici AB, et al. Evaluation and
management of postpartum hemorrhage: consensus from an international expert panel. Transfusion
2014;54:1756-1768.
36. Fawole B, Awolude OA, Adeniji AO, Onafowokan O . WHO recommendations for the prevention of postpartum haemorrhage: RHL guideline. The WHO Reproductive Health Library. Geneva: World Health Organization. Revised 1 May 2010. Acesso: https://www.researchgate.net/publication/237514678_WHO_
Recommendations_for_the_Prevention_of_Postpartum_Haemorrhage_Making_Pregnancy_Safer
37.FIGO Safe Motherhood and Newborn Health Committee; International Federation of Gynecology and
Obstetrics.Non-pneumatic anti-shock garment to stabilize women with hypovolemic shock secondary
to obstetric hemorrhage. Int J Gynaecol Obstet. 2015 ;128(3):194-5.
38.Georgiou C. Balloon tamponade in the management of postpartum haemorrhage: a review. BJOG.
2009 ; 116(6):748-57.
39.Georgiou C. Intraluminal pressure readings during the establishment of a positive 'tamponade test' in
the management of postpartum haemorrhage. BJOG. 2010; 117(3):295-303.
40.Girard T, Mörtl M, Schlembach D. New approaches to obstetric hemorrhage: the postpartum hemorrhage consensus algorithm. Curr Opin Anaesthesiol 2014;27(3):267-74.
41.Goodnough LT; Daniels K; Wong ME, Viele M, Fontaine MF, Butwick AJ. How we treat: transfusion
medicine support of obstetric services. Transfusion 2011;51(12): 2540-2548.
42.Grönvall M, Tikkanen M, Tallberg E, Paavonen J, Stefanovic V. Use of Bakri balloon tamponade in the
treatment of postpartum hemorrhage: a series of 50 cases from a tertiary teaching hospital. Acta Obstet Gynecol Scand. 2013; 92(4):433-8.
43.Gülmezoglu AM, Lumbiganon P, Landoulsi S, Widmer M, Abdel-Aleem H, Festin M et al. Active management of the third stage of labour with and without controlled cord traction: a randomised, controlled,
non-inferiority trial. Lancet. 2012; 379 (9827):1721-7.
46
44.Gutierrez MC, Goodnough LT, Druzin M, Butwick AJ. Postpartum hemorrhage treated with a massive transfusion protocol at a tertiary obstetric center: a retrospective study. Int J Obstet Anesth.
2012;21(3):230-5.
45.Hofmeyr GJ, Abdel-Aleem H, Abdel-Aleem MA. Uterine massage for preventing postpartum haemorrhage. Cochrane Database Syst Rev. 2013 Jul 1;7:CD006431.
46.Jelks A, Berletti M, Hamlett L, Hugin M. Nonpneumatic Antishock Garment Combined with Bakri Balloon as a Nonoperative “Uterine Sandwich” for Temporization of Massive Postpartum Hemorrhage from
Disseminated Intravascular Coagulation. Case Rep Obstet Gynecol. 2015;2015:124157
47.Jennings A, Brunning J, Brennan C. Management of obstetric haemorrhage anaesthesia tutorial of the
week 257. atotw 257 – Management of obstetric haemorrhage, Apr. 2012. Acesso: http://www.frca.
co.uk/Documents/257%20Management%20of%20Obstetric%20Haemorrhage.pdf
48.Johanson R, Kumar M, Obhrai M, Young P. Management of massive postpartum haemorrhage: use of
a hydrostatic balloon catheter to avoid laparotomy. BJOG. 2001 ; 108(4):420-2.
49.Johansson IP, Stensballe J , Oliveri R , Wade CE , Ostrowski SR, Holcomb JB. How I treat patients
with massive hemorrhage. BLOOD, 2014;124(20). Acesso: http://www.bloodjournal.org/content/bloodjournal/124/20/3052.full.pdf
50.Kayem G, Kurinczuk JJ, Alfirevic Z, Spark P, Brocklehurst P, Knight M; U.K. Obstetric Surveillance
System (UKOSS).Uterine compression sutures for the management of severe postpartum hemorrhage. Obstet Gynecol. 2011;117(1):14-20.
51.Kramer MS, Berg C, Abenhaim H, Dahhou M, Rouleau J, Mehrabadi A, et al. Incidence, risk factors,
and temporal trends in severe postpartum hemorrhage.Am J Obstet Gynecol. 2013;209(5):449.e1-7.
52.Gabel KT, Weeber TA. Measuring and Communicating Blood Loss During Obstetric Hemorrhage. J
Obstet Gynecol Neonatal Nurs. 2012;41(4):551-8.
53.Laas E, Bui C, Popowski T, Mbaku OM, Rozenberg P. Trends in the rate of invasive procedures after
the addition of the intrauterine tamponade test to a protocol for management of severe postpartum
hemorrhage. Am J Obstet Gynecol. 2012; 207(4):281.e1-7.
54.Lalonde A, Daviss BA, Acosta A, Herschderfer K. Postpartum hemorrhage today: ICM/FIGO initiative
2004-2006. Int J Gynaecol Obstet. 2006; 94(3):243-53.
55.de Lange NM, Lancé MD, de Groot R, Beckers EA, Henskens YM, Scheepers HC. Obstetrics Hemorrhage and Coagulation: An update. Thromboelastography, thromboelastometry, and conventional
coagulation tests in the diagnosis and prediction of postpartum hemorrhage. Obstet Gynecol Surv.
2012;67(7):426-35
56.Shields L, Lee R, Druzin M, McNulty J, Mason H, . Blood product replacement: obstetric hemorrhage. CMQCC obstetric hemorrhage toolkit obstetric hemorrhage care guidelines and compendium of best
practices. Reviewed by cadph-mcah: 11/24/09.. Acesso: https://www.cmqcc.org/resource/916/download.
57.Le Bas A, Chandraharan E, Addei A, Arulkumaran S. Use of the "obstetric shock index" as an adjunct
in identifying significant blood loss in patients with massive postpartum hemorrhage. Int J Gynaecol
Obstet. 2014;124(3):253-5.
58.Lilley G, Burkett-St-Laurent D, Precious E, Bruynseels D, Kaye A, Sanders J et al. Measurement of
blood loss during postpartum haemorrhage. Int J Obst Anest 2015; 24(1): 8–14.
59.Lombaard H, Pattinson RC. Common errors and remedies in managing postpartum haemorrhage.
Best Pract Res Clin Obstet Gynaecol. 2009;23(3):317-26.
60.Lyndon A, Lagrew D, Shields L, Melsop K, Bingham B, Main E (Eds). Improving Health Care Response to
Obstetric Hemorrhage. (California Maternal Quality Care Collaborative Toolkit to Transform Maternity Care)
Developed under contract #08-85012 with the California Department of Public Health; Maternal, Child and
Adolescent Health Division; Published by the California Maternal Quality Care Collaborative, July 2010.
61.Maslovitz S, Barkai G, Lessing JB, Ziv A, Many A. Improved accuaracy of postpartum blood loss estimation as assessed by simulation. Acta Obstet Gynecol 2008;87:929–34.
62.Mavis N. Schorn. Measurement of Blood Loss: Review of the Literature. J Midwifery Womens Health.
2010;55(1):20-7.
63.Soltan MH1, Faragallah MF, Mosabah MH, Al-Adawy AR. External aortic compression device: The
first aid for postpartum hemorrhage control. J Obstet Gynaecol Res. 2009; 35(3):453–458.
64.Miller S, Martin HB, Morris JL. Anti-shock garment in postpartum haemorrhage Best Pract Res Clin
Obstet Gynaecol. 2008;22(6): 1057–1074.
65.Miller S. NASG Frequently Asked Questions for Clinicians. Safe Motherhood Program. 2013. http://
www.safemotherhood.ucsf.edu/wp-content/uploads/2014/08/NASG-FAQs-Clinicians.pdf
47
Protocolo de Hemorragia puerperal
66.27. Nathan HL, El Ayadi A, Hezelgrave NL, Seed P, Butrick E, Miller S, et al.. Shock index: an effective
predictor of outcome in postpartum haemorrhage? BJOG. 2015 ;122(2):268-75.
67.Nelson WL, O'Brien JM. The uterine sandwich for persistent uterine atony: combining the B-Lynch
compression suture and an intrauterine Bakri balloon. Am J Obstet Gynecol. 2007 ; 196(5):e9-10.
68.Nesbitt A, Rai N, Limbu J, Leslie I, Yoong W. To tamponade or not to tamponade?. Acta Obstet Gynecol Scand. 2013; 92(9):1118-9.
69.Novikova N, Hofmeyr GJ. Tranexamic acid for preventing postpartum haemorrhage. Cochrane Database Syst Rev. 2010(7):CD007872.
70.Osada H, Silber S, Kakinuma T, Nagaishi M, Kato K, Kato O. Surgical procedure to conserve the
uterus for future pregnancy in patients suffering from massive adenomyosis. Reprod Biomed Online.
2011;22(1):94-9..
71.Pacagnella RC, Souza JP, Durocher J, Perel P, Blum J, Winikoff B. et al. A systematic review of the
relationship between blood loss and clinical signs. Plos One, 2013 ;8(3):e57594 Acesso: https://www.
ncbi.nlm.nih.gov/pmc/articles/PMC3590203/
72.Pacheco LD, Saade GR, Gei AF, Hankins GDV. Cutting-edge advances in the medical management of
obstetrical hemorrhage. Am J Obstet Gynecol. 2011 Dec;205(6):526-32.
73.Palacios-Jaraquemada JM, Fiorillo A. Conservative approach in heavy postpartum hemorrhage associated with coagulopathy. Acta Obstet Gynecol. 2010; 89: 1222–1225.
74.Palacios-Jaraquemada JM, García Mónaco R, Barbosa NE, Ferle L, Iriarte H, Conesa HA. Lower
uterine blood supply: extrauterine anastomotic system and its application in surgical devascularization
techniques. Acta Obstet Gynecol Scand. 2007;86(2):228-34.
75.Palacios-Jaraquemada JM. Efficacy of surgical techniques to control obstetric hemorrhage: analysis of
539 cases. Acta Obstet Gynecol Scand. 2011;90(9):1036-42.
76.Patel A, Goudar SS, Geller SE, Kodkany BS, Edlavitch SA, Wagh K, et al. Drape estimation vs. visual
assessment for estimating postpartum hemorrhage. Int J Gynaecol Obstet 2006; 93:220–4.
77.Paula LB, Fernandes AO, Mota EMS. Hemorragia pós-parto. IN: Filho ALS, Laranjeira CLS, Silva
CHM, Peret FJA, Bonomi IBA editores. Manual SOGIMIG de Emergências Obstétricas. 1ª Ed. Rio de
Janeiro: Medbook, 2016; 401-10.
78.Pileggi-Castro C, Nogueira-Pileggi V, Tunçalp Ö, Oladapo OT, Vogel JP, Souza JP. Non-pneumatic anti-shock garment for improving maternal survival following severe postpartum haemorrhage: a systematic
review. Reprod Health. 2015;12:28. Acesso: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3590203/
79.Prasertcharoensuk W, Swadpanich U, Lumbiganon P. Accuracy of the blood loss estimation in the
third stage of labor. Int J Gynaecol Obstet 2000;71:69–70.
80. Huijgen Q C A , Gijsen A F, Hink E, Van Kesteren P J M. Cervical tourniquet in case of uncontrollable haemorrhage during caesarean section owing to a placenta accreta. BMJ Case Rep. 2013; 2013: bcr2013009237.
81.Razvi K, Chua S, Arulkumaran S, Ratnam SS. A comparison between visual estimation and laboratory
determination of blood loss during the third stage of labour. Aust N Z J Obstet Gynaecol 1996;36:152–4.
82.RCOG. Blood Transfusion in Obstetrics. Green-top Guideline No. 47. May 2015. Acesso: https://www.
rcog.org.uk/globalassets/documents/guidelines/gtg-47.pdf
83.RCOG. Clamping of the Umbilical Cord and Placental Transfusion. Scientific Impact Paper No. 14,
February 2015. Acesso: https://www.rcog.org.uk/globalassets/documents/guidelines/scientific-impact-papers/sip-14.pdf
84.RCOG. Prevention and management of postpartum haemorrhage. Green-top Guideline No 52. 2011
(Peer Review 2015) Acesso;https://www.rcog.org.uk/globalassets/documents/guidelines/gt52postpartumhaemorrhage0411.pdf
85.Representantes del Grupo Desarrollador de la Guía - Universidad Nacional de Colombia - Alianza
Cinets*. Guía de práctica clínica para la prevención y el manejo de la hemorragia posparto y complicaciones del choque hemorrágico. Rev Colomb Obstet Ginecol 2013; 64:425-452. Acesso: http://www.
scielo.org.co/pdf/rcog/v64n4/v64n4a04.pdf
86.Secretaria Municipal de Saúde de Belo Horizonte. Assistência ao parto e nascimento – Diretrizes para
o cuidado multidisciplinar, 2015. Acesso: file:///C:/Users/pr084643/Downloads/protocolo-assistencia_
parto_nascimento-13-01-2016%20(1).pdf
87.Sentilhes L, Vayssière C, Deneux-Tharaux C, Aya AG, Bayoumeu F, Bonnet MP et al. Postpartum hemorrhage: guidelines for clinical practice from the French College of Gynaecologists and Obstetricians
(CNGOF) in collaboration with the French Society of Anesthesiology and Intensive Care (SFAR). Eur J
Obstet Gynecol Reprod Biol. 2016;198:12-21..
48
88.Shakur H, Elbourne D, Gülmezoglu M, Alfirevic Z, Ronsmans C, Allen E, et al. The WOMAN Trial
(World Maternal Antifibrinolytic Trial): tranexamic acid for the treatment of postpartum haemorrhage:
an international randomised, double blind placebo controlled trial. Trials. 2010;11:40. Acesso: https://
www.ncbi.nlm.nih.gov/pmc/articles/PMC2864262/
89.Maslovitz S, Barkai G, Lessing JB, Ziv A, Many A. Recurrent Obstetric Management Mistakes Identified by Simulation. Obstet Gynecol. 2007;109(6):1295-1300.
90.Skupski DW, Lowenwirt IP, Weinbaum FI, Brodsky D, Danek M, Eglinton GS. Improving hospital systems for the care of women with major obstetric hemorrhage. Obstet Gynecol. 2006;107(5):977-83.
91.SOGC Clinical Practice Guideline. Active Management of the Third Stage of Labour: Prevention and
Treatment of Postpartum Hemorrhage, No. 235 October 2009;
92.Sohn CH, Kim WY, Kim SR, Seo DW, Ryoo SM, Lee Y et alS. An increase in initial shock index is associated with the requirement for massive transfusion in emergency department patients with primary
postpartum hemorrhage. Schock 2013;40(2):101-105.
93.Solomon C, Collis RE, Collins PW. Haemostatic monitoring during postpartum haemorrahage and
implications for management. Br J Anaesth. 2012;109(6):851-63..
94.Stafford I, Dildy GA, Clark SL, Belfort MA. Visually estimated and calculated blood loss in vaginal and
cesarean delivery. Am J Obstet Gynecol 2008; 199:519;e1–e7.
95.Sukprasert M, Choktanasiri W, Ayudhya NI, Promsonthi P, O-Prasertsawat P. Increase accuracy of
visual estimation of blood loss from education programme. J Med Assoc Thai 2006;89: S54–9.
96.Tindell K, Garfinkel R, Abu-Haydar E, Ahn R, Burke TF, Conn K, et al. Uterine balloon tamponade
for the treatment of postpartum haemorrhage in resource-poor settings: a systematic review. BJOG.
2013;120(1):5-14.
97.Toledo P; McCarthy RJ; Burke CA; Goetz K, Wong C; Grobmann WA. The effect of live and web-based education on the accuracy of blood loss estimation in simulated obstetric scenarios. Am J Obstet
Gynecol. 2010;202(4):400.e1-5.
98.Turan J, Ojengbede O, Fathalla M, Mourad-Youssif M, Morhason-Bello IO, Nsima D et al. Positive Effects
of teh Non-pneumatic Atni-Shock Garment on Delays in Acessing Care for Postpartum and Postabortion
Hemorrhage in Egypt and Nigeria. Journal of Womens Health. 2011. Vol..20. No.1: p.91-98
99. Verkuyl DA. Fast and easy provisional treatment of severe postpartum haemorrhage. Comment.
2007;114(7):908-9; 909.
100.Vintejoux E, Ulrich D, Mousty E, Masia F, Marès P, de Tayrac R et al. Success factors for Bakri TM
balloon usage secondary to uterine atony: a retrospective, multicentre study. Aust N Z J Obstet Gynaecol. 2015;55(6):572-7.
101.WHO guidelines for the management of postpartum haemorrhage and retained placenta, World Health Organization, 2012. Acesso: http://apps.who.int/rhl/guidelines/appraisal_pph/en/
102.WHO recommendations for the prevention and treatment of postpartum haemorrhage - WHO Library Cataloguing-in-Publication Data. World Health Organization 2012. Acessado em 02/2016: http://
www.ncbi.nlm.nih.gov/books/NBK131942/pdf/Bookshelf_NBK131942.pdf
103.Wikkelsoe AJ, Afshari A, Stensballe J, Langhoff-Roos J, Albrechtsen C, Ekelund K, et al. The FIB-PPH trial: fibrinogen concentrate as initial treatment for postpartum haemorrhage: study protocol for
a randomised controlled trial. Trials. 2012;13:110.
104.Wright CE, Chauhan SP, Abuhamad AZ. Bakri balloon in the management of postpartum hemorrhage: a review. Am J Perinatol. 2014 ;31(11):957-64.
49
Protocolo de Hemorragia puerperal
Anotações
50
Anotações
51
Protocolo de Hemorragia puerperal
Anotações
52