QUÍMICA
Prof. Daniel Pires
AULA 01 - EXERCÍCIOS DE CINÉTICA - SÉRIE SALA
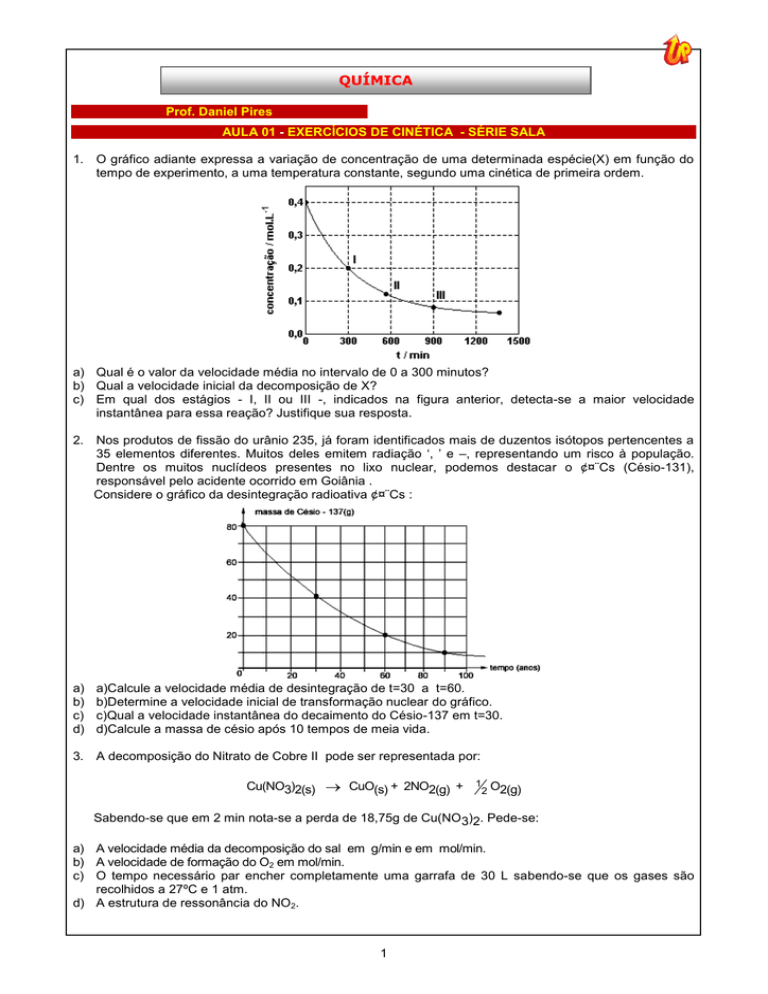
1. O gráfico adiante expressa a variação de concentração de uma determinada espécie(X) em função do
tempo de experimento, a uma temperatura constante, segundo uma cinética de primeira ordem.
a) Qual é o valor da velocidade média no intervalo de 0 a 300 minutos?
b) Qual a velocidade inicial da decomposição de X?
c) Em qual dos estágios - I, II ou III -, indicados na figura anterior, detecta-se a maior velocidade
instantânea para essa reação? Justifique sua resposta.
2. Nos produtos de fissão do urânio 235, já foram identificados mais de duzentos isótopos pertencentes a
35 elementos diferentes. Muitos deles emitem radiação „, ‟ e –, representando um risco à população.
Dentre os muitos nuclídeos presentes no lixo nuclear, podemos destacar o ¢¤¨Cs (Césio-131),
responsável pelo acidente ocorrido em Goiânia .
Considere o gráfico da desintegração radioativa ¢¤¨Cs :
a)
b)
c)
d)
a)Calcule a velocidade média de desintegração de t=30 a t=60.
b)Determine a velocidade inicial de transformação nuclear do gráfico.
c)Qual a velocidade instantânea do decaimento do Césio-137 em t=30.
d)Calcule a massa de césio após 10 tempos de meia vida.
3. A decomposição do Nitrato de Cobre II pode ser representada por:
Cu(NO3)2(s)
CuO(s) + 2NO2(g) + 12 O2(g)
Sabendo-se que em 2 min nota-se a perda de 18,75g de Cu(NO3)2. Pede-se:
a) A velocidade média da decomposição do sal em g/min e em mol/min.
b) A velocidade de formação do O2 em mol/min.
c) O tempo necessário par encher completamente uma garrafa de 30 L sabendo-se que os gases são
recolhidos a 27ºC e 1 atm.
d) A estrutura de ressonância do NO2.
1
4. A redução das concentrações de gases responsáveis pelo efeito estufa constitui o desafio central do
trabalho de muitos pesquisadores. Uma das possibilidades para o seqüestro do CO2 atmosférico é sua
transformação em outras moléculas. O diagrama a seguir mostra a conversão do gás carbônico
em metanol.
a)
b)
c)
d)
e)
f)
g)
Indique as etapas endotérmicas e exotérmicas.
Calcule a variação da entalpia na conversão do CO2 em metanol.
Indique a etapa lenta do processo. Justifique sua resposta.
Determine a energia de ativação e a energia do complexo ativado de todas as etapas.
Como seria a ação do catalisador na etapa I-II e do inibidor sobre a etapa III-IV?
Explique como a Platina (catalisador) e o Lítio (promotor) atuam sobre o CO 2
Cite 3 fatores que atuam nas colisões efetivas da reação entre o CO 2 e o H2.
5. Considere uma reação química endotérmica entre reagentes, todos no estado gasoso.
-1
a) Se a reação com velocidade de 2 moles.s variou sua temperatura de 10°C para 80°C. Qual seria o
valor da nova velocidade?
b) Explique através da equação de Arrhenius, se há influência da temperatura e/ou do catalisador sobre a
energia de ativação da reação.
c) Cite 3 outros fatores não citados na questão que influenciam a velocidade da reação.
6. Em uma reação de decomposição podemos fazer uso do conceito de meia-vida, que é o tempo
necessário para que a concentração do reagente se reduza à metade da concentração inicial.
A meia-vida da reação representada no diagrama abaixo é 2,4 horas a 30 °c.
a) Qual é o efeito sobre a entalpia da reação quando um catalisador é adicionado ao sistema?
b) Quantos gramas permanecerão na decomposição de 10 g de N2O5 a 30 °C, após um período de
4,8 horas?
c) Monte o gráfico da velocidade de decaimento do pentóxido de dinitrogênio do item b.
d) Sabendo que o NO2 é um dos responsáveis pela chuva ácida, escreva o nome dos ácidos formados
através da sua reação com água.
2
7. Entre o doping e o desempenho do atleta, quais são os limites? Um certo “ -bloqueador”, usado no
tratamento de asma, é uma das substâncias proibidas pelo Comitê Olímpico Internacional (COI), já que
provoca um aumento de massa muscular e diminuição de gordura. A concentração dessa substância
no organismo pode ser monitorada através da análise de amostras de urina coletadas ao longo do
tempo de uma investigação. O gráfico mostra a quantidade do “ -bloqueador” contida em amostras
de urina de um indivíduo, coletadas periodicamente durante 90 horas após a ingestão da substância.
Este comportamento é válido também para além das
90 horas. Na escala de quantidade, o valor 100 deve ser
100
entendido como sendo a quantidade observada num tempo
inicial considerado arbitrariamente zero.
a) a)A velocidade de desaparecimento do -bloqueador é maior
nas 20horas iniciais ou após 80horas? Explique.
b) b)Depois de quanto tempo a quantidade eliminada
corresponderá a 1
4
do valor inicial, ou seja, duas meias
Quantidade
80
60
40
20
vidas de residência da substâncias no organismo?
c) c)Um atleta realizou um teste antidoping que detectou 0,35
0
do bloqueador. Em que tempo após a ingestão foi realizado
0
20
40
60
80
o teste? (log 285,7 = 2,46 log2 = 0,3 )
Tempo em horas
d) d)Suponha que o doping para esta substância seja
considerado positivo para valores acima de 1,0 · 10–6 g/mL de urina (1 micrograma por mililitro) no
momento da competição. Numa amostra coletada 120 horas após a competição, foram encontrados
15 microgramas de “ -bloqueador” em 150 mL de urina de um atleta. Se o teste fosse realizado em
amostra coletada logo após a competição, o resultado seria positivo ou negativo? Justifique?
8. Considere a reação A + B → C e as informações contidas no quadro abaixo:
Experimentos
I
II
III
IV
Concentração de [A] Concentração de [B]
(mol/L)
(mol/L)
1
1
2
1
1
2
2
2
Velocidade de
–1 –1
reação (mol L s )
0,020
0,040
0,080
0,160
Determinar:
a) A ordem global da reação.
b) O valor de k.
c) Se a reação é elementar, justifique.3
9. A tabela abaixo indica valores das velocidades de reação e as correspondentes molaridades dos
reagentes, em idênticas condições, para o processo químico representado pela equação.
v(mol . L-1 . min-1 )
[X]
[Y]
10
5
10
40
40
10
10
10
20
Determine a equação de velocidade deste processo.
3
10. (Vunesp-SP) Uma das reações que ocorrem na camada de ozônio da atmosfera entre NO e O3 é
expressa pela equação NO + O3
NO2 + O2.
Essa reação foi estudada em laboratório e os seguintes dados foram obtidos, a 25ºC.
NO mol L 1
O3 mol L 1
NO2 / t
mol L 1 s 1
1,00 10 6
3,00 10 6
0,660 10 1
1,00 10 6
6,00 10 6
1,32 10 1
1,00 10 6
9,00 10 6
1,98 10 1
2,00 10 6
9,00 10 6
3,96 10 1
3,00 10 6
9,00 10 6
5,94 10 1
Determine a expressão da Lei de Velocidade e a unidade de k.
11. UERJ) A oxidação do brometo de hidrogênio pode ser descrita em três etapas:
I. HBr(g) + O2(g)
HOObr(g) (etapa lenta)
II. HBr(g) + HOOBr(g)
III. HOBr(g) + HBr(g)
2 HOBr(g) (etapa rápida)
Br2(g) + H2O(g) (etapa rápida)
a) Apresente a expressão da velocidade da reação de oxidação do brometo de hidrogênio.
b) Utilizando a equação global da oxidação do brometo de hidrogênio, determine o número de mols de Br2
produzido quando são consumidos 3,2 g de O2.
(Dados: O = 16; Br = 90)
4












