Aula: 08
Temática: Halogênios
Olá! Hoje iremos aprender sobre o grupo dos halogênios, um grupo
bastante interessante formado por elementos não metais. Vamos lá!
HALOGÊNIOS
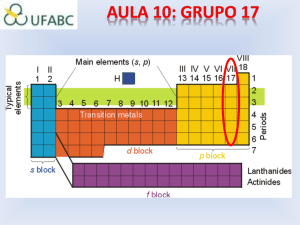
A série química dos halogênios é o grupo 17 (7A) da tabela periódica dos
elementos, formado pelos seguintes elementos: flúor, cloro, bromo, iodo e
astato (este último, radioativo e pouco comum). Esse grupo, juntamente com o
grupo 18 (8A) dos gases nobres, são as únicas famílias formadas por nãometais. A palavra provém do grego e significa formador de sais. Na forma
natural são encontrados como moléculas diatômicas, X2.
Ocorrência
Todos os halogênios são reativos e não ocorrem no estado livre. Contudo,
todos são encontrados na forma de compostos na crosta terrestre, exceto o
astato (este é radioativo e tem meia-vida). O flúor é o décimo - terceiro
elemento mais abundante em peso na crosta terrestre, e o cloro é o vigésimo.
Esses dois elementos são razoavelmente abundantes, mas o bromo e o iodo
são relativamente raros.
A principal fonte de flúor é o mineral CaF2, conhecido como fluorita (o nome
alternativo fluorita se deve à fluorescência do mineral, isto é, ele emite luz
quando aquecido). Outro mineral bastante conhecido contendo flúor é a
fluorapatita, [3Ca(PO4)2.CaF2]. Ele é essencialmente utilizado como matériaprima para a obtenção de fósforo. Não é utilizado para produzir HF e F2,
porque o mineral contém quantidades apreciáveis de SiO2. O HF produzido
reage com o SiO2 que forma ácido fluorssilícico, H2(SiF6). Esse ácido é usado
na fluoretação da água potável, no lugar do NaF. O mineral criolita Na3(AlF6) é
muito raro e é usado na obtenção eletrolítica do alumínio.
QUÍMICA INORGÂNICA
O composto mais abundante de cloro é o NaCl, do qual provém praticamente
todo o Cl2 e HCl produzidos. Uma parte do NaCl é minerado como sal-gema, e
a outra parte é obtida pela evaporação da água do mar ao sol. Os cloretos e
brometos são lixiviados do solo pela ação das chuvas e são arrastados para o
mar. A água do mar contém em média cerca de 15000 ppm (1,5%) de NaCl.
Todavia, a água de alguns lagos interiores contém quantidades bem maiores (o
Mar Morto contém 8% e o Grande Lago Salgado/Utah, EUA, contém 23%). Os
leitos secos de alguns lagos e mares contém depósitos de NaCl, misturados
com quantidades menores de CaCl2, KCl e MgCl2. Em contraste, a quantidade
de fluoretos na água do mar é muito baixa (1,2 ppm). Isso ocorre, porque a
água do mar contém uma grande concentração da Ca2+ , e o CaF2 é insolúvel.
O bromo não se encontra livre na natureza, aparece numa proporção de 67
mg/L na forma de brometo que são encontrados na água do mar. Os iodetos só
ocorrem na água do mar em pequenas concentrações, mas são absorvidos e
concentrados pelas algas. Antigamente, o iodo era extraído de algas, mas
atualmente há fontes mais convenientes. Algumas salmouras naturais contêm
elevadas concentrações de I-. O iodato de sódio (NaIO3) e o periodato de
sódio, (NaIO4), ocorrem como impurezas nos depósitos de NaNO3 (salitre) do
Chile.
Obtenção e Aplicações
O flúor é extremamente reativo, pois dificulta enormemente sua preparação e o
manuseio. O flúor é obtido tratando-se CaF2 com H2SO4 concentrado. Desta
forma, obtém-se uma solução aquosa de HF, que é posteriormente destilado
para se obter HF anidro líquido. Finalmente, F2 e H2 são obtidos pela eletrólise
de uma solução esfriada de KHF2 em HF anidro.
CaF2 + H2SO4 → CaSO4 + 2HF
KF + HF → K(HF2)
HF + K(HF2)
→
H2 + F2 + KF
(eletrólise)
QUÍMICA INORGÂNICA
Os fluoretos inorgânicos, tais como AlF3 e Na3(AlF6) sintético são usados na
obtenção de alumíno. Os isótopos de urânio podem ser separados por difusão
do gás UF6, na obtenção do urânio enriquecido. A indústria nuclear consome
cerca de 75% do flúor produzido. O UF6 é obtido como se segue:
U ou UF2 + HF → UF4
UF4 + F2
→ UF6
UF4 + ClF3 → UF6 + ClF
Os fluoroalcenos podem ser polimerizados, por processos térmicos ou
utilizando radicais livres como iniciadores. O politetrafluoreteno é conhecido
comercialmente como PTFE ou teflon. É usado como revestimento em
utensílios de cozinha não aderentes. Usado na produção do CFC’s, teve a sua
produção proibida devido aos problemas que causava na camada de ozônio. O
F2 é usado na fabricação de SF6, um gás muito inerte usado como dielétrico
(isolante) em equipamentos de alta tensão e na obtenção de agentes de
fluoração, como ClF3, BrF3. Seu uso em pequenas quantidades de íons
fluoreto, F-, na água potável (cerca de 1ppm) reduz significativamente a
incidência de cáries dentárias. O NaF é usado nos cremes dentais fuoretados.
O cloro é produzido industrialmente em grandes quantidades por dois métodos
principais: eletrólise de soluções aquosas de NaCl, no processo de fabricação
do NaOH: 2NaCl + 2H2O
→ 2NaOH + Cl2 + H2 , e na eletrólise do NaCl
fundido, no processo de fabricação do sódio: 2NaCl → 2Na + Cl2.
O cloro é usado na fabricação de:
• Solventes organoclorados, como cloreto de metila e cloreto de etila.
• Percloro e dicloroeteno.
• Mono, di e triclorobenzeno.
• Hexaclorobenzeno.
• Fenóis clorados.
• Hormônios de crescimento vegetal.
• Alvejantes, hipoclorito de sódio (NaClO), dióxido de cloro (ClO2) e
diversos cloretos de metais e não-metais.
QUÍMICA INORGÂNICA
O bromo é obtido a partir da água do mar e de lagos salgados. A água do mar
contém aproximadamente 65 ppm de Br-. Inicialmente, o pH é ajustado para
cerca de 3,5 com H2SO4, e, a seguir, o Cl2 gasoso é borbulhado na solução
para oxidar o Br- a Br2.
Cl2 + 2Br- → 2Cl- + Br2
O bromo é removido com auxílio de um fluxo de ar, pois é muito volátil, e
borbulhado numa solução de Na2CO3, na qual é absorvido reagindo e
formando uma mistura de NaBr e NaBrO3. Finalmente, a solução é acidificada
e destilada para se obter o bromo puro.
3Br2 + 3Na2CO3 → 5NaBr + NaBrO3 + 3CO2
5NaBr + NaBrO3 + 3H2SO4 → 5HBr + HBrO3 + 3Na2SO4
5HBr + HBrO3 → 3Br2 + 3H2O
O bromo é empregado na obtenção de derivados orgânicos, tais como brometo
de metila, brometo de etila e dibromocloropropano que são usados na
agricultura, como os pesticidas. Também é empregado na fabricação de
retardantes de chama, fibras acrílicas e poliéster, emulsões fotográficas, filtros
bactericidas para água potável e corantes. O KBr é usado como sedativo e
como anti-convulsivo no tratamento da epilepsia.
O iodo é obtido por dois métodos industriais. O método depende da matériaprima, ou seja, o salitre do Chile ou uma salmoura natural.
O salitre do Chile é constituído essencialmente por NaNO3, mas contém
pequenas quantidades de iodato de sódio, NaIO3 e periodato de sódio, NaIO4.
O NaNO3 puro é obtido dissolvendo-se o salitre em água e recristalizando-o.
A água do mar contém apenas 0,05 ppm de I-, uma quantidade muito baixa
para permitir uma exploração economicamente viável. A salmoura natural, que
pode conter de 50 a 100 ppm, é tratada com Cl2 para oxidar os íons I- a I2. Este
é removido por um fluxo de ar de modo semelhante ao bromo, ou, após a
QUÍMICA INORGÂNICA
oxidação com Cl2, a solução pode ser passada através de uma resina de troca
iônica. O I2 fica adsorvido na coluna na forma de íons triiodeto, I3-, que é
removido da resina com uma solução alcalina.
O iodo é usado na obtenção de uma variedade de compostos orgânicos, que
inclui o iodofórmio, CHI3 (usado como anti-séptico), e o iodeto de metila, CH3I.
O AgI (Iodeto de Prata) é usado em filmes fotográficos e para semear nuvens
para provocar a precipitação de chuvas artificiais. Pequenas quantidades de
iodo são necessárias na dieta humana, por isso adiciona-se cerca de 10 ppm
de NaI (Iodeto de Sódio) ao sal de cozinha. O KI é adicionado à ração de
animais (mamíferos e aves). O iodo também é usado como antisséptico; na
análise volumétrica; na preparação da tintura de iodo, que é uma solução
aquosa de iodo em KI (“lugol”) e o iodo “francês” que é uma solução alcoólica
de iodo.
O astato não ocorre na natureza, mas foram obtidos artificialmente mais de
vinte isótopos. Todos são radioativos. Os isótopos mais estáveis são o
(meia-vida de 8,3 horas) e o
211
210
At
At (meia-vida de 7,5 horas).
Estrutura e Propriedades
Todos apresentam 7 elétrons no seu último nível de energia, terminando a sua
configuração eletrônica em subnível p com 5 elétrons. Para um halogênio
adquirir estabilidade química, o seu último nível de energia precisa receber um
elétron, transformando-se num íon mononegativo, X-. Este íon é denominado
haleto e os seus sais de haletos. Um dos haletos mais famosos é o cloreto de
sódio, conhecido como sal de cozinha.
Muitos compostos orgânicos sintéticos e alguns naturais contém halogênios.
Estes compostos são denominados compostos halogenados.
Possuem uma eletronegatividade ≥ 2 5 segundo a escala de Pauling, sendo o
flúor o de maior eletronegatividade (4,0). O valor da eletronegatividade no
grupo decresce de cima para baixo, e o astato é o menos eletronegativo. São
altamente oxidantes (decrescendo esta propriedade, no grupo, de cima para
QUÍMICA INORGÂNICA
baixo), por isso reagem espontaneamente com os metais, não-metais,
substâncias redutoras e até com os gases nobres.
Devido a esta alta reatividade podem ser perigosos ou letais para organismos
vivos em quantidade suficiente. São tóxicos (exceto o iodo), voláteis em
condições ambientais, em que pode ocasionar queimaduras na pele e nas vias
respiratórias.
O flúor e o cloro são gasosos, o bromo é líquido, o iodo e o astato
são sólidos. Todos os halogênios são solúveis em água, mas o grau em que
reagem com a mesma e o mecanismo da reação variam. O flúor é o mais
reativo de todos os elementos da tabela periódica. Ele reage com todos os
elementos, exceto os gases nobres mais leves He, Ne, Ar. Suas reações com a
maioria dos elementos são vigorosas e muitas vezes explosivas. A grande
reatividade do flúor é atribuída a dois fatores: a pequena energia de
dissociação da ligação F-F (energia de ativação da reação é baixa) e a
formação de ligações muito fortes. Todos os halogênios são muito
eletronegativos. A maioria dos compostos formados pelos halogênios é iônica,
contudo, haletos covalentes são formados em alguns casos em que o íon
metálico é muito pequeno e tem carga elevada (as estruturas do BeCl2 e do
AlCl3). O estado de oxidação mais comum dos halogênios é –1, mas pode
possuir outros valores de oxidação.
Está foi nossa última aula da primeira unidade, na qual falamos
sobre o grupo halogênios, suas estruturas e utilizações. Nos grupos
halogênios, estão os elementos mais reativos quando comparados com os
outros elementos periódicos. Por esse motivo, deve-se tomar cuidado ao
manipular esses elementos. Faça a auto-avaliação e teste seu conhecimento.
Caso haja alguma dúvida, entre em contato com os tutores. Até a próxima
unidade.
QUÍMICA INORGÂNICA