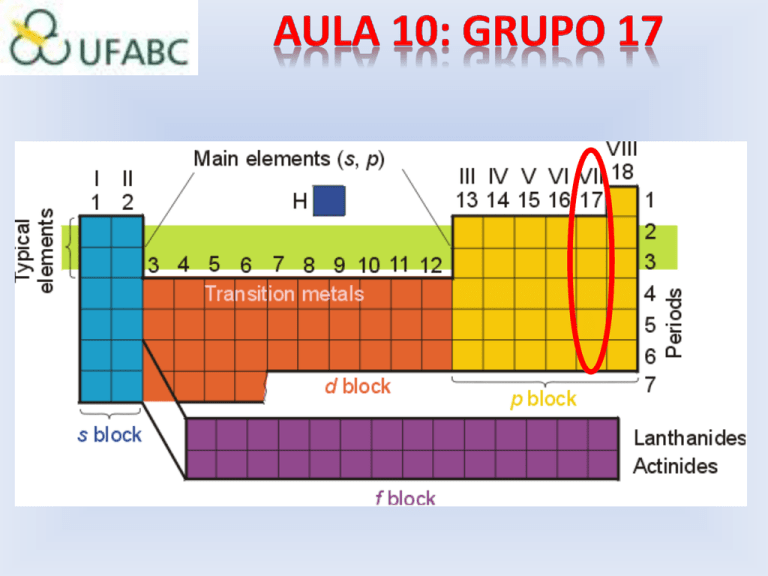
Elementos do Grupo 17 - Halogênios
Do Grego: Formador de sal
Configuração Eletrônica
F [He] 2s2 2p5
Cl [Ne] 3s2 3p5
Br [Ar] 3d10 4s2 4p5
I
[Kr] 4d10 5s2 5p5
At [Xe] 4f14 5d10 6s2 6p5
Propriedades Atômicas
Configuração Eletrônica
Estados Oxidação
F
[He] 2s2 2p5
-1, 0
Cl
[Ne] 3s2 3p5 3d0
-1,0,+1,+3,+4,+5,+6, +7
Br
[Ar] 3d10 4s2 4p54d0
-1,0,+1,+3,+4,+5,+6
I
[Kr] 4d10 5s2 5p55d0
-1,0,+1,+3,+5,+7
At
[Xe] 4f14 5d10 6s2 6p5
ns
np
nd
Heptóxido de dicloro
Dióxido de cloro
Propriedades Atômicas
Propriedades Atômicas
Os elementos desse grupo são muito semelhantes:
• possuem sete elétrons no nível mais externo
• eletronegatividade decresce para baixo no grupo
•Formam ligação iônica quando adquirem um
elétron formando íon X- ou formam ligação
covalente e completam seu octeto.
• O flúor é sempre monovalente negativo
• Os demais elementos do grupo podem possuir
números de oxidação que podem variar entre -1
até +7 (desemparelhamento de elétrons)
Propriedades Gerais
• PF e PE aumentam com o aumento do número atômico
flúor e cloro gases
bromo líquido
iodo sólido
• todos formam moléculas diatômicas
• as moléculas X2 são coloridas devido a absorção de luz visível e
conseqüente promoção de elétrons mais externos, que passam para
níveis mais energéticos.
•quanto mais pesado o átomo, menor a quantidade de energia
necessária para promover os elétrons (Br2 e I2: cores região do vermelho
(absorve a luz verde – 490-560 nm) e roxo (absorve luz amarela 560 –
580 nm))
• F2: quase incolor (absorve radiação UV)
•Cl2: verde-amarelo.
Energia de dissociação das moléculas diatômicas
• A energia de dissociação do F2 é
muito baixa devido a repulsão dos
pares de elétrons não ligantes, o que é
responsável pela sua grande
reatividade.
• Esta repulsão é maior no F pelo seu
tamanho reduzido, o que aumenta a
repulsão entre elétrons por estarem
mais próximos devido à atração
elétron-núcleo
Entalpias de dissociação das ligações:
- carbono-halogênio
- hidrogênio-halogênio
- halogênio-halogênio
A força da ligação
H-X
muda em função do
comprimento de
C-X
ligação (que depende
do tamanho dos
átomos envolvidos).
Note a força das
ligações H-F e F-F
X-X
Poder oxidante
Relacionado com a afinidade eletrônica do elemento
(capacidade de receber elétrons = poder oxidante de um elemento)
F
Cl
Br
I
Todos os halogênios são agentes oxidantes.
O poder oxidante decresce do flúor para o iodo.
Reatividade dos Halogênios
Relacionada com a força de ligação X-X e com a eletronegatividade
do elemento
Reatividade dos halogênios diminui com a
aumento do número atômico
O flúor é o mais reativo dos halogênios, reage com todos os
elementos exceto He, Ne e Ar.
Sua grande reatividade é devida:
- a baixa energia da ligação F – F
- ao seu extremo poder oxidante
- ao pequeno tamanho de seus átomo ou íons
- a sua alta eletronegatividade
A alta eletronegatividade leva a formação de ligações fortes com
outros elementos.
Ocorrência, Obtenção e Uso dos halogênios
Como são muito reativos, na natureza são encontrados como compostos
Abundância
(mg/kg) (crosta)
F
900
Cl
314
Br
1,6
I
0,3
Ocorrência, Obtenção e Uso dos halogênios
• Latim - Fluir
• Fluorita – CaF2
• Apatita – Ca3(PO4)2(OH, F, Cl)
• Grego - Esverdeado
• Halita – NaCl
• Sodalita – Na4Al3(SiO4)3Cl
• Água do mar
15000 mg/kg
Porque o flúor está presente principalmente em
minérios e o cloro na água do mar?
O fluoreto (F-) é um ânion
pequeno
seus compostos iônicos tem
uma alta entalpia de rede
baixa solubilidade
Solubilidade
Energia em processos de dissolução: Entalpia de Rede + Entalpia Hidratação
CaF2 (s) Ca+ (aq) + 2 F- (aq)
2709 + (-2623) = +86 KJ.mol-1
endotérmica
NaCl (s) Na+ (aq) + Cl- (aq)
787 + (-784) = +3 KJ.mol-1
endotérmica
KCl (s) K+ (aq) + Cl- (aq)
717 + (-701) = +16 KJ.mol-1
endotérmica
Ocorrência, Obtenção e Uso dos halogênios
• Grego - Fétido
Br
• Água do mar
• Difuso em outros minerais
I
• Água do mar
• Difuso em salitre (NaIO3 e NaIO4)
Ocorrência, Obtenção e Uso dos halogênios
• O Astato ocorre em traços nos minerais Uranita e Torita
(Th, U)SiO4
UO2
• Tempo de meia-vida de 8,1 h
• Estima-se cerca de ± 31g de Astato na Crosta Terrestre
Métodos de Obtenção
Esquema de uma célula eletrolítica
para produção de flúor a partir de
fluoreto de potássio dissolvido em
fluoreto de hidrogênio líquido (1:2)
fluorita
CaF2 + H2SO4 CaSO4 + 2HF
KF + HF K[HF2]
HF + K[HF2] H2 + F2 ELETRÓLISE
Aplicações
• adicionado à água para prevenir perda dos dentes
Ca5(PO4)3OH (s) + 4 H3O+ (aq) 5 Ca2+ (aq) + 3HPO42-(aq) + 5 H2O (l)
Tratamento com Flúor forma uma cobertura mais resistente ao ataque:
Ca5(PO4)3OH (s) + F- (aq) Ca5(PO4)3F (s) + OH-(aq)
•O Flúor é usado na separação dos isótopos do urânio
(processamento de combustível nuclear).
U 235O2 4 HF U 235F4 H 2O
U 235F4 F2 U 235F6 ( gás)
U 238O2 4 HF U 238F4 H 2O
U 238F4 F2 U 238F6 ( gás)
Aplicações
• usado na produção de
compostos orgânicos
fluorados (Teflon)
São compostos inertes a
oxidação do ar, de ácido
nítrico, sulfúrico e outros
agentes oxidantes.
Métodos de Obtenção
Eletrólise NaCl fundido
2 NaCl( fund) eletrólise
2 Na(0s )
no cátodo
Cl2 (g)
no ânodo
Eletrólise NaCl aquoso
2 NaCl( aq) 2H 2O(l ) eletrólise
2 NaOH( aq) H 2 (g) Cl2 (g)
Métodos de Obtenção
Em laboratório:
• Oxidação do NaCl a partir do (K2Cr2O7)
• Cl2 é borbulhado na água
6Cl- + Cr2O72- + 14H+ 3Cl2 + 2Cr3+ + 7H2O
Aplicações
• O cloro é empregado na fabricação de plásticos, canos, solventes e
pesticidas.
• Usado como alvejante de papel e tecido e para tratamento de água.
Métodos de Obtenção
É obtido pelo borbulhamento de Cl2 na água do mar
(7 toneladas de água do mar fornece 0,5 kg de bromo)
Cl2( g ) 2 Br( aq) 2 Cl( aq) Br2( dispersoem água)
a - O bromo é adsorvido em solução de Na2CO3 formando NaBr
e NaBrO3.
b – a mistura é acidificada e destilada evaporando o Br2
• O bromo é usado na fabricação de 1,2-dibromoetano para
remoção do chumbo na gasolina, produção de AgBr para filme
fotográfico
Métodos de Obtenção
• Ocorre como impureza no salitre do Chile na forma de iodato e de
periodato.
• Ocorre como íon iodeto na água do mar (pode ser obtido de plantas
marinhas que contém grande quantidade de água do mar: 2000 Kg
de plantas fornecem 1 Kg de iodo).
A oxidação do I- com gás cloro produz iodo
elementar:
Cl2( g ) 2 I ( aq) 2 Cl( aq) I 2( dispersoem água)
• Empregado como anti-séptico de ação oxidante moderada
• É adicionado ao sal de cozinha para evitar o bócio
Preparação do iodo no laboratório:
2 I- + 4 H+ + MnO2 Mn2+ + I2 + 2 H2O
NaI + MnO2
Adição de H2SO4;
produz I2.
209
4
211
1
Não ocorre na natureza
Bi
At
2
83
2
85
0N
Existem 20 isótopos todos radioativos
Propriedades Químicas
Principais Compostos
Haletos de Hidrogênio (HX)
• Todos os halogênios reagem com hidrogênio formando haletos
• A reatividade entre halogênios e hidrogênio diminui com o
aumento do número atômico.
• O HF e HCl são preparados por reação dos sais com ácido sulfúrico
CaF2( s ) H 2 SO4(l ) 2 HF( aq) CaSO4 ( s )
CaCl2( s ) H 2 SO4 (l ) 2 HCl( aq) CaSO4( s )
Haletos de Hidrogênio (HX)
• O HBr é obtido pelas reações a seguir:
H 3 PO4( aq) 3 NaBr( s ) Na3 PO4( s ) 3 HBr( aq)
ou
P4( s ) 6 Br2(g) 4 PBr3(s)
PBr3( s ) 3 H 2O(l ) H 3 PO4 ( aq) 3 HBr( g )
• O HI pode ser obtido de forma semelhante adicionando-se água a
uma mistura de fósforo e iodo.
Para produção de HBr e HI não pode ser utilizado H2SO4, pois ele
provoca a oxidação dos produtos
Haletos de Hidrogênio (HX)
• HCl, HI e HBr são gases
• HF é liquido com ponto de ebulição de 19 C. Esse ponto de
ebulição elevado é devido a presença de ligações de hidrogênio no
HF
• no estado gasoso todos os hidretos são covalentes
• quando dissolvidos em água o HCl, HI e HBr dissociam-se
comportando-se como ácidos fortes:
HX ( g ) H 2O( l ) H 3O ( aq) X ( aq)
X Cl , Br ou I
• força dos ácidos
HI HBr HCl HF
Por que o HF não é o mais forte ?
Força dos ácidos
HX (hidrat) H+ (hidrat) + X- (hidrat)
Força ácida H(desidrat.) H ( dissoc.) E(ioniz.) AE H ( hidrat.)
Força dos ácidos
Força ácida H(desidrat.) H ( dissoc.) E(ioniz.) AE H ( hidrat.)
G H TS
(Todos os valores estão em kJ/mol)
Logo, o HF é o ácido mais fraco
Principais Compostos
Óxidos de Halogênio
• Flúor e oxigênio forma-se fluoretos de oxigênio e não óxidos de
flúor (flúor = ânion e oxigênio = cátion) devido a maior
eletronegatividade do flúor
•Quase todos são instáveis e explodem quando submetidos a
choques ou a luz
•A estabilidade decresce na seguinte ordem: I > Cl > Br
•Óxidos nos quais o halogênio possui número de oxidação mais altos
são mais estáveis
•As ligações são sempre covalentes devido as pequenas diferenças
entre as eletronegatividades dos halogênios e do oxigênio.
OF2 – Não é um óxido
• é um gás incolor
• já foi usado na propulsão de foguetes
• é um agente oxidante forte que reage violentamente com metais, S,
P e halogênios formando fluoretos e óxidos
Obtenção: 2 F2(g) 2 NaOH(aq) 2 NaF(aq) H 2O2(aq) OF2( s )
Cl2O e Br2O
Cl2O – é um gás
Br2O – é um líquido
2 Cl2( g ) 2 HgO( s ) 300
o HgCl2 .HgO( s ) Cl 2 O( g )
C
Obtenção:
2 Br2( g ) 2 HgO( s ) 300
o HgBr2 .HgO( s ) Br2 O( l )
C
Ambos são coloridos
e explodem na
presença de agentes
redutores
Principais Compostos
Oxiácidos de Halogênio
Cloro, bromo e iodo formam oxiácidos do tipo:
Quanto mais átomos
de oxigênio, maior é
a tendência dos
elétrons da ligação
OH serem atraídos
para longe da mesma
e mais fraca será
essa ligação
Ácidos hipohalosos (HOX)
•Todos são fracos somente existindo em solução aquosa.
•Podem ser preparados pela adição do gás de halogênio a água:
X 2(g) H 2O(l) HXO(aq) HX(aq)
Quando reagem com NaOH formam os hipohalitos: NaClO, NaBrO,
NaIO
• Os hipocloritos são usados como alvejantes e como desinfetantes
pois são capazes de oxidar matérias orgânicas:
2 HClO (aq) 2 H+ (aq) + 2 Cl- (aq) + O2 (g)
• O hipoclorito de sódio é usados em piscinas:
NaClO (aq) + Cl- (aq) + H2O (l) 2 OH- (aq) Na ++ Cl2 (g)
• O hipoclorito de sódio é obtido industrialmente pela eletrólise de
uma solução esfriada de NaCl, sob vigorosa agitação
Cl2 (g)
2Cl- (aq) Cl2 (g) + 2e
+ 2OH- (aq) + ClO- (aq) + Cl- (aq) + H2O
No ânodo
Ácidos hálicos (HXO3)
HClO3 e HBrO3 – somente existem em solução
HIO3 – existe na forma sólida
• Quando neutralizados formam cloratos, bromatos e iodatos
• Os cloratos liberam O2 quando aquecidos, e são usados como
fonte de oxigênio em fogos de artifício
2 KClO3 (s) 2 KCl (s) + 3 O2 (g)
• usados na preparação do dióxido de cloro ClO2, que é usado para
branquear papel, já que oxida os pigmentos presentes sem degradar
as fibras da madeira.
2 NaClO3 (s) + SO2 (g) + H2SO4 (l) 2 NaHSO4 (aq) + 2 ClO2 (g)
Ácidos perhálicos (HXO4)
• Existem ácidos perclórico, perbrômico e periódico.
• O ácido perclórico (HClO4) explode na presença de uma pequena
quantidade de material orgânico.
• São agentes oxidantes muito fortes (estado de oxidação do Cl é +7)
•O perclorato de amônio é empregado em um combustível sólido
usado na propulsão de foguetes. A mistura é composta por alumínio
em pó (combustível), perclorato de amônio (oxidante) e óxido de
ferro(III), que é empregado como catalisador. Uma das reações que
pode ser formada na combustão é:
Fe2O3
3 NH4ClO4 (s) + 3 Al (s) Al2O3 (s) + AlCl3 (s) + 6 H2O (l) + 3 NO (g)
Principais Compostos
Compostos de Halogênios
Os halogênio formam compostos entre eles
mesmos, conhecidos como interhalogênios.
• são preparados pela reação direta entre os halogênios
• possuem propriedades físicas intermediárias aos halogênios que os formam.
• fluoretos de halogênio, quanto mais pesado o halogênio, menor a energia de
dissociação entre os átomos e mais reativo o composto
Principais Compostos
Poli-Haletos
Íons haletos podem reagir com moléculas de halogênio formando íons polihaletos.
São estabilizados por cátions grandes.
São compostos tipicamente iônicos: cristalinos, solúveis em água, conduzem
eletricidade quando em solução.
Se decompõem quando aquecidos.
•Iodo: pouco solúvel em água (0,34 g.L-1), mas a solubilidade é aumentada
na presença de íons iodeto em solução:
Formação de poli-haleto: I2 + I- I3• Bromo: Br3- é muito menos estável do que I3-.
• Poucos compostos estáveis contendo Cl3- e nenhum F3- é conhecido.
Aplicações Industriais
Bibliografia
• Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio Ambiente, 3
ed., Porto Alegre: Bookman, 2006.
•Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
• Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3’ ed., São Paulo, 1980












