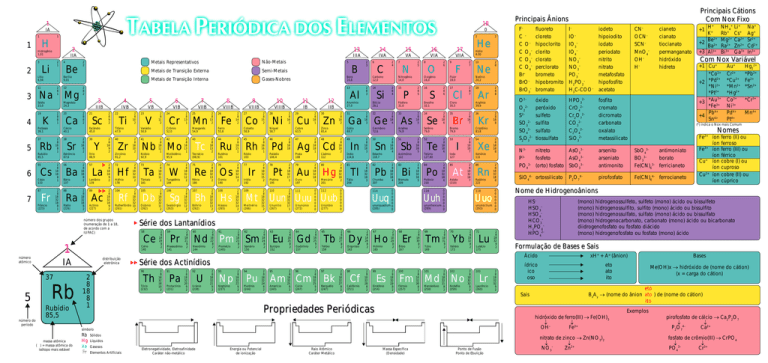
1
18
IA
0
1
1
1
H
3
2
Li
Lítio
6,94
Na
K
Potássio
39,1
12
Mg
20
Ca
Rb
Rubídio
85,5
Cs
Césio
133
Fr
Frâncio
(223)
2
8
18
8
1
38
2
8
18
18
8
1
56
2
8
18
32
18
8
1
88
Sr
Estrôncio
87,6
Ba
Bário
137
Ra
Rádio
(226)
Não-Metais
Metais de Transição Externa
Semi-Metais
Metais de Transição Interna
Gases-Nobres
3
4
IIIB
2
8
8
2
21
Sc
Escândio
45,0
2
8
18
8
2
39
2
8
18
18
8
2
57
2
8
18
32
18
8
2
89
Y
Ítrio
88,9
La
Lantânio
139
Ac
Actínio
(227)
5
IVB
2
8
9
2
22
Ti
2
8
18
9
2
40
2
8
18
18
9
2
72
2
8
18
32
18
9
2
104
Zr
Zircônio
91,2
Hf
Háfnio
178
23
V
2
8
18
10
2
41
2
8
18
32
10
2
73
Nb
Nióbio
92,9
Ta
Tântalo
181
105
Db
Dúbnio
(262)
58
Ce
IA
número do
período
Rb
Rubídio
85,5
2
8
18
8
1
24
Cr
VIIB
2
8
13
1
Crômio
52,0
2
8
18
12
1
42
2
8
18
32
11
2
74
2
8
18
32
32
11
2
106
Mo
Molibdênio
95,9
W
Tungstênio
184
Sg
Seabórgio
(263)
8
25
Mn
VIIIB
2
8
13
2
Manganês
54,9
2
8
18
13
1
43
2
8
18
32
12
2
75
2
8
18
32
32
12
2
107
Tc
Tecnécio
(98,9)
Re
Rênio
186
Bh
Bóhrio
(262)
9
26
Boro
10,8
Fe
Ferro
55,8
2
8
18
13
2
44
2
8
18
32
13
2
76
2
8
18
32
32
13
2
108
Ru
Rutênio
101
Os
Ósmio
190
Hs
Hássio
(265)
10
VIIIB
2
8
14
2
27
Co
Cobalto
58,9
2
8
18
15
1
45
2
8
18
32
14
2
77
2
8
18
32
32
14
2
109
2
8
18
23
8
2
62
Rh
Ródio
103
Ir
Irídio
192
Mt
Meitnério
(266)
11
VIIIB
2
8
15
2
28
Ni
Níquel
58,7
2
8
18
16
1
46
2
8
18
32
15
2
78
2
8
18
32
32
15
2
110
Pd
Paládio
106,4
Pt
Platina
195
Cu
2
8
18
1
47
Ag
Prata
108
2
8
18
32
17
1
79
2
8
18
32
32
17
1
111
2
8
18
25
8
2
64
Au
Ouro
197
30
Zn
Zinco
65,4
2
8
18
18
1
48
2
8
18
32
18
1
80
Cd
Cádmio
112
Hg
Mercúrio
201
0
0
0
0
0
0
0
112
2
8
18
25
9
2
65
Uun Uuu Uub
Ununilio
(267)
Ununúnio
(272)
2
8
18
2
Unúnbio
(277)
31
Ga
2
8
3
49
2
8
18
32
18
2
81
In
Índio
114,8
Tl
Tálio
204
C
VA
2
4
14
Si
2
8
18
3
32
Ge
2
8
4
50
2
8
18
32
18
3
82
0
0
0
0
0
0
0
Sn
Estanho
118,7
Pb
Chumbo
207
N
15
P
2
8
18
4
33
As
51
2
8
18
32
18
4
83
Sb
Antimônio
122
Bi
Bismuto
209
O
2
8
5
16
S
34
Se
2
8
6
52
2
8
18
32
18
5
84
0
0
0
0
0
ununquadium 0
(285)
0
Te
Telúrio
127,60
Po
Polônio
210
F
2
7
17
Cl
2
8
18
6
35
Br
2
8
7
53
2
8
18
32
18
6
85
Iodo
127
I
At
Astato
(210)
Ne
18
Ar
2
8
18
7
36
massa atômica
( ) = massa atômica do
isótopo mais estável
Kr
2
8
18
18
7
54
2
8
18
32
18
7
86
0
0
0
0
0
ununhexium 0
(289)
0
Xe
Xenônio
131
Rn
Radônio
222
116
118
Uuq
Uuh
Uuo
2
8
18
19
9
2
59
2
8
18
21
8
Praseodímio 2
141
Pr
60
2
8
18
22
8
2
Nd
Neodímio
144
61
Pm
Promécio
(145)
Sm
Samário
150
2
8
18
24
8
2
63
Eu
Európio
152
Gd
Gadolínio
157
Tb
Térbio
159
2
8
18
27
8
2
66
Dy
Disprósio
163
2
8
18
28
8
2
67
Ho
Hólmio
165
2
8
18
29
8
2
68
Er
Érbio
167
2
8
18
30
8
2
69
Tm
Túlio
169
2
8
18
31
8
2
70
Yb
Itérbio
173
2
8
18
32
8
2
71
Lu
Lutécio
175
Th
Tório
(232)
2
8
18
32
18
10
2
91
Pa
Protactínio
(231)
2
8
18
32
20
9
2
92
U
Urânio
(238)
2
8
18
32
21
9
2
93
Np
Neptúnio
(237)
2
8
18
32
22
9
2
94
Pu
Plutônio
(244)
2
8
18
32
24
8
2
95
2
8
18
32
25
8
2
96
Am Cm
Amerício
(243)
Cúrio
(247)
2
8
18
32
25
9
2
97
Bk
Berquélio
(247)
2
8
18
32
27
8
2
98
Cf
Califórnio
(251)
2
8
18
32
28
8
2
99
Es
Einstênio
(254)
2
8
18
32
29
8
2
100
Fm
Férmio
(257)
2
8
18
32
30
8
2
101
2
8
18
32
31
Mendelévio 8
(258)
2
Md
102
No
Nobélio
(259)
2
8
18
32
32
8
2
103
Lr
Laurêncio
(260)
2
8
18
18
8
2
8
18
32
18
8
2
8
18
32
9
2
2
8
18
32
32
9
2
F–
C –
C O–
C O2–
C O3–
C O4–
Br–
BrO–
BrO3–
fluoreto
cloreto
hipoclorito
clorito
clorato
perclorato
brometo
hipobromito
bromato
I–
IO–
IO3–
IO4–
NO2–
NO3–
PO3–
H2PO2–
H3C-COO–
iodeto
hipoiodito
iodato
periodato
nitrito
nitrato
metafosfato
hipofosfito
acetato
O2–
O22–
S2–
SO32–
SO42–
S2O32–
óxido
peróxido
sulfeto
sulfito
sulfato
tiossulfato
HPO32–
CrO42–
Cr2O72–
CO32–
C2O42–
SiO32–
fosfito
cromato
dicromato
carbonato
oxalato
metassilicato
Propriedades Periódicas
Eletronegatividade, Eletroafinidade
Caráter não-metálico
Energia ou Potencial
de ionização
Raio Atômico
Caráter Metálico
Ponto de Fusão
Ponto de Ebulição
cianeto
cianato
tiocianato
permanganato
hidróxido
hidreto
Li+
Cs+
Ca2+
Zn2+
Ga3+
Na+
Ag+
Sr2+
Cd2+
In3+
Com Nox Variável
+1 Cu+
*Co2+
2+
+2 *Pd2+
*Ni
*Pt2+
3+
+3 *Au3+
*Fe
Pb4+
+4
Sn4+
Au+
Cr2+
*Cu2+
*Mn2+
*Hg2+
Co3+
Ni3+
Pd4+
Pt4+
Hg22+
*Pb2+
Fe2+
*Sn2+
*Cr3+
Mn4+
Nomes
SbO43–
antimoniato
BO33–
borato
Fe(CN)63– ferricianeto
SiO44– ortossilicato
pirofosfato
Fe(CN)64– ferrocianeto
P2O74–
NH4+
Rb+
Mg2+
Ra2+
Bi3+
H+
K+
Be2+
+2
Ba2+
+3 Al3+
+1
(*) indica o Nox mais Comum
arsenito
arseniato
antimonito
Fe2+ íon ferro (II) ou
íon ferroso
Fe3+ íon ferro (III) ou
íon férrico
Cu+ íon cobre (I) ou
íon cuproso
Cu2+ íon cobre (II) ou
íon cúprico
Nome de Hidrogenoânions
HS–
HSO3–
HSO4–
HCO3–
H2PO4–
HPO42–
(mono) hidrogenossulfeto, sulfeto (mono) ácido ou bissulfeto
(mono) hidrogenossulfito, sulfito (mono) ácido ou bissulfito
(mono) hidrogenossulfato, sulfato (mono) ácido ou bissulfato
(mono) hidrogenocarbonato, carbonato (mono) ácido ou bicarbonato
diidrogenofosfato ou fosfato diácido
(mono) hidrogenofosfato ou fosfato (mono) ácido
Formulação de Bases e Sais
Ácido
xH+ + Ax–(ânion)
Bases
ídrico
ico
oso
eto
ato
ito
Me(OH)x → hidróxido de (nome do cátion)
(x = carga do cátion)
eto
BxAy → (nome do ânion ato ) de (nome do cátion)
ito
hidróxido de ferro(III) → Fe(OH)3
↓
↓
OH–
Fe3+
Massa Específica
(Densidade)
CN–
OCN–
SCN–
MnO4–
OH–
H–
N3–
nitreto
AsO33–
3–
P
fosfeto
AsO43–
PO43– (orto) fosfato SbO33–
Sais
Líquidos
Elementos Artifíciais
2
8
18
8
0
0
0
0
0
ununoctium 0
(293)
0
114
Sólidos
Gasosos
2
8
8
Criptônio
83,8
símbolo
Rb
Hg
Xe
2
8
Argônio
39,9
Bromo
79,9
2
8
18
18
6
10
Neônio
20,2
Cloro
35,5
Selênio
79,0
2
8
18
18
5
9
Flúor
19,0
Enxofre
32,1
2
8
18
5
Hélio
4,00
VIIA
2
6
Oxigênio
16,0
Arsênio
74,9
2
8
18
18
4
8
He
17
VIA
2
5
Fósforo
31,0
Germânio
72,6
2
8
18
18
3
7
Nitrogênio
14,0
Silício
28,1
Gálio
69,7
2
8
18
18
2
6
Carbono
12,0
Alumínio
27,0
IIB
29
Cobre
63,5
2
8
18
18
Al
12
IB
2
8
16
2
IVA
2
3
16
Série dos Actinídios
90
5
B
15
Série dos Lantanídios
Cério
140
distribuição
eletrônica
7
VIB
2
8
11
2
Vanádio
50,9
2
8
18
32
32
Rutherfórdio 10
(261)
2
Rf
6
VB
2
8
10
2
Titânio
47,9
1
37
5
13
número dos grupos
(numeração de 1 a 18,
de acordo com a
IUPAC)
número
atômico
Metais Representativos
2
8
2
Cálcio
40,1
87
7
Be
14
IIIA
2
2
Magnésio
24,3
2
8
8
1
55
6
2
8
1
Sódio
23,0
37
5
4
Berílio
9,01
19
4
13
IIA
2
1
11
3
2
Hidrogênio
1,01
Principais Ânions
2
2
Principais Cátions
Com Nox Fixo
nitrato de zinco → Zn(NO3)2
↓
↓
NO3–
Zn2+
Exemplos
pirofosfato de cálcio → Ca2P2O7
↓
↓
P2O74–
Ca2+
fosfato de crômio(III) → CrPO4
↓
↓
PO43–
Cr3+
Reatividade dos Metais e Não-Metais
Quadro Geral das Reações Químicas
Metais:
Síntese
Não-metais:
A+B...→C
S + O2
→
SO2
1
O
2 2
SO3 + H2O
→
SO3
→
H2SO4
SO2 +
}
Forças de Ácidos e Bases
HC , HBr, HI e oxiácidos Hx E Oy nos quais y - x ≥ 2:
(HNO3, H2SO4, HIO4, etc)
Ácidos moderados: HF e oxiácidos Hx E Oy nos quais y - x = 1:
(H3PO4, HC O2, HNO2)
Ácidos fracos:
H2S, HCN e oxiácidos Hx E Oy nos quais y - x = 0:
(H3BO3, HC O, HIO)
Exceção:
o H2CO3 é um ácido fraco devido ao fato de ser muito instável:
H2O + CO2 )
(H2CO3
As bases dos metais alcalinos e alcalino-terrosos são fortes. As demais são fracas.
Ácidos fortes:
Chuva ácida
Análise ou Decomposição
CaCO3
Luz
2AgC
2NaC
A→B+C...
∆
Eletricidade
Enzimas
2H2O2
CaO + CO2
Pirólise
2Ag + C
2
Fotólise
2Na + C
2
Eletrólise
2H2O + O2
Volatilidade
Ácidos voláteis:
Ácidos fixos:
Enzimálise
H2CO3
Condições de Ocorrência
→
→
CB + A (metal)
AC + B (não-metal)
Reatividade de C > Reatividade de A
Reatividade de C > Reatividade de B
CuSO4 + Zn
CuSO4 + Ag
2NaBr + C 2
NaBr + I2
2HC + Mg
HC + Ag
2HOH + 2Na
→
→
→
→
→
→
→
ZnSO4 + Cu
não há reação
2NaC + Br2
não há reação
MgC 2 + H2
não há reação
2NaOH + H2
Reatividade do Zn > Reatividade do Cu
Reatividade do Ag < Reatividade do Cu
Reatividade do C > Reatividade do Br
Reatividade do I < Reatividade do Br
Reatividade do Mg > Reatividade do H
Reatividade do Ag < Reatividade do H
Reatividade do Na > Reatividade do H
Dupla Troca ou Metátese
Condições de Ocorrência
NaC O + HC
→
ácido forte
K2S + H2SO4
base solúvel
NaC + HC O
ácido fraco
→
ácido forte
e fixo
CuSO4 + 2NaOH
mais fraco(s)
AD e/ou CB devem ser mais volátil(eis) que AB e/ou CD
menos solúvel(eis)
AD + CB
K2S + H2S
NH4C + KOH
→
Na2SO4 + Cu(OH)2
base insolúvel
→
base forte
Na2CO3 + 2HC
ácido fraco
e volátil
H2SO3
Ba(NO3)2 + Na2SO4
sal solúvel
Solúveis:
Parcialmente Solúveis:
Insolúveis:
H2O + SO2
NH4OH
H2O + NH3
bases de metais alcalinos e NH4OH
bases de metais alcalino-terrosos
demais bases
Solubilidade dos Sais em Água
Sais
Solubilidade
Exceções
nitratos
cloratos
acetatos
percloratos
cloretos
brometos
iodetos
sulfatos
fluoretos
outros
solúveis
solúveis
solúveis
solúveis
solúveis
solúveis
solúveis
solúveis
insolúveis
insolúveis
KC O4 (Parcialmente Solúvel)
AgC , Hg2C 2, PbC 2
AgBr, Hg2Br2, HgBr2, PbBr2
Agl, Hg2I2, Hgl2, Pbl2
CaSO4, SrSO4, BaSO4, Ag2SO4, Hg2SO4, PbSO4
NaF, KF, RbF, CsF, NH4F, A F3
sais de metais alcalinos e amônio
KC + NH4OH
→
Energias dos níveis e subníveis
da eletrosfera do átomo
Partículas
Subatômicas
1s
2s
2p
No núcleo:
Na eletrosfera:
prótons (p+)
nêutrons (n)
elétrons (e–)
Nº atômico (Z)
Nº de massa (A)
→
→
nº de prótons
nº de prótons +
nº de nêutrons
Isótopos
Isóbaros
Isótonos
→
→
→
Isoeletrônicos
→
Átomos com =s Z e ≠s A
Átomos com ≠s Z e =s A
Átomos com ≠s Z, ≠s A e
=s nos de nêutrons
Átomos ou íons
com =s nos de elétrons
1s
3s
3p
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
6s
6p
6d
4s
3d
5s
Extensivo (Biomédicas • Exatas • Humanas)
Semi especial para a GV • Semi unificado
Turma de Maio • Revisão para 1a e 2a fases
4d
5p
6s
CPV EDITORA
2NaC + H2CO3
4f
Material para: Ensino Fundamental • Ensino Médio • Pré-Vestibular
H2O + CO2
ácido fraco
e instável
→
Química
4p
CPV VESTIBULARES
H2O + NH3
base fraca
e instável
ácido forte
sal solúvel
H2O + CO2
Solubilidade das Bases em Água
AB + C (metal)
AB + C (não-metal)
→
Tabela de
HF, HC , HBr, HI, H2S, HCN, HNO3, H3C - COOH (acético)
H2SO4, H3PO4, etc.
Principais Ácidos e Bases Instáveis
Deslocamento ou Simples Troca
AB + CD
Li > Rb > K > Cs > Ba > Sr > Ca > Na > Mg > Be > Al > Mn > Zn > Cr > Fe > Co > Ni >
Sn > Pb > H > Cu > Hg > Ag > Pt > Au
F > O > N > C > Br > I > S > C
5d
6p
CPV COLÉGIO
2NaNO3 + BaSO4
7s
5f
Ensino Médio
sal insolúvel
Consolação
256-8981
•
Eldorado
3813-6299
•
Morumbi
3742-4530
•
www.cpv.com.br
6d
7s












