Química Orgânica
Experimental
PREPARAÇÃO DO ACETATO DE
ISOPENTILA (versão II)
Discentes: Eliana Alves Arxer
Fernanda Maciel Barbosa Gubbiotti
Nathalia Abe Santos
Docentes: José Eduardo de Oliveira
Amanda Coelho Danuello
Temas
zIntrodução;
zReação geral de Fisher;
zObjetivo;
zMecanismo;
zTécnicas envolvidas na síntese;
zAgente Secante;
zEmulsão
zCorreção do P.E.;
zCálculo do rendimento;
zFluxograma;
zTabela com propriedades físico-químicas;
zCuidados, toxicidade e segurança;
zTratamentos dos resíduos;
zBibliografia.
Os ésteres
zAssemelham-se aos aromas de flores e
frutas;
zSão utilizados na fabricação de
aromatizantes artificiais, tais como de
abacaxi (propanoato de etila), pêssego
(acetato de benzila), pêra (acetato de
propila) e vários outros.
Acetato de Isopentila
zO acetato de isopentila é um éster que
apresenta cheiro característico de banana.
Ele é obtido através da reação de
esterificação do ácido acético com álcool
isopentilico, a qual é catalisada por um
ácido mineral (nesta prática será utilizado
o H2SO4(concentrado)). Esta reação é
conhecida como esterificação de Fisher.
Váriaveis da esterificação
zTemperatura
zConcentração
zAmbas aceleram ou retardam a
velocidade da reação
Reação Geral Fisher
zElas se desenvolvem muito lentamente na
ausência de ácidos fortes, mas alcançam
o equilíbrio em poucas horas, quando o
ácido e o álcool refluxados com pequena
quantidade de H2SO4 (concentrado) ou HCl
(concentrado) :
Reação Geral Fisher
Mecanismo de reação de esterificação do ácido
acético e álcool isopentilico
Por que e como deslocar o equilibrio?
Objetivo da prática:
zPreparar acetato de isopentila a partir da
reação de esterificação do ácido acético
com álcool isopentilico;
zExtrair o éster obtido;
zCalcular o rendimento.
Técnicas envolvidas:
zRefluxo;
zExtração com solvente;
zExtração quimicamente ativa ;
zSalting-out;
zDecantação e Filtração;
zDestilação Simples;
Por que??
Por que??
Que tipo de aquecedor usa-se??
Cuidados
z Sentido do fluxo de água: de baixo para cima;
z Fluxo de água constante para favorecer o resfriamento;
z A pressão do fluxo de água deve ser alta o suficiente
para manter o fluxo, mas não excessivamente forçando
a mangueira do condensador;
z Cuidado com escape de vapores.
Extração
Fase orgânica
Fase
Faseaquosa
aquosa
Extração Quimicamente Ativa
Efeito Salting Out
z A adição de solução saturada de cloreto de
sódio, irá diminuir a solubilidade do éster em
água, fazendo com que esta possa ser
removida, sem perda do produto desejado.
Fase alcoolica
Fase aquosa
Mistura de água
e metanol.
Separação de duas fases
Adiciona-se carbonato de potássio
Agente Secante
z Sulfato de Magnésio anidro: Trata-se de uma gente secante
neutro, de ação rápida e quimicamente inerte.
Colóides
z Colóides são misturas heterogêneas;
z com pelo menos duas fases diferentes: uma das fases na
forma finamente dividida (sólido, líquido ou gás), denominada
fase dispersa e outra fase contínua (sólido, líquido ou gás),
denominada meio de dispersão;
z Num sistema coloidal um dos componentes da mistura
apresenta uma dimensão no intervalo de 1 a 1000
nanômetros(1 nm= 10-9 m).
Emulsão
“Emulsão é uma suspensão coloidal
de um líquido em outro intimamente
disperso sob a forma de gotículas.
Ex:. Água e óleo.
Agente emulsificante:
Facilitam e estabilizam
emulsões
Leite
Estrutura Microscópica do leite
Exemplos de emulsificantes: proteínas (ovoalbumina, caseína),
sabões e detergentes, fósforos lipídeos.
Correção do ponto de ebulição
z Correção para líquidos associados (formam ligações de
hidrogênio):
ΔT = 0,00010(760-p).(t +273)
t760=ΔT + t
z ΔT: correção, em ºC a ser aplicada ao ponto de ebulição
observado,
z t: temperatura de ebulição observado no laboratório
z p: pressão barométrica local;
z t760: temperatura de ebulição a 760 mmHg (ponto de
ebulição normal);
Correção do ponto de ebulição
Exemplo:
Considerando p = 686 mmHg e t = 98°C, a correção feita será:
ΔT = 0,00010(760-686).(98 + 273)
ΔT = 2,74
T760 = ΔT + t
T760 = 2,74 + 98T760 = 100,74°C
Ou seja a pressão de 760 mmHg a temperatura de ebulição é 100,47°C.
CÁLCULO DO RENDIMENTO:
Vácido= 20 ml
dácido= 1,053g/ml
MMácido= 60,05g/mol
Válcool= 15 ml
Véster
dálcool= 0,813g/ml
déster= 0,876 g/ml
MMálcool= 88,15g/mol
MMéster= 130,19g/mol
CÁLCULO DO RENDIMENTO:
Ácido Acético
Álcool Isopentílico
d = m/V
m = d.V
m = 1,053. (20) = 21,06g
m = d.V
m =0,813.(15) = 12,20g
1 mol ácido -------60,05g
n------------------21,06g
1 mol -------------88,15g
n ---------------12,20g
n = 0,351 mol
Reagente em excesso
n = 0,138 mol
Reagente Limitante
Por que o Ac. Acético é o reagente em excesso??
CÁLCULO DO RENDIMENTO:
n mols de éster = n mols do álcool = 0,138 mol:
1 mol de éster ----------------------------------------130,19g de éster
0,138 mol de éster ------------------------------m = 17,97g de éster
z Essa massa corresponde a 100 % de rendimento (m
estequiométrica)
z Cálculo da porcentagem de rendimento:
z Rendimento = (m obtida . 100%)/ m estequiométrica
z Exemplo: obteve-se 12,45g de éster
z Rendimento = (12,45g ) / (17,97g) . 100% = 69,28%
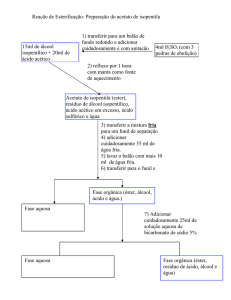
FLUXOGRAMA
Tabela de Propriedades
Nomenclatura
Densidade /g mL-1
Mol /g mol-1
p.f. /0C
p.e. /0C
Ácido Acético CH3O2H
1,0492
60,05
16,604
118
Álcool
Isopentílico
C5H12O
0,813
88,15
-117,2
130,5
Bicarbonato de Sódio NaHCO3
2,159
84,01
______
_____
10
0
Ácido Sulfúrico
H2SO4
1,84
Cloreto de
Sódio NaCl
2,17
58,45
1,67
120,37
Sulfato de magnésio MgSO4
0,8670
Acetato de Isopentila
C7H14O2
98,08
130,19
29
804
-78,5
1413
142
Tabela de Propriedades
Toxicidade
Solubilidade
Propriedades Físicas
-Ingestão pode causar corrosões bucais e
gastro-intestinais, com vômitos,
diarréia, colapso circulatório e morte.
- Excelente solvente para diversos
compostos orgânicos.
- Miscível em água, álcool glicerol e éter
Líquido, odor pungente
-Irritante para as menbranas mucosas, altas
concentrações podem causar depressão
no sistema nervoso central
-fracamente solúvel em H2O (2g em 100
mL)
- miscível em álcool, éter, benzeno,
clorofórmio
líquido, odor desagradável característico
________________
- Solúvel em 10 partes de água
- Insolúvel em álcool
- Cristais brancos ou granulados
- em contato com os olhos pode resultar em
perda total da visão
- corrosivo
- ingestão causa enjôo e morte
- miscível em água e em álcool com
liberação de muito calor e contração
de volume
- líquido incolor e volátil
________________
-1g dissolve em 2,8 mL de água
- 1g dissolve em 10 mL de glicerol
- insolúvel em HCl concentrado
-cúbico, cristais brancos
- grânulos ou pó
- incolor
- pode causar insuficiência renal e
intoxicação.
- solúvel em água, levemente solúvel em
álcool
cristais ou pó eflorescentes
-causa irritações aos olhos, e outros tecidos
-pode causar dermatite
-1g solúvel em 400 partes de água
-miscível em álcool, éter, acetato de etila
incolor e líquido neutro.
Toxicidade das substâncias
Ácido acético glacial (CH3CO2H)
z Inalação: garganta inflamada, tosse, queimação, dor de cabeça, vertigens,
respiração dificultada e dolorida. Primeiros-socorros: ar fresco; requer
atenção médica.
z Pele: dor, vermelhidão, bolhas, ardor. Primeiros-socorros: remover as
roupas contaminadas, lavar com água e sabão; requer atenção médica.
z Olhos: vermelhidão, dor intensa, queimação, perda de visão. Primeirossocorros: lavar com água corrente por vários minutos (remova lentes de
contato) e procurar oftalmologista.
z Ingestão: dor abdominal, sensação de queimação, diarréia, choque ou
colapso, garganta inflamada, vômito. Primeiros-socorros enxágüe a boca,
não induza o vômito, dê porções de água para a pessoa beber; requer
atenção médica.
Toxicidade das substâncias
Álcool isopentílico (C5H12O )
z Inalação:garganta inflamada, tosse, náusea, dor de cabeça, vertigens.
Primeiros-socorros: ar fresco; requer atenção médica.
z Pele:dor, vermelhidão, pele seca, aspereza. Primeiros-socorros: remover
as roupas contaminadas, lavar com água e sabão.
z Olhos : vermelhidão, dor. Primeiros-socorros: lavar com água corrente por
vários minutos (remova lentes de contato) e procurar um oftalmologista.
z Ingestão:dor abdominal, sensação de queimação no tórax e no
estômago,dor de cabeça, náusea, inconsciência, vômito, fraqueza.
z Primeiros-socorros: enxágüe a boca, não induza o vômito, dê porções de
água com carvão ativado para a pessoa beber; requer atenção médica.
Toxicidade das substâncias
Ácido sulfúrico (H2SO4 )
z Inalação: corrosivo, garganta inflamada, queimação, respiração dificultada
e dolorida. Primeiros-socorros: ar fresco; respiração artificial, se necessário;
requer atenção médica.
z Pele: corrosivo, dor, vermelhidão, bolhas, sérias queimaduras. Primeirossocorros: remover as roupas contaminadas, lavar com água; requer
atenção médica.
z Olhos: corrosivo, vermelhidão, dor, intensa queimação. Primeiros-socorros:
lavar com água corrente por vários minutos (remova lentes de contato) e
procurar um oftalmologista.
z Ingestão: corrosivo, dor abdominal, sensação de queimação, choque ou
colapso. Primeiros-socorros: enxágüe a boca, não induza o vômito; procure
um médico.
Toxicidade das substâncias
Acetato de isopentila (C7H14O2)
z Inalação: garganta inflamada, tosse, dor de cabeça, fraqueza, sonolência.
Primeiros-socorros: ar fresco; requer atenção médica.
z Pele: secura. Primeiros-socorros: remover as roupas contaminadas, lavar
com água.
z Olhos: vermelhidão, dor. Primeiros-socorros: lavar com água corrente por
vários minutos (remova lentes de contato) e procurar um oftalmologista
z Ingestão: dor abdominal, garganta inflamada, náuseas. Primeiros-socorros:
beber porções de água; requer atenção médica.
Toxicidade das substâncias
Bicarbonato de sódio (NaHCO3)
z Nenhuma consideração venenosa.
z Baixíssima toxicidade.
Sulfato de Magnésio (MgSO4)
z Nenhuma consideração venenosa.
z Baixíssima toxicidade.
Cuidados
z Mantenha separado solventes halogenados de não halogenados.
z Separe solventes orgânicos de soluções aquosas.
z Mantenham os solventes acidificados de outros solventes e
resíduos ácidos.
z Não misture ácidos inorgânicos fortes ou oxidantes com compostos
orgânicos.
z Mantenha ácidos, bases e soluções aquosas contendo metais
pesados separados de outros resíduos.
z Evite misturar ácidos e bases concentrados num mesmo recipiente.
BIBLIOGRAFIA:
z PAVIA, D. L., LAMPMAN, G. M., KRIZ, G. S.
Introductionto OrganicLaboratory Techniques: A
Contemporary Approach. 3ed. Philadelphia :
Hancourt Brace College Publischers, 1995.
z •MANO, E. B., SEABRA, A. F. Práticas de Química
Orgânica. 2.ed. São Paulo : Edart, l977.
z •SITE:
z www.jeduardo.unesp.br (acessado 23/03/2009)
z http://cftc.cii.fc.ul.pt/PRISMA (acessado 7/04/2009)
z •SOLOMONS, G. T.W., FRYHLE, C. B. Química
Orgânica 1 e 2, 8ªedição
zFluxograma
Adectato de
Isopentila