UNIVERSIDADE ESTADUAL PAULISTA
Instituto de Química
ARARAQUARA / SP
6 – Preparação e Purificação do
Acetato de Isopentila (parte II)
Discentes: Grupos IX e XXIV
Camila Francisconi Lima
Marcus Massahiro Sinzato
Mariane Spadoto
Vinícius Garcia
Profº. Dr. José Eduardo de Oliveira
Prof. Dr. Leonardo Pezza
Profa. Juliana Rodrigues
• Entre os compostos encontrados na natureza, os ésteres estão entre os mais
comuns. Estes compostos comumente estão associados ao odor agradável exalado
por flores e frutos. Os ésteres também podem ser encontrados na gordura animal e
nos óleos vegetais (os triglicerídeos).
• A reação de esterificação é um processo reversível, obtendo como produto
principal um éster específico. Entre os diversos métodos que podem ser utilizados
para sintetizar os ésteres, um bom exemplo é a reação de esterificação de Fischer
(1895), na qual, sob aquecimento, um ácido carboxílico reage com um álcool
(produzindo éster e água). Esta reação, quando processada em temperatura
ambiente, é lenta, mas pode ser acelerada com o emprego de aquecimento e/ ou
catalisador (exemplo, o ácido sulfúrico H2SO4).
• A atenção dada aos ésteres orgânicos decorre de estas substâncias despertarem
grande interesse por causa de sua importância industrial, especialmente nas
atividades que envolvem emprego de solventes, vernizes, resinas, plastificantes,
polímeros, intermediários para a indústria farmacêutica, fragrâncias e essências
sintéticas.
Pode-se citar como exemplos:
Acetato de isopentila
Acetato de benzila
Acetato de butila
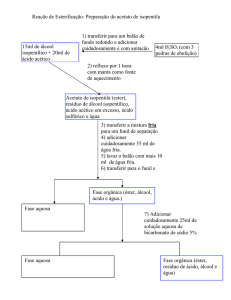
O acetato de isopentila é obtido através da reação de
esterificação do ácido acético com álcool isopentílico, a qual é
catalisada por um ácido mineral (nesta prática será utilizado o
H2SO4(concentrado)).
Ácido acético
Álcool Isopentílico
Acetato de Isopentila
Água
Destilação é um processo de separação para líquidos, tanto de impurezas
como de outros líquidos com pontos de ebulição diferentes. Este processo
consiste na vaporização do líquido com menor ponto de ebulição e a
subsequente condensação em outro recipiente.
O processo de destilação é muito utilizado na indústria de bebidas para a
fabricação de: tequila, vodca, rum, cachaça e gim.
• Separar um líquido de impurezas não-voláteis
(em solução no líquido);
• Separar um líquido de um solvente utilizado
numa extração;
• Separar líquidos de ponto de ebulição
separados.
Cabeça de destilação
Termômetro
Condensador
→ Manter Erlenmeyer em banho de gelo;
→ Usar de vidraria seca;
→ Usar pedras de aquecimento;
→ Manter a destilação na velocidade adequada (20 gotas por minuto);
→ Completar o balão de destilação a no máximo ¾ do volume.
O recolhimento das frações deverá ser feito em 3 etapas.
I.
Até 134°C: esta fração consiste principalmente em álcool
isopentílico (TE - 130,5°C).
II. De 134°C até 143°C: fração de interesse – acetato de isopentila
(TE – 142°C).
III. Acima de 143°C: impurezas com temperaturas de ebulição
maiores.
Durante a segunda etapa da destilação, a temperatura que se
mantiver constante será utilizada para a correção do ponto de
ebulição.
Correção para líquidos associados, por formarem pontes de hidrogênio.
Exemplo:
Considerando p = 686 mmHg e t = 98°C, a correção feita será:
ΔT = 0,00010(760-686).(98 + 273)
ΔT = 2,74
t760= ΔT + t
t760= 2,74 + 98 = 100,74°C
Ou seja, a pressão de 760 mmHg a temperatura de ebulição é
100,47°C.
Ácido acético
Álcool Isopentílico
Acetato de Isopentila
Água
Máximo de rendimento utilizando as quantidades do roteiro e sem nenhuma perda.
O rendimento obtido pelo experimento deverá ser menor que o máximo calculado
anteriormente e pode ser calculado da seguinte forma:
Nomenclatura
Fórmula estrutural
Ponto de
fusão (°C)
Ponto de
ebulição
(°C)
Ácido acético
1,0492
60,05
16,604
118
Álcool Isopentílico
0,813
88,15
-117,2
130,5
Bicarbonato de Sódio
2,159
84,01
Ácido Sulfúrico
1,84
98,08
10
290
Cloreto de Sódio
2,17
58,45
804
1413
Sulfato de Magnésio
1,67
120,37
Acetato de Isopentila
0,867
130,19
-78,5
142
Substância
Solubilidade
Propriedades Físicas
Ácido acético
Excelente solvente para diversos compostos
orgânicos, miscível em água, álcool glicerol e éter
Líquido, odor pungente.
Álcool Isopentílico
Fracamente solúvel em água, miscível em álcool,
éter, benzeno e clorofórmio.
Líquido, odor desagradável
característico.
Bicarbonato de Sódio
Solúvel em água, insolúvel em álcool.
Cristais brancos ou
granulados.
Ácido Sulfúrico
Miscível em água e em álcool com liberação de
muito calor e contração de volume.
Líquido incolor e volátil.
Cloreto de Sódio
Insolúvel em ácido concentrado.
Cristais brancos, grânulos
ou pó, incolor.
Sulfato de Magnésio
Solúvel em água, levemente solúvel em álcool.
Cristais ou pó eflorescente
(perde água).
Acetato de Isopentila
Miscível em álcool, éter, acetato de etila.
Incolor e líquido neutro.
• Ácido acético glacial: Libera vapores de odor irritante. Manusear em capela. Evitar
contato com pele, olhos e boca. Ingestão pode causar corrosão da boca e do trato
gastrointestinal.
• Acetato de isopentila: os principais indícios de exposição prolongada são: irritação dos
olhos, pele, nariz e garganta; dermatites.
• Álcool isopentílico: exposição prolongada causa irritações nos olhos, pele, nariz e
garganta; dor de cabeça, tontura; tosse, dificuldade na respiração, náusea, vômito e
diarréia; rachadura na pele.
• Sulfato de magnésio: em contato com os olhos causa vermelhidão e a ingestão causa
câimbras e diarréia.
• Bicarbonato de sódio: baixíssima toxicidade.
• Cloreto de sódio: baixíssima toxicidade.
Inalação: remova a vítima para local com ar
fresco.Procure orientação médica.
Ingestão: dê grandes quantidades de água para
vítima.
Contato com a pele: limpe o local da pele atingido
e então lave imediatamente a pele com
abundância de água por ao menos 15 minutos.
Contato com os olhos: lavar imediatamente os
olhos. Procure orientação médica se a vítima
desenvolver irritação.
Em caso de contato de qualquer um dos
reagentes com os olhos ou pele, lave-os
imediatamente com água em abundancia.
Em caso de ingestão de qualquer reagente,
procure auxílio médico imediato.
Livros:
•
PAVIA, D. L., LAMPMAN, G. M., KRIZ, G. S. Introductionto OrganicLaboratory Techniques: A
Contemporary Approach. 3ed. Philadelphia : Hancourt Brace College Publischers, 1995.
•
SOLOMONS, T. W. Graham; FRYHLE, Craig B. Química Orgânica, V. 1 . 8ª ed. Rio de
Janeiro, LTC, 2005
Sites:
• www.jeduardo.unesp.br
• http://www.iq.unesp.br/FICHA-SEGURANCA/BICARBONATO%20DE%20SODIO.pdf
• http://www.iq.unesp.br/FICHA-SEGURANCA/HIDROXIDO%20DE%20SODIO.pdf
• http://www.iq.unesp.br/FICHA-SEGURANCA/ACIDO%20SULFURICO.pdf