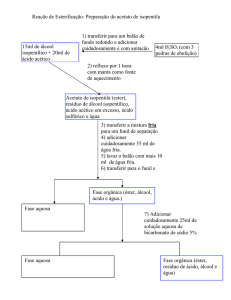
Preparação do acetato de isopentila
I - Introdução
Neste experimento, será preparado um éster, acetato de
isopentila. Este éster é frequentemente chamado de óleo de
banana, uma vez que possui odor característico dessa fruta.
Os ácidos carboxílicos reagem com álcoois produzindo ésteres
quando aquecidos na presença de um ácido mineral (geralmente
ácido sulfúrico concentrado ou ácido clorídrico anidro).
O acetato de isopentila é preparado pela esterificação direta de
ácido acético com álcool isopentílico na presença de ácido
sulfúrico.
II - Reações
Esterificação
H+
CH3CO2H + (CH3)2CH2CH2CH2OH
CH3CO2CH2CH2CH(CH3)2
+
H2O
Neutralização
2 NaHCO3 + H2SO4
NaHCO3 + CH3CO2H
Na2SO4 + H2O + CO2
CH3CO2Na + CO2 + H2O
Hidratação
MgSO4 + 7 H2O
MgSO4.7 H2O
III - Técnicas envolvidas
01. Refluxo
A reação de um ácido orgânico com um álcool é lenta. Isso
significará que à temperatura ambiente, a maioria das colisões
entre as moléculas não possue energia suficiente para que a
reação proceda. Umas das maneiras de se aumentar a
frequência (ou número de colisões) é através do aumento da
temperatura no frasco reacional. Quando os reagentes, os
produtos e/ou o solvente da reação são voláteis, o aquecimento
pode
levar
à evaporação e consequentemente perda de substâncias. O
procedimento de refluxo permite que um meio reacional, à
pressão ambiente, seja aquecido à temperatura constante sem
que haja perda de substâncias voláteis.
Em um balão, de fundo redondo adapta-se um
condensador na posição vertical e o sistema é colocado em uma
fonte de aquecimento (no caso usa-se uma manta elétrica), o
condensador é resfriado com água da torneira ou água
refrigerada, dependendo do ponto de ebulição do solvente.
Quando o sistema reacional dentro do balão é aquecido,
qualquer substância que vaporize do meio reacional condensa-se
no condensador e volta para o frasco. A velocidade do refluxo
deve ser tal que a condensação de vapores se dê, no máximo, até
a metade da altura do condensador, isto evita que algum vapor
consiga escapar através do condensador.
Obs.01: Na experiência é utilizado condensador de bolas
porque este condensa o éster com maior eficiência devido sua
superfície de contato ser maior.
02. Destilação
O éster formado na reação deve ser separado das outras
substâncias (ácido e álcool). Como todas elas são menos voláteis,
com exceção do álcool, pode-se usar a destilação simples
descartando-se os primeiros 10% de substâncias destiladas.
03. Extração Múltipla
Utiliza-se esta técnica para separar o ácido sulfúrico, ácido
acético e álcool etílico do acetato de isopentila. Retornar ao
seminário número 1, que explicou essa técnica.
Nomenclatu- Densida
Mol
P.F
ra
de
(g/mol) (°C)
(g/mL)
Ácido
Acético
CH3OOH
1,0492
60,05 16,604
Álcool
Isopentílico
C5H12O
Bicarbonato
de Sódio
NaHCO3
Ácido
Sulfúrico
H2SO4
Cloreto de
Sódio
NaCl
0,813
88,15
2,159
84,01
1,84
2,17
98,08
58,45
P.E
(°C)
118
Toxidade
Solubilidade
Ingestão
pode
causar
corrosões bucais e gastro - - Excelente solvente p/ diversos
intestinais, com vômitos, compostos orgânicos
diarréia,
colapso
-miscível em H2O, álcool glicerol e éter
circulatório e morte.
Propried.
físicas
Líquido, odor
pungente
Irritante para as membranas -fracamente solúvel em H2 (2g em100mL) -líquido,odor
-117,2 130,5 mucosas,
desagradável
altas -miscível em álcool,
concentrações
podem éter,benzeno,clorofórnio
característico
causar
depressão
no
sistema nervoso central
_____
10
804
____ ______________________
290
___
_____________
-em contato com os olhos
pode resultar na perda total
da visão,
-corrosivo, na pele pode
______________________________
causar necrose,
-ingestão causa enjôo e
morte.
-1g dissolve em 2.8 mL de H2O
-1 g dissolve em 10 mL de glicerol
______________________ -insolúvel em HCl concentrdo
-cristais brancos ou
granulados
-líquido
volátil
incolor
-cúbico, cristais
brancos
-grânulos ou pó
-incolor
e
Sulfato de
magnésio
1,67
MgSO4
Acetato de
Isopentila
C7H14O2
-pode causar insuficiência
renal e intoxicação.
120,37
_______
102,05
____
____
142
-causa irritações aos olhos,
____ e outros tecidos
-pode causar dermatites
-solúvel em água, levemente solúvel em
álcool
-cristais ou pó
eflorescentes
-1 g solúvel em 400 partes de H2O
-micível em álcool,éter,acetato de etila
-incolor e líquido
neutro
BIBLIOGRAFIA
1-Pavia, Donald, Lampman, Gary M, Kriz, Georges-Introduction to Organic Laboratory
Techiniques, 3th edition, 1988; pg 89,90,509,510
2-The Merck Index, 8th edition
3-Handbook of Chemistry and Physics, 48th edition.
4-Solomons, T.W. Graham, Química Orgânica 3, tradução de Marília Ottoni da Silva Pereira, Alaíde
Braga de Oliveira- RJ; LTC Editora S.A., 1983; pg 786,787