Físico-Química Experimental FQE001
Exp. 02
Equilíbrio Químico
1. Introdução
Para a reação hipotética geral:
𝑎𝐴 + 𝑏𝐵 ⇋ 𝑐𝐶 + 𝑑𝐷 (1)
a constante de equilíbrio é dada pela expressão:
𝐾=
𝑎𝐶𝑐 . 𝑎𝐷𝑑
𝑎𝐴𝑎 . 𝑎𝐵𝑏
(2)
Se considerarmos que uma reação ocorra inteiramente na fase líquida, e aproximando
que as atividades são iguais às concentrações, a Equação 2 pode ser reescrita como:
𝐾=
[𝐶]𝑐 . [𝐷]𝑑
[𝐴]𝑎 . [𝐵]𝑏
(3)
Onde os colchetes indicam que as concentrações são expressas em mol/L.
Com o objetivo de determinar a constante de equilíbrio, K, a estequiometria da reação em
análise deve ser conhecida (a, b, c, d). Além disso, deve-se dispor de um método analítico para
determinar a concentração das espécies químicas envolvidas no equilíbrio. Uma forma de
simplificar a determinação da concentração das espécies químicas envolvidas é determinar a
concentração em equilíbrio de uma única espécie, se a concentração inicial de todas as
espécies são conhecidas e conhecendo-se a estequiometria da reação, determinação a
concentração das demais espécies químicas envolvidas.
Você utilizará esta forma simplificada para determinar o valor de K para a reação do acetato de
etila em presença de água. O acetato de etila é um solvente muito empregado em sínteses
orgânicas e por ser um éster é facilmente hidrolisado em etanol e ácido acético.
(4)
A reação inversa, ácido acético em presença de etanol é chamada de esterificação.
Na reação de esterificação:
𝐶𝐻3 𝐶𝑂𝑂𝐻 + 𝐶2 𝐻5 𝑂𝐻 ⇋ 𝐶𝐻3 𝐶𝑂𝑂𝐶2 𝐻5 + 𝐻2 𝑂
(5)
onde 𝑎 = 𝑏 = 𝑐 = 𝑑 = 1
(6)
[𝐶𝐻 𝐶𝑂𝑂𝐶2 𝐻5 ][𝐻2 𝑂]
3 𝐶𝑂𝑂𝐻][𝐶2 𝐻5 𝑂𝐻]
Portanto: 𝐾 = [𝐶𝐻 3
𝑛á𝑔𝑢𝑎
𝑛
( 𝑒𝑠𝑡𝑒𝑟
)( 𝑉 )
𝑛𝑒𝑠𝑡𝑒𝑟 . 𝑛á𝑔𝑢𝑎
𝑉
𝐾= 𝑛
𝑛𝑒𝑡𝑎𝑛𝑜𝑙 = 𝑛á𝑐.𝑎𝑐é𝑡𝑖𝑐𝑜 . 𝑛𝑒𝑡𝑎𝑛𝑜𝑙
á𝑐.𝑎𝑐é𝑡𝑖𝑐𝑜
(
)( 𝑉 )
𝑉
(7)
(8)
1
Físico-Química Experimental FQE001
Exp. 02
onde n representa o número de mols do éster (acetato de etila), água, ácido acético e etanol,
respectivamente, em qualquer mistura em equilíbrio, de volume total V. Como os volumes se
compensam, não é necessário determinar o volume da mistura em equilíbrio.
Para a reação estudada, o calor de reação (H) é muito próximo a zero, e assim, a
constante de equilíbrio (Kc) é quase independente da temperatura. Não é necessário, portanto,
estudar a reação em temperatura constante.
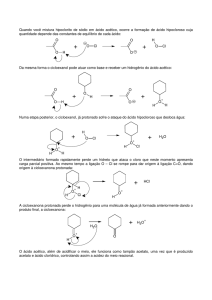
A reação de hidrólise do acetato de etila é lenta, portanto, para acelerar o processo
utilizaremos um catalisador – HCl. O tempo necessário para que o equilíbrio seja alcançado
diminui quando se usa ácido clorídrico como catalisador.
2. Objetivos
Determinar a constante de equilíbrio da reação de hidrólise do acetato de etila (reação
4) por análise química da mistura em equilíbrio.
3. Metodologia:
Tabela 1: Misturas reacionais para a determinação da constante de equilíbrio da reação 4.
Volumes / mL
Solução
HCl
3 mol/L
Éster
H2O
Etanol
0
1
2
3
4
5
Densidade
(g/mL)
Massa molar
(g/mol)
5
5
5
5
5
5
1,0435
5
2
4
4
0,9003
5
3
0,9982
1
4
0,7893
Ác.
Acético
glacial
1
1
1,0492
36,5
88
18
46
60
Éster
Número de mols iniciais
H2O
Etanol
Ác. Acético
[NaOH] =_____________mol/L
A massa de água em cada frasco é obtida pela soma da massa da água pura e da massa
de água contida na solução de HCl 3,0 mol/L. A massa de água na solução de HCl é obtida
subtraindo a massa de HCl contida em 5 mL desta solução.
A quantidade de ácido acético no equilíbrio de cada frasco é obtida pela subtração do
volume (em mL) de NaOH 1,0 mol/L usado na titulação da amostra 0 pelo volume de NaOH 1,0
mol/L utilizado na titulação das amostras em equilíbrio.
Nas amostras 4 e 5, o ácido acético é adicionado na solução original, e esta quantidade
deve ser considerada nos cálculos das quantidades em equilíbrio dos outros reagentes.
Para cada mol de ácido acético que reagiu, um mol de etanol desaparece da solução,
um mol de acetato de etila é produzido e um mol de água também surge na mistura.
Se os número de mols de cada um dos quatro reagentes na mistura original é
conhecido, sabendo-se também o número de mols de ácido acético que reagiu, pode-se
2
Físico-Química Experimental FQE001
Exp. 02
determinar os números de mols dos demais reagentes em equilíbrio e, então, a constante de
equilíbrio (Kc).
4. Experimental
Materiais por equipe
•
•
•
•
•
6 erlenmeyers com rolhas
1 bureta de 25 mL
Pipetas de 5, 2 e 1 mL
HCl 3,0 mol/L
NaOH 1,0 mol/L
•
•
•
•
Fenolftaleína
Acetato de etila
Ácido acético glacial
Álcool etílico 99,8%
Procedimento
Identifique os 6 erlenmeyers de sua equipe e, então, pipete as quantidades indicadas
na tabela acima nos respectivos erlenmeyers e tampe-os imediatamente. Vede bem para
evitar evaporação.
Espere que o equilíbrio seja atingido. Mantenha sua amostra devidamente identificada
à temperatura ambiente, agitando de vez em quando, durante uma semana.
Faça a titulação das amostras com solução de NaOH 1,0 mol/L, usando fenolftaleína
como indicador.
Determine a quantidade de ácido acético presente no equilíbrio e, baseado na
estequiometria da reação, dos demais reagentes, preenchendo a Tabela 2 na folha de dados.
Calcule a constante de equilíbrio em cada amostra.
5. Discussão dos Resultados
Calcule a constante de equilíbrio para cada amostra e compare os resultados.
A partir das diferentes composições iniciais e dos resultados obtidos, discuta o
princípio de Le Chatellier.
3
Físico-Química Experimental FQE001
Exp. 02
Folha de Dados - Equilíbrio Químico do Acetato de Etila
Nomes:
Tabela 2: Composição das amostras após o equilíbrio e constante de equilíbrio
calculada para cada caso.
Amostra
NaOH gasto na
titulação / mL
Número de mols no equilíbrio
Éster
H2O Etanol Ác.
Acético
Kc
0
1
2
3
4
5
Observações: A partir das diferentes composições iniciais e dos resultados obtidos,
discuta o princípio de Le Chatellier.
Utilize esta folha e mais quantas forem necessárias para apresentar os cálculos
efetuados para responder os dados nas Tabelas 1 e 2.
4
Físico-Química Experimental FQE001
Exp. 02
Questionário – Equilíbrio Químico do Acetato de Etila
Nomes:__________________________________________________________
1) Qual a relação matemática entre as constantes de equilíbrio das reações (4) e (5)?
2) O que ocorrerá com a amostra 1 em equilíbrio, se perturbarmos o equilíbrio
acrescentando ácido acético à solução? Quais variações ocorrerão nas concentrações
das espécies químicas?
3) Por que o ácido clorídrico atua como catalisador? Relembre seus conceitos de reações
orgânicas.
4) Partindo de ∆G1o = -RT1 ln K1, onde 1 representa a temperatura 1, demonstre como
chegar na equação que demonstra a dependência de K em função da Temperatura,
K(T). Qual o nome dado a esta equação?
5) A constante de equilíbrio K para a síntese da amônia é 6,8 x 105 a 298K. Preveja seu
valor a 400K.
5