REVISÃO: FUNÇÕES INORGÂNICAS
Prof. Guilherme F. Martins
ÁCIDOS
Segundo Arrhenius é toda substância que em
meio aquoso libera por ionização, como única
espécie de carga positiva, o íon H+ (próton).
Obs. Os ácidos são compostos moleculares...
Link: http://www.mhhe.com/physsci/chemistry/animations/chang_2e/acid_ionization.swf
ÁCIDOS: CLASSIFICAÇÕES
HIDRÁCIDOS: ácidos que não apresentam
átomos de oxigênio em sua fórmula:
Ex. HCl, HBr, HI, HF, H2S, H2Te, etc.
OXIÁCIDOS: ácidos que apresentam átomos de
oxigênio em sua fórmula:
Ex. HNO3, H2SO4, H3PO4, HClO, H2SO3, etc.
ÁCIDOS: CLASSIFICAÇÃO QUANTO A
QUANTIDADE DE HIDROGÊNIOS
IONIZÁVEIS
• MONOÁCIDO: 1 H ionizável: Ex. HCl, HNO3
• DIÁCIDO: 2 H ionizáveis: Ex. H2SO4, H2SO3
• TRIÁCIDO: 3 H ionizáveis: Ex. H3PO4
ÁCIDOS: FORÇA
• HIDRÁCIDOS:
FORTES
HI, HBr e HCl
MOD.
HF
FRACO
H2S, HCN
DEMAIS...
Obs. Lembrando que a força é medida pelo grau
de ionização (α)...
ÁCIDOS: FORÇA
• OXIÁCIDOS: Pode-se usar a regra de Pauling
(mas há exceções).
Regra de Pauling:
Exceção: H2CO3
ÁCIDOS: EQUAÇÕES DE IONIZAÇÃO
TOTAL E PARCIAL
ÁCIDOS: NOMENCLATURA
• HIDRÁCIDOS:
ÁCIDO + PREFIXO DO NOME DO + ÍDRICO
ELEMENTO EM LATIM
Ex.
HCl = Ácido clorídrico
HBR = Ácido bromídrico
H2S = Ácido sulfídrico
HCN = Ácido cianídrico
HNC = Ácido isocianídrico
ÁCIDOS: NOMENCLATURA
• OXIÁCIDOS:
ÁCIDO + PREFIXO DO NOME DO + ICO (p/ nox = +5, +6, +7)
ELEMENTO EM LATIM
ÁCIDO + PREFIXO DO NOME DO + OSO (p/ nox = +1, +2, +3, +4)
ELEMENTO EM LATIM
Obs. p/ nox +1 e +2 deve-se acrescentar o termo
hipo antes do prefixo em latim.
Obs. p/ nox +7 deve-se acrescentar o termo per
antes do prefixo em latim.
ÁCIDOS: NOMENCLATURA
• Ex.
H2SO4 = Ácido Sulfúrico (S nox = +6)
HBrO4 = Ácido Perbrômico (Br nox = +7)
HNO2 = Ácido Nitroso (N nox = +3)
HClO = Ácido Hipocloroso (Cl nox = +1)
Obs: ácidos que contenham átomos de C, B e Si,
são exceções a estas regras de nomenclatura...
BASES
Segundo Arrhenius é toda substâncias que em
meio aquoso libera por dissociação iônica, como
única espécie de carga negativa, o íon OH(hidroxila).
Obs. As bases são compostos iônicos...
BASES: CLASSIFICAÇÃO QUANTO AO
N° DE HIDROXILAS DISSOCIÁVEIS
• MONOBASE: 1 OH- DISSOCIÁVEL
• DIBASE: 2 OH- DISSOCIÁVEIS
• TRIBASE: 3 OH- DISSOCIÁVEIS
BASES: CLASSIFICAÇÃO QUANTO A
SOLUBILIDADE
• BASES SOLÚVEIS: São as bases de metais
alcalinos (NaOH, KOH, RbOH) e amônio (NH4OH).
• BASES POUCO SOLÚVEIS: são bases de metais
alcalinos terrosos [Mg(OH)2, Ca(OH)2, Sr(OH)2].
• BASES PRATICAMENTE INSOLÚVEIS: são todas as
outras bases com exceção dos dois itens
anteriores [NiOH, Fe(OH)2, AgOH].
BASES: FORÇA
BASES FORTES = São as bases de metais
alcalinos e alcalinos terrosos [FORTES APENAS
Ba(OH)2,Ca(OH)2 e Sr(OH)2] .
BASES FRACAS = As demais com exceção do
item anterior. (O NH4OH é uma base solúvel,
porém, fraca!!!)
Obs. Lembrado que para as bases também há
uma medida chamada grau de dissociação
BASES: EQUAÇÕES DE DISSOCIAÇÃO
TOTAL E PARCIAL
Medida da acidez ou basicidade
de uma solução: o pH
REAÇÕES DE NEUTRALIZAÇÃO ÁCIDOBASE
REAÇÕES DE NEUTRALIZAÇÃO ÁCIDOBASE
http://science.taskermilward.org.uk/mod1/Year%208/Mod12/Neutralisation.
swf
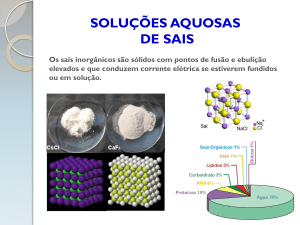
SAIS
Toda substância que, em meio aquoso, libera
pelo menos um cátion diferente de H+ um ânion
diferente de OH-.
Ex. EQUAÇÕES DE DISSOCIAÇÃO IÔNICA
Obs. Os sais são compostos iônicos...
SAIS: CLASSIFICAÇÃO QUANTO A
QUANTIDADE DE ELEMENTOS
BINÁRIOS: 2 átomos distintos (NaCl, KI, MgBr2)
TERNÁRIOS: 3 átomos distintos (K2SO4, AlPO4)
QUATERNÁRIOS: 4 átomos distintos (NaHCO3,
AlHSO4).
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
1 - SAIS NEUTROS: Sais que em meio aquoso
não alteram o pH da solução. Geralmente são
formados pela reação entre um ácido forte e
uma base forte.
HCl + NaOH
NaCl + H2O
H2SO4 + 2KOH
K2SO4 + 2H2O
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
2 - SAIS ÁCIDOS: Sais que, em meio aquoso,
promovem alteração no pH da solução
(diminuição do pH). Geralmente são formados
pela reação entre um ácido forte e uma base
fraca.
HCl + NH4OH
NH4Cl + H2O
2HNO3 + Ni(OH)2
Ni(NO3)2 + 2H2O
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
3 - SAIS BÁSICOS: Sais que, em meio aquoso,
promovem alteração no pH da solução
(aumento do pH). Geralmente são formados
pela reação entre um ácido fraco e uma base
forte.
H2S + KOH
K2S + H2O
2HCN + Ca(OH)2
Ca(CN)2 + 2H2O
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
4 - HIDROGENOSSAIS: São sais resultantes da
neutralização parcial de um ácido, apresentando
em sua fórmula hidrogênios que podem ser
ionizados. (alguns autores classificam esses sais
como sendo ácidos, mas nem sempre isso é
verdade!!!).
H2SO4 + NaOH
NaHSO4 + H2O
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
5 – HIDROXISSAIS: São sais resultantes da
neutralização
parcial
de
uma
base,
apresentando em sua fórmula hidroxilas que
podem ser dissociadas. (alguns autores
classificam esses sais como sendo básicos, mas
nem sempre isso é verdade!!!).
Mg(OH)2 + HCl
Mg(OH)Cl + H2O
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
6 – SAIS DUPLOS (MISTOS): Sais que
apresentam dois cátions ou dois ânions em sua
estrutura (exceção H+ e OH-).
Ex. CsKS, CaAgBO3, TiSO3S, AlClS
SAIS: CLASSIFICAÇÃO QUANTO A
NATUREZA DOS ÍONS
7 – SAIS HIDRATADOS: no retículo cristalino
desse sal são encontradas moléculas de água,
sendo essa água chamada de água de
hidratação.
Ex. CuSO4 . 5 H2O
SAIS - NOMENCLATURA
SAIS - NOMENCLATURA
Exemplos:
KCl: cloreto de potássio
NaCl: cloreto de sódio
CaCl2:cloreto de cálcio
Na2SO4: sulfato de sódio
CaCO3: carbonato de cálcio
NH4Cl: cloreto de amônio
NaHSO4: hidrogeno-sulfato de sódio
Mg(OH)Cl: hidroxi-cloreto de magnéso
CsKS: sulfeto de césio e potássio
CaAgBO3: borato de cálcio e prata
TiSO3S: sulfito-sulfeto de titânio IV
AlClS: cloreto-sulfeto de alumínio
CaSO4.5H2O: Sulfato de cálcio pentaidratado
CuSO .H O: Sulfato de cobre II monohidratado