ACOMETIMENTO RENAL NAS DOENÇAS SISTÊMICAS - AULA 7-Professora: Maristela
DIABETES:
A principal doença sistêmica que afeta o rim é o diabetes, sendo que, em torno, de 10% da população tem
diabetes, e que cerca de 40-50% desses (tanto DM1 como DM2), tem acometimento renal. Então como o DM é
uma doença freqüente (principalmente com pelos hábitos ocidentais, como obesidade, sedentarismo, stress,...),
acaba que muitas pessoas vão ter nefropatia diabética (ND), sendo essa a principal causa de diálise em países
desenvolvidos, no Brasil ainda não é assim, sendo a segunda causa, ficando em primeiro lugar a hipertensão, e em
terceiro lugar as nefropatias primárias. Essa diferença deve-se principalmente ao fato de a longevidade dos DM
em países desenvolvidos ser maior, eles sobrevivem até entrarem em diálise, pois a principal causa de morte em
pacientes DM com problema renal é doença cardiovascular, ou seja, a maioria dos pacientes DM com nefropatia
morre antes de entrar em diálise, por doença cardiovascular nos países subdesenvolvidos e em desenvolvimento
(BR). Com o aumento nos estudos para doenças cardiovasculares, teve diminuição na porcentagem de morte,
aumentando a sobrevida, chegando mais pacientes para diálise, então logo no BR a principal causa de diálise será
a ND. Lembrar que nem todos os pacientes DM que entram em diálise, é pela doença própria do DM no rim, a ND
(60%), porque a DM predispõe a aterosclerose, que são as placas de colesterol na camada íntima dos vasos, que
quando depositas na artéria renal, levando a estenose, diminuindo a perfusão sanguínea, levando a nefropatia
isquêmica (13%). Além disso, nada impede que o DM tenha outro tipo de nefropatia (27%), por exemplo, a
nefropatia hipertensiva, rim policístico.
O DM afeta o rim de 2 formas, pela via metabólica e pela via hemodinâmica. Sendo que na via metabólica, o
excesso de glicose no sangue ativa uma série de vias patológicas, como produtos avançados da glicosilação,
citocinas, entre outros, levando a lesão mitocondrial e renal, principalmente no mesângio glomerular.
No mesângio existe um receptor para esse produto
avançado da glicosilação (decorrente da glicemia alta), e
quando esse se liga no receptor, leva a secreção pela
célula mesangial de citocinas, sendo a principal o fator
de crescimento derivado das plaquetas. E essa secreção
aumentada de citocinas leva ao aumento da síntese de
colágeno, causando fibrose do glomérulo.
Via hemodinâmica: No paciente DM, a arteríola aferente
fica dilatada, e a eferente constrita, provavelmente pela produção aumentada de angiotensina II no DM,
ocorrendo um aumento na pressão capilar glomerular, sendo responsável pela primeira fase da ND que é a fase
de hiper-filtração, então o rim vai funcionar mais, mas esse aumento de pressão glomerular, a longo prazo, é
lesivo, porque ativa as células mesangiais a fabricar citocinas inflamatórias, lesando os podócitos (desgarra da
membrana basal, então altera as proteínas da fenda de filtração) e começa a surgir proteinúria, sendo essa a
segunda fase. Na primeira fase tem apenas microalbuminúria, passando uma pequena quantidade de proteínas,
de 30 a 300mg/24h, e com o avançar da lesão nos podócitos, começa a surgir macroalbuminúria (>300mg/24h),
fase de nefropatia clínica. E os IECA e BRA são benéficos pra ND. Sistema renina-angiotensina-aldosterona: a
renina é fabricada na arteríola aferente, toda vez que ela sente uma pressão menor, ela produz renina, na
circulação plasmática é convertida pelo angiotensinogênio em angiotensina I, que vai ser convertida,
principalmente nos capilares pulmonares, pela enzima conversora de angiotensina (ECA) em angiotensina II, e
essa tem vários efeitos sistêmicos, como por exemplo, a secreção de aldosterona, acarretando em retenção de sal
e água, ela também faz vaso-constrição, inclusive da arteríola eferente, porque ela é cheia de receptores para
angiotensina II, assim fazendo constrição predominantemente na eferente. Então o benefício em usar IECA
(captopril, enalapril), é que ele se ele inibir a ECA, a angiotensina I não consegue virar angiotensina II, diminuindo
a vaso-constrição da eferente, diminuindo a pressão nos capilares glomerulares, diminuindo a ativação mesangial
que alteraria os podócitos, diminuindo a proteinúria. O BRA (losartan, valsartan) vai direto ao receptor da
angiotensina II na eferente, inibindo a ligação, tendo mesmo efeito que os IECA. Esses medicamentos são
extremamente benéficos pra esses pacientes diabéticos, pois atuam na causa hemodinâmica da ND, sendo
agentes que diminuem a proteinúria, e quanto menor, mais tempo resiste o rim. As doenças que cursam com
mais proteínas na urina, são as que apresentam falência renal primeiro.
OBS: paciente atendida com 31 gramas de proteinúria, lembrando que o normal é <300mg, e que acima de 3,5g já
é síndrome nefrótica. E ta medicando ele com IECA e BRA, pra tentar abrir o máximo da eferente, diminuindo a
proteinúria, para manter ele mais longe da diálise.
Na biópsia (MO), vai aparecer expansão do mesângio, devido às glicosilas, que a célula mesangial secreta levando
a fibrose, e em uma minoria (<50%) dos pacientes diabéticos formam-se os nódulos de Kimmelstiel Wilson (é
matriz mesangial que expandiu e fibrosou), que é a lesão patognomônica da ND. E quando essa lesão
patognomônica aparecer, posso confirma o diagnóstico, mas quando não aparecer, não pode descartar, porque
ela acontece só na minoria dos pacientes.
FASES DA ND: a primeira é quando ocorre a hiperfiltração, quando a aferente abre e eferente fecha, aumenta
pressão capilar glomerular, o rim ainda funciona direito, mas já observo um DCE >120, mas não é bom, ele ta
hiper-filtrando, e essa hiper pressão faz desgarrar o podócito, perdendo proteína na urina, nesse caso a
microalbuminúria, ou nefropatia incipiente (30 a 300mg/24h) então no EQU não vai aparecer proteinúria ainda,
mas se eu fizer pesquisa de microalbuminúria, já aparece uma perda de proteínas (albumina) entre 30 e
300mg/24h. Essas duas primeiras fases, da hiperfiltração e da microalbuminúria são REVERSÍVEIS. Com o
avançar da lesão, começa eliminar mais proteínas passando das 300mg/24h, já aparecendo no EQU, já vai ter as
cruzes de proteínas (1 cruz já é macro), tendo a macroalbuminúria (>300mg/24h), que já faz parte da nefropatia
clínica, e essa é IRREVERSÍVEL. Então, se cuidar a DM, dar IECA, BRA, controlar a glicemia (hemoglobina glicada <
7), o colesterol (LDL <100, uso de estatinas se necessário), a pressão (<130x90mmHg) restringir a proteína animal
na dieta, interrupção do tabagismo (paciente que fuma perde 2x mais rápido a função renal, devido aos radicais
livres), ou seja, tomar medidas que retardam a progressão da nefropatia, o paciente das 2 primeiras fases pode
regredir pra normoalbuminúria, então detectado precocemente é possível reverter, mas na macroalbuminúria
não reverte mais. Mas mesmo o paciente estando na fase de macroalbuminúria, tem que manter esses cuidados
citados, pra retardar a progressão da ND e a necessidade de diálise.
Como começa a surgir a nefropatia na evolução do DM? A macroalbuminúria começa aparecer após 5 anos da
doença, do DM, sendo recomendado que o paciente DM1 faça EQU anualmente após 5 anos do diagnóstico,
porque esse paciente tem uma clínica muito exuberante, sendo feito o diagnóstico no inicio da doença. Já no
DM2, que é menos exuberante, sendo que muitas vezes o paciente já é diabético há vários anos antes do
diagnóstico, então nesse paciente não tem como saber o momento exato de quando começou, e o screening com
exame de urina anual no DM2 começa a partir do diagnóstico, porque não tem como prever a quanto tempo o
paciente tem o DM. E depois que iniciar a proteinúria, como se comporta a perda da função renal (diminuição da
DCE)? Geralmente depois de 1 ano que se desenvolveu a macroalbuminúria, começa a ter uma perda progressiva
da função renal.
OBS: ao fazer o EQU anualmente, se ele vier normal, tenho que pedir dosagem de microalbuminúria, para tentar
diagnosticar aumento de proteína, antes desenvolver macroalbuminúria. O screening do paciente com DM é
solicitar anualmente o EQU e a creatinina, e se EQU normal dosagem de microalbuminúria, para tentar reverter
pra normoalbuminúria intervindo no paciente, e caso já esteja em macroalbuminúria, também vou intervir pra
retardar a progressão, mas não volta pra normo. A relação proteinúria creatininúria pra saber quantas gramas o
paciente ta perdendo em 24 horas, quanto mais ele ta perdendo pior o prognóstico, ou pede dosagem de
proteinúria em 24 horas (mas daí da só a proteinúria).
HAS x ND: Muitos DM são hipertensos, e na DM 1 a HAS geralmente ocorre como conseqüência da ND, por
exemplo, um adolesce diabético que esteja com HAS, vou presumir que ele já tenha ND, pois a HAS é uma
conseqüência dela, então ficar atento se na DM1 desenvolver HAS, porque provavelmente já esteja com ND. Já na
DM 2 a HAS geralmente surge muitos anos antes da ND, precede a ND por anos. Fisiopatologia da HAS na ND:
Retenção renal de sódio (o rim no DM, não se sabe por qual motivo, faz uma retenção desesperada de sal
e água, tanto que o edema do diabético nefrótico é super difícil de tratar, muita dificuldade em reverter o
inchaço desses pacientes, já que retêm muito sal e água);
Ativação do SRAA intra-renal (fabrica mais renina, mais angiotensina II, por isso causa mais vasoconstrição
da arteríola eferente);
Ativação do nervo simpático renal (fica hiperativado);
Disfunção endotelial com ↓ ON;
Aumento da rigidez arterial: ↑ PP: HAS sistólica.
AMILOIDOSE: doença bem mais rara!
É uma doença em que subunidades protéicas de baixo peso molecular se polimerizam (grudam uma na outra) e
formam fibrilas insolúveis (forma tipo caninho), no EXTRACELULAR, em vários órgãos (rins, coração, fígado,
cérebro, baço, vasos sanguíneos, pele). Amilóide é o nome dado a essas proteínas fibrilares. E a detecção na
biópsia é pela coloração vermelho-congo, e ao olhar esse tecido corado na luz birrefringente ficar com a
coloração verde-maçã, é amilóide,ou seja, tem amiloidose. Amiloidose pode ser causada por várias doenças que
causam esse deposito extracelular de proteínas.
Classificação antiga: Secundária: causada por infecções (tem um germe envolvido) ou inflamações (resposta de
defesa) crônicas (osteomielite, TB, trauma, alergias, doença autoimune – artrite reumatóide, etc.) e o tipo de
proteína fabricada pelo corpo quando apresenta inflamação crônica são as imunoglobulinas (proteína de defesa),
então a amiloidose secundária é causada por deposição de fragmentos de anticorpos de cadeia leves das
imunoglobulinas, então quem constitui essa subunidade protéica na inflamação crônica, são pedaços de
anticorpo, mais especificamente cadeia leve das imunoglobulinas, e com a produção crônica eles vão se depositar
nos tecidos extracelulares, gerando amiloidose secundária, também chamada de amiloidose ‘‘AA’’ porque
deposita no tecido o amilóide sérico A, que é uma proteína que aumenta no processo inflamatório (de fase
aguda), e se deposita junto com os pedaços de anticorpos. E amiloidose primária: sem causa identificada, não é
encontrada nenhuma inflamação crônica ou causada por mieloma múltiplo (muitas vezes) que é uma neoplasia
dos plasmócitos, que é uma célula de defesa, que vai se diferenciar em linfócito B, responsável pela resposta
humoral, baseada em imunoglobulinas, então ele pode depositar anticorpos anormais (imunoglobulinas) que vão
polimerizar e formar o amilóide, e depositar no extracelular, causando amiloidose. Mas essa classificação é
antiga, a atual é baseada no tipo de proteína que constitui as fibrilas.
Hoje em dia já se sabe de 27 proteínas cujos pedaços podem formar amilóide, e essas, diferente das
imunoglobulinas, na grande maioria das vezes, causam amiloidose por anormalidade genética nessas proteínas,
então são casos familiares de amiloidose, é a pessoa que tem o gene da pró-calcitonina anormal, sendo familiar,
ela forma agregados fibrilares que se depositam nos tecidos, e hoje já tem 27 proteínas que quando sofrem
mutação se depositam nos tecidos formando amiloidose. Então esse gene mutante produz uma proteína
anormal, com capacidade de polimerizar e depositar no extracelular, sendo que a primeira proteína descoberta
foi a imunoglobulina, mas depois descobriu-se, que em casos de doenças genéticas familiares, podem formar
fibrila e se depositar no tecido, mas são raras. E porque as proteínas se depositam? Nas formas herdadas
(genéticas) as proteínas vão se depositar principalmente por MUTAÇÕES, essa proteína mutante dobra, então
essa conformação espacial anormal, leva a tendência de polimerizar, formar fibrilas e se depositar. E nas doenças
crônicas ou no mieloma vão se depositar principalmente por ter MAIOR DISPONIBILIDADE, na amiloidose AA, da
inflamação crônica, tem tantos anticorpos que acabam se polimerizando, formando fibrilas e se depositando no
extracelular e também no mieloma que tem tanta imunoglobulina anormal, porque o plasmócito canceroso ta
fabricando em excesso, que acaba depositando.
O diagnóstico é pela histologia do tecido, ou seja, pela biópsia. Eu posso suspeitar pelo quadro clínico, mas
diagnóstico definitivo só com biópsia. Faz à biopsia, cora com vermelho-congo, olha na luz birrefringente, se
aparecer nódulos verde-maçã é amiloidose, mas não consigo saber qual é a proteína, se a das inflamações
crônicas ‘’AA’’, do mieloma múltiplo, das formas familiares. Daí pode ser feito a imunofluorescência
(imunoistoquímica), pega a biopsia, e liga o anticorpo com um elemento de molécula fluorescente, e derramo.
Por exemplo, pra saber se tem proteínas AA, eu pego um anticorpo anti-AA e ligo com a molécula fluorescente,
depois lava a biopsia, e se tiver AA no fragmento, vai grudar no tecido, então vou ver fluorescência, e se não tiver
AA no tecido, não ficar fluorescente. Então descobre se tem amiloidose pelo vermelho-congo, e o tipo de
amiloidose pela imunofluorescência.
AA (inflamação crônica) e AL (ou que não tem causa, ou que tem mieloma):
Tecido renal: 90% (órgão mais afetado)
Gordura subcutânea: 60 a 80%
Biopsia de reto: 50 a 70%
Para diferenciar AA de AL (e
também as formas genéticas – 27):
imunoistoquímica
Pele: 50%
O ideal para diagnóstico de amiloidose seria biopsia renal já que é o mais atingido, mas como ele é um órgão
interno, posso fazer biopsia do tecido subcutâneo, tendo uma chance de 60-80% de fechar o diagnóstico, mas se
der negativo, vou ter que fazer do rim.
A figura 2: é a peça 1 corada com
vermelho congo; e a figura 3 é essa
corada em vermelho-congo sob luz
birrefringente, daí essa coloração verdemaçã comprova que é amiloidose.
Biopsia renal com amiloidose. Figura1: é MO (microscópio comum),
aparecendo nódulos no mesângio (depósitos eosinofílicos, fibrilas
no extracelular), bem parecidos com os nódulos de Kimmelstiel
Wilson, sendo então a amiloidose o principal diagnóstico diferencial
dos nódulos de KW (expansão da célula mesangial).
FIGURA depósito mesangial de amilóide / ME: só para demonstrar o formato das fibrilas, tipo fios de cabelo.
Condições associadas com amiloidose AA:
Doenças inflamatórias crônicas:
(auto-imune)
-Artrite reumatóide
-Espondilite anquilosante
-Artrite psoriática
-Síndrome de Reiter
-Síndrome de Behçet
-Doença de Crohn
Infecções crônicas:
-Tuberculose
-Lepra
-Osteomielite
-Bronquiectasias
-Úlceras de decúbito
Neoplasias:
-Linfoma Hodgkin
-Doença de Castleman
-Carcinoma de células renais
Herdadas:
-Febre familiar do
mediterrâneo (também cursa
com inflamação de crônica)
-Síndrome de Muckle-Wells
-TRAPS
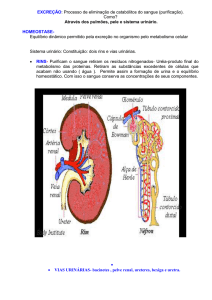
Manifestações clínicas amiloidose AA: como o rim é o órgão mais atingido, a principal manifestação é a
proteinúria, hematúria microscópica (1/3), insuficiência renal com rim de tamanho normal e rápida progressão
(isso gostam de perguntar nas provas: quando o paciente vai pra diálise com rins de tamanhos normais, sem que
o rim murche, uma das situações é a amiloidose, porque o rim fica cheio de nódulos de fibrilas, então mesmo
que encolha, devido aos nódulos fica grande, outra causa de insuficiência renal terminal com rim de tamanho
normal é o DM devido aos nódulos de KW), hipoesplenismo, supressão adrenal, hepatomegalia, hemorragia
digestiva, disfagia, gastroparesia, mal-absorção e constipação, comprometimento cardíaco geralmente
assintomático, hipotireoidismo ou pan-hipopituitarismo. Os órgãos mais atingidos são em primeiro lugar os rins,
coração em segundo e fígado em terceiro.
Tratamento AA: Redução da reação de fase aguda – 1) Eliminar foco inflamatório;
2) Tratamento da doença reumatológica subjacente: agentes alquilantes (cloranbucil, ciclofosfamida) e
corticoesteróides;
Sobrevida de 5 ano sem tto: <30%; e sobrevida de 5 anos com tto: >70% então tem que tratar!
Amiloidose AL: Fragmentos de cadeias leves produzidas por plasmócitos monoclonais polimerizam para formar as
fibrilas, sendo que 1/3 tem mieloma (>20% plasmócitos na medula, lesões ósseas líticas e hipercalcemia) e 10 a
15% dos pacientes com mieloma desenvolve amiloidose AL . Em 85% tem Ig ou cadeias leves monoclonais no soro
ou na urina (imunofixação). As manifestações clínicas da AL raramente < 40 anos, geralmente ± 65 anos, com
sintomas inespecíficos: cansaço, perda de peso, dispnéia e edema. Pode acometer o rim (proteinúria, IR), o
coração (agora com manifestação clínica, cursando com IC, arritmias, IAM, sendo uma diferença para AA que
não tinha manifestação clínica a nível cardíaco). Outra diferença importante é que a AL costuma pegar o nervo
periférico, tanto sensitivo como motor (parestesias, dor em extremidades, perda de força) e autonômico
(hipotensão postural, retenção urinária, constipação), já a ‘’AA’’ não. Então já vimos diferenças importantes que
ajudam no diagnóstico diferencial, as manifestação clínica cardíaca e alteração em nervos periféricos presentes
na AL. A AL também gosta de se depositar em músculo esquelético, causando macroglossia em paciente com
amiloidose AL, com “imprint” dos dentes na face lateral, sendo bem característica da AL.
Prognóstico e tratamento da AL: sobrevida média sem mieloma sem tto: 6 meses; com mieloma sem tto: 4 meses
e com tto: 29 meses. O tratamento é Melphalan (quimioterapia) + prednisolona, ou transplante de medula (não
tem bom resultado, é ultima alternativa, com sobrevida baixa também). Então a AL tem mal prognóstico, com
sobrevida média com tratamento de 2 anos, então é baixa, e mesmo não sendo mieloma, eu trato como se fosse.
E a AA tratando a inflamação melhora, então tem melhor prognóstico.
Bons estudos, Guilherme M.