HIBRIDIZAÇÃO DO CARBONO
(OU HIBRIDAÇÃO)
Química Orgânica Fundamental
PROF: LEONARDO
Introdução
Foi Kekulé, 1858, quem estabeleceu a
tetravalência do elemento carbono.
HIBRIDIZAÇÃO DO CARBONO
Introdução
Assim, a molécula de metano (CH4) costuma ser
representada como:
H
I
H–C–H
I
H
Fórmula estrutural plana do
metano.
HIBRIDIZAÇÃO DO CARBONO
Introdução
Com a descoberta de novos fenômenos
químicos, como por exemplo isomeria óptica,
houve necessidade de aperfeiçoar o modelo
de molécula plana apresentado.
HIBRIDIZAÇÃO DO CARBONO
Introdução
Desse modo, Le Bel e Van’t Hoff, em 1874,
lançaram a idéia do carbono tetraédrico,
portanto espacial.
HIBRIDIZAÇÃO DO CARBONO
O carbono no estado fundamental
HIBRIDIZAÇÃO DO CARBONO
O carbono hibridizado
HIBRIDIZAÇÃO DO CARBONO
Então, o que realmente acontece com o C?
A hibridação é um fenômeno que permite ao átomo realizar um
número maior de ligações, aumentando assim a sua
estabilidade.
Hibridação consiste na fusão de orbitais atômicos incompletos,
que se transformam, originando novos orbitais, em igual
número. Esses novos orbitais são denominados de orbitais
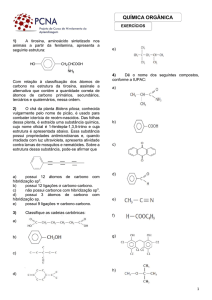
híbridos.
Existem 3 tipos de hibridações para o átomo de carbono:
sp3, sp2 e sp
Hibridização sp3
Na hibridização sp3 um elétron “s” é promovido para o orbital
“p” vazio, originando o carbono no estado ativado
(intermediário).
Hibridização sp3
Em seguida, há “fusão” entre o orbital “s” e os
três obtitais “p”.
Daí, hibridização sp3.
HIBRIDIZAÇÃO DO CARBONO
Hibridização sp3
Carbono hibridizado
(gráfico energético)
HIBRIDIZAÇÃO DO CARBONO
Hibridização sp3
Carbono hibridizado
(formas dos orbitais híbridos)
HIBRIDIZAÇÃO DO CARBONO
Hibridização sp3
Nas ligações com outros átomos, forma quatro
ligações “sigma”. Hibridação na molécula do
metano CH4
Geometria
tetraédrica
Hibridização sp2
Na hibridização sp2 um elétron “s” é também promovido para o
orbital “p” vazio, originando o carbono no estado ativado
(intermediário). Entretanto, a “fusão” de orbitais ocorre entre
o orbital “s” e dois “p”.Daí, hibridização sp2.
Note que um dos orbitais “p” permaneceu puro.
Hibridização sp2
Carbono hibridizado
(formas dos orbitais híbridos)
Hibridização sp2
Nas ligações com outros átomos, forma três
ligações “sigma” e uma “pi”.
Geometria trigonal planar
Hibridização sp2
Carbono hibridizado
(na molécula de eteno)
HIBRIDIZAÇÃO DO CARBONO
Hibridização sp
De forma semelhante, na hibridização sp um elétron “s” é também
promovido para o orbital “p” vazio, originando o carbono no estado
ativado (intermediário). Agora, a “fusão” de orbitais ocorre entre o orbital
“s” e um “p”, permanecendo dois orbitais “p” puros. Daí, hibridização sp.
Hibridização sp
Nas ligações com outros
átomos, forma duas
ligações “sigma” e duas
“pi”.
Geometria linear
Ângulo de 180
Hibridização sp
Carbono hibridizado
(a molécula de etino)
HIBRIDIZAÇÃO DO CARBONO
Encerrando . . .
O enxofre, por exemplo, na formação do
composto SF6 também apresenta o fenômeno
da hibridização.
HIBRIDIZAÇÃO DO CARBONO








![Roteiro Mensal [1ª série] – Biologia – Química – Empreendedorismo](http://s1.studylibpt.com/store/data/002323123_1-73e0a36762e852c083cac33c9b995a74-300x300.png)