Tema 5
Rev. Medicina Desportiva informa, 2012, 3 (5), pp. 25–28
Exercício físico e
insuficiência cardíaca
Dr. José Carlos Carneiro1, Dr.ª Rafaela Veríssimo2, Prof. Doutor Manuel Teixeira Veríssimo3
1
Interno de Pneumologia, CHVNG. Pós-Graduado em Medicina Desportiva. 2Interna de Medicina Interna,
CHVNG. Vila Nova de Gaia. 3Especialista em Medicina Interna e Medicina Desportiva. Professor da
Faculdade de Medicina de Coimbra.
Resumo ABSTRACT
A insuficiência cardíaca (IC) crónica é uma síndrome caracterizada pelo declínio progressivo da tolerância ao exercício físico. Nos últimos anos a prescrição de exercício físico nestes doentes sofreu alterações, desde a sua proibição até se tornar numa indicação absoluta.
Na maioria dos doentes com IC a prática regular de exercício físico tem evidenciado ser
uma intervenção segura. Todos os doentes devem ser previamente avaliados em relação às
contra-indicações para a prática de exercício. Na maior parte dos doentes este deverá consistir numa combinação de exercício aeróbio de moderada intensidade, 5-7 dias/semana, e
treino de força de baixa intensidade 2 dias/semana.
Chronic heart failure (CHF) is a syndrome characterized by progressive decline in exercise tolerance.
In the last years prescription of exercise in CHF patients changed from total prohibition to an absolute indication.In the majority of CHF patients regular exercise participation has been shown to be
a safe intervention. All patients should be closely monitored prior to exercise for contraindications.
In most patients it should consist of moderate intensity aerobic exercise 5-7 days/week and low
intensity resistance training 2 days/week.
Palavras chave Key-words
Insuficiência cardíaca, efeitos do exercício, prescrição de exercício.
Heart failure, effects of exercise, exercise prescription.
Introdução
comparado com o indivíduo saudável1,2. A prática de exercício físico
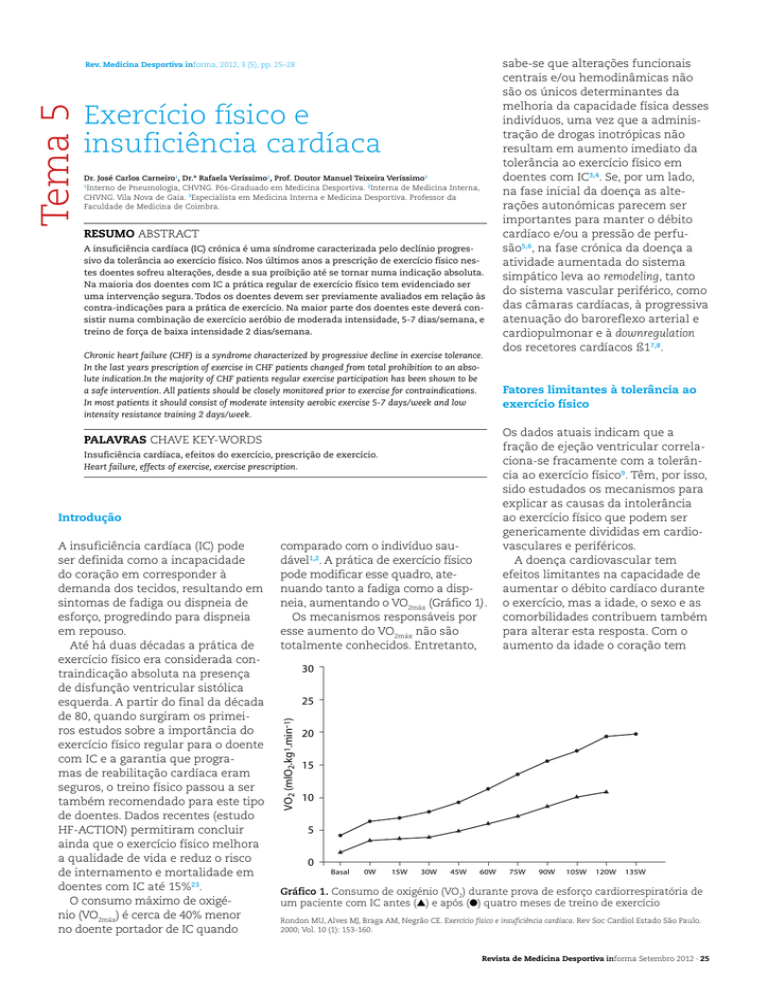
pode modificar esse quadro, atenuando tanto a fadiga como a dispneia, aumentando o VO2máx (Gráfico 1).
Os mecanismos responsáveis por
esse aumento do VO2máx não são
totalmente conhecidos. Entretanto,
Fatores limitantes à tolerância ao
exercício físico
Os dados atuais indicam que a
fração de ejeção ventricular correlaciona-se fracamente com a tolerância ao exercício físico9. Têm, por isso,
sido estudados os mecanismos para
explicar as causas da intolerância
ao exercício físico que podem ser
genericamente divididas em cardiovasculares e periféricos.
A doença cardiovascular tem
efeitos limitantes na capacidade de
aumentar o débito cardíaco durante
o exercício, mas a idade, o sexo e as
comorbilidades contribuem também
para alterar esta resposta. Com o
aumento da idade o coração tem
30
25
VO2 (mlO2.kg1.min-1)
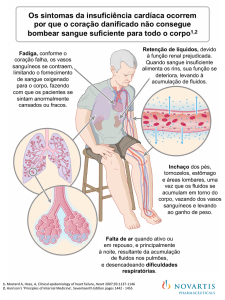
A insuficiência cardíaca (IC) pode
ser definida como a incapacidade
do coração em corresponder à
demanda dos tecidos, resultando em
sintomas de fadiga ou dispneia de
esforço, progredindo para dispneia
em repouso.
Até há duas décadas a prática de
exercício físico era considerada contraindicação absoluta na presença
de disfunção ventricular sistólica
esquerda. A partir do final da década
de 80, quando surgiram os primeiros estudos sobre a importância do
exercício físico regular para o doente
com IC e a garantia que programas de reabilitação cardíaca eram
seguros, o treino físico passou a ser
também recomendado para este tipo
de doentes. Dados recentes (estudo
HF-ACTION) permitiram concluir
ainda que o exercício físico melhora
a qualidade de vida e reduz o risco
de internamento e mortalidade em
doentes com IC até 15%23.
O consumo máximo de oxigénio (VO2máx) é cerca de 40% menor
no doente portador de IC quando
sabe-se que alterações funcionais
centrais e/ou hemodinâmicas não
são os únicos determinantes da
melhoria da capacidade física desses
indivíduos, uma vez que a administração de drogas inotrópicas não
resultam em aumento imediato da
tolerância ao exercício físico em
doentes com IC3,4. Se, por um lado,
na fase inicial da doença as alterações autonómicas parecem ser
importantes para manter o débito
cardíaco e/ou a pressão de perfusão5,6, na fase crónica da doença a
atividade aumentada do sistema
simpático leva ao remodeling, tanto
do sistema vascular periférico, como
das câmaras cardíacas, à progressiva
atenuação do baroreflexo arterial e
cardiopulmonar e à downregulation
dos recetores cardíacos ß17,8.
20
15
10
5
0
Basal
0W
15W
30W
45W
60W
75W
90W
105W
120W
135W
Gráfico 1. Consumo de oxigénio (VO2) durante prova de esforço cardiorrespiratória de
um paciente com IC antes (▲) e após (●) quatro meses de treino de exercício
Rondon MU, Alves MJ, Braga AM, Negrão CE. Exercício físico e insuficiência cardíaca. Rev Soc Cardiol Estado São Paulo.
2000; Vol. 10 (1): 153-160.
Revista de Medicina Desportiva informa Setembro 2012 · 25
aumentos exacerbados da atividade
oxidativa enzimánervosa simpática e da resposta
tica e a acumuventilatória, causando aumento da
lação de lactato
resistência periférica e redução da
sérico durante o
perfusão muscular22.
exercício19. É possível que os doentes
com IC, que têm
compromisso
Prescrição de exercício físico
severo das capacidades aeróbias,
A prescrição de um programa de
possam ter uma
exercício físico está recomendada
resposta angiogénos casos de IC crónica estável24,25,
nica mal-adaptada
mas de modo individualizado, porao exercício físico,
que a maioria das vezes o doente
aumentando a
com IC apresenta co-morbilidades
Coração normal
Insuficiência cardíaca
densidade capilar
importantes e é polimedicado. A este
antes de ocorrerem propósito salientam-se os IECA, os
alterações do músculo esquelético,
ARA, a digoxina e os nitratos que
menor capacidade para reduzir o
sugerindo que ocorra extração ou
aumentam a tolerância ao exercício
volume sistólico final do ventrículo
entrega anormal de oxigénio20.
e ainda os beta-bloqueadores, os
esquerdo, agravando o pré-load10. Em
quais, com o seu efeito cronotrópico
relação ao sexo, em qualquer idade,
A tolerância ao exercício não
negativo, relegam para segundo
a mulher tem menor capacidade
dependente apenas da capacidade
plano a utilização da frequência
aeróbia que o homem, explicado
cardiopulmonar para a entrega do
cardíaca na monitorização da intenpelo menor nível de hemoglobina
oxigénio ao músculo, mas também
sidade do exercício físico26.
sérica e menor extração periférica
do fluxo renal, ou seja, da capaci11
de oxigénio .
dade da vasculatura redistribuir o
Neste tipo de doentes os mecanisdébito cardíaco ao músculo durante
mos termorreguladores encontramA função hemodinâmica central,
o exercício físico. Nos indivíduos
-se alterados, com diminuição da
como a melhoria da função cardíaca
saudáveis 85% do débito cardíaco é
resposta ao aumento da tempee a maior resposta no débito cardistribuído ao músculo, sob exercício ratura corporal provocada pelo
díaco, não são suficientes para
intenso, mas este fluxo sanguíneo
exercício físico27 (devido a efeitos
explicar a intolerância ao exercício
muscular parece reduzido na IC
físico. Os fatores periféricos também
iatrogénicos, p. ex.), pelo que é
paralelamente com a redução do
contribuem, incluindo anormalidanecessário estar mais atento aos
débito cardíaco21.
des da função endotelial, ativação
sinais e sintomas de hipertremia e
ergoreflexa, capacidade de vasodesidratação, bem como ter espeUm novo paradigma sugere
dilatação e distribuição do débito
cial atenção ao vestuário usado na
também a contribuição de um sinal
cardíaco. O endotélio é também
prática desportiva e às condições do
específico do músculo em exercício
um fator interveniente na perfusão
meio envolvente.
que está anormalmente aumentecidular no doente com IC. O óxido
Antes de iniciar o programa de
tado na IC – ativação ergoreflexa.
nítrico (NO) libertado, que é um
exercício físico tem de se proceder
Essa aferência muscular aumenmediador importante da vasodilataà estratificação de risco através
tada desencadeia, reflexamente,
ção e perfusão tecidual, parece estar
Tabela 1. Contra-indicações absolutas e relativas para o treino de
diminuído neste tipo de doentes15-17.
exercício em doentes com insuficiência cardíaca
Por outro lado, a falência do afluxo
Contra-indicações absolutas Contra-indicações relativas
sanguíneo ao músculo durante o
• Agravamento progressivo da dispneia de
• Aumento de peso >2kg nos últimos 1 a
exercício físico é devida, não apenas
esforço ou dispneia em repouso ou em
3 dias
à redução do débito cardíaco, mas
esforço ‘de novo’ nos últimos 3 a 5 dias
• Terapia intermitente ou contínua com
também à deficiente vasodilatação
• Isquemia significativa em exercício de baixa
dobutamina
periférica12 presente nos doentes
intensidade [<2 METs (metabolic equivalents)
• Queda no valor da TA sistólica >10 mmHg
com IC, devida à estimulação simpáou ~50W]
durante o exercício
• Diabetes Mellitus mal controlada
• New York Heart Association classe IV
tica excessiva, ativação do sistema
• Doença sistémica aguda ou febre
• Arritmia ventricular complexa em repouso
renina-angiotensina e altos níveis de
• Embolia recente
ou com o exercício
13,14
endotelina
.
• Tromboflebite
• FC em decúbito dorsal >100 bpm
Outra causa importante de
• Pericardite aguda ou Miocardite
• Presença de co-morbilidades
intolerância ao exercício físico é o
• Estenose aórtica severa
• Estenose aórtica moderada
• Insuficiência valvular (a necessitar correção
• TA> 180/110 mmHg
metabolismo anaeróbio que ocorre
cirúrgica)
precocemente durante o exercício na
• EAM nas últimas 3 semanas
IC17. Os doentes com IC têm dimi• Fibrilação auricular ‘de novo’
nuição das fibras tipo I oxidativas e
• FC em repouso >120 bpm
aumento das fibras IIb glicolíticas18.
Adaptado de Recommendations for exercise training in chronic heart failure patients. Working Group
Os estudos revelaram que existe
on Cardiac Rehabilitation & Exercise Physiology and Working Group on Heart Failure of the European
uma relação inversa entre atividade
Society of Cardiology. Eur Heart J 2001;22:125–35.
26 · Setembro 2012 www.revdesportiva.pt
da realização de prova de esforço
cardiorrespiratória em cicloergómetro (protocolo incremental de 10W/
min) ou passadeira (protocolo de
Bruce 30’’)28 e avaliar as eventuais
contraindicações clínicas para a sua
realização (Tabela 1).
O exercício físico não está contraindicado nos doentes portadores
de dispositivos implantados, mas
refira-se que no caso de doentes
com cardioversor-desfibrilador
implantado (CDI), recomenda-se que
a FCmáx atingida seja 10 a 15 batimentos abaixo do limiar de taquicardia detetado pelo CDI29.
A necessidade de monitorização e
de supervisão do exercício é advogada nalguns estudos, pelo menos
na fase inicial (e especialmente
naqueles doentes com arritmias
induzidas pelo exercício ou com
formas de IC grave)26,30, mas nos
casos de doentes com a doença
estabilizada é possível a obtenção
de bons resultados com programas
domiciliários desde que mantidos
em consultas regulares de follow-up.
O princípio FITT
Os príncipios gerais de exercício
físico estão sumariados na sigla FITT
– frequência, intensidade, tempo e
tipo28. Tradicionalmente, e até cerca
de 1980, preconizava-se somente
exercícios aeróbios, com movimentos cíclicos e que envolviam grandes
grupos musculares (caminhada,
ciclismo, corrida lenta, natação).
Recentemente demonstrou-se que,
ao contrário do que se pensava, o
treino de força não aumenta o afterload cardíaco para níveis deletérios
e que existe mesmo uma correlação
positiva independente entre a força
muscular e o prognóstico clínico
do doente com IC31. Este deverá ser
um exercício de força dinâmico, por
oposição ao treino isométrico que é
contraindicado neste tipo de doentes
devido à potencial ocorrência concomitante da manobra de Valsalva32, e
atualmente deverá ser associado ao
exercício aeróbio nos programas de
treino uma vez que melhora o tónus
muscular e pode aumentar o VO2máx
até 16%33,34.
A duração do exercício físico
deve incluir um período de aquecimento, que normalmente é de
28 · Setembro 2012 www.revdesportiva.pt
Treino aeróbio
Intensidade
Duração
Tipo / forma
40-70% FC máx
20-30 min
Grandes grupos
11 a 14 (Borg)
Freq semanal
5a6
musculares
Treino de força
40-60% de 1RM
máx 30 min
8-15 reps; 3-4 séries
10 a 15 minutos, mas deve ser
mais longo à medida que o doente
está clinicamente mais debilitado.
A fase do exercício aeróbio deve
durar 20-30 minutos na intensidade
recomendada para o indivíduo em
causa (podendo ser progressivamente aumentada até 40 minutos),
seguindo-se um período de arrefecimento de cerca de 10 minutos26.
Quanto ao treino de força, este deve
incluir 3-4 séries, com 8-15 repetições em menos de 60 segundos, com
duração máxima da sessão de 30
minutos35. A relação entre exercício
e repouso deverá ser >1:2 neste tipo
de treino36.
As sessões de exercício físico
devem ser realizadas 4 a 6 vezes
por semana, de preferência em dias
intercalados, para permitir a adequada recuperação do doente. O
treino de força, por seu turno, deve
ser efetuado 2 vezes por semana37.
Não existe uma relação clara entre
intensidade de exercício e capacidade funcional38. Mais frequentemente utiliza-se nos programas
de treino em doentes com IC como
indicador da intensidade do exercício desejável o valor 40% a 80% do
VO2máx ou, em alternativa, a 40% a
75% da frequência cardíaca máxima
(FCmáx)25,39. Em todos os doentes, mas
especialmente em doentes sob beta-bloqueadores, deve-se utilizar em
simultâneo a escala de percepção
do esforço de Borg (RPE – rating of
perceived exertion), devendo o doente
manter-se nos valores de 11 a 14
(escala de 6 a 20) durante o exercício26,39.
No treino de força as cargas não
devem ultrapassar os 3 kg, devendo-se iniciar com cargas de 40% de
1RM (repetição máxima), até um
máximo de 60% de 1RM40.
Apesar da inexistência de vasta
literatura sobre o exercício físico
em indivíduos NYHA classe IV, ele
deve ser preconizado neste tipo de
doentes, ainda que com adaptações
especialmente no que diz respeito ao
2
treino de força37.
Dados recentes revelam que os
benefícios fisiológicos de um programa de treino deixam de existir
após 8 semanas da sua cessação41,
pelo que é fundamental manter o
doente o mais empenhado e motivado possível na manutenção da
atividade física.
Conclusão
A IC crónica é uma síndrome progressiva caraterizada pela diminuição da função do ventrículo
esquerdo. Apesar do treino não ser a
cura para a IC, a prescrição adequada de exercício aumenta a tolerância ao esforço através da melhoria da função músculo-esquelética,
ventilatória e autonómica, havendo
mesmo alguma evidência de melhoria concomitante do miocárdio (através dos seus efeitos anti-remodeling).
A prescrição de exercício físico
individualizada e monitorizada,
quando efetuada por profissionais
de saúde treinados e em associação
com uma terapêutica médica otimizada, pode alterar o prognóstico e a
qualidade de vida nos doentes com
IC crónica estável.
Bibliografia
1. Cohen-Solal A, Chabernaud JM, Gourgon
R. Comparison of oxygen uptake during bicycle
exercise in patients with chronic heart failure
and in normal subjects. J Am Coll Cardiol
1990;16:80-85.
2. Sullivan MJ, Higginbotham MB, Cobb FR.
Exercise training in patients with chronic heart
failure delays ventilatory anaerobic threshold
and improves submaximal exercise performance. Circulation 1989;79:324-329.
3. Maskin CS, Forman R, Sonnenblick EH, et
al. Failure of dobutamine to increase exercise
capacity despite haemodynamic improvement
in severe chronic heart failure. Am J Cardiol
1983;51:177- 182.
4. Wilson JR, Martin JL, Ferraro N. Impaired
skeletal muscle nutritive flow during exercise
in patients with congestive heart failure: role
of cardiac pump dysfunction as determined
by the effect of dobutamine. Am J Cardiol
1984;53:1308-1315.
5. Dubach P, Myers J, Dziekan G, et al. Effect of
exercise training on myocardial remodeling in
patients with reduced left ventricular function
after myocardial infarction: application of
magnetic resonance imaging. Circulation
1997;95:2060-2067.
6. Coats AJS, Adamopoulos S, Radaelli A, et al.
Controlled trial of physical training in chronic
heart failure. Exercise performance, hemodynamics, ventilation, and autonomic function.
Circulation 1992;85:2119-2131.
7. Harris P. Congestive heart failure: central
role of the arterial blood pressure. Br Heart J
1987;58:190- 203.
8. Hirsch AT, Dzau VS, Creager MA. Baroreceptor function in congestive heart failure: effect on
neurohumoral activation and regional vascular
resistance. Circulation 1987;75(suppl 4):3648.
9. Franciosa JA, Park M, Levine TB. Lack of correlation between exercise capacity and indexes
of resting left ventricular performance in heart
failure. Am J Cardiol. 1981;47:33–39.
10.Fleg JL, O’Connor F, Gerstenblith G, et al.
Impact of age on the cardiovascular response to
dynamic upright exercise in healthy men and
women. J Appl Physiol. 1995;78:890–900.
11.Sullivan MJ, Cobb FR, Higginbotham MB.
Stroke volume increases by similar mechanisms
during upright exercise in normal men and
women. Am J Cardiol. 1991;67:1405–1412.
12.Zelis R, Mason DT, Braunwald E. A comparison of the effects of vasodilator stimuli on
peripheral resistance vessels in normal subjects
and in patients with congestive heart failure. J
Clin Invest. 1968;47:960–970.
13.Zelis R, Sinoway LI, Musch TI, et al. Regional blood flow in congestive heart failure:
concept of compensatory mechanisms with
short and long time constants. Am J Cardiol.
1988;62:2E–8E.
14.McMurray JJ, Ray SG, Abdullah I, et al.
Plasma endothelin in chronic heart failure.
Circulation. 1992;85:1374–1379.
15.Drexler H, Lu W. Endothelial dysfunction of
hindquarter resistance vessels in experimental
heart failure. Am J Physiol. 1992;262:H1640–
H1645.
16.Drexler H, Hayoz D, Munzel T, et al. Endothelial function in chronic congestive heart failure.
Am J Cardiol. 1992;69:1596–1601.
17.Kubo SH, Rector TS, Bank AJ, et al. Endothelium-dependent vasodi- lation is attenuated
in patients with heart failure. Circulation.
1991;84:1589–1596.
18.Drexler H, Riede U, Munzel T, et al. Alterations of skeletal muscle in chronic heart failure.
Circulation. 1992;85:1751–1759.
19.Sullivan MJ, Green HJ, Cobb FR. Altered
skeletal muscle metabolic responses to exercise
in chronic heart failure: relation to skeletal
muscle aerobic enzyme activity. Circulation.
1991;84:1597–1607.
20.Duscha BD, Kraus WE, Keteyian SJ, et al.
Capillary density of skeletal muscle: a contributing mechanism for exercise intolerance in
class II-III chronic heart failure independent of
other peripheral alterations. J Am Coll Cardiol.
1999;33:1956–1963.
21.Yamabe H, Itoh K, Yasaka Y. The role of cardiac output response in blood flow distribution
during exercise in patients with chronic heart
failure. Eur Heart J. 1995;16:951–960.
22.Clark AL, Poole-Wilson PA. Exercise limitation
in chronic heart failure: central role of periphery.
J Am Coll Cardiol. 1996;28:1092–1102.
23.O’Connor CM, Whellan DJ, Lee KL, et al.
Efficacy and safety of exercise training in
patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA.
2009;301:1439–1450.
24.US Department of Health and Human
Services. Agency for Health Care Policy and
Research. Clinical Practice Guideline No. 17:
Cardiac Rehabilitation. Washington, DC:
Agency for Health Care Policy and Research;
October 1995. AHCPR Publication No.
96-0672.
25.Working Group on Cardiac Rehabilitation and
Exercise Physiology and Working Group on
Heart Failure of the European Society of Cardiology. Recommendations for Exercise Training
in Chronic Heart Failure Patients. Eur Heart J.
2001;22,125-135.
26.Pina IL, Apstein CS, Balady GJ, et al. Exercise
and heart failure: a statement from the American Heart Association Committee on exercise,
rehabilitation, and prevention. Circulation.
2003;107:1210–1225.
27.Green DJ, Maiorana AJ, Siong JH, et al. Impaired skin blood flow response to environmental
heating in chronic heart failure. Eur Heart Fail.
2006;27:338-43.
28.ACSM. Exercise prescription for patients with
cardiac disease. In: Thompson WR, Gordon NF,
Pescatello LS, editors. ACSM’s guidelines for
exercise testing and prescription. 8th ed.
Philadelphia, PA: Lippincott Williams &
Wilkins; 2010:105–134.
29.Lampman RM, Knight BP. Prescribing Exercise training for patients with defibrillators.
Am J Phys Med Rehabil. 2000;79:292–297.
30.American Association of Cardiovascular
and Pulmonary Rehabilitation. Guidelines
for Cardiac Rehabilitation and Secondary
Prevention Programs. 4th ed., Champaign, Ill:
Human Kinetics Publishers; 2004.
31.Levinger I, Bonks R, Cody DV, et al. The
effect of resistance training on left ventricular
function and structure of patients with chronic
heart failure. Int J Cardiol. 2005;105(2):159163.
32.Williams MA, Haskall WL, Ades PA, et al.
Resistance exercise in individuals with and
without cardiovascular disease: 2007 update.
A scientific statement from the American Heart
Association Council on Clinical Cardiology and
Council on Nutrition, Physical Activity and
Metabolism. Circulation. 2007;116(5):572584.
33.Maiorana A, O’Driscoll G, Cheetham C, et al.
Combined aerobic and resistance exercise training improves functional capacity and strength
in CHF. J Appl Physiol. 2000;88:1565–1570.
34.Delegardelle C, Feiereisen P, Autier P.
Strength/endurance training versus endurance
training in congestive heart failure. Med Sci
Sports Exerc. 2007;34:1869-1872.
35.Delagardele C, Feiereisen P, Krecké R, et
al. Objective effects of a 6 month endurance
training program in outpatients with congestive heart failure. Med Sci Sports Exerc.
1999;31:1102-1107.
36.Meyer K. Resistance exercise in chronic heart
failure- landmark studies and implications for
practice. Med Clin Exp. 2006;29(3):166-169.
37.Braith RW, Beck DT. Resistance exercise: training adaptations and developing a safe exercise
programme. Heart Fail Rev.2008;13(1):69-79.
38.Smart N, Marwick T. Exercise training for
patients with heart failure: a systematic review
of factors that improve mortality and morbidity.
Am J Med. 2004;116:693-706.
39.Myers J. Principles of Exercise Prescription for
Patients with Chronic Heart Failure. Heart
Failure Reviews. 2007;13 (1):61-68.
40.Volkalis KA, Tokmakidis SP. Resistance
training in patients with heart heart failure.
Sports Med. 2005; 35(12): 1085-1103.
41.Maiorana A, O’Driscoll G, Dembo L, et al.
Effect of aerobic and resistance training on
vascular function in heart failure. Am J Physiol
Heart Circ Physiol. 2000;279(4):1999-2005.
Revista de Medicina Desportiva informa Setembro 2012 · 29