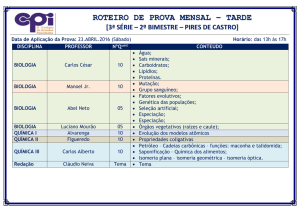
Resumo - Isomeria
Isomeria
- Compostos que possuem a mesma fórmula molecular, mas
diferem no arranjo dos átomos na estrutura das moléculas
(moléculas diferentes).
1.
Isomeria plana ou constitucional
1.1 Isomeria de Função
- Compostos que possuem mesma fórmula molecular,
mas diferem na função orgânica.
Exemplo:
Cadeia homogênea e cadeia heterogênea
Éter e álcool
1.3 Isomeria de Posição
- Compostos que possuem mesma fórmula molecular,
mesma função orgânica, mesma cadeia carbônica, mas
diferem na posição do grupo funcional, instauração ou
ramificação.
Exemplo:
Ramificação
Aldeído e Cetona
Grupo Funcional
Éster e Ácido carboxílico
Insaturação
1.2 Isomeria de Cadeia
- Compostos que possuem mesma fórmula molecular,
mesma função orgânica mas diferem no tipo de cadeia
carbônica.
Exemplo:
Cadeia normal e cadeia ramificada
1.4 Isomeria de compensação ou Metameria
É um caso especial de isomeria de posição onde os
isômeros diferem na posição do heteroátomo.
Exemplo:
Cadeia aberta e cadeia fechada
http://regradetres.com
Prof. Thiago Bernini
Resumo - Isomeria
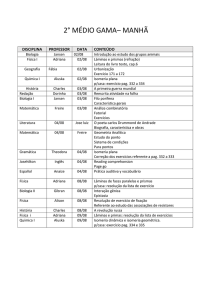
1.5 Isomeria dinâmica ou Tautomeria
É um caso especial de isomeria de função onde os
isômeros coexistem em um equilíbrio dinâmico.
2.
Equilíbrio Aldo-enólico
Equilíbrio Ceto-enólico
2.2 Isomeria Óptica
- São isômeros que apresentam moléculas assimétricas em
que os isômeros diferem no desvio da luz polarizada.
- Condição:
Para que sejam assimétricos devem possuir pelo
menos um carbono quiral ou assimétrico (Carbono
com 4 ligantes diferentes).
Exemplo:
Isomeria Espacial ou Estereoisomeria
- São isômeros que diferem na disposição espacial dos
átomos na molécula.
2.1 Isomeria Geométrica ou Cis-Trans
Todo composto que apresenta um carbono quiral na
molécula será representado sempre por dois isômeros
opticamente ativos: um dextrogiro e outro levogiro
(enantiômeros), cujas moléculas funcionam como objeto
e imagem em relação a um espelho plano.
- Condições:
Os carbono envolvidos não podem girar
independentemente um do outro. (cadeias
abertas com ligação dupla ou cadeias fechadas)
Os carbonos envolvidos na isomeria devem
possuir dois ligantes diferentes cada um.
Exemplo:
A
D
B
E
Dextrogiro ( d ) ou ( + )
Uma mistura com quantidades iguais (equimolares) de
isômeros Dextrógios e Levógiros é conhecida como
mistura racêmica ou racemato, sendo opticamente
inativa.
Em compostos com dois ou mais carbonos quirais
diferentes, a quantidade de isômeros opticamente ativos
e de misturas
racêmicas pode ser calculada
utilizando-se as fórmulas:
Onde A ≠ B e D ≠ E
Forma ou isômero Cis
Levogiro ( l ) ou ( - )
Forma ou isômero Trans
Exemplo:
Forma ou isômero Cis
http://regradetres.com
Forma ou isômero Trans
Prof. Thiago Bernini