Estabilidade de complexos de alumínio (III) contendo glicose
Paola Gimenez Mateus, Antonio Carlos Dias Ângelo, Alexandre de Oliveira Legendre
Universidade Estadual Paulista Júlio de Mesquita Filho, Faculdade de Ciências - Campus Bauru
Licenciatura em Química. E-mail: [email protected]. Bolsista PIBIC
Palavras Chave: Complexos de alumínio(III), compostos de coordenação com carboidratos, potenciometria.
Introdução
Resultados e Discussão
Carboidratos são moléculas constituintes dos
organismos vivos e suas principais fontes
alimentares, tendo fórmula geral (CH2O)n, em que
n≥3. A combinação de suas diferentes funções
bioquímicas permite a integridade da célula e de
todos os processos metabólicos, fisiológicos e
1
genéticos dos seres vivos.
O alumínio é considerado o metal mais abundante
na crosta terrestre e seu custo é baixo se
comparado com a maioria dos metais. No estado de
oxidação trivalente, este metal forma numerosos
complexos, sendo os números de coordenação 4, 5
2
e 6 os mais comuns. O campo de estudo de
complexos metálicos com açúcares é pouco
explorado devido à dificuldade de se obter
compostos com estabilidade suficientemente grande
para que tais complexos possam ser isolados e
3
caracterizados adequadamente, o que reflete a
existência de lacunas a serem preenchidas neste
campo de pesquisa.
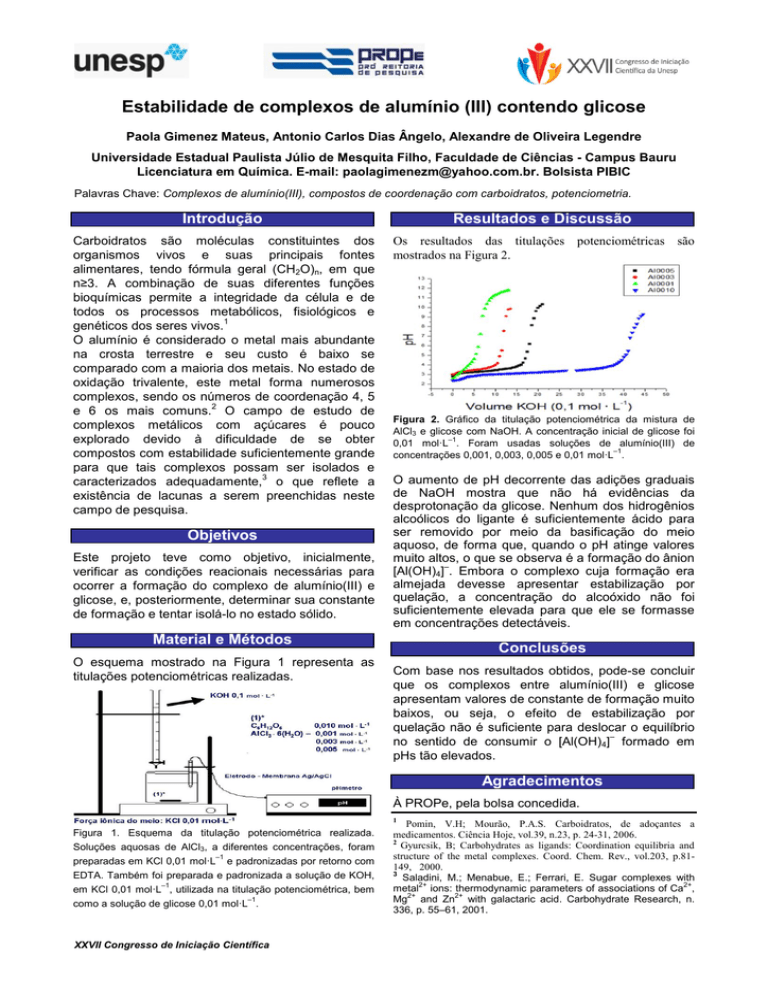
Os resultados das titulações potenciométricas são
mostrados na Figura 2.
Objetivos
Este projeto teve como objetivo, inicialmente,
verificar as condições reacionais necessárias para
ocorrer a formação do complexo de alumínio(III) e
glicose, e, posteriormente, determinar sua constante
de formação e tentar isolá-lo no estado sólido.
Figura 2. Gráfico da titulação potenciométrica da mistura de
AlCl3 e glicose com NaOH. A concentração inicial de glicose foi
0,01 mol·L–1. Foram usadas soluções de alumínio(III) de
concentrações 0,001, 0,003, 0,005 e 0,01 mol·L–1.
O aumento de pH decorrente das adições graduais
de NaOH mostra que não há evidências da
desprotonação da glicose. Nenhum dos hidrogênios
alcoólicos do ligante é suficientemente ácido para
ser removido por meio da basificação do meio
aquoso, de forma que, quando o pH atinge valores
muito altos, o que se observa é a formação do ânion
–
[Al(OH)4] . Embora o complexo cuja formação era
almejada devesse apresentar estabilização por
quelação, a concentração do alcoóxido não foi
suficientemente elevada para que ele se formasse
em concentrações detectáveis.
Material e Métodos
O esquema mostrado na Figura 1 representa as
titulações potenciométricas realizadas.
Conclusões
Com base nos resultados obtidos, pode-se concluir
que os complexos entre alumínio(III) e glicose
apresentam valores de constante de formação muito
baixos, ou seja, o efeito de estabilização por
quelação não é suficiente para deslocar o equilíbrio
–
no sentido de consumir o [Al(OH)4] formado em
pHs tão elevados.
Agradecimentos
À PROPe, pela bolsa concedida.
1
Figura 1. Esquema da titulação potenciométrica realizada.
Soluções aquosas de AlCl3, a diferentes concentrações, foram
preparadas em KCl 0,01 mol·L–1 e padronizadas por retorno com
EDTA. Também foi preparada e padronizada a solução de KOH,
em KCl 0,01 mol·L–1, utilizada na titulação potenciométrica, bem
como a solução de glicose 0,01 mol·L–1.
XXVII Congresso de Iniciação Científica
Pomin, V.H; Mourão, P.A.S. Carboidratos, de adoçantes a
medicamentos. Ciência Hoje, vol.39, n.23, p. 24-31, 2006.
2
Gyurcsik, B; Carbohydrates as ligands: Coordination equilibria and
structure of the metal complexes. Coord. Chem. Rev., vol.203, p.81149, 2000.
3
Saladini, M.; Menabue, E.; Ferrari, E. Sugar complexes with
metal2+ ions: thermodynamic parameters of associations of Ca2+,
Mg2+ and Zn2+ with galactaric acid. Carbohydrate Research, n.
336, p. 55–61, 2001.