FUNDAÇÃO EDUCACIONAL BARRIGA VERDE – FEBAVE
CENTRO UNIVERSITÁRIO BARRIGA VERDE – UNIBAVE
CURSO: Engenharia de Produção
DISCIPLINA: Química III
PROFESSOR: MSc Luciano Giassi
ALUNO(A):
FASE:
Análise Volumétrica
1. Defina os termos: titulação, ponto de equivalência, ponto final de uma titulação, padrão primário, padronização,
indicadores ácido-base.
2. Qual o critério usado na seleção de um indicador para uma titulação ácido-base em particular?
3. Quando se faz necessária a padronização de uma solução?
4. Por que nem todas soluções são padrões?
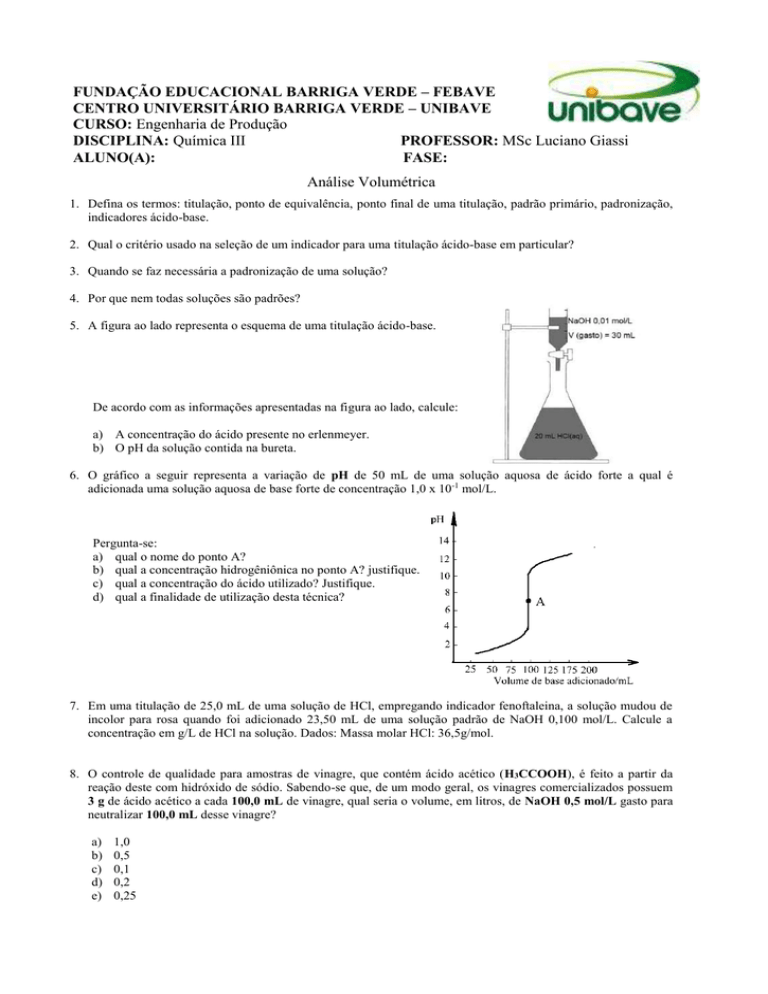
5. A figura ao lado representa o esquema de uma titulação ácido-base.
De acordo com as informações apresentadas na figura ao lado, calcule:
a) A concentração do ácido presente no erlenmeyer.
b) O pH da solução contida na bureta.
6. O gráfico a seguir representa a variação de pH de 50 mL de uma solução aquosa de ácido forte a qual é
adicionada uma solução aquosa de base forte de concentração 1,0 x 10-1 mol/L.
Pergunta-se:
a) qual o nome do ponto A?
b) qual a concentração hidrogêniônica no ponto A? justifique.
c) qual a concentração do ácido utilizado? Justifique.
d) qual a finalidade de utilização desta técnica?
7. Em uma titulação de 25,0 mL de uma solução de HCl, empregando indicador fenoftaleina, a solução mudou de
incolor para rosa quando foi adicionado 23,50 mL de uma solução padrão de NaOH 0,100 mol/L. Calcule a
concentração em g/L de HCl na solução. Dados: Massa molar HCl: 36,5g/mol.
8. O controle de qualidade para amostras de vinagre, que contém ácido acético (H3CCOOH), é feito a partir da
reação deste com hidróxido de sódio. Sabendo-se que, de um modo geral, os vinagres comercializados possuem
3 g de ácido acético a cada 100,0 mL de vinagre, qual seria o volume, em litros, de NaOH 0,5 mol/L gasto para
neutralizar 100,0 mL desse vinagre?
a)
b)
c)
d)
e)
1,0
0,5
0,1
0,2
0,25
9. A curva de titulação do hidróxido de amônio (NH4OH) com ácido clorídrico (HCl) é
mostrada ao lado:
No ponto estequiométrico, ocorre a reação descrita pela seguinte equação:
NH 4 OH(aq) HCl(aq) NH 4 Cl(aq) H 2 O(l)
Baseando-se
nessas
informações,
o
ponto
estequiométrico
CORRETAMENTE identificado na curva de titulação pelo ponto:
a)
b)
c)
d)
está
IV.
II.
III.
I.
10. Na reação de neutralização de 40 mL de solução 1,5 mol L –1 de hidróxido de sódio
com 60 mL de solução 1,0 mol L–1 de ácido clorídrico, é CORRETO afirmar que a
concentração em quantidade de matéria (mol L–1) de Na+ nos 100 mL resultantes da
mistura das soluções é igual a:
a)
b)
c)
d)
e)
0,2
0,4
0,6
0,8
1,2
11. O vinagre comercial contém ácido acético (CH3COOH). Na titulação de 6,0 mL de vinagre comercial com
densidade 1,01 g mL–1, gastaram-se 10,0 mL de uma solução 0,40 mol L–1 de hidróxido de sódio (NaOH). Qual é
a porcentagem de ácido acético contido no vinagre analisado? (Dados: C = 12, H = 1 e O = 16). Anote o inteiro
mais próximo.
12. Numa titulação ácido-base de 15,0 mL de ácido sulfúrico (H 2SO4) foram gastos 22,5 mL de solução de NaOH
0,2 mol/L. Então, a concentração molar de ácido da solução titulada será de
a)
b)
c)
d)
e)
0,15 mol/L.
0,20 mol/L.
0,30 mol/L.
0,60 mol/L.
1,50 mol/L.
13. Titulação é a operação que consiste em juntar lentamente uma solução a outra até o
término da reação entre seus solutos, com a finalidade de determinar a concentração
de uma das soluções a partir da concentração, já conhecida, da outra solução.
Observe a figura ao lado:
Considerando que foram gastos 100 mL de HNO3 para neutralizar 0,2L de KOH, a
concentração da solução de KOH, nessa análise, é:
a)
b)
c)
d)
e)
0,50 mol/L
0,05 mol/L
0,10 mol/L
0,03 mol/L
0,02 mol/L
14. Dois equipamentos de laboratórios comumente utilizados em titulações são:
a)
b)
c)
d)
e)
funil de separação e bureta
bureta e erlenmeyer
balão de fundo redondo e condensador
balão volumétrico e cadinho
pipeta e mufla