AMANDA BRAGA DE FIGUEIREDO
Leishmania amazonensis prejudica resposta de
células dendríticas via inibição da expressão de
CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A2B
Ouro Preto
2012
UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Leishmania amazonensis prejudica resposta de
células dendríticas via inibição da expressão de
CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A2B
AUTORA: AMANDA BRAGA DE FIGUEIREDO
ORIENTADOR: PROF. DR. LUÍS CARLOS CROCCO AFONSO
Dissertação apresentada ao Programa de PósGraduação em Ciências Biológicas do Núcleo de
Pesquisas
em
Ciências
Biológicas
da
Universidade Federal de Ouro Preto, como parte
integrante dos requisitos para a obtenção do título
de Mestre em Ciências Biológicas, área de
concentração: Imunobiologia de Protozoários.
Ouro Preto
2012
F475l
Figueiredo, Amanda Braga de.
Leishmania amazonensis prejudica a resposta de células dendríticas
via inibição da expressão de CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A2B : [manuscrito] / Amanda Braga de
Figueiredo. - 2012.
xiv, 101f. , il.
Orientador: Prof. Prof. Dr. Luís Carlos Crocco Afonso.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto.
Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências
Biológicas.
Área de concentração: Imunobiologia de Protozoários
1.Leishmaniose amazonensis - Teses. I. Universidade Federal de Ouro
Preto. II. Título.
CDU: 616.993.161
Catalogação: [email protected]
Trabalho
desenvolvido
no
Laboratório
de
Imunoparasitologia do Núcleo de Pesquisas em
Ciências Biológicas da Universidade Federal de Ouro
Preto, sob a orientação do Prof. Dr. Luís Carlos Crocco
Afonso, com auxílio financeiro da Fundação de
Amparo à Pesquisa do Estado de Minas Gerais
(FAPEMIG), Coordenação de Aperfeiçoamento de
Pessoal de Nível Superior (CAPES) e Conselho
Nacional de Desenvolvimento Científico e Tecnológico
(CNPq).
iii
“We do need time to think. We do need time to digest. We do need time to
misunderstand each other, especially when fostering lost dialogue
between humanities and natural sciences. We cannot continuously tell
you what our science means; what it will be good for; because we simply
don’t know yet. Science needs time.”
(The Slow Science Manifesto)
iv
Agradecimentos
AGRADECIMENTOS
Aos meus pais, que eu amo tanto, meus grandes exemplos de vida, pelo apoio e incentivo
incondicionais e por sempre torcerem por minhas conquistas. Dedico a eles este trabalho.
Aos meus irmãos pela força e às minhas sobrinhas por sempre me trazerem alegria.
Ao professor Luís Carlos, meu querido chefe, exemplo de caráter e profissionalismo, um
dos grandes responsáveis pelo prazer que sinto com a ciência. Agradeço pela amizade,
oportunidade, confiança, paciência e dedicada orientação. Seus ensinamentos, que vão
muito além de como realizar bem um experimento ou escrever bem uma dissertação,
jamais serão esquecidos.
Aos companheiros do Laboratório de Imunoparasitologia por tornarem agradáveis as horas
de trabalho. Ao Leandro e ao Marcorélio pelo apoio técnico. Aos colegas e ex-colegas de
bancada, pela ajuda na realização de grande parte dos experimentos. À Míriam e à Priscila,
pelo suporte no dia-a-dia. Ao Eduardo, pelo treinamento e disponibilidade. Em especial,
aos amigos Tiago, Pauline e Rodrigo, inseparáveis no trabalho e na diversão, e parceiros de
grandes momentos.
Aos meus amigos, em especial Aline, Daniella, Darília e Elienay, por perdoarem meus
momentos de ausência, por gentilmente ouvirem nas horas de estresse e desabafo, pelas
mensagens de apoio e, principalmente, pelos incríveis momentos de descontração.
Aos professores Milton de Oliveira e Fátima Dias (UFG) pelo auxílio com a diferenciação
de células dendríticas, Leda Quercia Vieira (UFMG) por gentilmente ceder o corante
PKH26 e o anticorpo anti-CD40, tão importantes para que essa história fosse assim
contada, Ricardo Gonçalves (UFMG) pela ajuda com a microscopia de fluorescência e
com a citometria de fluxo e pelas sugestões, e José Roberto Meyer Fernandes (UFRJ) pela
contribuição com os experimentos de dosagem da atividade ectonucleotidásica.
À CAPES, à FAPEMIG e ao CNPq pelo financiamento.
E enfim, agradeço a todos os colegas, professores e funcionários do NUPEB, que, direta ou
indiretamente, contribuíram para a conclusão deste trabalho.
v
Resumo
RESUMO
Infecções por Leishmania podem resultar num amplo espectro de manifestações
clínicas, e o resultado da doença é determinado pela espécie do parasito e a resposta imune
do hospedeiro. Células dendríticas desempenham um papel essencial na modulação da
resposta imune, incluindo durante a infecção por Leishmania. O ATP extracelular exibe
propriedades pró-inflamatórias, enquanto a adenosina é um importante mediador antiinflamatório. Baseados nessas observações, nosso objetivo foi investigar os efeitos da
infecção por Leishmania na resposta de células dendríticas e a participação da sinalização
purinérgica nesse processo. Células dendríticas derivadas de medula óssea de
camundongos C57BL/6J foram infectadas com promastigotas metacíclicas de L.
amazonensis, L. braziliensis ou L. major marcadas com CFSE (numa proporção de 3
parasitos por célula dendrítica). Células infectadas reduziram a expressão de MHCII e
CD86, independentemente da espécie de parasito utilizada. A expressão de CD40 foi
significativamente maior em células dendríticas infectadas com L. braziliensis ou L. major,
quando comparadas a células dendríticas não infectadas. Por outro lado, a expressão de
CD40 não foi alterada em células dendríticas infectadas com L. amazonensis, e estas
células apresentaram uma capacidade reduzida de induzir a proliferação de linfócitos T,
durante a reação mista de leucócitos e o ensaio de proliferação antígeno-específica. Para
tentar descrever os mecanismos envolvidos nesses processos, inicialmente analisamos a
produção de IL-10 em sobrenadantes de cultura por ELISA e não encontramos diferenças
entre culturas controles e culturas de células dendríticas infectadas. O bloqueio do receptor
de IL-10 pelo anticorpo 1B1.3a restaurou parcialmente a expressão de MHCII e CD86 em
células dendríticas infectadas com L. braziliensis ou L. major, mas não em células
dendríticas infectadas com L. amazonensis. A co-expressão das ectonucleotidases CD39 e
CD73 e a atividade enzimática destas enzimas foram significativamente aumentadas em
células infectadas e a inibição da hidrólise do ATP extracelular por suramina aumentou a
expressão de MHCII e CD86 nestas células, independentemente da espécie de parasito
utilizada. Curiosamente, a presença de MRS1754, um antagonista altamente seletivo do
receptor de adenosina A2B, no momento da infecção, aumentou a expressão de MHCII,
CD86 e CD40 somente em células dendríticas infectadas com L. amazonensis, células com
expressão diferenciada desse receptor, e recuperou a capacidade de células dendríticas de
induzirem a proliferação de linfócitos T. Concluindo, diferentes espécies de Leishmania
utilizam mecanismos diferentes para evadir a resposta imune, e propomos que a atividade
vi
Resumo
ectonucleotidásica e a ativação do receptor A2B de células dendríticas podem ser utilizadas
por L. amazonensis para esse fim.
Palavras-chave: Células dendríticas. Leishmania amazonensis. CD40. Ectonucleotidases.
Receptores de adenosina.
vii
Abstract
ABSTRACT
Leishmania amazonensis impairs dendritic cells response via inhibition of CD40
expression mediated by ectonucleotidases and activation of A2B adenosine receptor
Leishmania infections can result in a wide spectrum of clinical manifestations, and
the outcome of disease is determined by parasite species and the host immune response.
Dendritic cells play an essential role in the modulation of immune response including
during Leishmania infection. Extracellular-ATP exhibits pro-inflammatory properties
whereas adenosine is an important anti-inflammatory mediator. Based on these
assumptions, our objective was to investigate the effects of Leishmania infection on
dendritic cells response and the participation of purinergic signaling in this process.
C57BL/6J bone marrow dendritic cells were infected with CFSE-labeled metacyclic
promastigotes of L. amazonensis, L. braziliensis or L. major (1:3 cell to parasite ratio).
Infected cells decreased the expression of MHCII and CD86, independent of the parasite
specie. The expression of CD40 was significantly increased in dendritic cells infected with
L. braziliensis or L. major, when compared with uninfected dendritic cells. On the other
hand, CD40 expression was not changed in L. amazonensis infected dendritic cells, and
these cells presented a reduced ability to induce T cell proliferation, in mixed leukocyte
reaction and antigen-specific proliferation assays. To describe the mechanisms involved in
this process, we initially analyzed the production of IL-10 in culture supernatants by
ELISA and found no differences between control and infected dendritic cells cultures.
Blockade of IL-10 receptor by 1B1.3a antibody partially restored the MHCII and CD86
expression in L. braziliensis or L. major infected dendritic cells, but not in L. amazonensis
infected dendritic cells. Co-expression of ectonucleotidases CD39 and CD73 and
enzymatic activity of these enzymes were significantly increased in infected cells and the
inhibition of extracellular ATP hydrolysis by suramin increased the expression of MHCII
and CD86, regardless of parasite specie used. Interestingly, the presence of MRS1754, a
highly selective A2B adenosine receptor antagonist, at the time of infection, increased the
expression of MHCII and CD86 and CD40 only in L. amazonensis infected dendritic cells,
cells with differentiated expression of this receptor, and recovered dendritic cells ability to
induce T cell proliferation. In conclusion, different species of Leishmania use different
mechanisms to evade the immune response, and we propose that ectonucleotidases activity
and activation of A2B receptor of dendritic cells may be used by L. amazonensis to this aim.
viii
Abstract
Keywords: Dendritic cells. Leishmania amazonensis. CD40. Ectonucleotidases. Adenosine
receptors.
ix
Índice
ÍNDICE
Agradecimentos ............................................................................................................
v
Resumo ..........................................................................................................................
vi
Abstract .........................................................................................................................
viii
Lista de figuras .............................................................................................................
xii
Lista de siglas e abreviaturas ......................................................................................
xiii
1. Introdução .................................................................................................................
15
1.1. Leishmania e leishmanioses ...........................................................................
16
1.2. Resposta imune frente à Leishmania, células hospedeiras e evasão da
resposta pelo parasito .....................................................................................
18
1.3. Células dendríticas .........................................................................................
21
1.4. Influência da infecção por Leishmania na resposta de células dendríticas ....
24
1.5. ATP, adenosina e resposta inflamatória .........................................................
25
1.6. Sinalização purinérgica ..................................................................................
27
1.7. ATP e adenosina na resposta de células dendríticas ......................................
30
1.8. Justificativa ....................................................................................................
30
2. Objetivos ....................................................................................................................
31
2.1. Objetivo geral .................................................................................................
32
2.2. Objetivos específicos .....................................................................................
32
3. Material e métodos ...................................................................................................
33
3.1. Animais e parasitos ........................................................................................
34
3.2. Obtenção de células dendríticas derivadas de medula óssea .........................
35
3.3. Infecção de células dendríticas in vitro ..........................................................
36
3.4. Avaliação da viabilidade celular ....................................................................
37
3.5. Determinação da produção de IL-10 ..............................................................
37
3.6. Dosagem da atividade ectonucleotidásica .....................................................
38
3.7. Microscopia de fluorescência ........................................................................
38
3.8. Ensaio de proliferação antígeno-específica ...................................................
39
3.9. Reação mista de leucócitos (MLR) ..............................................................
40
3.10. Citometria de fluxo ......................................................................................
40
3.11. Análise estatística .........................................................................................
31
4. Resultados .................................................................................................................
42
x
Índice
4.1. Leishmania infecta células dendríticas sem alterar a viabilidade celular ......
43
4.2. Promastigotas metacíclicas de Leishmania alteram a expressão de
marcadores de superfície em células dendríticas ...........................................
44
4.3. Inibição da ativação de células dendríticas por L. amazonensis é
independente de IL-10 e a inibição por L. braziliensis ou L. major é
parcialmente dependente dessa citocina ........................................................
47
4.4. Suramina altera o estado de ativação de células dendríticas infectadas por
ação na célula e não no parasito .....................................................................
49
4.5. Infecção por Leishmania aumenta a expressão e a atividade enzimática de
ectonucleotidases em células dendríticas .......................................................
50
4.6. Infecção por L. amazonensis favorece a expressão dos receptores de
adenosina A2A e A2B .......................................................................................
54
4.7. L. amazonensis prejudica funções de células dendríticas por mecanismos
dependentes da hidrólise de ATP e da ativação do receptor de adenosina
A2B .................................................................................................................
55
5. Sumário dos resultados ............................................................................................
61
6. Discussão ...................................................................................................................
63
7. Conclusão ..................................................................................................................
72
8. Referências bibliográficas ........................................................................................
74
9. Anexos ........................................................................................................................
87
9.1. Protocolo de aprovação pelo Comitê de Ética ...............................................
88
9.2. Cópia do artigo aprovado para publicação no periódico European Journal
of Immunology ..............................................................................................
89
xi
Lista de figuras
LISTA DE FIGURAS
Figura 1. Ciclo de vida do parasito Leishmania .......................................................... 17
Figura 2. Efeitos do ATP e da adenosina sobre células do sistema imune .................
26
Figura 3. Influência da sinalização purinérgica sobre a resposta imune ..................... 29
Figura 4. Marcação de parasitos com CFSE ...............................................................
35
Figura 5. Caracterização da população de células dendríticas .................................... 36
Figura 6. Infecção de células dendríticas com promastigotas metacíclicas de L.
amazonensis, L. braziliensis ou L. major ................................................................
43
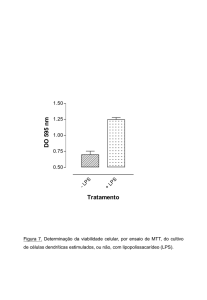
Figura 7. Viabilidade de células dendríticas infectadas com Leishmania ..................
44
Figura 8. Infecção por Leishmania prejudica a ativação de células dendríticas .........
46
Figura 9. Inibição da ativação de células dendríticas por Leishmania é
independente da produção de IL-10 ........................................................................
47
Figura 10. Inibição da ativação de células dendríticas por L. braziliensis e L. major
é parcialmente dependente do receptor de IL-10 ....................................................
48
Figura 11. Suramina afeta o estado de ativação de células dendríticas infectadas
com L. amazonensis por ação na célula e não no parasito ......................................
49
Figura 12. Infecção por Leishmania aumenta a expressão de ectonucleotidases em
células dendríticas ...................................................................................................
51
Figura 13. Infecção por Leishmania aumenta a atividade de ectonucleotidases em
células dendríticas ...................................................................................................
53
Figura 14. L. amazonensis estimula a expressão dos receptores A2A e A2B em
células dendríticas ...................................................................................................
55
Figura 15. L. amazonensis prejudica ativação de células dendríticas via receptor
A2B ...........................................................................................................................
Figura 16. Leishmania
prejudica
ativação
de
células
dendríticas
56
via
ectonucleotidases e/ou receptor A2B ........................................................................
58
Figura 17. L. amazonensis prejudica a proliferação linfócitos por mecanismos
dependentes da hidrólise de ATP e da ativação do receptor A2B ............................
60
Figura 18. Mecanismos utilizados por L. amazonensis, L. braziliensis e L. major
para inibir funções de células dendríticas e evadir a resposta imune ......................
70
xii
Lista de siglas e abreviaturas
LISTA DE SIGLAS E ABREVIATURAS
5’-nucleotidase: fosfohidrolase de nucleosídeos 5’-monofosfatados
ADOR: receptor de adenosina
ADP: difosfato de adenosina
AMP: monofosfato de adenosina
AMPc: monofosfato de adenosina cíclico
ANOVA: análise de variância
APC: aloficocianina
ATP: trifosfato de adenosina
BSA: albumina sérica bovina
CFSE: éster de succinimidil-carboxifluoresceína
Cols: colaboradores
DC: célula dendrítica
EDTA: ácido etilenodiaminotetra acético
ELISA: ensaio imunoenzimático
ENTPDase: ectodifosfohidrolase de nucleosídeos trifosfatados
Epac: proteína de troca diretamente ativada por AMPc
ERK: cinase regulada por sinal extracelular
FITC: isotiocianato de fluoresceína
GM-CSF: fator estimulador de colônias de granulócitos e monócitos
IFN-γ: interferon- γ
IL: interleucina
IP3: inositol trifosfato
JNK: cinase c-Jun N-terminal
La: Leishmania amazonensis
Lb: Leishmania braziliensis
Lm: Leishmania major
LPS: lipopolissacarídeo
MAPK: proteína cinase ativada por mitógeno
MEK: cinase de proteína cinase ativada por mitógeno
MHC(I ou II): complexo principal de histocompatibidade (de classe I ou II)
MLR: reação mista de leucócitos
xiii
Lista de siglas e abreviaturas
MRS1754: (N-(4-cianofenil)-2-[4-(2,3,6,7-tetrahidro-2,6-dioxo-1,3-dipropil-1H-purina-8il)fenoxi]-acetamida)
NF-κB: fator de transcrição nuclear κB
PBS: salina tamponada com fosfato
PE: ficoeritrina
PE-Cy7: ficoeritrina cianina 7
Pi: fosfato inorgânico
PI3K: fosfatidilinositol-3-cinase
PIP2: fosfatidilinositol bifosfato
PKA: proteína cinase A
PKB/Akt: proteína cinase B
PKC: proteína cinase C
ROI: intermediário reativo de oxigênio
SFB: soro fetal bovino
TGF-β: fator de transformação do crescimento- β
TLR: receptor do tipo Toll
TNF-α: fator de necrose tumoral- α
ZM241385: (4-(2-[7-amino-2-(2-furil)[1,2,4]triazol[2,3-α][1,3,5]triazina-5ilamino]etil)fenol)
α,β-MAD: α,β-metileno adenosina difosfato
xiv
1. INTRODUÇÃO
1. Introdução
1. INTRODUÇÃO
1.1. Leishmania e leishmanioses
Leishmaniose é um grupo de doenças causadas por protozoários do gênero
Leishmania e transmitida entre os hospedeiros mamíferos por insetos flebotomíneos.
Possui um amplo espectro de manifestações clínicas, e o resultado da infecção será
determinado não só pela espécie do parasito, mas também pela resposta imune montada
pelo hospedeiro (Awasthi e cols., 2004).
A leishmaniose visceral representa a forma mais grave da doença. É causada pelas
espécies L. donovani e L. infantum e caracterizada pelo acometimento de várias vísceras,
principalmente baço e fígado, e medula óssea, podendo levar à caquexia grave e à morte
(Herwaldt, 1999). A leishmaniose tegumentar é subdividida em quatro grupos, dependendo
dos tipos de manifestações clínicas: (1) leishmaniose cutânea, provocada principalmente
por L. braziliensis e L. guyanensis, no Novo Mundo, e L. tropica, L. major (forma
zoonótica) e L. aethiopica, no Velho Mundo, caracterizada normalmente por úlceras no
local da picada do inseto e com resolução espontânea; (2) leishmaniose cutânea
disseminada, onde se encontram várias lesões não contíguas formadas pela disseminação
do parasito por vias hematogênica ou linfática, provocada principalmente por L.
braziliensis; (3) leishmaniose mucocutânea, causada normalmente por L. braziliensis e
caracterizada por uma resposta imune exacerbada e ineficaz, com acometimento das
mucosas, principalmente da nasofaringe, onde são encontradas lesões destrutivas; e (4)
leishmaniose difusa, associada a lesões difusas não ulceradas, ricas em parasitos, e a um
processo anérgico, onde a resposta de linfócitos T é ausente ou muito prejudicada, tendo
como principais agentes etiológicos L. amazonensis e L. pifanoi (Herwaldt, 1999).
O parasito apresenta um ciclo de vida heteroxênico, com um estágio de
desenvolvimento em mamíferos, que é intracelular, e um estágio extracelular em
flebotomíneos dos gêneros Phlebotomus (Velho Mundo) e Lutzomyia (Novo Mundo)
(Figura 1). A infecção é iniciada quando fêmeas de flebotomíneos, durante seu repasto
sanguíneo, ingerem macrófagos infectados com amastigotas. Inicialmente, amastigotas se
transformam em promastigotas procíclicas, lentas e com flagelo curto. Esses parasitos
passam por mais algumas etapas de diferenciação e multiplicação e, finalmente, por um
processo denominado metaciclogênese, se transformam em formas promastigotas
metacíclicas infecciosas, com alta motilidade, corpo celular curto e flagelo longo, sendo
16
1. Introdução
altamente adaptadas para a transmissão ao hospedeiro mamífero. Durante um novo repasto
sanguíneo, um pequeno número de formas infecciosas é inoculado na pele do hospedeiro
vertebrado. Essas formas são eficientemente opsonizadas por componentes do soro e
internalizadas por macrófagos, suas principais células hospedeiras, onde residem em
fagolisossomos e se transformam em formas amastigotas replicativas. O ciclo se reinicia
quando esses macrófagos são ingeridos durante o repasto sanguíneo de flebotomíneos
(Kamhawi, 2006; Sacks & Noben-Trauth, 2002).
Figura 1. Ciclo de vida do parasito Leishmania. Parasitos do gênero Leishmania são
transmitidos por fêmeas de flebotomíneos, que durante seu repasto sanguíneo no hospedeiro
mamífero, ingerem macrófagos infectados com amastigotas. No intestino desses insetos, os
protozoários passam por diversas etapas de diferenciação, originando, por fim, formas
promastigotas metacíclicas, que são as formas infecciosas para o hospedeiro vertebrado.
Metacíclicas são transmitidas aos mamíferos durante novo repasto sanguíneo do flebotomíneo
infectado, infectam células, principalmente macrófagos, e se transformam novamente em
formas amastigotas replicativas, que podem infectar novas células ou outro inseto vetor,
reiniciando o ciclo. ATP pode ser liberado para o meio extracelular em situações de injúria,
como durante a picada do flebotomíneo e o rompimento de macrófagos contendo amastigotas
(Adaptada de Sacks & Noben-Trauth, 2002).
Parasitos do gênero Leishmania são incapazes de realizar a síntese de novo de
nucleotídeos, sendo dependentes da via de salvação para obtenção dessas substâncias,
essenciais para o seu desenvolvimento. Como forma de compensação, eles possuem a
enzima ectodifosfohidrolase de nucleosídeos trifosfatados (ENTPDase) e a enzima
17
1. Introdução
fosfohidrolase de nucleosídeos 5’-monofosfatados (5’-nucleotidase) (Asai e cols., 1995;
Berredo-Pinho e cols., 2001; Coimbra e cols., 2002; Maioli e cols., 2004; Marques-daSilva e cols., 2008; Meyer-Fernandes e cols., 1997). Essas enzimas são capazes de
hidrolisar o ATP extracelular, acumulado em situações de injúria celular (por exemplo,
durante a picada do flebotomíneo e durante o rompimento de macrófagos contendo
amastigotas de Leishmania, Figura 1), a adenosina, que posteriormente poderá ser utilizada
pelas vias de salvação ou se ligar a receptores específicos. Dados já publicados de nosso
laboratório também nos permitem fazer uma relação entre o grau de virulência e a
atividade ectonucleotidásica de parasitos do gênero Leishmania (Maioli e cols., 2004;
Marques-da-Silva e cols., 2008). Estudos em andamento ainda apontam a importância da
expressão dessas enzimas em parasitos sobre a modulação de macrófagos pela ativação de
algum receptor específico para essa enzima.
Por possuírem graus de virulência variáveis (Marques-da-Silva e cols., 2008),
decidimos trabalhar com três espécies de Leishmania, a saber, L. amazonensis, L.
braziliensis e L. major. L. amazonensis destaca-se de outras espécies por causar lesões
crônicas não-resolutivas em camundongos genuinamente resistentes a outras espécies,
como L. braziliensis e L. major (Afonso & Scott, 1993; Maioli e cols., 2004; Marques-daSilva e cols., 2008), e em seres humanos, L. amazonensis é causadora da leishmaniose
cutânea difusa, condição caracterizada por uma falta de resposta de células T específicas
contra o parasito (Barral e cols., 1995).
1.2. Resposta imune frente à Leishmania, células hospedeiras e evasão da resposta
pelo parasito
Leishmaniose é um ótimo exemplo de interação complexa entre parasito e
hospedeiro. A resposta imune frente à Leishmania será dependente da espécie do parasito e
da genética do hospedeiro. Embora os macrófagos sejam considerados as principais células
hospedeiras, permitindo a sobrevivência e a multiplicação de amastigotas de Leishmania
(quando os mecanismos leishmanicidas são incompetentes), neutrófilos e células
dendríticas também são infectados e desempenham um papel importante na infecção
(Awasthi e cols., 2004; Brandonisio e cols., 2004; Peters e cols., 2008).
Neutrófilos são as primeiras células a migrarem para os locais de infecção (Peters e
cols., 2008), sendo capazes de fagocitar os parasitos e destruí-los pela ação de enzimas
proteolíticas estocadas em grânulos e de intermediários reativos de oxigênio produzidos
18
1. Introdução
(ROIs) (Awasthi e cols., 2004). Neutrófilos ainda produzem IL-8, que tem a função de
atrair outros neutrófilos para o local, e MIP-1α (CCL3) e MIP-1β (CCL4), que têm a
função de atrair monócitos / macrófagos (Awasthi e cols., 2004). Macrófagos ingerem
neutrófilos infectados pela identificação de fosfatidilserina em células apoptóticas, e a
ingestão de células apoptóticas não ativa funções microbicidas em macrófagos,
favorecendo a permanência do parasito no hospedeiro (Laskay e cols., 2003). Nesse
momento, neutrófilos apresentam funções contraditórias, ora ajudando e ora prejudicando
no combate a infecções por Leishmania (Afonso e cols., 2008; John & Hunter, 2008;
Laskay e cols., 2003; Novais e cols., 2009; Peters e cols., 2008).
Macrófagos, as principais células hospedeiras desses protozoários, representam o
principal mecanismo de eliminação do parasito, pela produção de ROIs e óxido nítrico.
Macrófagos são ativados pela citocina IFN-γ e, a partir de então, tornam-se capazes de
produzir as citocinas inflamatórias TNF-α, IL-1 e IL-6, além de IL-12 (Awasthi e cols.,
2004). IL-12 é um adjuvante efetivo e um pré-requisito para a montagem de uma resposta
Th1 protetora (Afonso e cols., 1994). Células dendríticas também são importante fonte de
IL-12 (Awasthi e cols., 2004).
A resposta de linfócitos específicos para Leishmania é essencial para o controle da
infecção por esse parasito. Linfócitos T CD4+ se diferenciam em células secretoras de
citocinas que exibem fenótipos diferentes dependendo da espécie do parasito e das
características genéticas do hospedeiro. Células do tipo Th1 secretam IFN-γ e/ou TNF-α
que contribuem para a eliminação do parasito, principalmente pela ativação de macrófagos.
Células do tipo Th2, diferenciadas na ausência de IL-12, secretam grandes quantidades de
IL-4, IL-5 e IL-13, que inibem a montagem de uma resposta protetora contra patógenos
intracelulares. Linfócitos T CD8+ também auxiliam no combate aos parasitos do gênero
Leishmania por serem importante fonte de IFN- γ (Mougneau e cols., 2011). A associação
entre as respostas Th1 e Th2 à resistência e susceptibilidade de camundongos à infecção
por Leishmania foi bem descrita para a espécie L. major (Sacks & Noben-Trauth, 2002).
Essa mesma associação não foi verdadeira para L. amazonensis, que apesar de ativarem
células Th1, desenvolvem infecções não controladas pelo hospedeiro (Afonso & Scott,
1993). Durante a resposta à Leishmania, tem-se ainda a produção das citocinas IL-10 e
TGF-β por diferentes tipos celulares, como macrófagos, células dendríticas e células T
reguladoras, sendo essas as principais citocinas imunomoduladoras e supressoras da
resposta protetora contra esse parasito (Awasthi e cols., 2004).
19
1. Introdução
Assim como são capazes de ativar diversos mecanismos microbicidas das respostas
inata e adaptativa, protozoários do gênero Leishmania desenvolveram diversos
mecanismos de evasão para prevenir o desenvolvimento de uma imunidade esterilizante
(Olivier e cols., 2005). Inicialmente, promastigotas metacíclicas escapam da lise mediada
pelo complemento com o auxílio das moléculas de superfície LPG e gp63; a primeira inibe
a formação do complexo de ataque à membrana, e a segunda cliva fragmentos C3b em suas
formas inativas C3bi, que opsonizam os parasitos para serem reconhecidos pelos receptores
de complemento CR1 e CR3 e facilitam a fagocitose (Sacks & Sher, 2002). Além disso, a
molécula de LPG atrasa a fusão do fagossomo ao lisossomo e a proteína gp63 inibe a
atividade de hidrolases lisossomais, prevenindo a destruição dos parasitos (Zambrano-Villa
e cols., 2002).
A resposta protetora mediada por macrófagos e células dendríticas é dependente da
ativação de diversas vias de sinalização iniciadas pela ativação de um receptor presente na
célula hospedeira, e essas vias de sinalização atuam por um balanço entre estímulos
negativos e positivos. Leishmania, assim como outros patógenos intracelulares, são
capazes de distorcer esse balanço entre influências positivas e negativas e prejudicar a
montagem de uma resposta protetora por interferirem sobre as vias de sinalização
dependentes principalmente de Ca2+, fator de transcrição nuclear κB (NF-κB), cinase c-Jun
N-terminal (JNK), proteína cinase C (PKC) e proteínas cinases ativadas por mitógeno
(MAPK) (Olivier e cols., 2005). Como consequências desses processos, teremos, por
exemplo, a inibição da produção de moléculas de MHC e co-estimuladores, prejudicando a
apresentação de antígenos, inibição da produção de IL-12 e do desenvolvimento da
resposta Th1, estimulação da produção das citocinas imunossupressoras IL-10 e TGF-β e
consequente indução da resposta de células T reguladoras (Mougneau e cols., 2011; Olivier
e cols., 2005; Sacks & Sher, 2002; Zambrano-Villa e cols., 2002).
Nos últimos anos, tem-se avaliado a importância da expressão de ectonucleotidases
na superfície de parasitos do gênero Leishmania como um mecanismo de escape da
resposta imune, já que essas enzimas levarão à hidrólise do ATP, com conhecidas
propriedades inflamatórias, até adenosina, uma importante substância anti-inflamatória
(Berredo-Pinho e cols., 2001; Maioli e cols., 2004; Marques-da-Silva e cols., 2008). Os
efeitos do ATP e da adenosina na resposta imune também serão tratados adiante.
Durante o repasto sanguíneo, a saliva do flebotomíneo também é inoculada e, além
de facilitar a alimentação do inseto, exerce papel importante na interação do parasito com o
hospedeiro. Uma das substâncias encontradas na saliva é o maxadilan, que possui
20
1. Introdução
significativa propriedade vasodilatadora (Kamhawi, 2000), além de propriedades
imunomoduladoras, pelo aumento da síntese de IL-10, IL-6 e TGF-β, e diminuição da
síntese de IL-12, TNF-α, IFN-γ e NO (Brodie e cols., 2007; Rogers & Titus, 2003; Soares
e cols., 1998; Wheat e cols., 2008). Saliva de flebotomíneos, além de induzir a produção de
IL-10 por células dendríticas, estimula a produção de prostaglandinas E2, que atua sobre a
própria célula dendrítica, gerando efeitos anti-inflamatórios (Carregaro e cols., 2008). A
saliva contém, ainda, ectonucleotidases capazes de produzir ADP, AMP e adenosina; os
dois últimos também estão naturalmente presentes na saliva. O ADP possui propriedade
anti-agregação plaquetária. AMP e adenosina inibem a agregação plaquetária, são
vasodilatadores e possuem propriedades imunomoduladoras (Ribeiro e cols., 1999).
1.3. Células dendríticas
Células dendríticas são essenciais para a resposta imune inata e para a conexão
entre as respostas inata e adquirida, inclusive durante a infecção por Leishmania
(Brandonisio e cols., 2004). Essas células foram descritas pela primeira vez na década de
70, por Steinman e colaboradores (Steinman & Cohn, 1973; Steinman & Cohn, 1974;
Steinman e cols., 1974). Morfologicamente, foram destacadas das outras células do baço
por serem células grandes, com citoplasma arranjado em pseudópodos que variam em
comprimento, largura, forma e número, resultando numa variedade de formas celulares,
que vão de formas alongadas bibolares a células elaboradas e estreladas. Essas células
parecem estender e retrair em resposta a delicados processos celulares. O citoplasma
contém muitos grânulos e não há evidência morfológica de atividade endocítica ativa. O
núcleo é muito grande e com uma espessa membrana (Steinman & Cohn, 1973). No fim
dessa mesma década, essas células assumiram o papel de potentes estimuladoras da reação
mista de leucócitos (Steinman & Witmer, 1978).
Já foram descritas um grande número de subpopulações de células dendríticas,
localizadas tanto nos tecidos linfoides como nos tecidos não linfoides, e que podem ser
distinguidas pela expressão de marcadores de superfície e por propriedades funcionais
(Sabatte e cols., 2007). Embora sejam descritas populações distintas, há evidências que as
funções de células dendríticas sejam alteradas simplesmente pelo ambiente de citocinas e
outras substâncias, confirmando a alta plasticidade dessas células (Banchereau e cols.,
2000). Células dendríticas se desenvolvem a partir de duas vias distintas: mieloide e
linfoide. Células de origem mieloide e linfoide se diferenciam em fenótipo, localização e
21
1. Introdução
função. Ambas expressam altos níveis da integrina CD11c, da molécula apresentadora de
antígeno MHCII, e dos co-estimuladores CD86 e CD40; CD8α é um marcador específico
de células linfoides. Em camundongos, a relação entre células de Langerhans (população
de células dendríticas presentes na pele) e células dendríticas linfoides e mieloides não é
completamente compreendida, mas sabe-se que células de Langerhans compartilham a
maioria de seus marcadores com células dendríticas mieloides (Banchereau e cols., 2000).
Essas células são particularmente frequentes em tecidos não linfoides que formam
uma interface com o ambiente externo, onde funcionam como sentinelas, capturando
patógenos para serem levados aos tecidos linfoides (Granucci e cols., 2008). Embora essa
seja a via natural de resposta dessas células, um grande número de células dendríticas
presentes nos órgãos linfoides são derivadas de células do sangue e são consideradas
células residentes, e respondem a antígenos transferidos por células que migraram a partir
da periferia ou antígenos que chegaram a esses órgãos pelas vias linfática ou sanguínea,
sem serem carreados por células (Coquerelle & Moser, 2010; Reis e Sousa, 2006).
Células dendríticas interagem com micro-organismos através de receptores
codificados na linhagem germinativa, que podem ter funções além do reconhecimento e
captura de antígenos, como a associação a moléculas sinalizadoras e o direcionamento do
tráfego celular. Entre os vários tipos de receptores temos: receptores para porções Fc,
langerina (CD207), dectina-1,2, ligante de molécula de adesão intercelular não integrina
específica de células dendríticas (DC-SIGN ou CD209), imunoreceptor de células
dendríticas (DCIR), receptor imuno-ativador de células dendríticas (DCAR), receptor de
manose (MMR ou CD206), receptor de células dendríticas e epiteliais de 205 kDa (DEC205 ou CD205) e receptores para células mortas (Steinman & Hemmi, 2006). Células
dendríticas classicamente não possuem função microbicida, mas têm mecanismos únicos
para o processamento de antígenos e apresentação via MHC, uma vez que a proteólise de
antígenos é mais direcionada para a liberação de pequenos fragmentos que para a
destruição total, além dessas células serem capazes de aumentar a meia-vida do complexo
peptídeo-MHC exposto na membrana plasmática e sincronizar o processamento de
antígenos à produção de moléculas de MHC (Granucci e cols., 2008). Células dendríticas
apresentam antígenos extracelulares tanto via MHCII, que é a via clássica para a
apresentação desse tipo de antígeno e essencial para a estimulação de linfócitos T
auxiliares, quanto via MHCI, que é a via desenvolvida para a apresentação de antígenos
intracelulares. A característica de apresentar antígenos extracelulares via MHCI (conhecida
como apresentação cruzada) é exclusiva de células dendríticas e se inicia com a
22
1. Introdução
internalização de células infectadas ou tumorais; esse tipo de apresentação é essencial para
a ativação de linfócitos T citotóxicos contra vírus que não infectam células dendríticas e
contra células tumorais (Coquerelle & Moser, 2010).
Após o contato com micro-organismos ou outras substâncias infecciosas ou
inflamatórias, as células dendríticas iniciam o processo de maturação. Tal processo é
caracterizado pelo aumento da expressão de MHCII e dos co-estimuladores CD40, CD80,
CD86 e CD54, diminuição da capacidade fagocítica, aumento da secreção de citocinas, e
expressão de diferentes receptores de quimiocinas. Durante o processo de maturação, essas
células adquirem, ainda, a capacidade de migrar para as zonas de células T dos órgãos
linfoides, onde são capazes de apresentar os antígenos a células T naive e modular a
resposta das últimas (Banchereau e cols., 2000; Brandonisio e cols., 2004). Células
dendríticas imaturas residentes nos órgãos periféricos expressam vários receptores de
quimiocinas, dentre eles CCR1, CCR2 e CCR5. Após a ativação, há diminuição da
expressão dessas moléculas e é estimulada a expressão de CCR7, o receptor para as
quimiocinas CCL19 e CCL21, que guia a migração das células em questão para os órgãos
linfoides. Recentemente, tem sido mostrado que, além da quimiotaxia, o CCR7 controla a
cito-arquitetura, a sobrevivência, a velocidade de migração e a maturação de células
dendríticas (Sanchez-Sanchez e cols., 2006). CXCR4, o receptor para a quimiocina
CXCL12, também tem se mostrado importante para a migração de células dendríticas a
partir da pele para os linfonodos (Kabashima e cols., 2007). Essas alterações na expressão
de receptores de quimiocinas ocorrem, principalmente, por intermédio das citocinas IL-1β
e TNF-α, produzidas pelas próprias células dendríticas e por outras células presentes na
periferia. Outros eventos são também associados ao processo de migração, dentre eles: a
produção de IL-12p40, a ação da colagenase de matriz metaloproteinase-9 e a atividade da
enzima CD38, uma glicoproteína que catalisa a conversão de NAD+ em cADP-ribose, um
mensageiro intracelular (Cumberbatch e cols., 2000; Sanchez-Sanchez e cols., 2006).
Células dendríticas são as únicas células capazes de induzir a resposta de células B
e T sem o uso de adjuvantes. Produzem uma ampla variedade de citocinas e conseguem
direcionar a resposta para praticamente qualquer população de célula T auxiliar, como Th1,
Th2 e Th17, que então serão responsáveis por estimularem os inúmeros mecanismos
efetores da imunidade adaptativa (Coquerelle & Moser, 2010).
Na ausência de sinais co-estimuladores, células dendríticas podem induzir a
tolerância em células T CD4+ ou T CD8+ e induzir deleção, anergia ou geração de células
T reguladoras, sendo essenciais na eliminação de linfócitos auto-reativos e na prevenção da
23
1. Introdução
auto-imunidade. Citocinas imunossupressoras, principalmente TGF-β e IL-10, produzidas
por células dendríticas, têm ação direta sobre o desenvolvimento, homeostase e/ou funções
de células T reguladoras e outros tipos celulares (Coquerelle & Moser, 2010). Existem,
ainda, células dendríticas que expressam co-estimuladores negativos, como PD-L1 e B7H1, mesmo na presença de co-estimuladores convencionais (CD80, CD86 e CD40) – e que
também são tolerogênicas –, e células que produzem citocinas inflamatórias (TNF-α, IL-1
e IL-12) e citocinas supressoras (IL-10 e TGF-β) simultaneamente – e que por serem
produtoras de citocinas são consideradas maduras. Sendo assim, o balanço entre os
diversos sinais de co-estimulação positiva e negativa, que muitas vezes se dá de forma
quantitativa e sutil e que altera durante a maturação / ativação de células dendríticas, deve
controlar as funções opostas dessas células. Resumindo, é um equívoco associar de forma
simplista células dendríticas imunogênicas e tolerogênicas a células maduras ou imaturas,
respectivamente (Coquerelle & Moser, 2010; Reis e Sousa, 2006).
1.4. Influência da infecção por Leishmania na resposta de células dendríticas
Muitos estudos têm avaliado a interação entre parasitos do gênero Leishmania e
células dendríticas, e os resultados dessa interação dependem, principalmente, da espécie
do parasito e da população de célula dendrítica utilizadas (Brandonisio e cols., 2004;
Soong, 2008). L. amazonensis é capaz de modular diversas funções de células dendríticas,
por alterarem a expressão dos marcadores MHCII, CD80 e CD86 e a produção das
citocinas IL-10 e IL-12 (Favali e cols., 2007; Prina e cols., 2004; Qi e cols., 2001; Vasquez
e cols., 2008; Xin e cols., 2008). L. major também é capaz de modular a resposta de células
dendríticas, sendo determinante no balanço entre respostas Th1 e Th2 em camundongos
resistentes ou susceptíveis à infecção por Leishmania (Suzue e cols., 2008). Além disso,
essa espécie estimula a expressão de MHCII, CD80, CD86 e CD40 e a produção de IL12p40 (Liu e cols., 2009) e interfere sobre a produção de quimiocinas, bem como a
expressão de receptores de quimiocinas, atuando sobre a capacidade migratória de células
dendríticas por diminuir a expressão de CCR5 e aumentar a expressão de CCR7
(Steigerwald & Moll, 2005). Infecção por L. braziliensis induz a ativação de células
dendríticas e a montagem de uma resposta imune protetora (Vargas-Inchaustegui e cols.,
2008), assim como mantém essas mesmas células com baixa expressão de marcadores de
ativação, mas capazes de produzir TNF-α (Carvalho e cols., 2008). Por fim, um estudo
com L. donovani mostrou que células dendríticas infectadas têm a expressão de CCR7
24
1. Introdução
prejudicada, o que pode contribuir para a imunossupressão e para a patogênese da
leishmaniose visceral (Ato e cols., 2002).
Embora muito se saiba sobre os efeitos da infecção por Leishmania na resposta de
células dendríticas, os mecanismos envolvidos ainda não estão completamente
estabelecidos.
1.5. ATP, adenosina e resposta inflamatória
Uma resposta imune adequada se dá pela interação entre mecanismos pró e antiinflamatórios, uma vez que o controle da inflamação previne um excesso de dano tecidual
(Sitkovsky & Ohta, 2005).
O ATP, quando liberado para o meio extracelular, por exemplo, em situações de
injúria, tem sido descrito como sinal de perigo, estimulando assim, uma resposta
inflamatória, caracterizada principalmente pela produção de IL-12 e TNF-α (La Sala e
cols., 2003). Este nucleotídeo estimula a adesão de neutrófilos ao endotélio vascular e
consequente migração para os locais de injúria, além de estimular a fagocitose e ativar os
mecanismos microbicidas dessas células (Bours e cols., 2006). O ATP extracelular também
desempenha um papel importante no recrutamento de monócitos e na produção de
imunomediadores por macrófagos, como citocinas (IL-1α, IL-1β, IL-6, IL-18 e TNF-α),
quimiocinas e eicosanóides, além de óxido nítrico e ROIs (Bours e cols., 2006). Essa
molécula ainda induz a maturação de células dendríticas para um perfil estimulador da
resposta Th1 (Bours e cols., 2006; La Sala e cols., 2003). A proliferação de linfócitos e
ativação de linfócitos T citotóxicos também é estimulada por ATP (Bours e cols., 2006).
As concentrações extracelulares de ATP e adenosina, produto do catabolismo do
ATP, são controladas pelas enzimas ENTPDase, que hidrolisa ATP até AMP, e 5’nucleotidase, que hidrolisa AMP até adenosina. Ambas enzimas estão presentes em
diversas populações celulares (Kumar & Sharma, 2009). A expressão das mesmas tem sido
apontada como responsável pela resposta imunossupressora de células T reguladoras e
células de Langerhans (Borsellino e cols., 2007; Deaglio e cols., 2007; Mizumoto e cols.,
2002).
A família de NTPDases compreende um grupo de 8 enzimas, dentre as quais 4 são
ancoradas na membrana celular e possuem o sítio catalítico voltado para a face extracelular
(NTPDase 1,2 3 e 8). A NTPDase 1, também conhecida como ENTPDase ou CD39,
hidrolisa ATP e ADP igualmente, e requer Ca2+ ou Mg2+ como cofatores. As formas não
25
1. Introdução
glicosiladas dessas enzimas possuem uma massa molecular predita de 55-60 kDa (Robson
e cols., 2006; Zimmermann, 2000). A enzima 5’-nucleotidase, também conhecida como
CD73, está presente na superfície celular ou em sua forma solúvel. É uma enzima com
massa molecular de 64-72 kDa e que apresenta o Zn2+ como cofator (Zimmermann, 2000).
A razão de hidrólise do ATP é maior do que a hidrólise do AMP e os valores de Km são
mais elevados para a hidrólise de ATP e ADP que para a hidrólise de AMP (Zimmermann,
1996).
A adenosina, balanceando a atividade pró-inflamatória do ATP, desempenha
propriedades imunomoduladoras, pela inibição da produção de citocinas inflamatórias por
macrófagos e células dendríticas e da produção de substâncias microbicidas por neutrófilos
e macrófagos, e pela estimulação da síntese de IL-10 (Bours e cols., 2006; Deaglio e cols.,
2007; Kumar & Sharma, 2009). Uma síntese do papel de ATP e adenosina em diferentes
células do sistema imune é mostrada na figura 2.
Figura 2. Efeitos do ATP e da adenosina sobre células do sistema imune. O ATP presente no
meio extracelular atua sobre diversas células. É capaz de estimular a produção de ROIs por
macrófagos e neutrófilos, a produção de IL-1 e TNF-α por macrófagos e células dendríticas e a
produção de IL-12 por células dendríticas maduras, a produção de IL-12 leva à diferenciação de
linfócitos produtores de IFN-γ. A adenosina, produzida a partir da hidrólise do ATP por
ectonucleotidases, tem efeitos antagônicos ao ATP, levando à diminuição da produção de citocinas
pró-inflamatórias e substâncias microbicidas por neutrófilos e macrófagos, além de estimular a
produção de IL-10 por células dendríticas, levando à imunossupressão. iDC: célula dendrítica
imatura; inf: linfócito; mDC: célula dendrítica madura; MΦ: macrófago; Neut: neutrófilo; ROIs:
intermediários reativos de oxigênio. (Baseada em Bours e cols., 2006).
26
1. Introdução
1.6. Sinalização purinérgica
Todas as respostas mediadas pelo ATP extracelular são iniciadas pela ativação de
receptores purinérgicos conhecidos como receptores P2. Os receptores P2 ainda são
subdivididos em dois subgrupos: receptores P2X, que são associados a canais iônicos, e
receptores P2Y, que são receptores com sete domínios transmembrana acoplados à
proteína G (Bours e cols., 2006; Di Virgilio e cols., 2001). Já foram descritos sete
receptores P2X (P2X1-7) e todos eles respondem primariamente ao ATP (Di Virgilio e
cols., 2001). Destacamos o receptor P2X7 porque além de sinalizar a presença de ATP
extracelular, é capaz de mediar a secreção dessa molécula (Pellegatti e cols., 2005). Os
receptores P2Y ainda se subdividem em grupos dependendo de sua especificidade: P2Y1 e
P2Y11 são específicos para purinas, P2Y4 e P2Y6 são específicos para pirimidinas, P2Y2
apresenta seletividade mista, P2Y12 e P2Y13 respondem apenas a ADP e P2Y14 a UDP
(Bours e cols., 2006).
A adenosina exerce seus efeitos por meio de 4 subtipos de receptores – A1, A2A,
A2B e A3 –, que variam em distribuição celular, afinidade e funções. Os receptores A2 são
responsáveis pela resposta anti-inflamatória da adenosina, enquanto os receptores A1 e A3
parecem regular a ação dos receptores A2, com o objetivo de prevenir um excesso de
inibição das células imunes (Abbracchio & Ceruti, 2007). O receptor A2A tem maior
afinidade para adenosina, seguido pelos receptores A2B, A1 e A3, nessa ordem. Como os
receptores A1 e A3 possuem menor afinidade, serão ativos somente em concentrações
elevadas de adenosina, já com o objetivo de regular a ação desse nucleosídeo (Abbracchio
& Ceruti, 2007).
Os quatro receptores de adenosina são membros da família de receptores acoplados
à proteína G (Abbracchio & Ceruti, 2007), e podem ativar diferentes vias de sinalização.
Esses receptores foram originalmente classificados de acordo com sua capacidade de
estimular (receptores A2) ou inibir (receptores A1 e A3) a enzima adenilato ciclase, e
consequentemente, estimular ou não a produção de AMPc, respectivamente (Schulte &
Fredholm, 2003). O segundo mensageiro AMPc interage com diferentes moléculas
efetoras, como proteína cinase A (PKA), proteína de troca diretamente ativada por AMPc
(Epac) e a fosfatidilinositol-3-cinase (PI3K) (especialmente para o receptor A2B). Essas
proteínas fosforilam diferentes fatores de transcrição e outras cinases, como a cinase
regulada por sinal extracelular (ERK) levando, entre inúmeros outros efeitos, à inibição da
geração de mediadores inflamatórios, da expressão de CD40 e da fagocitose (Schulte &
27
1. Introdução
Fredholm, 2003; Serezani e cols., 2008). Outras proteínas envolvidas nas cascatas de
sinalização via receptor A2B são a p38, JNK, proteína cinase B/Akt (PKB/Akt) e NF-κB,
mas os efeitos desencadeados pela ativação dessas proteínas ainda não são bem conhecidos
(Aherne e cols., 2011; Jacobson & Gao, 2006; Schulte & Fredholm, 2003).
A interação da adenosina ao receptor A2B pode, ainda, ativar a enzima fosfolipase
C, levando a um aumento dos níveis intracelulares de Ca2+ e da ativação da PKC, que
também desencadeará suas funções via ERK, inibindo a expressão de CD40, a produção de
IL-12p40 e a apoptose (Aherne e cols., 2011; Hasko e cols., 2009). Receptores A1 e A3
também podem levar à ativação da fosfolipase C, mas os efeitos decorrentes dessa ativação
sobre a resposta imune ainda não são bem elucidados (Schulte & Fredholm, 2003).
A figura 3 mostra um esquema simplificado dos pontos relevantes da sinalização
purinérgica, classificados como relevantes dentro de nosso estudo, e seus possíveis efeitos
sobre a resposta imune.
Figura na próxima página.
Figura 3. Influência da sinalização purinérgica sobre a resposta imune. (1) Células dendríticas expressam em sua
superfície ectonucleotidases capazes de hidrolisar o ATP extracelular até adenosina, que então poderá ativar 4 tipos de
receptores, sendo eles A1, A2A, A2B e A3, e desencadear vários efeitos. (2) O receptor P2X 7 pode ter um papel importante
na secreção de ATP, fornecendo substrato para ação das enzimas ectonucleotidases. (3) As subunidades α da proteína G
acoplada aos receptores A2A e A2B são estimuladoras da adenilato ciclase, que leva ao acúmulo de AMPc. Esse
mensageiro ativa as proteínas Epac e PKA, que posteriormente ativam MEK e ERK, levando à inibição da geração de
mediadores inflamatórios, da atividade microbicida e da fagocitose. (4) A proteína PKA ainda pode estimular vias com
participação da proteína p38 e do fator de transcrição CREB. (5) O acúmulo de AMPc intracelular também pode ativar a
proteína PI3K, que por sua vez ativa 2 vias diferentes, a primeira via PKB e NF-κB, e segunda, dependente de MEK e
ERK, levando à inibição da expressão de CD40, da produção de IL-12 e da apoptose. (6) As subunidades α da proteína G
acoplada aos receptores A1 e A3 são inibidoras da adenilato ciclase, e esses receptores parecem prevenir um excesso de
inibição de células imunes. (7) A proteína JNK também é ativada pelo receptor A2B, mas por um processo desconhecido.
(8) A ativação do receptor A2B ainda pode levar ao acúmulo de Ca2+ intracelular via fosfolipase C. O Ca2+ acumulado
ativa a PKC, que por sua vez ativa as proteínas MEK e ERK, gerando efeitos já descritos. 5’-NT: fosfohidrolase de
nucleosídeos 5’-monofosfatados; AC: adenilato ciclase; DAG: diacilglicerol; ENTPDase: ecto-difosfohidrolase de
nucleosídeos trifosfatados; Epac: proteína de troca diretamente ativada por AMPc; ERK: cinase regulada por sinal
extracelular; IP3: inositol trifosfato; JNK: cinase c-Jun N-terminal; MEK: cinase de proteína cinase ativada por mitógeno;
NF-κB: fator de transcrição nuclear κB; PI3K: fosfatidilinositol-3-cinase; PIP2: fosfatidilinositol bifosfato; PKA: proteína
cinase A; PKB/Akt: proteína cinase B/Akt; PKC: proteína cinase C; PLC: fosfolipase C. (Baseada em Abbracchio &
Ceruti, 2007; Aherne e cols., 2011; Di Virgilio e cols., 2001; Hasko e cols., 2009; Pellegatti e cols., 2005; Schulte &
Fredholm, 2003; Serezani e cols., 2008).
28
Figura 3. Influência da sinalização purinérgica sobre a resposta imune. Legenda na página anterior.
1. Introdução
29
1. Introdução
1.7. ATP e adenosina na resposta de células dendríticas
Células dendríticas expressam em sua superfície ectonucleotidases e receptores
funcionais para ATP (Berchtold e cols., 1999), bem como receptores para adenosina (Ben
Addi e cols., 2008; Novitskiy e cols., 2008; Wilson e cols., 2009), e, portanto, estão
sujeitas aos efeitos desencadeados por nucleotídeos e nucleosídeos presentes no meio
extracelular.
Estudos apontam o ATP como uma molécula capaz de induzir a maturação e
ativação de células dendríticas, por estimular a expressão de MHCII, CD80, CD83, CD86
e CD54 e a produção de IL-12, IL-1, TNF-α e IL-6, auxiliando no estabelecimento de uma
resposta inflamatória (La Sala e cols., 2001; Schnurr e cols., 2000). Além disso, esse
nucleotídeo é capaz de alterar a expressão de receptores de quimiocinas, aumentando a
expressão de CCR7 e diminuindo a expressão de CCR5 (La Sala e cols., 2002).
A adenosina, em contrapartida, diminui a migração de células dendríticas (Hofer e
cols., 2003), além de reduzir a produção de CXCL10 e estimular a produção de CCL17,
favorecendo a atração de células do perfil Th2 (Panther e cols., 2003). A diminuição da
produção de IL-12 e TNF-α e o aumento da produção de IL-10 são observados em células
dendríticas tratadas com adenosina (Panther e cols., 2003), mas dados sobre os efeitos da
adenosina sobre a expressão de marcadores de ativação (MHCII, CD80 e CD86) são
contraditórios (Hofer e cols., 2003; Panther e cols., 2003; Wilson e cols., 2009).
1.8. Justificativa
A infecção por parasitos do gênero Leishmania causa uma série de manifestações
clínicas, que variam com a espécie do parasito e a resposta imune do hospedeiro. Células
dendríticas são células essenciais para a resposta imune, uma vez que são capazes de
direcionar e modular a resposta adquirida efetora, inclusive durante a infecção por
Leishmania. Em situações de injúria, o ATP é acumulado no meio extracelular e
desempenha funções pró-inflamatórias. As concentrações desse nucleotídeo são reguladas
por ectonucleotidases, levando à produção de adenosina, que possui propriedades
imunossupressoras. Baseados nisso, pretendemos avaliar o efeito da infecção por diferentes
espécies de Leishmania, com graus de virulência variáveis, sobre a resposta de células
dendríticas, e a participação da adenosina nesse processo.
30
2. OBJETIVOS
2. Objetivos
2. OBJETIVOS
2.1. Objetivo geral
Avaliar a participação da hidrólise do ATP extracelular e da ativação de receptores
de adenosina na modulação da resposta de células dendríticas de camundongos C57BL/6J
infectadas por Leishmania.
2.2. Objetivos específicos
Avaliar o efeito da infecção por diferentes espécies de Leishmania sobre o estado
de ativação de células dendríticas.
Avaliar a participação da citocina IL-10 sobre o estado de ativação de células
dendríticas infectadas.
Comparar células dendríticas não infectadas e células dendríticas infectadas em
relação à expressão e atividade de ectonucleotidases e expressão de receptores de
adenosina.
Avaliar a participação de ectonucleotidases e receptores de adenosina sobre o
estado de ativação de células dendríticas infectadas.
Avaliar o efeito da infecção por Leishmania sobre a capacidade de células
dendríticas de estimular a proliferação de linfócitos.
32
3. MATERIAL E MÉTODOS
3. Material e métodos
3. MATERIAL E MÉTODOS
3.1. Animais e parasitos
Camundongos das linhagens C57BL/6J e BALB/c de 2 a 4 meses de idade foram
obtidos e mantidos no Centro de Ciência Animal da Universidade Federal de Ouro Preto,
onde receberam água e alimento ad libitum. Todos os procedimentos aos quais os animais
foram submetidos foram aprovados pela Câmara de Experimentação Animal do Comitê de
Ética em Pesquisa, dessa mesma instituição, pelo Ofício CEP n° 005/2009, de 16 de
janeiro de 2009, como comprovado pelo documento em anexo.
Promastigotas
(IFLA/BR/67/PH8
de
–
(MHOM/BR/75/M2903
Leishmania
La),
–
(Leishmania)
Leishmania
Lb)
e
(Viannia)
Leishmania
amazonensis,
braziliensis,
(L.)
major,
cepa
cepa
cepa
PH8
M2903
Friedlin
(MHOM/IL/80/Friedlin – Lm) foram cultivadas em meio de Grace (Sigma-Aldrich, St.
Louis, MO, EUA) suplementado com 10% de soro fetal bovino inativado (SFB – LGC,
Cotia, SP, Brasil), L-glutamina (Gibco BRL, Grand Island, NY, EUA) 2 mM e penicilina G
(USB Corporation, Cleveland, OH, EUA) 100 U/mL, pH 6,5, a 25°C. Promastigotas
metacíclicas foram enriquecidas a partir de parasitos de cultura em fase estacionária (5°
dia) por centrifugação em gradiente de Ficoll, como previamente descrito por Spath e
Beverley (Spath & Beverley, 2001) e adaptado por Marques-da-Silva (Marques-da-Silva e
cols., 2008). Os parasitos foram lavados duas vezes com salina tamponada com fosfato
(PBS), pH 7,2, a 1540 x g / 4°C / 10 minutos e o precipitado foi ressuspendido em meio
DMEM (Sigma-Aldrich), pH 7,2 e sobreposto em Ficoll 400 (Sigma-Aldrich) 10%. A
preparação foi centrifugada a 1.070 x g / 25 °C / 15 minutos, o sobrenadante enriquecido
de promastigotas metacíclicas foi retirado e os parasitos foram novamente lavados.
Para os experimentos de infecção de células dendríticas in vitro, promastigotas
metacíclicas, ressuspendidas em PBS / 5% SFB, pH 7,2, a uma concentração de 6 x 107
parasitos/mL, foram incubadas com éster de succinimidil-carboxifluoresceína (CFSE –
Sigma-Aldrich) 5 µM, a 37°C, por 10 minutos, ao abrigo da luz. Lavaram-se os parasitos
duas vezes, a primeira com PBS / 10% SFB, pH 7,2, e a segunda com PBS, pH 7,2
(Goncalves e cols., 2005). Alternativamente, os parasitos foram marcados com PKH26
(Sigma-Aldrich), seguindo instruções do fabricante. A eficiência da marcação foi avaliada
por citometria de fluxo, como mostrado para CFSE (Figura 4). A eficiência da marcação
com PKH26 foi semelhante a observada para CFSE.
34
3. Material e métodos
Figura 4. Marcação de parasitos com CFSE. Promastigotas metacíclicas de Leishmania
foram incubadas na presença de CFSE, conforme descrito anteriormente. Para avaliar a eficácia
do método avaliaram-se os parasitos por citometria de fluxo.
3.2. Obtenção de células dendríticas derivadas de medula óssea
Células dendríticas foram diferenciadas a partir de células da medula óssea, como
previamente descrito (Lutz e cols., 1999). Retiraram-se fêmures e tíbias de camundongo
C57BL/6J e imergiram-se os ossos em álcool 70°GL por 2 minutos, seguidos por imersão
em PBS, pH 7,2. Cortaram-se as duas epífises e injetaram-se, pelas extremidades, 5 mL de
PBS / 5% SFB, pH 7,2. A suspensão de células foi centrifugada a 210 x g / 4°C / 10
minutos e as células foram ressuspendidas em meio RPMI-1640 (Sigma-Aldrich)
suplementado com 10% de SFB,
L-glutamina
2 mM, penicilina G 100 U/mL e β-
mercaptoetanol (Pharmacia Biotech AB, Uppsala, Suécia) 50 µM, pH 7,2. As células
foram plaqueadas em placas de Petri a uma concentração de 3 x 105 células/mL, e
incubadas a 37°C / 5% CO2. O fator estimulador de colônias de granulócitos e monócitos
(GM-CSF – R&D Systems, Minneapolis, MN, EUA) foi adicionado a cada placa nos dias
0, 3 e 6, a uma concentração de 3 ng/mL (1050 U/mL). Células não aderentes foram
coletadas no 9° dia de cultura. A população de células dendríticas foi caracterizada pela
expressão dos marcadores de superfície CD11c, CD11b, CD207, F4/80, Gr-1, CD4, CD8,
MHCII, CD86 e CD40 por citometria de fluxo (Figura 5). A expressão dos marcadores foi
similar à encontrada no protocolo de referência.
35
3. Material e métodos
Figura 5. Caracterização da população de células dendríticas. Células dendríticas obtidas após 9 dias de cultivo na
presença de GM-CSF foram analisadas por citometria de fluxo. Avaliou-se a expressão dos marcadores de superfície
CD11c, CD11b, CD207, F4/80, Gr-1, CD4, CD8, MHCII, CD86 e CD40. Os números entre parênteses representam a
porcentagem de células presentes nos respectivos quadrantes.
3.3. Infecção de células dendríticas in vitro
Promastigotas metacíclicas e células dendríticas foram co-incubadas em tubos de
polipropileno, numa proporção de 3 parasitos por célula dendrítica, a 33°C / 5% CO2, por 3
horas. Para permitir a completa ativação dessas células, lipopolissacarídeo (LPS – SigmaAldrich), a uma concentração de 2 µg/mL, foi adicionado à cultura e as células foram
incubadas a 37°C / 5% CO2, por mais 17 horas. Células dendríticas infectadas foram
submetidas à análise por citometria de fluxo, dosagem da atividade ectonucleotidásica ou
36
3. Material e métodos
microscopia de fluorescência, ou utilizadas em ensaios de proliferação. Para as análises por
dosagem da atividade ectonucleotidásica e microscopia de fluorescência, foi utilizada a
proporção de 10 parasitos por célula dendrítica, como explicado no texto.
Em alguns experimentos, células dendríticas foram previamente incubadas por 30
minutos, a 25°C, na presença de 15 µg/mL do anticorpo monoclonal 1B1.3a (Harlan
Bioproducts for Science, Indianapolis, IN, EUA) para bloquear o receptor de IL-10, e
então submetidas à infecção; IgG de rato (produzida em nosso laboratório) foi utilizada
como controle de isotipo. Em outros experimentos, suramina (Sigma-Aldrich) ou
antagonistas de receptores de adenosina A2A e A2B, 4-(2-[7-amino-2-(2-furil)[1,2,4]triazol
[2,3-α][1,3,5]triazina-5-ilamino]etil)fenol (ZM241385) e N-(4-cianofenil)-2-[4-(2,3,6,7tetrahidro-2,6-dioxo-1,3-dipropil-1H-purina-8-il)fenoxi]-acetamida
(MRS1754),
respectivamente (Tocris Bioscience, Park Ellisville, MO, EUA), foram adicionados no
momento da infecção de células dendríticas como descrito nas legendas das figuras.
Ambos ZM241385 e MRS1754 foram diluídos em dimetilsufóxido, que foi adicionado às
culturas controles.
3.4. Avaliação da viabilidade celular
A viabilidade de células dendríticas foi avaliada por coloração com azul de Trypan
e por marcação com iodeto de propídeo. Suspensões de células foram diluídas em igual
volume de azul de Trypan (Sigma-Aldrich) 0,4% e as células contadas em câmara de
Neubauer. Fez-se a contagem diferencial das células vivas (íntegras e não coradas) e das
células mortas (permeabilizadas e coradas em azul). Por fim, calculou-se a porcentagem de
células viáveis. Células a uma concentração de 107 células/mL, em PBS, pH 7,2, foram
incubadas na presença de iodeto de propídeo (Sigma-Aldrich), a uma diluição de 1:500,
por 1 minuto, a 25°C. Lavaram-se as células com PBS, pH 7,2, e ressuspendeu-se em uma
solução de 1% de paraformaldeído, cacodilato de sódio 47,7 mM e NaCl 113 mM, pH 7,2.
Por fim, as células foram analisadas por citometria de fluxo.
3.5. Determinação da produção de IL-10
Os sobrenadantes das culturas de células dendríticas foram coletados após 20 horas
e os níveis de IL-10 foram dosados por ELISA utilizando um kit para ensaio em sanduíche,
seguindo instruções do fabricante (PeproTech Inc., Rock Hill, NJ, EUA).
37
3. Material e métodos
3.6. Dosagem da atividade ectonucleotidásica
As atividades de hidrólise de ATP, ADP e AMP foram medidas pela incubação de
5 x 103 (para ATP ou ADP) ou 5 x 104 (para AMP) células dendríticas intactas por 1 hora a
30°C em tampão de reação (NaCl 116 mM, KCl 5,4 mM, D-glicose 5,5 mM, MgCl2 5 mM
e tampão HEPES-tris 50 mM, pH 7,2), na presença de ATP, ADP ou AMP (SigmaAldrich) 5 mM. Para os experimentos de bloqueio da atividade ectonucleotidásica, as
células foram incubadas na presença dos inibidores suramina ou α,β-metileno adenosina
difosfato (α,β-MAD – Sigma-Aldrich), ambos na concentração final de 200 µM. A reação
foi interrompida pela adição, na proporção 2:1, de carvão diluído em HCl 0,1 M (MeyerFernandes e cols., 1997). Hidrólise não específica foi determinada pela adição de células
após a reação ser interrompida. As suspensões foram centrifugadas e alíquotas dos
sobrenadantes foram usadas para a quantificação do Pi liberado adicionando-se 1/3 do
volume do sobrenadante de uma mistura contendo 1 parte de molibdato de amônio 10%
diluído em HCl 4M para 3 partes de verde de malaquita 0,2% diluído em HCl 4M. Foi feita
uma curva padrão utilizando diferentes concentrações de soluções de Na3PO4, numa
quantidade máxima de 31,25 nmol de Pi, reagindo com a mesma mistura descrita acima. A
quantificação do Pi liberado foi feita após 10 minutos de incubação, a 25°C, por
espectrofotometria sob comprimento de onda de 650 nm (Ekman & Jager, 1993). Por fim,
a atividade enzimática, indiretamente determinada pela quantidade de Pi liberado, foi
calculada pela subtração da hidrólise não específica e ajustada para valores gerados por 106
células/hora.
3.7. Microscopia de fluorescência
105 células foram lavadas com PBS, pH 7,2, sedimentadas em lâminas por
centrifugação a 300 x g / 10 minutos, a após completa secagem das lâminas, foram fixadas
e permeabilizadas com metanol por 2 minutos. Após lavagem com PBS, pH 7,2, realizouse o bloqueio do receptor para Fcγ na presença do anticorpo anti-CD16/CD32 de
camundongo (eBioscience, San Diego, CA, EUA), a 0,5 µg/106 células, em PBS, pH 7,2,
por 5 minutos. Descartou-se todo o líquido e procedeu-se com a incubação com os
anticorpos de coelho anti-A1 ADOR (policlonal H-40), anti-A2A ADOR (policlonal H-82),
anti-A2B ADOR (policlonal H-40) ou anti-A3 ADOR (policlonal H-80 – Santa Cruz
Biotechnology, Santa Cruz, CA, EUA) por 30 minutos, a 4°C. O controle foi feito
38
3. Material e métodos
substituindo os anticorpos primários por IgG de coelho normal. Todos os anticorpos foram
diluídos a 1:50 em PBS, pH 7,2. Lavaram-se as lâminas duas vezes com PBS, pH 7,2.
Seguiu-se com a incubação com o anti-IgG de coelho conjugado a FITC (Sigma-Aldrich),
diluído a 1:100 em PBS, pH 7,2, por 30 minutos, a 4°C, ao abrigo da luz. Lavaram-se as
lâminas duas vezes com PBS, pH 7,2. Adicionou-se uma solução de iodeto de propídeo,
diluído a 1:100 em PBS, pH 7,2, e incubou-se por 1 minuto, a 25°C, ao abrigo da luz.
Escorreu-se todo o líquido e aguardou-se a completa secagem, overnight. Fixaram-se
lâmina e lamínula com Mowiol® 4-88 (Sigma-Aldrich), preparado seguindo instruções do
fabricante, e aguardou-se completa secagem das lâminas para análise ao microscópio de
fluorescência. Todas as lâminas foram mantidas a 4°C, ao abrigo da luz, até o momento da
análise. As lâminas foram examinadas no microscópio de fluorescência Olympus BX51 e
as imagens foram adquiridas com o auxílio do programa Image-Pro Express 4.0 (Media
Cybernetics, Bethesda, MD, EUA). Utilizou-se o microscópio do Laboratório de NeuroImuno Patologia Experimental (UFMG), coordenado pela professora Rosa Maria Esteves
Arantes.
3.8. Ensaio de proliferação antígeno-específica
Camundongos C57BL/6J foram inoculados no coxim plantar esquerdo com 107
promastigotas de L. amazonensis. Os camundongos foram eutanasiados na 10ª semana de
infecção, e os baços retirados e macerados em DMEM, pH 7,2. As hemácias foram lisadas
com solução de cloreto de amônio e as células lavadas com PBS, pH 7,2, por centrifugação
a 210 x g / 4°C / 10 minutos. Ajustou-se a concentração de células para 107/mL, em PBS /
ácido etilenodiaminotetra acético (EDTA) 2 mM, pH 7,2, acrescentou-se IgG de rato
purificada (produzida em nosso laboratório) a 1 µg/107 células e incubou-se por 30
minutos, a 4°C. Lavaram-se as células com PBS, pH 7,2 e ajustou-se a concentração para
108/mL, em PBS / EDTA 2 mM, pH 7,2. As células foram, então, incubadas com o
anticorpo GK1.5-biotinado (anticorpo anti-CD4 de camundongo, produzido em nosso
laboratório), a uma concentração de 0,75 µg/107 células, por 30 minutos, a 4 °C. Lavaramse as células duas vezes com PBS / EDTA 2 mM, pH 7,2 e ressuspendeu-se na mesma
solução, ajustando a concentração de células para 108/900 µL. Acrescentaram-se 100 µL
de estreptoavidina conjugada com beads magnéticos (Miltenyi Biotec GmbH, Bergisch
Gladbach, Alemanha) por 108 células. Incubou-se por 15 minutos, a 4°C e lavaram-se as
células com PBS / EDTA 2 mM, pH 7,2. Por fim, ajustou-se a concentração de células para
39
3. Material e métodos
108/mL, em PBS / EDTA 2 mM / 0,5% albumina sérica bovina (BSA), pH 7,2. A
separação magnética de células CD4 foi realizada por passagem das células através de
colunas MS acopladas ao separador MiniMACS (Miltenyi Biotec GmbH), seguindo
instruções do fabricante. A pureza dos linfócitos T CD4+ foi de aproximadamente 90%,
conforme análise por citometria de fluxo. A concentração de linfócitos foi ajustada para 5
x 106 células/mL, em PBS / 5% SFB, pH 7,2. Esta suspensão foi incubada com CFSE 5
µM a 25°C, por 5 minutos, ao abrigo da luz (Quah e cols., 2007). As células foram lavadas
duas vezes com PBS, pH 7,2, e ressuspendidas em RPMI-1640 suplementado com 10% de
SFB, L-glutamina 2 mM, penicilina G 100 U/mL, HEPES 25 mM e β-mercaptoetanol 50
µM, pH 7,2. Linfócitos (5 x 105 células) foram co-cultivados com células dendríticas
previamente infectadas (5 x 104 células), em placas de 48 poços, num volume total de 500
µL/poço. As co-culturas foram incubadas a 37°C / 5% CO2. Após 4 dias, as células foram
coletadas para serem analisadas por citometria de fluxo.
3.9. Reação mista de leucócitos (MLR)
Para o ensaio de MLR, células de baço de camundongos BALB/c não infectados
foram marcadas com CFSE como descrito anteriormente. Leucócitos (5 x 105 células)
foram co-cultivados com células dendríticas previamente infectadas (5 x 104 células), em
placas de 48 poços, num volume total de 500 µL/poço. As co-culturas foram incubadas a
37°C / 5% CO2. Após 4 dias, as células foram coletadas para serem analisadas por
citometria de fluxo. Analisou-se a proliferação de células CD3+.
3.10. Citometria de fluxo
Células a uma concentração de 107 células/mL, em PBS / 1% BSA, pH 7,2, foram
submetidas ao bloqueio do receptor para Fcγ na presença do anticorpo anti-CD16/CD32 de
camundongo, a 0,5 µg/106 células, em PBS, pH 7,2, por 5 minutos. 25 µL da suspensão de
células foram incubados com a combinação dos anticorpos de interesse a 4°C, por 30
minutos, ao abrigo da luz. Os anticorpos utilizados foram: anti-CD11c (APC, FITC ou PECy7, clone HL3, a 1 µg/106 células), anti-CD40 (FITC, clone 3/23, a 1 µg/106 células –
BD Pharmingen, San Diego, CA, EUA), anti-CD11b (FITC, clone M1/70, a 1 µg/106
células), anti-MHCII (APC, clone M5 114.15.2, a 0,004 µg/106 células), anti-CD86 (PE,
clone GL1, a 0,032 µg/106 células), anti-CD39 (Alexa Fluor 647, clone 24DMS1, a 0,015
40
3. Material e métodos
µg/106 células), anti-CD73 (PE, clone TY.11.8, a 0,125 µg/106 células), anti-CD4 (FITC,
clone RM4-5, a 0,025 µg/106 células), anti-CD8 (PerCP-Cy5.5, clone 53-6.7, a 0,25 µg/106
células – eBioscience), anti-F4/80 (PE-Cy7, clone BM8, a 0,1 µg/106 células), anti-Gr-1
(FITC, clone RB6-8C5, a 0,25 µg/106 células), anti-CD3ε (PE, clone 145-2C11, a 0,25
µg/106 células – BioLegend, San Diego, CA, EUA), e seus respectivos controles de
isotipo. Todos os anticorpos utilizados são específicos para camundongos. As suspensões
foram centrifugadas e as células lavadas com PBS, pH 7,2 e ressuspendidas em uma
solução de 1% de paraformaldeído, cacodilato de sódio 47,7 mM e NaCl 113 mM, pH 7,2.
As amostras foram analisadas no citômetro de fluxo BD FACSCaliburTM. A aquisição de
células foi realizada com o auxílio do programa BD CellQuestTM Pro. A análise dos dados
foi realizada utilizando o programa FlowJo (Tree Star, Ashland, OR, EUA).
3.11. Análise estatística
Os dados foram submetidos à análise estatística por teste t de Student ou ANOVA
one-way seguida do pós-teste de Tukey com o auxílio do programa Prism 5.0 (GraphPad
Software, La Jolla, CA, EUA). Valores de p inferiores a 0,05 foram considerados
estatisticamente significantes.
41
4. RESULTADOS
4. Resultados
4. RESULTADOS
4.1. Leishmania infecta células dendríticas sem alterar a viabilidade celular
Iniciamos este trabalho pela avaliação da capacidade de promastigotas de diferentes
espécies de Leishmania de infectar células dendríticas. Células dendríticas derivadas de
medula óssea foram incubadas na presença de promastigotas metacíclicas de L.
amazonensis, L. braziliensis ou L. major previamente marcadas com CFSE, numa
proporção de 3 parasitos por célula dendrítica, e analisadas por citometria de fluxo. Após 3
horas de incubação, L. amazonensis foi capaz de infectar uma maior quantidade de células
dendríticas, quando comparada a L. braziliensis ou L. major (Figura 6A). Após 20 horas,
encontramos uma média de 35 a 45% de células infectadas, e os resultados foram similares
entre as 3 espécies de parasitos (Figura 6B). É importante considerar que todos os
tratamentos realizados ao longo deste trabalho não interferiram sobre a capacidade de
infecção dos parasitos (dados não mostrados).
Figura 6. Infecção de células dendríticas com promastigotas metacíclicas de L. amazonensis, L. braziliensis ou L.
major. Células dendríticas obtidas após 9 dias de cultivo com GM-CSF foram incubadas com promastigotas metacíclicas
marcadas com CFSE na proporção de 3 parasitos por célula. Incubou-se por 20 h, sendo as 3 h iniciais a 33°C / 5% CO2 e
o restante a 37°C / 5% CO2. Após o primeiro período de incubação, as células foram estimuladas com LPS. Por fim,
analisou-se a porcentagem de células CFSE+ após 3 h (A) ou 20 h (B) de incubação, por meio da citometria de fluxo. Os
resultados representam média e desvio padrão de pelo menos dois experimentos independentes. Asteriscos indicam
diferença estatística (p < 0,05, ANOVA one-way seguida pelo pós-teste de Tukey) entre os grupos ligados.
A viabilidade de células dendríticas não infectadas e de células dendríticas
infectadas foi avaliada por exclusão de azul de Trypan ou por incorporação de iodeto de
propídeo. A porcentagem de células viáveis não foi alterada pela infecção, independente da
técnica utilizada para a avaliação (Figura 7).
43
4. Resultados
Figura 7. Viabilidade de células dendríticas infectadas com Leishmania. Células dendríticas foram infectadas
conforme descrito na figura 6. (A) Porcentagem de células viáveis calculada a partir da contagem diferencial das células
vivas e das células mortas, coradas pelo azul de Trypan. (B) Células dendríticas foram separadas em populações de
células não infectadas (células CFSE-) e de células infectadas (células CFSE+), e a incorporação de iodeto de propídeo foi
avaliada nas duas populações. Por fim, avaliou-se a porcentagem de células que não incorporaram iodeto de propídeo
(células viáveis). Os resultados representam média e desvio padrão de três experimentos independentes. (C) Histogramas
da intensidade de iodeto de propídeo representativos de três experimentos independentes.
4.2. Promastigotas metacíclicas de Leishmania alteram a expressão de marcadores de
superfície em células dendríticas
Vários pesquisadores têm mostrado que diferentes espécies de Leishmania são
capazes de interferir com a expressão de moléculas de superfície em células dendríticas
(Carvalho e cols., 2008; Favali e cols., 2007; Prina e cols., 2004; Qi e cols., 2001; Xin e
cols., 2008). Porém, na maioria desses estudos, foram analisados os efeitos na população
total de células, e nenhuma diferenciação foi feita entre as células que estavam infectadas e
as células, que apesar de terem entrado em contato com os parasitos, permaneceram não
infectadas. Para evitar essa situação, células dendríticas foram incubadas com parasitos
marcados com CFSE ou PKH26. Após 3 horas de incubação, essas células foram
estimuladas com LPS, para permitir sua completa ativação. As populações de células não
infectadas (células CFSE- ou PKH26-) e de células infectadas (células CFSE+ ou PKH26+)
foram avaliadas separadamente, como mostrado na Figura 8A.
44
4. Resultados
A expressão de MHCII e CD86 foi significativamente diminuída em células
dendríticas infectadas (Figura 8B). Esse efeito foi observado não somente quando
analisado pela porcentagem de células ativadas (células MHCII+CD86+), mas também pela
intensidade da expressão desses marcadores em células infectadas e ativadas (Figura 8CD), independentemente da espécie de parasito utilizada.
A expressão de CD40 em células dendríticas infectadas também foi avaliada.
Apesar de inibir a expressão de MHCII e CD86, a infecção por L. braziliensis e L. major
induziu um aumento significativo na expressão de CD40. Em contrapartida, essa alteração
não foi observada em células dendríticas infectadas com L. amazonensis (Figura 8E).
Para avaliar se a inibição de células dendríticas por Leishmania foi devida a uma
influência na sinalização por LPS via receptor TLR-4, os experimentos anteriores foram
realizados na ausência de LPS, e as 3 espécies de parasitos continuaram capazes de inibir a
ativação de células dendríticas (dados não mostrados).
Juntos, nossos resultados mostram que a intensidade do prejuízo na ativação de
células dendríticas infectadas é dependente da espécie de parasito utilizada, e é mais
intensa quando provocada por L. amazonensis que por L. braziliensis ou L. major, uma vez
que somente a primeira espécie manteve a expressão de CD40 baixa.
45
4. Resultados
Figura 8. Infecção por Leishmania prejudica a ativação de células dendríticas. Células dendríticas foram infectadas
conforme descrito na figura 6 e analisadas por citometria de fluxo. Células dendríticas foram separadas em populações de
células não infectadas (células CFSE- ou PKH26-) e de células infectadas (células CFSE+ ou PKH26+), e os marcadores
de superfície foram avaliados nas duas populações. (A) Dot plots e histogramas representativos da análise de células
dendríticas infectadas com L. amazonensis. (B) A porcentagem de células MHCII+CD86+ foi avaliada, bem como a IMF
de MHCII (C) e CD86 (D) nestas células. Também foi avaliada a porcentagem de células CD40+ em populações de
células não infectadas e de células infectadas (E). Os resultados representam média e desvio padrão de pelo menos 3
experimentos independentes. Asteriscos indicam diferença estatística (p < 0,05, teste t de Student não pareado) entre
células dendríticas não infectadas e células dendríticas infectadas.
46
4. Resultados
4.3. Inibição da ativação de células dendríticas por L. amazonensis é independente de
IL-10 e a inibição por L. braziliensis ou L. major é parcialmente dependente dessa
citocina
Para tentar elucidar os mecanismos envolvidos na inibição da ativação de células
dendríticas por Leishmania, começamos com a avaliação da influência da produção de IL10, uma vez que algumas publicações têm apontado essa citocina como o principal fator na
supressão da resposta de células dendríticas (Corinti e cols., 2001; Vasquez e cols., 2008;
Xin e cols., 2008). Para atingir esse objetivo, inicialmente avaliamos a produção de IL-10
no sobrenadante de cultura por ELISA e não encontramos diferenças entre as culturas
controle e de células dendríticas infectadas (Figura 9).
Figura 9. Inibição da ativação de células dendríticas por Leishmania é
independente da produção de IL-10. Células dendríticas foram infectadas
conforme descrito na figura 6 e dosaram-se os níveis da citocina IL-10 no
sobrenadante após 20 h por ELISA. Controle representa células dendríticas
estimuladas com LPS. Os resultados representam média e desvio padrão de 6
experimentos independentes.
No entanto, como o prejuízo nas funções de células dendríticas foi restrito às
células infectadas, seguimos com a avaliação do efeito de IL-10 na ativação de células
dendríticas separadamente na população de células não infectadas e na população de
células infectadas, pelo bloqueio do receptor de IL-10 com um anticorpo monoclonal
específico, anteriormente à infecção. Esse tratamento foi incapaz de reverter a inibição da
ativação de células dendríticas por L. amazonensis. Porém, o bloqueio do receptor de IL-10
parcialmente restaurou a expressão de MHCII e CD86 nas células dendríticas infectadas
47
4. Resultados
com L. braziliensis ou L. major (Figura 10A, C). Além disso, o bloqueio da ação da IL-10
não alterou a expressão de CD40, independentemente da espécie de parasito utilizada para
a infecção (Figura 10B).
Esses resultados apontam para distintos mecanismos de inibição da ativação de
células dendríticas utilizados por diferentes espécies de Leishmania. Enquanto os efeitos de
L. braziliensis e L. major na inibição de células dendríticas foram, pelo menos
parcialmente, dependentes de IL-10, essa citocina não teve nenhuma influência nos efeitos
de L. amazonensis sobre a ativação de células dendríticas.
Figura 10. Inibição da ativação de células dendríticas por L. braziliensis e L. major é parcialmente dependente do
receptor de IL-10. Células dendríticas foram previamente incubadas por 30 minutos a 25°C na presença de 15 µg/mL de
anticorpo 1B1.3a para bloquear o receptor de IL-10, IgG de rato foi utilizada como controle isotipo. Por fim, células
dendríticas foram infectadas conforme descrito na figura 6 e analisados por citometria de fluxo. A porcentagem de células
MHCII+CD86+ (A) e de células CD40+ (B) nas populações de células não infectadas e de células infectadas nos grupos
tratados foram expressos em relação ao grupo de células incubadas com parasitos na ausência de tratamentos,
considerado 100 (linha pontilhada), e representam média e desvio padrão de pelo menos 3 experimentos independentes.
Asteriscos indicam diferença estatística (p < 0,05, teste t de uma amostra contra o valor hipotético de 100) em relação ao
grupo não tratado. (C) Dot plots representativos das populações de células dendríticas infectadas com L. amazonensis
(painéis superiores), L. braziliensis (painéis intermediários) ou L. major (painéis inferiores) não tratadas (à esquerda) ou
tratadas com o anticorpo 1B1.3a (à direita). Os números entre parênteses representam a porcentagem de células
dendríticas MHCII+CD86+.
48
4. Resultados
4.4. Suramina altera o estado de ativação de células dendríticas infectadas por ação
na célula e não no parasito
Considerando que ectonucleotidases podem estar envolvidas no estabelecimento da
infecção por Leishmania e outros parasitos (Asai e cols., 1995; Berredo-Pinho e cols.,
2001; Bisaggio e cols., 2003; Coimbra e cols., 2002; Fietto e cols., 2004; Maioli e cols.,
2004; Marques-da-Silva e cols., 2008; Meyer-Fernandes e cols., 1997; Thammavongsa e
cols., 2009), investigamos se a ENTPDase de L. amazonensis, a espécie com maior
expressão dessa enzima (Marques-da-Silva e cols., 2008), está envolvida na redução da
ativação de células dendríticas mostrada anteriormente. Para isso, células dendríticas foram
infectadas com parasitos previamente tratados por 30 minutos com suramina 200 µM, um
inibidor de ENTPDase, e posteriormente lavados. Alternativamente, células dendríticas e
parasitos foram tratados simultaneamente com suramina. A Figura 11A mostra que os
parasitos tratados não alteraram o estado de ativação de células dendríticas.
Figura 11. Suramina afeta o estado de ativação de células dendríticas infectadas com L. amazonensis por ação na
célula e não no parasito. Células dendríticas foram infectadas conforme descrito na figura 6 e analisadas por citometria
de fluxo. (A) Células dendríticas foram infectadas com parasitos previamente tratados com 200 µM de suramina [DC +
(La + suramina 200 µM)]. Alternativamente, células dendríticas e parasitos foram tratados simultaneamente com
suramina no momento da infecção [(DC + La + suramina 30 µM) ou (DC + La + suramina 200 µM)]. A porcentagem de
células MHCII+CD86+ nas populações de células não infectadas e de células infectadas nos grupos tratados foram
expressos em relação ao grupo de células incubadas com parasitos na ausência de tratamentos, considerado 100 (linha
pontilhada). (B) Células dendríticas foram incubadas na presença de suramina 200 µM, controle representa células
estimuladas com LPS. Os resultados representam média e desvio padrão de pelo menos 2 experimentos independentes.
Asteriscos indicam diferença estatística (p < 0,05, teste t de uma amostra contra o valor hipotético de 100) em relação ao
grupo não tratado.
49
4. Resultados
Por outro lado, a incubação simultânea de suramina com parasitos e células
dendríticas reverteu parcialmente a redução da expressão de MHCII e CD86 em células
infectadas, somente quando o inibidor foi utilizado numa concentração de 200 µM (Figura
11A).
Uma vez que o tratamento do parasito com suramina promove uma redução
irreversível na atividade da ENTPDase, como mostrado por outros estudos em nosso
laboratório, os resultados sugerem que a restauração da ativação de células dendríticas
induzida por suramina não foi devida à inibição da ENTPDase do parasito, mas,
possivelmente, causada pela ação do inibidor na célula dendrítica. A expressão de MHCII
e CD86 não foi alterada em células não infectadas (Figura 11A) e o tratamento somente
com suramina não foi capaz de alterar a expressão desses marcadores em células que não
tiveram contato com parasitos (Figura 11B). Juntos, nossos dados sugerem que a suramina
atua somente na população de células dendríticas infectadas e que a ativação causada por
este inibidor foi devido a sua ação sobre a célula infectada, e não sobre os parasitos.
4.5. Infecção por Leishmania aumenta a expressão e a atividade enzimática de
ectonucleotidases em células dendríticas
Baseados nas observações que células dendríticas expressam ectonucleotidases em
sua superfície (Berchtold e cols., 1999), que essas enzimas desempenham importante papel
nas funções supressoras de células T reguladoras (Borsellino e cols., 2007) e que o
tratamento com suramina influenciou significativamente o processo de ativação de células
dendríticas por ação direta nessas células, avaliamos a expressão dessas enzimas em
células dendríticas pela investigação da expressão de CD39 (ou ENTPDase) e CD73 (ou
5’-nucleotidase). Independentemente da espécie de parasito utilizada, a co-expressão de
CD39 e CD73 foi significativamente aumentada em células infectadas (Figura 12).
50
4. Resultados
Figura 12. Infecção por Leishmania aumenta a expressão de
ectonucleotidases em células dendríticas. Células dendríticas foram infectadas
conforme descrito na figura 6 e analisadas por citometria de fluxo. Células
dendríticas foram separadas em populações de células não infectadas e de
células infectadas e a porcentagem de células CD39+CD73+ avaliadas em ambas
as populações. Os resultados representam média e desvio padrão de 4
experimentos independentes. Asteriscos indicam diferença estatística (p < 0,05,
teste t de Student não pareado) entre células dendríticas não infectadas e células
dendríticas infectadas.
Para tentar confirmar se o aumento na expressão de CD39 e CD73 é acompanhado
do aumento da capacidade de produção de adenosina por células dendríticas, avaliamos a
atividade ectonucleotidásica de células dendríticas após as 20 horas de incubação na
presença ou ausência de parasitos. Para essa análise, optamos pela infecção numa
proporção de 10 parasitos por célula dendrítica. Essa escolha se justifica pelos fatos que,
quando utilizada a proporção de 3 parasitos por célula dendrítica, menos de 50% das
células permanecem infectadas e a separação das populações de células não infectadas e de
células infectadas não é possível pela técnica utilizada para essa análise. Assim, os efeitos
que até esse momento foram restritos às células infectadas poderiam ser diluídos ou
mascarados pelas células que não foram capazes de internalizar parasitos se a dosagem
proposta fosse suportada por uma taxa de infecção tão baixa. Quando utilizamos 10
parasitos por célula dendrítica, conseguimos uma taxa de infecção, para L. amazonensis, de
82,5 ± 6,1%, sem alterar seus efeitos sobre o estado de ativação das células infectadas.
Como mostrado na Figura 13A, a capacidade de hidrólise de ATP, ADP e AMP foi
significativamente aumentada em células dendríticas infectadas, independentemente da
espécie de parasito utilizada. A hidrólise de ATP e ADP por células infectadas foi inibida
pela adição de suramina 200 µM, um conhecido inibidor da ENTPDase, e a hidrólise de
51
4. Resultados
AMP foi completamente bloqueada pela adição de α,β-MAD 200 µM, um inibidor da 5’nucleotidase, independentemente do grupo avaliado (Figura 13B-E).
Juntos, os resultados desta seção sugerem uma correlação entre a diminuição da
expressão de marcadores de ativação em células infectadas e a produção de adenosina por
células infectadas, mas ainda não explicam a diferença na expressão de CD40 entre células
dendríticas infectadas com L. amazonensis e células dendríticas infectadas com L.
braziliensis ou L. major.
52
4. Resultados
Figura 13. Infecção por Leishmania aumenta a atividade de ectonucleotidases em células dendríticas. Células
dendríticas foram infectadas conforme descrito na figura 6, porém utilizando uma proporção de 10 parasitos por célula.
Após 20 h de infecção, as células foram lavadas e incubadas com ATP, ADP ou AMP por 1 h, a 30°C, e a atividade
ectonucleotidásica avaliada pela liberação de P i, conforme descrito em Material e métodos. (A) Quantidade de Pi
produzido por 106 células a partir da hidrólise de ATP, ADP ou AMP. (B-D) Quantidade de Pi produzido por 106 células
a partir da hidrólise de ATP (B), ADP (C) ou AMP (D), na ausência (- Suramina) ou presença (+ Suramina) de suramina
200 µM. (E) Quantidade de Pi produzido por 106 células a partir da hidrólise de AMP, na ausência (-α,β-MAD) ou
presença (+α,β-MAD) de α,β-MAD 200 µM. Os resultados representam média e desvio padrão de 3 experimentos
independentes. Asteriscos indicam diferença estatística (p < 0,05, teste t de Student não pareado) entre os grupos ligados
(A) ou entre grupos não tratados e grupos tratados (B-E).
53
4. Resultados
4.6. Infecção por L. amazonensis favorece a expressão dos receptores de adenosina
A2A e A2B
A ação combinada de CD39 e CD73 sobre o ATP extracelular é a produção de
adenosina, que tem se mostrado capaz de diminuir a ativação de células dendríticas (Ben
Addi e cols., 2008; Hasko & Pacher, 2008; Hasko e cols., 2009; Novitskiy e cols., 2008),
agindo sobre os receptores P1, em particular, os receptores A2A e A2B. Assim, o próximo
objetivo deste trabalho foi verificar a expressão desses receptores em células dendríticas
infectadas com Leishmania. Pelos mesmos motivos apresentados para a dosagem da
atividade ectonucleotidásica, fez-se necessária a utilização de uma proporção de 10
parasitos por célula para a infecção de células dendríticas.
Nós observamos a expressão dos 4 receptores de adenosina em células dendríticas,
sendo eles A1, A2A, A2B e A3. Após o estímulo com LPS, a expressão dos receptores A1 e
A3 na superfície de células dendríticas foi estimulada e a expressão dos receptores A2A e
A2B inibida. No entanto, células dendríticas infectadas com L. amazonensis foram
refratárias a este estímulo, e observou-se uma perda da expressão dos receptores A1 e A3 e
um aumento significativo na expressão dos receptores A2A e A2B. Células dendríticas
infectadas por L. braziliensis foram capazes de expressar os 4 receptores de adenosina
igualmente. Por fim, células infectadas com L. major expressaram apenas os receptores
A2A, A2B e A3 (Figura 14).
Nesse momento, podemos sugerir que, apesar de a infecção por L. amazonensis, L.
braziliensis e L. major estimularem a expressão de CD39 e CD73 e a produção de
adenosina por células dendríticas, somente a infecção por L. amazonensis favorece a
expressão dos receptores de adenosina imunossupressores A2A e A2B, em detrimento da
expressão dos receptores A1 e A3, que são reguladores dos receptores A2.
54
4. Resultados
Figura 14. L. amazonensis estimula a expressão dos receptores A2A e A2B em células dendríticas. Células dendríticas
foram infectadas conforme descrito na figura 6, porém utilizando uma proporção de 10 parasitos por célula. Após 20 h de
infecção, sedimentaram-se as células em lâminas e avaliou-se a expressão dos receptores de adenosina por microscopia
de fluorescência conforme descrito em Material e métodos. As fotos são representativas de 3 experimentos
independentes.
4.7. L. amazonensis prejudica funções de células dendríticas por mecanismos
dependentes da hidrólise de ATP e da ativação do receptor de adenosina A2B
Uma vez mostrado que células dendríticas infectadas com L. amazonensis têm a
expressão dos receptores A2A e A2B aumentada, nosso próximo passo foi verificar se a
inibição desses receptores poderia alterar os efeitos da infecção por Leishmania sobre a
55
4. Resultados
ativação de células dendríticas. Inicialmente, células dendríticas foram infectadas com L.
amazonensis na presença de ZM241385 ou MRS1754, potentes antagonistas dos
receptores A2A e A2B, respectivamente. O tratamento com ZM241385 foi capaz de reverter
a inibição da ativação de células dendríticas infectadas somente quando utilizada uma
concentração muito alta (50 µM) (Figura 15A). Em contrapartida, o tratamento com
MRS1754 foi capaz de aumentar a expressão de marcadores de ativação na superfície de
células infectadas em todas as concentrações testadas (0,1 a 50 µM), numa relação dosedependente (Figura 15B), mostrando que somente a estimulação do receptor A2B é
importante para a inibição de células dendríticas infectadas com L. amazonensis.
Figura 15. L. amazonensis prejudica ativação de células dendríticas via receptor A2B. Células dendríticas foram
infectadas conforme descrito na figura 6 e analisadas por citometria de fluxo. (A-B) Células dendríticas e parasitos foram
tratados simultaneamente com diferentes concentrações dos antagonistas de receptores de adenosina ZM241385 (A) ou
MRS1754 (B) no momento da infecção. A porcentagem de células MHCII+CD86+ nas populações de células não
infectadas e de células infectadas nos grupos tratados foram expressos em relação ao grupo de células incubadas com
parasitos na ausência de tratamentos, considerado 100 (linha pontilhada), e representam média e desvio padrão de 3
experimentos independentes. Asteriscos indicam diferença estatística (p < 0,05, teste t de uma amostra contra o valor
hipotético de 100) em relação ao grupo não tratado.
Para melhor caracterizar a participação da sinalização purinérgica no prejuízo da
ativação de células dendríticas, seguimos com a avaliação do papel da ENTPDase
(responsável pela hidrólise inicial de ATP e que, além de diminuir a concentração desse
nucleotídeo pró-inflamatório, diminui a quantidade de substrato, AMP, para ser utilizado
pela 5’-nucleotidase), assim como do papel do receptor A2B (ativado pela adenosina
produzida pela ação das ectonucleotidases), na inibição das funções de células dendríticas
durante a infecção por L. amazonensis, L. braziliensis ou L. major. Para isso, células
dendríticas foram infectadas na presença de suramina 200 µM ou de MRS1754 50 µM (a
56
4. Resultados
concentração que melhor estimulou a expressão de marcadores de ativação em células
dendríticas infectadas com L. amazonensis).
Nossos resultados mostram que a incubação simultânea de suramina com parasitos
e células dendríticas reverteu parcialmente a redução da expressão de MHCII e CD86 em
células infectadas, independentemente da espécie de Leishmania utilizada. De forma
diferente, o tratamento com MRS1754 reverteu a inibição da expressão desses marcadores
de ativação somente em células dendríticas infectadas com L. amazonensis (Figura 16A,
C). Além disso, ambos os tratamentos aumentaram a expressão de CD40 em células
dendríticas não infectadas e em células dendríticas infectadas após a incubação com L.
amazonensis. Porém, nenhum efeito foi observado em células infectadas com L.
braziliensis ou L. major (Figura 16B-C).
57
4. Resultados
Figura 16. Leishmania prejudica ativação de células dendríticas via ectonucleotidases e/ou receptor A2B. Células
dendríticas foram infectadas conforme descrito na figura 6 e analisadas por citometria de fluxo. Células dendríticas e
parasitos foram tratados simultaneamente com 200 µM de suramina ou 50 µM de MRS1754 no momento da infecção. A
porcentagem de células MHCII+CD86+ (A) e de células CD40+ (B) nas populações de células não infectadas e de células
infectadas nos grupos tratados foram expressos em relação ao grupo de células incubadas com parasitos na ausência de
tratamentos, considerado 100 (linha pontilhada), e representam média e desvio padrão de pelo menos 3 experimentos
independentes. Asteriscos indicam diferença estatística (p < 0,05, teste t de uma amostra contra o valor hipotético de 100)
em relação ao grupo não tratado. (C) Dot plots representativos das populações de células dendríticas infectadas com L.
amazonensis, L. braziliensis ou L. major não tratadas (à esquerda) ou tratadas com o suramina (ao centro) ou MRS1754
(à direita). Os números entre parêntes representam a porcentagem de células dendríticas MHCII +CD86+ ou CD40+.
Considerando os efeitos da infecção por Leishmania na expressão de MHCII, CD86
e CD40 em células dendríticas, avaliou-se como e quanto a infecção poderia alterar a
habilidade de células dendríticas de induzir a proliferação de linfócitos. Para atingir esse
objetivo, linfócitos T CD4+ purificados de baços de camundongos C57BL/6J infectados
com L. amazonensis (para o ensaio de proliferação antígeno-específica) ou células de
baços de camundongos BALB/c (para o ensaio de MLR) foram marcadas com CFSE e
58
4. Resultados
incubadas com células dendríticas de camundongos C57BL/6J previamente infectadas. A
proliferação de linfócitos foi avaliada após 4 dias por citometria de fluxo (Figura 17A).
Nossos resultados mostram que a diminuição da ativação de células dendríticas
induzida por L. amazonensis resultou em uma inibição da MLR. Por outro lado, a infecção
por L. braziliensis ou L. major não interferiram com a proliferação de linfócitos (Figura
17B). Além disso, a proliferação antígeno-específica foi reduzida quando células
dendríticas foram infectadas com L. amazonensis, se comparadas a células dendríticas
infectadas com L. braziliensis ou L. major (Figura 17C). Para confirmar o papel da
sinalização purinérgica na inibição das funções de células dendríticas por L. amazonensis,
células dendríticas foram tratadas com suramina ou MRS1754 durante a infecção com essa
espécie de parasito. Antes da incubação com linfócitos marcados com CFSE, as células
dendríticas foram lavadas para a remoção dos inibidores adicionados. O tratamento de
células dendríticas com suramina ou MRS1754 resultou em um uma estimulação da MLR
assim como num aumento da proliferação de células T CD4+ antígeno-específicas, quando
comparadas a células dendríticas infectadas e não tratadas (Figura 17D-E).
Em conjunto, esses resultados sugerem que ectonucleotidases são importantes para
a redução da expressão de MHCII e CD86 em células dendríticas infectadas por todas as
espécies de parasitos utilizadas. No entanto, somente a infecção de células dendríticas por
L. amazonensis ativa o receptor de adenosina A2B, que inibe, além da expressão de MHCII
e CD86, a expressão de CD40, e consequentemente a habilidade de células dendríticas de
estimular a proliferação de linfócitos.
59
4. Resultados
Figura 17. L. amazonensis prejudica a proliferação de linfócitos por mecanismos
dependentes da hidrólise de ATP e da ativação do receptor A2B. Células do baço de
camundongos BALB/c não-infectados e linfócitos T CD4+ de camundongos C57BL/6J
previamente infectados com L. amazonensis foram marcados com CFSE para ensaio de MLR (B e
D) ou ensaio de proliferação antígeno-específica (C e E), respectivamente. Células marcadas com
CFSE foram co-cultivadas na presença de células dendríticas de camundongos C57BL/6J
infectadas. A infecção de células dendríticas com L. amazonensis também foi realizada na
presença de 200 µM de suramina ou 50 µM de MRS1754. Após 4 dias, a proliferação de células
CD3+ foi avaliada por citometria de fluxo (A). (B-E) Porcentagem de células CD3+ que dividiram.
Os resultados representam média e desvio padrão de 3 experimentos independentes. Asteriscos
indicam diferença estatística (p < 0,05, teste t de Student não pareado) em relação ao grupo
controle (células dendríticas estimuladas com LPS), e # indica diferença estatística (p < 0,05,
ANOVA one-way seguida pelo pós-teste de Tukey para comparação entre as espécies de
parasitos, ou teste t de Student não pareado para a comparação entre os grupos La e La com
tratamento) em relação ao grupo La.
60
5. SUMÁRIO DOS RESULTADOS
5. Sumário
5. SUMÁRIO DOS RESULTADOS
Após 20 horas de incubação, L. amazonensis, L, braziliensis e L. major infectaram
igualmente células dendríticas, sem alterarem a viabilidade celular (Figura 6).
De maneira geral, os marcadores de superfície MHCII, CD86 e CD40 foram
diferencialmente expressos em células infectadas e células, que apesar de terem
entrado em contato com os parasitos, permaneceram não infectadas (Figura 8).
Células dendríticas infectadas por Leishmania foram refratárias ao estímulo com
LPS e diminuíram a expressão de MHCII e CD86. Porém, apenas células infectadas
com L. amazonensis tiveram a expressão de CD40 prejudicada (Figura 8).
A inibição da ativação de células dendríticas por L. amazonensis foi independente
de IL-10, enquanto a inibição por L. braziliensis ou L. major foi parcialmente
dependente dessa citocina (Figura 10).
A inibição da ENTPDase de L. amazonensis pela suramina não reverteu a inibição
da expressão de MHCII e CD86 em células dendríticas infectadas. Porém, o
tratamento simultâneo de células dendríticas e parasitos com esse mesmo inibidor
aumentou a expressão de MHCII e CD86 em células infectadas com L.
amazonensis, L. braziliensis ou L. major. Além disso, esse mesmo tratamento
aumentou a expressão de CD40 somente em células incubadas na presença de L.
amazonensis (Figuras 11 e 16).
A infecção por L. amazonensis, L. braziliensis ou L. major aumentou a expressão e
a atividade de CD39 e CD73 em células dendríticas (Figuras 12 e 13).
Apenas L. amazonensis favoreceu a expressão dos receptores de adenosina A2A e
A2B em células dendríticas (Figura 14).
A inibição da ativação de células dendríticas por L. amazonensis foi independente
do receptor de adenosina A2A (Figura 15).
O tratamento com MRS1754, um antagonista do receptor de adenosina A2B,
aumentou a expressão de MHCII e CD86 em células dendríticas infectadas com L.
amazonensis, e a expressão de CD40 em células não infectadas e infectadas que
entraram em contato com o mesmo parasito (Figura 16).
Células dendríticas infectadas com L. amazonensis foram menos capazes de
estimular a proliferação de linfócitos, e o tratamento com suramina ou MRS1754
reverteram o prejuízo dessa função (Figura 17).
62
6. DISCUSSÃO
6. Discussão
6. DISCUSSÃO
Os efeitos da infecção por parasitos do gênero Leishmania na ativação, maturação e
migração de células dendríticas é dependente de inúmeros fatores, como a espécie ou a
cepa do parasito e o estágio de desenvolvimento do mesmo, o subtipo de célula dendrítica
analisada, assim como as condições experimentais do estudo (in vivo ou in vitro, com ou
sem estimulação adicional, etc.), como revisado por Soong (Soong, 2008).
Inicialmente, fizemos uma análise comparativa do nível de infecção de células
dendríticas por diferentes espécies de Leishmania. Os resultados da Figura 6 sugerem que
L. amazonensis é mais eficiente para infectar células dendríticas porque essa espécie foi
capaz de infectar uma maior quantidade de células após 3 horas de incubação, quando
comparada à L. braziliensis ou L. major. Porém, as taxas de infecção se igualaram após 20
horas de infecção. É importante considerar que durante uma infecção natural, esses
parasitos despendem poucas horas para infectarem suas células hospedeiras, já que são
protozoários intracelulares obrigatórios. Uma vez que L. amazonensis é mais rápida para
infectar células hospedeiras, isso poderia favorecer a sobrevivência e permanência do
parasito. Existe uma carência de análises comparativas sobre a capacidade de diferentes
espécies de Leishmania de infectarem células dendríticas, mas um estudo sugere que a
associação entre moléculas presentes na superfície dos parasitos e o receptor de célula
dendrítica DC-SIGN determinam o sucesso de uma ou outra espécie de Leishmania
(Colmenares e cols., 2004).
É amplamente aceito que a interação de promastigotas de Leishmania com células
dendríticas causará a ativação dessas células (Qi e cols., 2001; Xin e cols., 2008), como
mostrado pelo aumento da expressão de MHCII e co-estimuladores (CD40, CD80, CD83 e
CD86) e o estímulo à proliferação de células T CD4+. Porém, com exceção de um número
limitado de estudos, a avaliação da ativação de células dendríticas foi feita em culturas
totais, sem analisar separadamente as células infectadas e as células não infectadas.
Quando esse cuidado foi tomado, a infecção de células dendríticas foi associada à inibição
da ativação dessas células (Carvalho e cols., 2008; Prina e cols., 2004). Nossos dados
(Figura 8) corroboram esses estudos por mostrarem que células dendríticas infectadas com
Leishmania são refratárias à ativação por LPS, uma vez que a expressão de MHCII e CD86
foi diminuída quando comparada à expressão em células tratadas com LPS e não
infectadas. A possibilidade dos parasitos prejudicarem a ativação de células dendríticas por
interferirem com a sinalização do LPS via receptor TLR-4 foi descartada porque a infecção
64
6. Discussão
por Leishmania foi capaz de inibir a ativação das células mesmo na ausência de LPS
(dados não mostrados).
No que diz respeito à expressão de CD40, enquanto a infecção com L. braziliensis
ou L. major estimulou a expressão de CD40 em células infectadas, a infecção por L.
amazonensis não alterou a expressão dessa molécula, mantendo-a em valores semelhantes
ao encontrado para células não infectadas (Figura 8). Discrepâncias na expressão de CD40
em células dendríticas infectadas com diferentes espécies de Leishmania já foram
observadas. Foi mostrado que a expressão de CD40 foi menor em células dendríticas
infectadas com L. amazonensis que em células dendríticas infectadas com L. major
(Boggiatto e cols., 2009). Nossos resultados confirmam essas observações e ainda
estendem a análise para a infecção por L. braziliensis. Adicionalmente, uma menor
expressão de CD40 foi observada em macrófagos infectados com L. donovani (Buates &
Matlashewski, 2001) e células dendríticas infectadas com L. infantum (Neves e cols.,
2010). Ainda é possível associar o prejuízo na expressão de CD40 à geração de células T
reguladoras e à susceptibilidade à infecção por L. donovani (Martin e cols., 2010). Um
trabalho de nosso grupo mostrou que camundongos C57BL/6J são mais susceptíveis à
infecção por L. amazonensis que à infecção por L. braziliensis ou L. major (Marques-daSilva e cols., 2008). É importante lembrar que apenas L. amazonensis foi capaz de inibir a
expressão de CD40 em células dendríticas.
Os mecanismos pelos quais a infecção por Leishmania inibe a ativação de células
dendríticas não são completamente conhecidos, embora um aumento na produção de IL-10
venha sendo frequentemente sugerido como um possível fator (Belkaid e cols., 2001;
Vasquez e cols., 2008; Xin e cols., 2008). No entanto, já foi demonstrado que a
neutralização de IL-10 não reverte a inibição de células dendríticas, ao menos no que diz
respeito à produção de IL-12 (Soong, 2008). Em nosso trabalho, o envolvimento de IL-10
na supressão da ativação de células dendríticas infectadas foi dependente da espécie de
Leishmania utilizada. A inibição da ativação de células dendríticas foi parcialmente
dependente do receptor de IL-10 durante a infecção por L. braziliensis ou L. major. Por
outro lado, não foi encontrada nenhuma evidência que IL-10 pode estar envolvida na
inibição da ativação de células dendríticas infectadas por L. amazonensis (Figura 10).
Nucleotídeos e nucleosídeos extracelulares têm sido mostrados como capazes de
afetar a ativação e a migração de células dendríticas. Por exemplo, o ATP extracelular
induz a maturação de células dendríticas e a ativação de células do tipo Th1 enquanto a
adenosina inibe a ativação de células dendríticas e a produção de citocinas pró65
6. Discussão
inflamatórias (Hofer e cols., 2003; La Sala e cols., 2001; Panther e cols., 2003; Schnurr e
cols., 2000). O ATP extracelular é acumulado em situações de injúria celular ou infecção e
é considerado um “sinal de perigo” (La Sala e cols., 2003). A liberação de ATP pode ser
mediada por receptores P2X7, que não somente sinalizam concentrações extracelulares
dessa molécula, mas também estão envolvidos com a sua secreção (Pellegatti e cols.,
2005). Interessantemente, L. amazonensis aumenta a expressão do receptor P2X7 em
macrófagos murinos (Chaves e cols., 2009). É possível que esse mesmo mecanismo esteja
presente em células dendríticas infectadas com Leishmania.
Como já foi descrito, parasitos do gênero Leishmania expressam em sua superfície
ectonucleotidases capazes de converter ATP à adenosina (Marques-da-Silva e cols., 2008).
Baseados nessa observação, e de que L. amazonensis é a espécie com maior expressão
dessas enzimas, hipotetizamos que a produção de adenosina pela enzima do parasito estaria
envolvida na inibição da ativação de células dendríticas infectadas com L. amazonensis.
Nossos resultados, no entanto, demonstraram que a incubação prévia do parasito com
suramina, o que levaria à maior concentração de ATP por inibir sua degradação por
ENTPDase, não alterou o estado de ativação da célula infectada (Figura 11). Porém, esse
resultado não descarta o papel das ectonucleotidases presentes em parasitos do gênero
Leishmania como fatores de virulência e como moduladores da resposta imune, já que
durante a infecção, in vivo, essas enzimas podem ser importantes para a modulação de
outros tipos celulares, como neutrófilos, macrófagos e linfócitos. Curiosamente, quando
suramina foi adicionada no momento da infecção de células dendríticas, fomos capazes de
restaurar a habilidade do LPS de estimular a expressão de MHCII e CD86 por células
infectadas (Fig. 11). Estes resultados sugerem que o inibidor atuou em enzimas da própria
célula dendrítica, e não em enzimas do parasito. Isto nos encorajou a investigar a expressão
e o papel de ectonucleotidases expressas em células dendríticas.
Em mamíferos, as concentrações de ATP extracelular e adenosina também são
controladas pela ação dessas enzimas: ENTPDase (CD39), que hidrolisa ATP para ADP e
então para AMP, e 5’-nucleotidase (CD73), que converte o AMP a adenosina (Berchtold e
cols., 1999; Bours e cols., 2006). A expressão de CD39 e CD73 foi significativamente
aumentada em células dendríticas infectadas, assim como a atividade ectonucleotidásica
dessas células, independentemente da espécie de parasito utilizada para a infecção (Figuras
12-13). O aumento da expressão e da atividade de ectonucleotidases pode ser benéfico para
os parasitos, uma vez que esse mecanismo garante a produção de adenosina extracelular
mesmo após sua internalização, então prevenindo a ativação de células dendríticas.
66
6. Discussão
Essa hipótese foi inicialmente confirmada para todas as espécies de parasitos
utilizadas neste trabalho, pela recuperação da expressão de MHCII e CD86 na presença de
suramina (Figura 16), que poderia prevenir a hidrólise de ATP por inibir a atividade da
ENTPDase, e então diminuir o substrato (AMP) disponível para a 5’-nucleotidase, com
uma consequente redução na produção de adenosina.
Schnurr e colaboradores mostraram que o tratamento com suramina foi capaz de
diminuir a expressão de CD86 em células dendríticas, por atuar em receptores de ATP
(Schnurr e cols., 2000). Em nosso estudo, a suramina aumentou, ao invés de diminuir, a
expressão de MHCII e CD86, sugerindo que ela atuou, predominantemente, sobre a
atividade da ENTPDase (CD39). Além disso, quando utilizada numa concentração de 30
µM (concentração suficiente para bloquear os receptores P2, mas não inibir a atividade da
ENTPDase), a suramina não foi capaz de alterar a expressão de marcadores de ativação em
células dendríticas infectadas (Figura 11).
A adenosina exerce seus efeitos pelos receptores A1, A2A, A2B e A3 (Abbracchio &
Ceruti, 2007). Alguns estudos têm apontado o receptor A2B como o principal receptor
envolvido na inibição da resposta de células dendríticas no modelo murino (Novitskiy e
cols., 2008; Wilson e cols., 2009). Consistente com o papel da adenosina na inibição da
resposta de células dendríticas em nossos experimentos, o bloqueio do receptor A2B
também foi capaz de reverter a diminuição da expressão dos marcadores de ativação em
células dendríticas infectadas, como previamente mostrado para suramina. Porém, esse
receptor foi envolvido somente na infecção por L. amazonensis, independentemente do
marcador de ativação avaliado (MHCII, CD86 e CD40) (Figura 16), corroborando a
expressão diferenciada desse receptor entre células dendríticas infectadas com L.
amazonensis, L. braziliensis ou L. major (Figura 14). Curiosamente, a expressão de MHCII
e CD86 foi aumentada somente nas células infectadas, enquanto a expressão de CD40 foi
aumentada nas células infectadas e nas células que permaneceram não infectadas após o
contato com o parasito. É possível que a expressão de CD40 seja estimulada, após o
tratamento com MRS1754, por algum fator secretado pelas células infectadas, que será
capaz de agir em todas as células vizinhas, inclusive as não infectadas. É possível, ainda,
que células tratadas tenham perdido a capacidade de secretar aquele fator que mantinha a
expressão de CD40 baixa. Nós ainda não temos evidências sobre quais seriam esses
fatores, mas sabe-se que a expressão de CD40 é estimulada por TNF-α e inibida por TGF-β
(Benveniste e cols., 2004). Apesar de células dendríticas infectadas por L. braziliensis ou
L. major não expressarem os receptores de adenosina envolvidos na supressão da resposta
67
6. Discussão
dessas células, nada impede que a adenosina produzida por células infectadas interfira
sobre as funções de outras células imunes.
Embora L. amazonensis tenho sido capaz de favorecer a expressão dos receptores
A2A e A2B (Figura 14), somente o receptor A2B mostrou-se importante no processo de
inibição da resposta de células dendríticas induzida por esses parasitos (Figura 16). Um
trabalho recente mostrou que o receptor A2A está envolvido com a expressão do receptor
A2B na superfície celular (Moriyama & Sitkovsky, 2010), e talvez seja essa a relevância
para a presença desse receptor na superfície de células dendríticas infectadas com L.
amazonensis. Não podemos descartar a possibilidade de que maior atividade do receptor
A2B pode, ainda, ser devida a ausência de expressão dos receptores A1 e A3 em células
dendríticas infectadas com L. amazonensis. Por esse motivo, essas células não teriam a
regulação dos receptores A1 e A3 e a imunossupressão mediada pelo receptor A2B
prevaleceria (Abbracchio & Ceruti, 2007).
A infecção por L. amazonensis é caracterizada pela diminuição da proliferação de
linfócitos tanto em humanos como no modelo murino (Barral e cols., 1995; Maioli e cols.,
2004), e esse efeito foi reproduzido em nosso modelo. Somente células dendríticas
infectadas com L. amazonensis perderam sua habilidade de estimular a proliferação de
linfócitos, e o tratamento com suramina ou MRS1754 restaurou a habilidade dessas células
(Figuras 17). Em nosso trabalho, a expressão de CD40 mostrou-se essencial para a indução
de uma resposta celular, uma vez que células dendríticas infectadas com L. amazonensis
foram incapazes de expressar CD40 e o tratamento com suramina ou MRS1754 estimulou
a expressão desse marcador. Apesar de diminuírem a expressão de MHCII e CD86, células
dendríticas infectadas com L. braziliensis ou L. major, e que apresentaram maior expressão
de CD40, foram capazes de estimular a proliferação de linfócitos (Figuras 17). Num estudo
que avaliou as contribuições de diferentes moléculas co-estimuladoras nas reações de
rejeição a transplantes, foi demonstrado que CD40 de origem suína foi capaz de coestimular células T CD4+ humanas, independentemente da expressão de CD80/CD86
(Rogers e cols., 2003). Um segundo estudo mostrou que a ausência de CD40 ou CD40L
impedem células dendríticas de induzirem uma resposta adequada tanto de linfócitos T
CD4+ quanto de linfócitos T CD8+, mesmo quando células dendríticas expressam altos
níveis de peptídeo conjugado a moléculas de MHC e de moléculas co-estimuladoras
(CD80 e CD86) (Fujii e cols., 2004). Por fim, a interação entre o CD40 expresso em
células dendríticas e o CD40 ligante expresso em linfócitos ativados estimula a expressão
de marcadores de ativação e moléculas de adesão em células dendríticas (Ni & O'Neill,
68
6. Discussão
1997), o que poderia reverter a inibição da expressão de MHCII e CD86 em células
dendríticas infectadas com L. braziliensis ou L. major.
Como mencionado anteriormente, a expressão diferenciada de CD40 por diferentes
espécies de Leishmania já foi avaliada (Boggiatto e cols., 2009). Pouco se sabe sobre os
mecanismos envolvidos na regulação da expressão de CD40. Boggiato e cols. (2009)
demonstraram que a inibição da fosforilação de ERK1/2 restaurou a expressão de CD40
em células dendríticas infectadas com L. amazonensis. Interessantemente, a ativação do
receptor A2B também induz a fosforilação de ERK1/2 (Schulte & Fredholm, 2003). Então,
é possível que o bloqueio do receptor A2B em células dendríticas infectadas com L.
amazonensis leva à inibição da fosforilação de ERK1/2, com consequente restauração da
expressão de CD40.
A presença de adenosina no meio extracelular pode facilitar a permanência de
parasitos do gênero Leishmania no hospedeiro, devido às inúmeras propriedades
imunossupressoras dessa molécula (Bours e cols., 2006; Deaglio e cols., 2007; Hofer e
cols., 2003; Kumar & Sharma, 2009; Panther e cols., 2003). Um estudo recente mostrou
que a expressão de CD39 e a produção de adenosina foram aumentadas numa população de
células dendríticas tolerogênicas, caracterizadas por baixos níveis de CD40 e IL-12p40 e
menor habilidade de induzir a proliferação de células T (Torres-Aguilar e cols., 2010).
Outro trabalho apontou o AMPc (resultante da ativação de receptores A2, por exemplo)
como um componente chave para a inibição da expressão de marcadores de ativação em
células dendríticas mediada por células T reguladoras, enquanto a IL-10 não teve nenhuma
influência nesse aspecto, só sendo importante para a diminuição da produção de IL-12 e
IL-6 num momento mais tardio (Fassbender e cols., 2010). Encontramos resultados
similares quando células dendríticas foram infectadas com L. amazonensis. Além disso, a
ativação de receptores A2B prejudica a maturação de células dendríticas e,
consequentemente, reduz sua habilidade de ativar células T CD4+, em adição ao prejuízo
das funções de outras células imunes (Hasko e cols., 2009; Wilson e cols., 2009).
Interessantemente, recentemente foi mostrado que células de Langerhans, a população de
células dendríticas presente na pele, são reguladores negativos da resposta antiLeishmania, principalmente por estimular a expansão e a ativação de células T reguladoras
(Kautz-Neu e cols., 2011). Sem desconsiderar todas essas informações prévias, nosso
trabalho é inovador por mostrar, pela primeira vez em nosso conhecimento, que a infecção
de células dendríticas por parasitos protozoários (L. amazonensis) leva a uma diminuição
69
6. Discussão
na ativação de células dendríticas por um mecanismo dependente da expressão de
ectonucleotidases a ativação de receptores A2B.
Nossos resultados contribuem para o conhecimento dos mecanismos de evasão da
resposta imune por L. amazonensis, que é responsável por uma das mais graves formas de
leishmaniose cutânea, isto é, a leishmaniose cutânea difusa, uma doença caracterizada pela
anergia de células T em pacientes afetados. Em contrapartida, a infecção por L. braziliensis
ou L. major é, na maioria das vezes, caracterizada por uma forte resposta imune celular,
que parece levar ao controle do parasito (Da-Cruz & Pirmez, 2005). De acordo com nossos
dados, não observamos o envolvimento de receptores A2B em células dendríticas infectadas
por esses parasitos. Nesse caso, uma diminuição menos intensa da ativação de células
dendríticas foi observada, e que parece ser parcialmente mediada por IL-10. Em resumo,
nosso trabalho demonstrou um novo mecanismo de evasão da resposta imune por L.
amazonensis, via ativação de receptores A2B em células dendríticas infectadas (Figura 18).
Figura 18. Mecanismos utilizados por L. amazonensis, L. braziliensis e L. major para inibir funções de células
dendríticas e evadir a resposta imune. Infecção por L. amazonensis aumenta a expressão de CD39 e CD73, garantindo
a produção de adenosina (ADO). Adenosina ativa o receptor A2B e prejudica a ativação de células dendríticas infectadas,
especialmente por deficiência da expressão de CD40 e, consequentemente, reduz sua capacidade de estimular a
proliferação de linfócitos. L. braziliensis e L. major, apesar de induzirem o aumento da expressão de CD39 e CD73 e a
produção de adenosina, não ativam o receptor A2B. Estas duas espécies diminuem a expressão de MHCII e CD86, com a
participação de receptor de IL-10 (IL-10R), mas aumentam a expressão de CD40, e não afetam significativamente a
capacidade de células dendríticas de estimular a proliferação celular.
Futuramente, pretendemos caracterizar as vias de sinalização envolvidas com a
possível ativação por receptores de adenosina e a participação desses mecanismos na
migração de células dendríticas, in vivo. Além disso, a partir da descrição que células de
70
6. Discussão
Langerhans são importantes para a geração de células T reguladoras e consequente
supressão da resposta anti-Leishmania (Kautz-Neu e cols., 2011), pretendemos avaliar a
indução de células T reguladoras a partir da infecção por diferentes espécies de
Leishmania, bem como o envolvimento da sinalização purinérgica nesse processo.
Considerando que as leishmanioses consistem num grave problema de saúde
pública, que a manifestação da doença está intimamente relacionada à montagem da
resposta imune pelo hospedeiro, e que células dendríticas são células essenciais nessa
resposta, investigações de novos fatores de virulência do parasito e o melhor entendimento
das relações parasito-hospedeiro e dos mecanismos de evasão envolvidos abrem um
caminho para novas propostas terapêuticas para o controle da infecção por Leishmania.
71
7. CONCLUSÃO
7. Conclusão
7. CONCLUSÃO
Nossos resultados nos permitem concluir que L. amazonensis, L. braziliensis e L.
major aumentam a expressão de ectonucleotidases e consequentemente a produção de
adenosina por células dendríticas infectadas, e que essas enzimas são importantes para a
redução da expressão de MHCII e CD86 nessas células, independentemente da espécie de
parasito utilizada. No entanto, apenas a infecção de células dendríticas por L. amazonensis
é capaz de ativar o receptor de adenosina A2B, que inibe, além da expressão de MHCII e
CD86, a expressão de CD40 e, consequentemente, a capacidade de células dendríticas de
estimular a proliferação de linfócitos.
73
8. REFERÊNCIAS BIBLIOGRÁFICAS
8. Referências bibliográficas
8. REFERÊNCIAS BIBLIOGRÁFICAS
ABBRACCHIO M.P. & CERUTI S. (2007) P1 receptors and cytokine secretion.
Purinergic.Signal. 3, 13-25.
AFONSO L., BORGES V.M., CRUZ H., RIBEIRO-GOMES F.L., DOSREIS G.A.,
DUTRA A.N., CLARENCIO J., DE OLIVEIRA C.I., BARRAL A., BARRALNETTO M. & BRODSKYN C.I. (2008) Interactions with apoptotic but not with
necrotic neutrophils increase parasite burden in human macrophages infected with
Leishmania amazonensis. J.Leukoc.Biol. 84, 389-396.
AFONSO L.C.C., SCHARTON T.M., VIEIRA L.Q., WYSOCKA M., TRINCHIERI G. &
SCOTT P. (1994) The adjuvant effect of interleukin-12 in a vaccine against
Leishmania major. Science 263, 235-237.
AFONSO L.C.C. & SCOTT P. (1993) Immune responses associated with susceptibility of
C57BL/10 mice to Leishmania amazonensis. Infect.Immun. 61, 2952-2959.
AHERNE C.M., KEWLEY E.M. & ELTZSCHIG H.K. (2011) The resurgence of A2B
adenosine receptor signaling. Biochim.Biophys.Acta 1808, 1329-1339.
ASAI T., MIURA S., SIBLEY L.D., OKABAYASHI H. & TAKEUCHI T. (1995)
Biochemical and molecular characterization of nucleoside triphosphate hydrolase
isozymes from the parasitic protozoan Toxoplasma gondii.
J.Biol.Chem. 270,
11391-11397.
ATO M., STAGER S., ENGWERDA C.R. & KAYE P.M. (2002) Defective CCR7
expression on dendritic cells contributes to the development of visceral
leishmaniasis. Nat.Immunol. 3, 1185-1191.
AWASTHI A., MATHUR R.K. & SAHA B. (2004) Immune response to Leishmania
infection. Indian J.Med.Res. 119, 238-258.
BANCHEREAU J., BRIERE F., CAUX C., DAVOUST J., LEBECQUE S., LIU Y.J.,
PULENDRAN B. & PALUCKA K. (2000) Immunobiology of dendritic cells.
Annu.Rev.Immunol. 18, 767-811.
75
8. Referências bibliográficas
BARRAL A., COSTA J.M., BITTENCOURT A.L., BARRAL-NETTO M. &
CARVALHO E.M. (1995) Polar and subpolar diffuse cutaneous leishmaniasis in
Brazil: clinical and immunopathologic aspects. Int.J.Dermatol. 34, 474-479.
BELKAID Y., HOFFMANN K.F., MENDEZ S., KAMHAWI S., UDEY M.C., WYNN
T.A. & SACKS D.L. (2001) The role of interleukin (IL)-10 in the persistence of
Leishmania major in the skin after healing and the therapeutic potential of anti-IL10 receptor antibody for sterile cure. J.Exp.Med. 194, 1497-1506.
BEN ADDI A., LEFORT A., HUA X., LIBERT F., COMMUNI D., LEDENT C.,
MACOURS P., TILLEY S.L., BOEYNAEMS J.M. & ROBAYE B. (2008)
Modulation of murine dendritic cell function by adenine nucleotides and adenosine:
involvement of the A(2B) receptor. Eur.J.Immunol. 38, 1610-1620.
BENVENISTE E.N., NGUYEN V.T. & WESEMANN D.R. (2004) Molecular regulation
of CD40 gene expression in macrophages and microglia. Brain Behav.Immun. 18,
7-12.
BERCHTOLD S., OGILVIE A.L., BOGDAN C., MUHL-ZURBES P., OGILVIE A.,
SCHULER G. & STEINKASSERER A. (1999) Human monocyte derived dendritic
cells express functional P2X and P2Y receptors as well as ecto-nucleotidases.
FEBS Lett. 458, 424-428.
BERREDO-PINHO M., PERES-SAMPAIO C.E., CHRISPIM P.P., BELMONT-FIRPO
R., LEMOS A.P., MARTINY A., VANNIER-SANTOS M.A. & MEYERFERNANDES J.R. (2001) A Mg-dependent ecto-ATPase in Leishmania
amazonensis and its possible role in adenosine acquisition and virulence.
Arch.Biochem.Biophys. 391, 16-24.
BISAGGIO D.F., PERES-SAMPAIO C.E., MEYER-FERNANDES J.R. & SOUTOPADRON T. (2003) Ecto-ATPase activity on the surface of Trypanosoma cruzi and
its possible role in the parasite-host cell interaction. Parasitol.Res. 91, 273-282.
BOGGIATTO P.M., JIE F., GHOSH M., GIBSON-CORLEY K.N., RAMER-TAIT A.E.,
JONES D.E. & PETERSEN C.A. (2009) Altered dendritic cell phenotype in
response to Leishmania amazonensis amastigote infection is mediated by MAP
kinase, ERK. Am.J.Pathol. 174, 1818-1826.
76
8. Referências bibliográficas
BORSELLINO G., KLEINEWIETFELD M., DI M.D., STERNJAK A., DIAMANTINI
A.,
GIOMETTO
R.,
HOPNER
S.,
CENTONZE
D.,
BERNARDI G.,
DELL'ACQUA M.L., ROSSINI P.M., BATTISTINI L., ROTZSCHKE O. &
FALK K. (2007) Expression of ectonucleotidase CD39 by Foxp3+ Treg cells:
hydrolysis of extracellular ATP and immune suppression. Blood 110, 1225-1232.
BOURS M.J., SWENNEN E.L., DI VIRGILIO F., CRONSTEIN B.N. & DAGNELIE P.C.
(2006) Adenosine 5'-triphosphate and adenosine as endogenous signaling
molecules in immunity and inflammation. Pharmacol.Ther. 112, 358-404.
BRANDONISIO O., SPINELLI R. & PEPE M. (2004) Dendritic cells in Leishmania
infection. Microbes.Infect. 6, 1402-1409.
BRODIE T.M., SMITH M.C., MORRIS R.V. & TITUS R.G. (2007) Immunomodulatory
effects of the Lutzomyia longipalpis salivary gland protein maxadilan on mouse
macrophages. Infect.Immun. 75, 2359-2365.
BUATES S. & MATLASHEWSKI G. (2001) General suppression of macrophage gene
expression during Leishmania donovani infection. J.Immunol. 166, 3416-3422.
CARREGARO V., VALENZUELA J.G., CUNHA T.M., VERRI W.A., Jr., GRESPAN R.,
MATSUMURA G., RIBEIRO J.M., ELNAIEM D.E., SILVA J.S. & CUNHA F.Q.
(2008) Phlebotomine salivas inhibit immune inflammation-induced neutrophil
migration via an autocrine DC-derived PGE2/IL-10 sequential pathway.
J.Leukoc.Biol. 84, 104-114.
CARVALHO L.P., PEARCE E.J. & SCOTT P. (2008) Functional dichotomy of dendritic
cells following interaction with Leishmania braziliensis: infected cells produce
high levels of TNF-alpha, whereas bystander dendritic cells are activated to
promote T cell responses. J.Immunol. 181, 6473-6480.
CHAVES
S.P.,
TORRES-SANTOS
E.C.,
MARQUES
C.,
FIGLIUOLO
V.R.,
PERSECHINI P.M., COUTINHO-SILVA R. & ROSSI-BERGMANN B. (2009)
Modulation of P2X(7) purinergic receptor in macrophages by Leishmania
amazonensis and its role in parasite elimination. Microbes.Infect. 11, 842-849.
COIMBRA E.S., GONCALVES-DA-COSTA S.C., CORTE-REAL S., FREITAS F.G.,
DURAO A.C., SOUZA C.S., SILVA-SANTOS M.I. & VASCONCELOS E.G.
77
8. Referências bibliográficas
(2002)
Characterization
and
cytochemical
localization
of
an
ATP
diphosphohydrolase from Leishmania amazonensis promastigotes. Parasitology
124, 137-143.
COLMENARES M., CORBI A.L., TURCO S.J. & RIVAS L. (2004) The dendritic cell
receptor DC-SIGN discriminates among species and life cycle forms of
Leishmania. J.Immunol. 172, 1186-1190.
COQUERELLE C. & MOSER M. (2010) DC subsets in positive and negative regulation
of immunity. Immunol.Rev. 234, 317-334.
CORINTI S., ALBANESI C., LA S.A., PASTORE S. & GIROLOMONI G. (2001)
Regulatory activity of autocrine IL-10 on dendritic cell functions. J.Immunol. 166,
4312-4318.
CUMBERBATCH M., DEARMAN R.J., GRIFFITHS C.E. & KIMBER I. (2000)
Langerhans cell migration. Clin.Exp.Dermatol. 25, 413-418.
DA-CRUZ A.M. & PIRMEZ C. (2005) Leishmaniose Tegumentar Americana. In
Dinâmica das Doenças Infecciosas e Parasitárias. Guanabara Koogan Ed. Ed José
Rodrigues Coura. Rio de Janeiro: pp. 697-712.
DEAGLIO S., DWYER K.M., GAO W., FRIEDMAN D., USHEVA A., ERAT A., CHEN
J.F., ENJYOJI K., LINDEN J., OUKKA M., KUCHROO V.K., STROM T.B. &
ROBSON S.C. (2007) Adenosine generation catalyzed by CD39 and CD73
expressed on regulatory T cells mediates immune suppression. J.Exp.Med. 204,
1257-1265.
DI VIRGILIO F., CHIOZZI P., FERRARI D., FALZONI S., SANZ J.M., MORELLI A.,
TORBOLI M., BOLOGNESI G. & BARICORDI O.R. (2001) Nucleotide
receptors: an emerging family of regulatory molecules in blood cells. Blood 97,
587-600.
EKMAN P. & JAGER O. (1993) Quantification of subnanomolar amounts of phosphate
bound to seryl and threonyl residues in phosphoproteins using alkaline hydrolysis
and malachite green. Anal.Biochem. 214, 138-141.
78
8. Referências bibliográficas
FASSBENDER M., GERLITZKI B., ULLRICH N., LUPP C., KLEIN M., RADSAK
M.P., SCHMITT E., BOPP T. & SCHILD H. (2010) Cyclic adenosine
monophosphate and IL-10 coordinately contribute to nTreg cell-mediated
suppression of dendritic cell activation. Cell Immunol. 265, 91-96.
FAVALI C., TAVARES N., CLARENCIO J., BARRAL A., BARRAL-NETTO M. &
BRODSKYN C.I. (2007) Leishmania amazonensis infection impairs differentiation
and function of human dendritic cells. J.Leukoc.Biol. 82, 1401-1406.
FIETTO J.L.R., DEMARCO R., NASCIMENTO I.P., CASTRO I.M., CARVALHO T.M.,
SOUZA W., BAHIA M.T., ALVES M.J. & VERJOVSKI-ALMEIDA S. (2004)
Characterization and immunolocalization of an NTP diphosphohydrolase of
Trypanosoma cruzi. Biochem.Biophys.Res.Commun. 316, 454-460.
FUJII S., LIU K., SMITH C., BONITO A.J. & STEINMAN R.M. (2004) The linkage of
innate to adaptive immunity via maturing dendritic cells in vivo requires CD40
ligation in addition to antigen presentation and CD80/86 costimulation. J.Exp.Med.
199, 1607-1618.
GONCALVES R., VIEIRA E.R., MELO M.N., GOLLOB K.J., MOSSER D.M. &
TAFURI W.L. (2005) A sensitive flow cytometric methodology for studying the
binding of L. chagasi to canine peritoneal macrophages. BMC.Infect.Dis. 5, 39
GRANUCCI F., ZANONI I. & RICCIARDI-CASTAGNOLI P. (2008) Central role of
dendritic cells in the regulation and deregulation of immune responses.
Cell
Mol.Life Sci. 65, 1683-1697.
HASKO G., CSOKA B., NEMETH Z.H., VIZI E.S. & PACHER P. (2009) A(2B)
adenosine receptors in immunity and inflammation. Trends Immunol. 30, 263-270.
HASKO G. & PACHER P. (2008) A2A receptors in inflammation and injury: lessons
learned from transgenic animals. J.Leukoc.Biol. 83, 447-455.
HERWALDT B.L. (1999) Leishmaniasis. Lancet 354, 1191-1199.
HOFER S., IVARSSON L., STOITZNER P., AUFFINGER M., RAINER C., ROMANI
N. & HEUFLER C. (2003) Adenosine slows migration of dendritic cells but does
79
8. Referências bibliográficas
not affect other aspects of dendritic cell maturation. J.Invest Dermatol. 121, 300307.
JACOBSON K.A. & GAO Z.G. (2006) Adenosine receptors as therapeutic targets.
Nat.Rev.Drug Discov. 5, 247-264.
JOHN B. & HUNTER C.A. (2008) Immunology. Neutrophil soldiers or Trojan Horses?
Science 321, 917-918.
KABASHIMA K., SHIRAISHI N., SUGITA K., MORI T., ONOUE A., KOBAYASHI
M., SAKABE J., YOSHIKI R., TAMAMURA H., FUJII N., INABA K. &
TOKURA Y. (2007) CXCL12-CXCR4 engagement is required for migration of
cutaneous dendritic cells. Am.J.Pathol. 171, 1249-1257.
KAMHAWI S. (2000) The biological and immunomodulatory properties of sand fly saliva
and its role in the establishment of Leishmania infections. Microbes.Infect. 2,
1765-1773.
KAMHAWI S. (2006) Phlebotomine sand flies and Leishmania parasites: friends or foes?
Trends Parasitol. 22, 439-445.
KAUTZ-NEU K., NOORDEGRAAF M., DINGES S., BENNETT C.L., JOHN D.,
CLAUSEN B.E. & VON STEBUT E. (2011) Langerhans cells are negative
regulators of the anti-Leishmania response. J.Exp.Med. 208, 885-891.
KUMAR V. & SHARMA A. (2009) Adenosine: an endogenous modulator of innate
immune system with therapeutic potential. Eur.J.Pharmacol. 616, 7-15.
LA SALA A., FERRARI D., CORINTI S., CAVANI A., DI VIRGILIO F. &
GIROLOMONI G. (2001) Extracellular ATP induces a distorted maturation of
dendritic cells and inhibits their capacity to initiate Th1 responses. J.Immunol. 166,
1611-1617.
LA SALA A., FERRARI D., DI VIRGILIO F., IDZKO M., NORGAUER J. &
GIROLOMONI G. (2003) Alerting and tuning the immune response by
extracellular nucleotides. J.Leukoc.Biol. 73, 339-343.
LA SALA A., SEBASTIANI S., FERRARI D., DI VIRGILIO F., IDZKO M.,
NORGAUER J. & GIROLOMONI G. (2002) Dendritic cells exposed to
80
8. Referências bibliográficas
extracellular adenosine triphosphate acquire the migratory properties of mature
cells and show a reduced capacity to attract type 1 T lymphocytes. Blood 99, 17151722.
LASKAY T., VAN ZANDBERGEN G. & SOLBACH W. (2003) Neutrophil granulocytes
- Trojan horses for Leishmania major and other intracellular microbes? Trends
Microbiol. 11, 210-214.
LIU D., KEBAIER C., PAKPOUR N., CAPUL A.A., BEVERLEY S.M., SCOTT P. &
UZONNA J.E. (2009) Leishmania major phosphoglycans influence the host early
immune response by modulating dendritic cell functions. Infect.Immun. 77, 32723283.
LUTZ M.B., KUKUTSCH N., OGILVIE A.L., ROSSNER S., KOCH F., ROMANI N. &
SCHULER G. (1999) An advanced culture method for generating large quantities
of highly pure dendritic cells from mouse bone marrow. J.Immunol.Methods 223,
77-92.
MAIOLI T.U., TAKANE E., ARANTES R.M.E., FIETTO J.L.R. & AFONSO L.C.C.
(2004) Immune response induced by New World Leishmania species in C57BL/6
mice. Parasitol.Res. 94, 207-212.
MARQUES-DA-SILVA E.A., OLIVEIRA J.C., FIGUEIREDO A.B., LIMA-JUNIOR
D.S., CARNEIRO C.M., FIETTO J.L.R. & AFONSO L.C.C. (2008) Extracellular
nucleotide metabolism in Leishmania: influence of adenosine in the establishment
of infection. Microbes.Infect. 10, 850-857.
MARTIN S., AGARWAL R., MURUGAIYAN G. & SAHA B. (2010) CD40 expression
levels modulate regulatory T cells in Leishmania donovani infection. J.Immunol.
185, 551-559.
MEYER-FERNANDES J.R., DUTRA P.M., RODRIGUES C.O., SAAD-NEHME J. &
LOPES A.H. (1997) Mg-dependent ecto-ATPase activity in Leishmania tropica.
Arch.Biochem.Biophys. 341, 40-46.
MIZUMOTO N., KUMAMOTO T., ROBSON S.C., SEVIGNY J., MATSUE H.,
ENJYOJI K. & TAKASHIMA A. (2002) CD39 is the dominant Langerhans cell81
8. Referências bibliográficas
associated ecto-NTPDase: modulatory roles in inflammation and immune
responsiveness. Nat.Med. 8, 358-365.
MORIYAMA K. & SITKOVSKY M.V. (2010) Adenosine A2A receptor is involved in
cell surface expression of A2B receptor. J.Biol.Chem. 285, 39271-39288.
MOUGNEAU E., BIHL F. & GLAICHENHAUS N. (2011) Cell biology and immunology
of Leishmania. Immunol.Rev. 240, 286-296.
NEVES B.M., SILVESTRE R., RESENDE M., OUAISSI A., CUNHA J., TAVARES J.,
LOUREIRO I., SANTAREM N., SILVA A.M., LOPES M.C., CRUZ M.T. &
CORDEIRO DA S.A. (2010) Activation of phosphatidylinositol 3-kinase/Akt and
impairment of nuclear factor-kappaB: molecular mechanisms behind the arrested
maturation/activation state of Leishmania infantum-infected dendritic cells.
Am.J.Pathol. 177, 2898-2911.
NI K. & O'NEILL H.C. (1997) The role of dendritic cells in T cell activation.
Immunol.Cell Biol. 75, 223-230.
NOVAIS F.O., SANTIAGO R.C., BAFICA A., KHOURI R., AFONSO L., BORGES
V.M., BRODSKYN C., BARRAL-NETTO M., BARRAL A. & OLIVEIRA C.I.
(2009) Neutrophils and macrophages cooperate in host resistance against
Leishmania braziliensis infection. J.Immunol. 183, 8088-8098.
NOVITSKIY S.V., RYZHOV S., ZAYNAGETDINOV R., GOLDSTEIN A.E., HUANG
Y., TIKHOMIROV O.Y., BLACKBURN M.R., BIAGGIONI I., CARBONE D.P.,
FEOKTISTOV I. & DIKOV M.M. (2008) Adenosine receptors in regulation of
dendritic cell differentiation and function. Blood 112, 1822-1831.
OLIVIER M., GREGORY D.J. & FORGET G. (2005) Subversion mechanisms by which
Leishmania parasites can escape the host immune response: a signaling point of
view. Clin.Microbiol.Rev. 18, 293-305.
PANTHER E., CORINTI S., IDZKO M., HEROUY Y., NAPP M., LA SALA A.,
GIROLOMONI G. & NORGAUER J. (2003) Adenosine affects expression of
membrane molecules, cytokine and chemokine release, and the T-cell stimulatory
capacity of human dendritic cells. Blood 101, 3985-3990.
82
8. Referências bibliográficas
PELLEGATTI P., FALZONI S., PINTON P., RIZZUTO R. & DI VIRGILIO F. (2005) A
novel recombinant plasma membrane-targeted luciferase reveals a new pathway for
ATP secretion. Mol.Biol.Cell 16, 3659-3665.
PETERS N.C., EGEN J.G., SECUNDINO N., DEBRABANT A., KIMBLIN N.,
KAMHAWI S., LAWYER P., FAY M.P., GERMAIN R.N. & SACKS D.L. (2008)
In vivo imaging reveals an essential role for neutrophils in leishmaniasis
transmitted by sand flies. Science 321, 970-974.
PRINA E., ABDI S.Z., LEBASTARD M., PERRET E., WINTER N. & ANTOINE J.C.
(2004) Dendritic cells as host cells for the promastigote and amastigote stages of
Leishmania amazonensis: the role of opsonins in parasite uptake and dendritic cell
maturation. J.Cell Sci. 117, 315-325.
QI H., POPOV V. & SOONG L. (2001) Leishmania amazonensis-dendritic cell
interactions in vitro and the priming of parasite-specific CD4(+) T cells in vivo.
J.Immunol. 167, 4534-4542.
QUAH B.J., WARREN H.S. & PARISH C.R. (2007) Monitoring lymphocyte proliferation
in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein
diacetate succinimidyl ester. Nat.Protoc. 2, 2049-2056.
REIS E SOUSA C. (2006) Dendritic cells in a mature age. Nat.Rev.Immunol. 6, 476-483.
RIBEIRO J.M., KATZ O., PANNELL L.K., WAITUMBI J. & WARBURG A. (1999)
Salivary glands of the sand fly Phlebotomus papatasi contain pharmacologically
active amounts of adenosine and 5'-AMP. J.Exp.Biol. 202, 1551-1559.
ROBSON S.C., SEVIGNY J. & ZIMMERMANN H. (2006) The E-NTPDase family of
ectonucleotidases:
Structure
function
relationships
and
pathophysiological
significance. Purinergic.Signal. 2, 409-430.
ROGERS K.A. & TITUS R.G. (2003) Immunomodulatory effects of Maxadilan and
Phlebotomus papatasi sand fly salivary gland lysates on human primary in vitro
immune responses. Parasite Immunol. 25, 127-134.
83
8. Referências bibliográficas
ROGERS N.J., JACKSON I.M., JORDAN W.J., HAWADLE M.A., DORLING A. &
LECHLER R.I. (2003) Cross-species costimulation: relative contributions of
CD80, CD86, and CD40. Transplantation 75, 2068-2076.
SABATTE J., MAGGINI J., NAHMOD K., AMARAL M.M., MARTINEZ D.,
SALAMONE G., CEBALLOS A., GIORDANO M., VERMEULEN M. &
GEFFNER J. (2007) Interplay of pathogens, cytokines and other stress signals in
the regulation of dendritic cell function. Cytokine Growth Factor Rev. 18, 5-17.
SACKS D.L. & NOBEN-TRAUTH N. (2002) The immunology of susceptibility and
resistance to Leishmania major in mice. Nat.Rev.Immunol. 2, 845-858.
SACKS D.L. & SHER A. (2002) Evasion of innate immunity by parasitic protozoa.
Nat.Immunol. 3, 1041-1047.
SANCHEZ-SANCHEZ N., RIOL-BLANCO L. & RODRIGUEZ-FERNANDEZ J.L.
(2006) The multiple personalities of the chemokine receptor CCR7 in dendritic
cells. J.Immunol. 176, 5153-5159.
SCHNURR M., THEN F., GALAMBOS P., SCHOLZ C., SIEGMUND B., ENDRES S. &
EIGLER A. (2000) Extracellular ATP and TNF-alpha synergize in the activation
and maturation of human dendritic cells. J.Immunol. 165, 4704-4709.
SCHULTE G. & FREDHOLM B.B. (2003) Signalling from adenosine receptors to
mitogen-activated protein kinases. Cell Signal. 15, 813-827.
SEREZANI C.H., BALLINGER M.N., ARONOFF D.M. & PETERS-GOLDEN M.
(2008) Cyclic AMP: master regulator of innate immune cell function.
Am.J.Respir.Cell Mol.Biol. 39, 127-132.
SITKOVSKY M. & OHTA A. (2005) The 'danger' sensors that STOP the immune
response: the A2 adenosine receptors? Trends Immunol. 26, 299-304.
SOARES M.B., TITUS R.G., SHOEMAKER C.B., DAVID J.R. & BOZZA M. (1998)
The vasoactive peptide maxadilan from sand fly saliva inhibits TNF-alpha and
induces IL-6 by mouse macrophages through interaction with the pituitary
adenylate cyclase-activating polypeptide (PACAP) receptor.
J.Immunol. 160,
1811-1816.
84
8. Referências bibliográficas
SOONG L. (2008) Modulation of dendritic cell function by Leishmania parasites.
J.Immunol. 180, 4355-4360.
SPATH G.F. & BEVERLEY S.M. (2001) A lipophosphoglycan-independent method for
isolation of infective Leishmania metacyclic promastigotes by density gradient
centrifugation. Exp.Parasitol. 99, 97-103.
STEIGERWALD M. & MOLL H. (2005) Leishmania major modulates chemokine and
chemokine receptor expression by dendritic cells and affects their migratory
capacity. Infect.Immun. 73, 2564-2567.
STEINMAN R.M. & COHN Z.A. (1973) Identification of a novel cell type in peripheral
lymphoid organs of mice. I. Morphology, quantitation, tissue distribution.
J.Exp.Med. 137, 1142-1162.
STEINMAN R.M. & COHN Z.A. (1974) Identification of a novel cell type in peripheral
lymphoid organs of mice. II. Functional properties in vitro. J.Exp.Med. 139, 380397.
STEINMAN R.M. & HEMMI H. (2006) Dendritic cells: translating innate to adaptive
immunity. Curr.Top.Microbiol.Immunol. 311, 17-58.
STEINMAN R.M., LUSTIG D.S. & COHN Z.A. (1974) Identification of a novel cell type
in peripheral lymphoid organs of mice. III. Functional properties in vivo.
J.Exp.Med. 139, 1431-1445.
STEINMAN R.M. & WITMER M.D. (1978) Lymphoid dendritic cells are potent
stimulators
of
the
primary
mixed
leukocyte
reaction
in
mice.
Proc.Natl.Acad.Sci.U.S.A 75, 5132-5136.
SUZUE K., KOBAYASHI S., TAKEUCHI T., SUZUKI M. & KOYASU S. (2008)
Critical role of dendritic cells in determining the Th1/Th2 balance upon Leishmania
major infection. Int.Immunol. 20, 337-343.
THAMMAVONGSA V., KERN J.W., MISSIAKAS D.M. & SCHNEEWIND O. (2009)
Staphylococcus aureus synthesizes adenosine to escape host immune responses.
J.Exp.Med. 206, 2417-2427.
85
8. Referências bibliográficas
TORRES-AGUILAR H., AGUILAR-RUIZ S.R., GONZALEZ-PEREZ G., MUNGUIA
R., BAJANA S., MERAZ-RIOS M.A. & SANCHEZ-TORRES C. (2010)
Tolerogenic dendritic cells generated with different immunosuppressive cytokines
induce antigen-specific anergy and regulatory properties in memory CD4+ T cells.
J.Immunol. 184, 1765-1775.
VARGAS-INCHAUSTEGUI D.A., XIN L. & SOONG L. (2008) Leishmania braziliensis
infection induces dendritic cell activation, ISG15 transcription, and the generation
of protective immune responses. J.Immunol. 180, 7537-7545.
VASQUEZ R.E., XIN L. & SOONG L. (2008) Effects of CXCL10 on dendritic cell and
CD4+ T-cell functions during Leishmania amazonensis infection. Infect.Immun.
76, 161-169.
WHEAT W.H., PAUKEN K.E., MORRIS R.V. & TITUS R.G. (2008) Lutzomyia
longipalpis salivary peptide maxadilan alters murine dendritic cell expression of
CD80/86, CCR7, and cytokine secretion and reprograms dendritic cell-mediated
cytokine release from cultures containing allogeneic T cells.
J.Immunol. 180,
8286-8298.
WILSON J.M., ROSS W.G., AGBAI O.N., FRAZIER R., FIGLER R.A., RIEGER J.,
LINDEN J. & ERNST P.B. (2009) The A2B adenosine receptor impairs the
maturation and immunogenicity of dendritic cells. J.Immunol. 182, 4616-4623.
XIN L., LI K. & SOONG L. (2008) Down-regulation of dendritic cell signaling pathways
by Leishmania amazonensis amastigotes. Mol.Immunol. 45, 3371-3382.
ZAMBRANO-VILLA S., ROSALES-BORJAS D., CARRERO J.C. & ORTIZ-ORTIZ L.
(2002) How protozoan parasites evade the immune response. Trends Parasitol. 18,
272-278.
ZIMMERMANN H. (1996) Biochemistry, localization and functional roles of ectonucleotidases in the nervous system. Prog.Neurobiol. 49, 589-618.
ZIMMERMANN H. (2000) Extracellular metabolism of ATP and other nucleotides.
Naunyn Schmiedebergs Arch.Pharmacol. 362, 299-309.
86
9. ANEXOS
EJI
eji201141926 Dispatch: February 14, 2012 CE:
Journal MSP No.
1
Eur. J. Immunol. 2012. 42: 1–13
No. of pages: 13
PE: XXXXX
Immunity to infection
DOI: 10.1002/eji.201141926
2
3
4
5
6
7
8
9
15
16
17
Amanda B. Figueiredo1 , Tiago D. Serafim1 , Eduardo A.
Marques-da-Silva∗1 , José R. Meyer-Fernandes2 and Luı́s C. C. Afonso1
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
ED
EC
T
27
28
29
Dendritic cells (DCs) play an essential role in the modulation of immune responses and
several studies have evaluated the interactions between Leishmania parasites and DCs.
While extracellular ATP exhibits proinflammatory properties, adenosine is an important
anti-inflammatory mediator. Here we investigated the effects of Leishmania infection on
DC responses and the participation of purinergic signalling in this process. Bone marrowderived dendritic cell (BMDCs) from C57BL/6J mice infected with Leishmania amazonensis,
Leishmania braziliensis or Leishmania major metacyclic promastigotes showed decreased
major histocompatibility complex (MHC) class II and CD86 expression and increased ectonucleotidase expression as compared with uninfected cells. In addition, L. amazonensisinfected DCs, which had lower CD40 expression, exhibited a decreased ability to induce
T-cell proliferation. The presence of MRS1754, a highly selective A2B adenosine receptor
antagonist at the time of infection increased MHC class II, CD86 and CD40 expression in
L. amazonensis-infected DCs and restored the ability of the infected DCs to induce T-cell
proliferation. Similar results were obtained through the inhibition of extracellular ATP
hydrolysis using suramin. In conclusion, we propose that A2B receptor activation may be
used by L. amazonensis to inhibit DC function and evade the immune response.
RR
24
25
26
Laboratório de Imunoparasitologia, Departamento de Ciências Biológicas, ICEB/NUPEB,
Universidade Federal de Ouro Preto, Ouro Preto, Minas Gerais, Brazil
2
Laboratório de Bioquı́mica Celular, Instituto de Bioquı́mica Médica, Universidade Federal do
Rio de Janeiro, Rio de Janeiro, Rio de Janeiro, Brazil
N
CO
21
22
23
1
Keywords: Adenosine receptors
amazonensis
r
CD40
r
Dendritic cell
r
Ectonucleotidases
r
Leishmania
U
18
19
20
PR
O
O
F
12
13
14
Leishmania amazonensis impairs DC function
by inhibiting CD40 expression via A2B adenosine
receptor activation
10
11
Introduction
Leishmaniasis is a group of diseases that are caused by obligate
intracellular parasites of the genus Leishmania. Leishmania infections can result in a wide spectrum of clinical manifestations and
disease outcome is determined both by the parasite species and by
the host immune response. Leishmania amazonensis differs from
other species because it is able to cause chronic non-healing lesions
in mouse strains genuinely resistant to other Leishmania species,
such as Leishmania braziliensis and Leishmania major [1–3]. In
humans, L. amazonensis causes diffuse cutaneous leishmaniasis,
a condition characterised by a lack of antigen-specific T-cell responses against the parasite [4].
DCs play a critical role in orchestrating the innate and adaptive components of the immune system [5, 6]. Immature DCs capture and process antigens located throughout the body. After
Correspondence: Dr. Luı́s C. C. Afonso
e-mail: [email protected]
∗
Present address: Laboratório de Imunovirologia Molecular, Departamento de
Biologia Geral, CCB, Universidade Federal de Viçosa, Viçosa, Minas Gerais, Brazil
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
www.eji-journal.eu
1
1
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
PR
O
O
F
18
19
20
dendritic cell (BMDCs) were cultured in the presence of carboxyfluorescein diacetate succinimidyl ester (CFSE)-labelled L.
amazonensis, L. braziliensis or L. major metacyclic promastigotes
(1:3 cell to parasite ratio); the infections were then evaluated using flow cytometry. After a 20-h incubation period, approximately
35–45% of DCs were infected; the results were similar among the
three parasite species. Importantly, all treatments performed in
this work did not interfere with parasite infectivity. Furthermore,
DC viability, as assessed using trypan blue exclusion or propidium
iodide uptake, was not changed by infection (data not shown).
Different Leishmania species are known to be able to interfere
with DC surface marker expression [22–26]. However, in most
of these studies, bulk effects were analysed and no differentiation
was made between cells that became infected and cells that, albeit
being in contact with the parasite, remained uninfected was made.
To better clarify these findings situation, DCs were incubated with
CFSE-labelled parasites for 3 h and then stimulated with LPS. As
shown in Fig. 1A, the populations of infected (CFSE+ ) and uninfected (CFSE− ) cells were analysed separately. DC surface expression of MHCII and CD86 was significantly decreased in infected
cells (Fig. 1B). Reduced surface expression was observed both in
terms of the percentage of activated cells (MHCII+ CD86+ cells)
and in the intensity of expression of these markers in activated infected cells (Fig. 1C and D); these effects were observed regardless
of the parasite species examined.
We also evaluated CD40 surface expression in infected DCs. Interestingly, our results showed that, despite inhibiting MHCII and
CD86 expression, L. braziliensis and L. major infection induced
a significant increase in CD40 expression. In contrast, increased
CD40 surface expression was not observed in L. amazonensisinfected DCs (Fig. 1E).
These results show that the level of DC functional impairment
is dependent on the parasite species and that it is more intense
with L. amazonensis compared with L. braziliensis or L. major.
TE
D
15
16
17
EC
12
13
14
RR
10
11
CO
7
8
9
contacting microorganisms or other inflammatory substances,
these cells initiate their maturation process. DC maturation is
characterised by increased expression of major histocompatibility
complex (MHC) class II (MHCII) and co-stimulatory molecules,
such as CD40, CD80, CD86 and CD54; decreased phagocytic capacity; increased cytokine secretion and expression of different
chemokine receptors [5, 7].
Extracellular ATP, which is accumulated following cellular
injury, has important inflammatory properties characterised
by the induction of IL-12 (where IL is interleukin) and TNF-α
production [8–11]. On the other hand, adenosine has been recognised as an immunomodulatory molecule that inhibits the release
of proinflammatory cytokines and induces the release of IL-10
[9, 12, 13]. The combined action of CD39, which sequentially
hydrolyses ATP to ADP and then to AMP, and CD73, which
converts AMP to adenosine is essential in controlling extracellular
levels of ATP [9]. Recently, regulatory T cells have been shown
to express CD39 and CD73 on their surface and use adenosine to
control effector T-cell activation [12].
DCs exhibit surface expression of ectonucleotidases, functional
ATP receptors [14] and adenosine receptors [15–17]; consequently, they are sensitive to nucleotides and nucleosides present
in the extracellular environment. Studies have demonstrated that
ATP is able to induce increased surface expression of MHCII,
CD83, CD86 and CD54 in DCs, thus promoting the establishment
of inflammatory responses [18, 19]. Adenosine, on the other hand,
reduces DC migration and inhibits DC cytokine and chemokine
production [20, 21].
Several studies have evaluated the interactions between Leishmania parasites and DCs. Leishmania amazonensis promastigotes
modulate DC functions by altering MHCII, CD80 and CD86 expression and IL-10 and IL-12 production [22–25]. Studies with other
Leishmania species have shown that L. braziliensis-infected DCs remained immature and secreted TNF-α [26]. Leishmania major was
also able to modulate DC function by influencing the balance between Th1 and Th2 responses [27, 28]. Although much is known
regarding the ability of Leishmania infection to interfere with DC
maturation, activation and function, the underlying mechanisms
are not completely understood.
Given the known effects of adenosine on DC function, the
present study further evaluated the effects of Leishmania infection
on the activation and effector functions of DCs by analysing the
involvement of purinergic signalling in the process. Our results indicate that the hydrolysis of extracellular ATP and the activation of
the A2B adenosine receptor during L. amazonensis infection but not
during L. major or L. braziliensis infection, are responsible, at least
in part, for the inhibitory effects of the parasite on DC function.
N
4
5
6
U
2
Results
Infection with Leishmania metacyclic promastigotes
alters DC surface marker expression
Our initial objective was to assess whether promastigotes of different Leishmania species could infect DCs. Bone marrow-derived
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
Inhibition of DC activation by L. amazonensis is
independent of IL-10
To investigate the mechanisms involved in the inhibition of DC activation by Leishmania parasites, we first examined the influence of
autocrine IL-10 production. Several publications have implicated
this cytokine as a major factor in DC suppression [25, 29, 30].
Therefore, we initially analysed the production of IL-10 in culture
supernatants using ELISA and found no differences between control and infected DC cultures (Fig. 2A). However, because changes
in DC surface markers were restricted to infected cells, we decided
to evaluate the effect of IL-10 on DC activation by blocking the
IL-10 receptor using an IL-10R-specific monoclonal antibody prior
to DC infection. This treatment was unable to reverse the inhibition of DC activation induced following L. amazonensis infection.
However, IL-10 receptor blockade partially restored LPS-induced
upregulation of MHCII and CD86 expression in L. braziliensisand L. major-infected DCs (Fig. 2B). Additionally, IL-10 blockade
did not affect CD40 expression in infected DCs regardless of the
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
TE
D
24
25
26
EC
27
28
29
30
31
RR
32
33
34
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
N
41
42
43
Figure 1. Leishmania infection impairs DC activation. DCs obtained after 9 days of culture with GM-CSF were infected with CFSE- or PKH26-labelled
metacyclic promastigotes (1:3 cell to parasite ratio). After 3 h, the cells were stimulated with 2 µg/mL LPS and then incubated for up to 17 h
before flow cytometry analysis. (A) DCs were gated into populations of uninfected (CFSE− or PKH26− cells) and infected (CFSE+ or PKH26+ cells)
DCs and surface markers MHCII, CD86 and CD40 were analysed in both populations. Dot plots and histograms are representative of Leishmania
amazonensis-infected DCs. (B) The percentage of MHCII+ CD86+ cells was evaluated, as well as the MFI of (C) MHCII and (D) CD86 in these cells. (E)
The percentage of CD40+ cells in populations of uninfected and infected DCs was also examined. (B–E) The results represent the mean + SD from
at least three independent experiments performed in triplicates. *p < 0.05 between uninfected and infected DCs, unpaired two-tailed Student’s
t-test.
U
38
39
40
CO
35
36
37
parasite species examined (data not shown). These results suggest
that distinct inhibitory mechanisms are used by different Leishmania species to impair DC activation. While L. braziliensis- and L.
major-mediated effects on DC activation were partially dependent
on IL-10, this cytokine does not play a role in L. amazonensismediated DC inhibition.
Leishmania infection enhances DC ectonucleotidase
expression and enzymatic activity
On the basis of the observations that DCs express ectonucleotidases on their surface [14] and that these enzymes play important
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
roles in the suppressor functions of regulatory T cells [8], we
evaluated the expression of these enzymes on the surface of uninfected and infected DCs by examining the surface expression of
the ectonucleoside triphosphate diphosphohydrolase (ENTPDase)
CD39 and the 5’-nucleoside monophosphate phosphohydrolase
(5’-nucleotidase) CD73. Our results show that co-expression of
CD39 and CD73 was significantly increased in infected cells, regardless of the parasite species examined (Fig. 3A).
To confirm that the increased expression of CD39 and CD73
in infected DCs is accompanied by increased adenosine production, we evaluated the ectonucleotidase activity of these cells after 20 h of incubation in the presence or absence of parasites.
Because some of the effects on DC activation were unique to
www.eji-journal.eu
3
1
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
ED
24
25
26
EC
T
27
28
29
30
31
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
RR
35
36
37
Figure 2. Inhibition of DC activation by Leishmania amazonensis is independent of IL-10. (A) DCs were infected as described in Fig. 1 and IL-10
cytokine levels were measured in the supernatants after 20 h using an ELISA. Control is LPS-stimulated DCs. The results represent the mean + SD
from six independent experiments performed in duplicates. (B) DCs were incubated for 30 min with 1B1.3a antibody to block the IL-10 receptor; rat
IgG was used as isotype control. DCs were then infected as described in Fig. 1 and analysed using flow cytometry. The percentage of MHCII+ CD86+
cells in populations of uninfected and infected DCs in treated groups were expressed in relation to the group of cells incubated with parasites
without treatment, set at 100 (dotted line). Data represent the mean + SD from at least three independent experiments performed in duplicates.
*p < 0.05 versus untreated group, one-sample t-test with hypothetical value of 100. (C) Representative dot plots from at least three independent
experiments of DCs infected with L. amazonensis (top), Leishmania braziliensis (middle) or Leishmaniamajor (bottom) in the absence (left) or presence
(right) of 1B1.3a antibody. Numbers in parentheses indicate the percentage of MHCII+CD86+ DCs.
N
CO
32
33
34
infected cells and less than 50% of cells were infected after
20 h of incubation, we increased the percentage of infected cells
to ensure that the effects of the infection process were not diluted by the cells that did not internalise parasites. Therefore, we
used a 1:10 cell to parasite ratio that resulted in approximately
80% of cells being infected; this did not alter the parameters of
parasite-mediated inhibition of DC activation (data not shown).
Hydrolysis of ATP, ADP and AMP was significantly increased in
infected DCs, regardless of the parasite species used. Treatment
with suramin significantly inhibited the ATP and ADP hydrolysis
but had no effect on AMP, which is indicative of its action on CD39
(Fig. 3B to D).
After showing that Leishmania parasites increase ectonucleotidase expression in BMDCs, we decided to evaluate the expression
of these enzymes in DCs from the draining lymph nodes of infected
mice. To achieve this, mice were inoculated on the ears with CFSElabelled metacyclic promastigotes and 20 h later draining lymph
U
4
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
node cells were analysed by flow cytometry. The populations of infected (CFSE+ ) and uninfected (CFSE− ) CD11c+ were studied separately, as shown in Fig. 4A. Approximately 12.2 ± 0.9% of lymph
node cells were found to be CD11c+ and of these CD11c+ cells
9.4 ± 1.8% were CFSE+ ; these values were similar regardless of
the strain of Leishmania used. Our results showed that CFSE− (i.e.
uninfected) cells are predominantly CD39low CD73− . On the other
hand, CFSE+ (infected) cells are predominantly CD39high CD73low ,
independent of the parasite species used (Fig. 4B and C). Taken
together, our results showed that Leishmania is able to increase
the ectonucleotidase expression on DCs during both in vitro and
in vivo infections.
These results show a possible correlation between the decreased expression of activation markers on infected DCs and
extracellular adenosine production by infected cells; however,
they do not explain the difference in CD40 expression between
L. amazonensis- and L. braziliensis- or L. major-infected DCs.
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
ED
24
25
26
EC
T
27
28
29
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
N
CO
35
36
37
Figure 3. Leishmania infection increases DC ectonucleotidase expression and activity. (A) DCs were infected as described in Fig. 1 and analysed
using flow cytometry. DCs were gated into populations of uninfected (CFSE− cells) and infected (CFSE+ cells) DCs and the percentage of CD39+ CD73+
cells evaluated in both populations. The results represent the mean + SD from four independent experiments performed in triplicates. *p < 0.05
between uninfected and infected DCs, paired two-tailed Student’s t-test. (B–D) DCs were infected as described in Fig. 1, but at a ratio of ten parasites
per cell. After 20 h of infection, cells were washed and incubated with (B) ATP, (C) ADP or (D) AMP for 1 h at 30◦ C, in the absence (untreated) or
presence (+ suramin) of suramin. Ectonucleotidasic activity was then assessed by measuring Pi release, as described in the Materials and Methods
section. The results represent the mean + SD from three independent experiments performed in triplicates. #p < 0.05, unpaired two-tailed
Student’s t-test. *p < 0.05 between (untreated) and (+ suramin) groups, unpaired two-tailed Student’s t-test.
L. amazonensis impairs DC functions via A2B receptor
activation
U
32
33
34
RR
30
31
The combined action of ENTPDase and 5’-nucleotidase on extracellular ATP is the production of adenosine, which has been shown
to decrease DC activation [15, 17, 31, 32] by acting through P1 receptors, in particular, A2A and A2B receptors. Thus, our next step
was to verify whether the inhibition of these receptors could alter
the effects of Leishmania infection on DC activation. First, DCs
were infected with L. amazonensis in the presence of ZM241385
or MRS1754, potent A2A and A2B receptor antagonists, respectively. Our data showed that ZM241385 treatment only reversed
the parasite-mediated inhibition of DC activation when used in
very high concentrations (50 µM) (Fig. 5A). However, treatment
with MRS1754 was able to enhance the surface expression of activation markers on infected DCs at all concentrations tested in a
dose-dependent manner (Fig. 5B); these results indicate that only
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
stimulation of A2B receptor is important in parasite-mediated DC
inhibition.
To further characterise the participation of purinergic signalling in the impairment of DC activation, we evaluated the roles
of ENTPDase, which is responsible for ATP hydrolysis, and A2B
receptor in the inhibition of DC function during L. amazonensis,
L. braziliensis and L. major infection. For these experiments, DCs
were infected with parasites in the presence of 200 µM suramin, an
ENTPDase inhibitor, or 50 µM MRS1754, a concentration which
resulted in optimal surface activation marker expression in L.
amazonensis-infected DCs. Our results show that simultaneous incubation of suramin with the parasite and DCs partially reversed
the parasite-induced inhibition of MHCII and CD86 expression
on infected cells; these results were not parasite species specific.
However, MRS1754 treatment reversed the inhibition of activation markers expression only in DCs infected with L. amazonensis
(Fig. 5C). Moreover, both treatments increased CD40 expression
www.eji-journal.eu
5
1
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
EC
RR
32
33
34
Figure 4. Leishmania infection increases CD39 and CD73 expression on DCs from draining lymph nodes. Draining lymph nodes were isolated from
C57BL/6J mice 20 h after inoculation with CFSE-labelled metacyclic promastigotes via the ears and the lymph node cells were analysed using
flow cytometry. (A) CD11c+ cells were gated into populations of uninfected (CFSE− cells) and infected (CFSE+ cells) cells, and further gated into
CD39low CD73− cells (gate 1) and CD39high CD73low cells (gate 2) in each population. Data are representative of results from six L. amazonensis-infected
mice per group. The percentage of cells in (B) gate 1 and (C) gate 2 in mice infected with the indicated Leishmania species was evaluated. Data are
the mean + SD of two independent experiments with three animals per group. *p < 0.05 between uninfected and infected DCs, unpaired two-tailed
Student’s t-test.
in L. amazonensis-infected DCs. However, no effect on CD40 expression was observed in cells infected with L. braziliensis or L.
major (Fig. 5D).
Given the effects of Leishmania infection on the expression of
activation markers, we next evaluated whether infection could
alter the ability of DCs to induce T-cell proliferation. Thus,
CD4+ T cells purified from the spleens of L. amazonensis-infected
C57BL/6J mice (antigen-specific proliferation) or spleen cells from
non-infected BALB/c mice (mixed leukocyte reactions, MLR) were
labelled with CFSE and incubated with infected C57BL/6J DCs.
Lymphocyte proliferation was evaluated after 4 days using flow
cytometry. Our results demonstrated that the decreased activation of DCs induced by L. amazonensis infection resulted in decreased MLR. However, DC infection with L. braziliensis or L. major
parasites did not inhibit lymphocyte proliferation (Fig. 6A). Furthermore, Leishmania antigen-specific proliferation was reduced
when DCs were infected with L. amazonensis compared with DCs
infected with either L. braziliensis or L. major (Fig. 6B). To confirm the role of purinergic signalling on the down-modulation
of DC function by L. amazonensis, we treated DCs with suramin
or MRS1754 during infection with L. amazonensis. Prior to being incubated with CFSE-labelled lymphocytes, infected DCs were
washed to remove the inhibitors. Treatment of DCs with either
CO
30
31
N
27
28
29
TE
D
24
25
26
U
6
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
suramin or MRS1754 resulted in increased MLR and increased
Leishmania-specific CD4+ T-cell proliferation when compared with
untreated infected DCs (Fig. 6C and D).
Our results suggest that L. amazonensis, L. braziliensis and L.
major increase DC ectonucleotidase expression, which potentially
leads to an increase in adenosine production by infected DCs
and that these enzymes are important in Leishmania-mediated
inhibition of MHCII and CD86 expression following DC activation. However, only L. amazonensis infection of DCs activates the
immunosuppressive adenosine receptor A2B that inhibits CD40
expression in addition to MHCII and CD86 expression, consequently inhibiting the ability of DCs to stimulate lymphocyte
proliferation.
Discussion
The effect of infection by Leishmania parasites on the activation,
maturation and migration of DCs is dependent on several factors,
such as parasite species, strain and developmental stage; the subset of DCs analysed and the experimental conditions used in the
study (in vivo or in vitro, with or without further stimulation, etc.)
(reviewed by Soong [33]).
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
ED
24
25
26
EC
T
27
28
29
30
31
RR
32
33
34
41
42
43
44
45
46
U
38
39
40
N
CO
35
36
37
47
48
49
50
51
52
53
54
55
56
57
58
Figure 5. Leishmania amazonensis impairs DC activation via A2B receptor activation. DCs were infected as described in Fig. 1 and analysed using flow
cytometry. (A, B) DCs and L. amazonensis promastigotes co-cultures were treated with increasing concentrations of adenosine receptor antagonists
(A) ZM241385 or (B) MRS1754. The percentage of MHCII+ CD86+ cells in populations of uninfected and infected DCs in treated groups were expressed
in relation to the group of cells incubated with parasites without treatment, set at 100 (dotted line); results represent the mean + SD from three
independent experiments performed in duplicates. (C, D) DCs and parasites co-cultures were treated with 200 µM suramin or 50 µM MRS1754.
The percentage of (C) MHCII+ CD86+ cells or (D) CD40+ cells in populations of uninfected and infected DCs on treated groups were expressed in
relation to the group of cells incubated with parasites without treatment, set at 100 (dotted line); results represent the mean + SD from at least
three independent experiments performed in duplicates. *p < 0.05 versus untreated group, one-sample t-test with hypothetical value of 100. (E)
Representative dot plots from at least three independent experiments of DCs infected with L. amazonensis, Leishmania braziliensis or Leishmaniamajor
in the absence (left) or presence of suramin (middle) or MRS1754 (right). Numbers in parentheses indicate the percentage of MHCII+CD86+ DCs or
CD40+ DCs.
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
www.eji-journal.eu
7
1
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
4
5
6
7
8
9
10
11
PR
O
O
F
12
13
14
15
16
17
18
19
20
21
22
23
TE
D
24
25
26
EC
27
28
29
30
31
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
CO
38
39
40
Figure 6. Leishmania amazonensis promastigotes impair DC-stimulated T-cell proliferation by mechanisms dependent on ATP hydrolysis and A2B
receptor activation. Spleen cells from non-infected BALB/c mice or CD4+ T-cells from L. amazonensis infected C57BL/6J mice were labelled with
CFSE and then co-cultured in the presence of C57BL/6J infected DCs in the presence of 200 µM suramin or 50 µM MRS1754 where indicated. LPSstimulated DCs served as controls. (A) Gating strategy to determine CD3+ cell proliferation after 4 days. (B–E) Percentage (left axis) and absolute
number (right axis) of proliferating cells (mean + SD of three independent experiment performed in quadruplicates) as measured by (B, D) the MLR
assay and (C, E) antigen-specific proliferation assay. A total of 100,000 cells for MLR assay or 60,000 cells for antigen-specific proliferation assay
were acquired during flow cytometry analysis. *p < 0.05 versus control group (LPS-stimulated DCs), #p < 0.05 versus La group, unpaired two-tailed
Student’s t-test.
N
35
36
37
RR
32
33
34
The interaction of Leishmania promastigotes with DCs is generally accepted to cause activation of these cells [24, 25], as
shown by the enhanced expression of MHCII and co-stimulatory
molecules (CD40, CD80, CD83 and CD86) and the ability to stimulate CD4+ T-cell proliferation. However, with the exception of a
limited number of studies, evaluation of DC activation was performed using bulk cultures that did not separate infected from
uninfected DCs during analysis. When only infected cells were
analysed, DC infection was associated with an inhibition of DC
activation [23, 26]. Our results (Fig. 1A to D) corroborate these
findings by showing that Leishmania-infected DCs are refractory
to further activation by LPS because MHCII and CD86 expression
was decreased compared with uninfected cells. However, while
infection with L. braziliensis and L. major stimulated the expres-
U
8
sion of CD40 in infected DCs, L. amazonensis infection did not
alter CD40 expression (Fig. 1E). Discrepancies in CD40 expression in DCs infected with different species of Leishmania have previously been reported. For example, CD40 expression was lower
in L. amazonensis-infected DCs compared with L. major-infected
DCs [34]. Our results confirm these observations and extend these
findings to L. braziliensis infection. In addition, decreased CD40
expression has also been observed in Leishmania donovani-infected
macrophages [35] and DCs infected with L. infantum [36].
The mechanisms by which Leishmania infection inhibits DC
activation are not completely established. Although increased IL10 production has been frequently suggested as a possible factor
[25, 30, 37], neutralisation of IL-10 does not reverse DC downmodulation, at least with regard to IL-12 production [33]. In our
58
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
PR
O
O
F
21
22
23
able to reverse the decreased expression of activation markers on
infected DCs similar to suramin (Fig. 5). However, this receptor
was involved only in L. amazonensis infection and affected MHCII,
CD86 and CD40 expression. These results suggest that the expression of adenosine receptors may differ in DCs infected with L.
amazonensis, L. braziliensis and L. major. The role of A2B receptor in the modulation of DC function was confirmed using T-cell
proliferation assays (Fig. 6).
As mentioned previously, differential DC CD40 expression induced by distinct Leishmania species has been demonstrated [34].
However, the majority of these studies did not evaluate the mechanisms involved in the regulation of CD40 expression. Boggiatto
and co-workers [34] demonstrated that inhibition of ERK1/2
phosphorylation restored CD40 expression in L. amazonensisinfected DCs. Interestingly, activation of A2B receptors also induces ERK1/2 phosphorylation [34, 41]. Thus, the blockade of
A2B receptors in L. amazonensis-infected DCs may have led to inhibition of ERK1/2 phosphorylation with subsequent restoration
of CD40 expression.
The presence of adenosine in the extracellular environment
may facilitate the persistence of Leishmania in the host due to its
immunosuppressive properties [9, 12, 13, 20, 21]. A recent study
showed that CD39 expression and adenosine production were increased in a population of tolerogenic DCs, which were characterised by low levels of CD40 expression and IL-12p40 production
and a decreased ability to induce T-cell proliferation [42]. Other
work showed that cAMP, which could result from A2 receptor activation, was the key component in regulatory T-cell-mediated inhibition of DC activation marker expression; further, IL-10 was not
involved in the process [43]. We observed similar results when
DCs were infected with L. amazonensis. Moreover, activation of
A2B adenosine receptors has been shown to impair DC maturation
and, consequently, reduce their ability to activate CD4+ T cells.
A2B receptor activation was also shown to impair the function of
other immune cells [17, 32]. Our study expands on these findings
by demonstrating for the first time that infection of DCs by a parasitic protozoan (L. amazonensis) leads to decreased DC activation
by a mechanism dependent on ectonucleotidase expression and
A2B receptor activation.
These results contribute to the understanding of the immune
evasion mechanisms of L. amazonensis, which is responsible for diffuse cutaneous leishmaniasis, a disease characterised by impaired
T-cell activation. On the other hand, infection with L. major and
L. braziliensis is usually characterised by a strong cell-mediated
immune response that may lead to the control of the parasite. In
agreement with these observations, we did not observe the involvement of A2B adenosine receptors in DCs infected by these
parasite species. In this case, a less intense down-modulation of
DC activation that appeared to be mediated by IL-10 was observed.
In summary, our results demonstrate a new mechanism of L.
amazonensis immune evasion mediated through the activation of
A2B receptor in infected cells (Fig. 7). Future studies will characterise the expression of adenosine receptors on infected DCs
as well as the signalling pathways associated with their possible
TE
D
18
19
20
EC
15
16
17
RR
12
13
14
CO
10
11
N
7
8
9
study, the involvement of IL-10 in suppressing the activation of
infected DCs was dependent on the Leishmania species examined.
The inhibition of DC activation is partially dependent on IL-10
during L. braziliensis and L. major infection (Fig. 2). However,
we did not find any evidence supporting a role for IL-10 in the
decreased activation of L. amazonensis-infected DCs (Fig. 2).
Extracellular nucleotides and nucleosides have been shown to
affect DC activation and migration. For example, extracellular ATP
induces DC maturation and priming of Th1 cells while adenosine
has been shown to inhibit DC activation and proinflammatory
cytokine production [18–21]. Extracellular ATP accumulates during situations of cellular injury or infection and is considered to
be a ‘danger signal’ [10]. ATP release is thought to be mediated
by P2X7 receptors that not only sense extracellular concentrations of ATP but are also involved in ATP secretion [38]. Interestingly, L. amazonensis enhances P2X7 receptor expression on
murine macrophages [39]. The same mechanism may be present
in L. amazonensis-infected DCs.
In the mammalian host, the relative concentrations of extracellular ATP and adenosine are controlled by the sequential action of two enzymes: ENTPDase (CD39), which hydrolyses ATP
to ADP and then to AMP, and 5’-nucleotidase (CD73), which converts AMP to adenosine [9, 14]. Our results showed that CD39
and CD73 expression was significantly increased in infected cells;
importantly, enzyme activity was also increased in infected cells
(Fig. 3). The expression of ectonucleotidases was also enhanced in
infected DCs from draining lymph nodes of infected mice (Fig. 4).
The increased expression of ectonucleotidases on the surface of
infected cells can be beneficial to the parasite because this mechanism ensures the production of extracellular adenosine and the
subsequent inhibition of DC activation.
This hypothesis was initially confirmed for all parasite species
used in this work, as the MHCII and CD86 expression was restored in the presence of suramin (Fig. 5C), which prevents ATP
hydrolysis by inhibiting ENTPDase (CD39) activity thus decreasing
substrate (AMP) availability to 5’-nucleotidase, with a consequent
reduction in adenosine production.
Suramin has been shown to decrease DC CD86 expression
by acting through ATP receptors [19]. In our study, suramin
increased rather than decreased MHCII and CD86 expression,
suggesting that it predominantly acted on ENTPDase activity. In addition, when we used 30 µM suramin, a concentration sufficient to block the P2 receptor but not inhibit ENTPDases, we found no change in DC activation marker expression
(data not shown).
Adenosine exerts its effects by acting on four receptor subtypes,
A1 , A2A , A2B and A3 , that vary in distribution, affinity and function.
A2 receptors are responsible for the anti-inflammatory response of
adenosine, while A1 and A3 receptors may regulate the action of
A2 receptors to prevent the excessive inhibition of immune cells
[40]. Some studies have demonstrated that the A2B receptor is
the main receptor involved in inhibition of DC responses in mice
[16, 17]. Consistent with the role of adenosine in the inhibition of
DC activation in our experiments, A2B receptor blockade was also
U
4
5
6
58
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
www.eji-journal.eu
9
101
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
4
5
6
7
8
9
12
13
14
18
19
20
21
22
23
24
25
26
27
28
29
Figure 7. Mechanisms used by Leishmania amazonensis, Leishmania braziliensis and Leishmaniamajor to inhibit DC function and evade the immune
response. (A) L. amazonensis infection increases CD39 and CD73 expression, ensuring the production of adenosine (ADO). Adenosine activates A2B
receptor and impairs the activation of infected DCs, especially by inhibiting CD40 expression. Subsequently, their ability to stimulate lymphocyte
proliferation is reduced. (B) Infection with L. braziliensis and L. major, despite increasing the expression of CD39 and CD73, do not activate the A2B
receptor. These two species decrease the activation-induced expression of MHCII and CD86, with the participation of IL-10 receptor (IL-10R), but
do not affect CD40 expression. Consequently, DC infection with L. braziliensis and L. major does not significantly affect the ability of DC to stimulate
T-cell proliferation.
activation. Further investigation of this pathway may lead to new
therapeutic approaches for the control of leishmaniasis.
Differentiation of bone marrow-derived dendritic cells
(BMDCs)
Materials and methods
Animals and parasites
32
33
34
C57BL/6J or BALB/c mice (2–6 months of age) were obtained
from the Universidade Federal de Ouro Preto animal facility. Animals were given water and food ad libitum. All animal procedures
were approved by the University’s Ethical Committee on Animal
Experimentation.
Leishmania
(Leishmania)
amazonensis,
PH8
strain
(IFLA/BR/67/PH8), Leishmania (Vianna) braziliensis, M2903
strain (MHOM/BR/75/M2903) and Leishmania (L.) major,
FRIEDLIN strain (MHOM/IL/80/Friedlin) promastigotes were
cultured in GRACE’s medium (Sigma-Aldrich, St. Louis, MO, USA)
supplemented with 10% heat-inactivated foetal calf serum (FCS)
(LGC, Cotia, SP, Brazil), 2 mM L-glutamine (Gibco BRL, Grand
Island, NY, USA) and 100 U/mL penicillin G potassium (USB
Corporation, Cleveland, OH, USA); the final pH of the media was
6.5. Cultures were incubated at 25◦ C. Metacyclic promastigotes
were purified by gradient centrifugation of parasites at the stationary phase of culture (day 5) over Ficoll 400 (Sigma-Aldrich),
as previously described [3].
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
RR
CO
N
41
42
43
U
38
39
40
EC
30
31
35
36
37
PKH26 (Sigma-Aldrich) according to the manufacturer’s instructions.
TE
D
15
16
17
PR
O
O
F
10
11
Parasite staining
In in vitro DC infection experiments, metacyclic promastigotes
suspended in PBS with 5% FCS were incubated in the presence of
5 µM CFSE (Sigma-Aldrich) at 37◦ C for 10 min in the dark. The
suspensions were centrifuged and the parasites were washed in
PBS (pH 7.2) [44]. Alternatively, parasites were labelled with
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
BMDCs were obtained from C57BL/6J bone marrow as previously described [45]. Briefly, bone marrow cells were isolated
from the femur and tibia of C57BL/6J mice. Bone marrow cell
suspensions were centrifuged and cells cultured in RPMI-1640
(Sigma-Aldrich) supplemented with 10% FCS, 2 mM L-glutamine,
100 U/mL penicillin G potassium and 50 µM β-mercaptoethanol
(Pharmacia Biotech AB, Uppsala, Sweden), pH 7.2. Cells were
plated in Petri dishes at a concentration of 3 × 105 cells/mL and
incubated at 37◦ C in an atmosphere with 5% CO2 . Granulocytemacrophage colony-stimulating factor (GM-CSF, R&D Systems,
Minneapolis, MN, USA) was added to each plate on days 0, 3 and
6 at a concentration of 3 ng/mL (1050 U/mL). Non-adherent DCs
were collected on the ninth day of culture. DCs were characterised
by CD11b, CD11c, F4/80, Gr-1, MHCII, CD86 and CD40 expression using flow cytometry. Surface marker expression was similar
to that reported in the reference protocol.
In vitro DC infection
Metacyclic promastigotes and DCs were co-incubated (1:3 cell to
parasite ratio) at 33◦ C in a 5% CO2 atmosphere for 3 h. To ensure
full activation of these cells, LPS (Sigma-Aldrich) at a concentration of 2 µg/mL was added to the cultures; the cells were then
incubated at 37◦ C in a 5% CO2 atmosphere for up to 17 h. Infected
DCs were analysed using flow cytometry or used in proliferation
assays.
In selected experiments, DCs were incubated for 30 min at 25◦ C
in the presence of 15 µg/mL 1B1.3a antibody (Harlan Bioproducts
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
Determination of IL-10 production
DC culture supernatants were collected after 20 h and IL-10 cytokine levels were measured using an ELISA kit according to the
manufacturer’s instructions (PeproTech Inc., Rock Hill, NJ, USA).
Determination of ectonucleotidase activity
PR
O
O
F
18
19
20
antibody (rat anti-mouse CD4, produced in our laboratory) and
streptavidin-conjugated microbeads (Miltenyi Biotec GmbH, Bergisch Gladbach, Germany). CD4-positive selection was performed
by passing the cells through a MS column coupled to a MiniMACS separator (Miltenyi Biotec GmbH). The purity of the CD4+
T cells obtained was approximately 90% as assessed using flow
cytometry. The lymphocyte concentration was adjusted to 5 ×
106 cells/mL in PBS with 5% FCS. This suspension was incubated
with 5 µM CFSE at 25◦ C for 5 min in the dark [48]. The cells
were washed in PBS (pH 7.2) and resuspended in RPMI supplemented with 10% FCS, 2 mM L-glutamine, 100 U/mL penicillin
G potassium, 25 mM HEPES and 50 µM β-mercaptoethanol, pH
7.2. Lymphocytes (5 × 105 cells) were co-cultured with infected
DCs (5 × 104 cells) in 48-well plates in a total volume of 500
µL/well. Co-cultures were incubated at 37◦ C in a 5% CO2 atmosphere for 4 days; the cells were then collected and analysed using
flow cytometry.
Mixed leukocyte reactions
ED
15
16
17
To analyse ectonucleotidase activity, infections were performed
using a 1:10 cell to parasite ratio. The hydrolysis of ATP, ADP and
AMP was measured by incubating 5 × 103 (for ATP or ADP) or
5 × 104 (for AMP) intact DCs for 1 h at 30◦ C in reaction buffer
(116 mM NaCl, 5.4 mM KCl, 5.5 mM D-glucose, 5 mM MgCl2 and
50 mM HEPES-tris buffer, pH 7.2) in the presence of 5 mM ATP,
ADP or AMP (Sigma-Aldrich). The reactions were stopped by the
addition of activated charcoal diluted in 0.1 M HCl [46]. Nonspecific hydrolysis was determined by the addition of cells after
the reactions were stopped. The suspensions were pelleted and
supernatant aliquots were assessed for released inorganic phosphate (Pi ) as previously described [47]. Enzymatic activity was
expressed as nanomole of Pi released by 106 cells/h.
EC
T
12
13
14
RR
10
11
N
CO
7
8
9
for Science, Indianapolis, IN, USA) to block the IL-10 receptor prior
to being infected; rat IgG (produced in our laboratory) was used
as isotype control. In other experiments, suramin (Sigma-Aldrich)
or A2A and A2B adenosine receptors antagonists, ZM241385
(4-(2-[7-amino-2-(2-furyl)[1,2,4]triazolo[2,3-α][1,3,5]triazin5-ylamino]ethyl)phenol) and MRS1754 (N-(4-cyanophenyl)2-[4-(2,3,6,7-tetrahydro-2,6-dioxo-1,3-dipropyl-1H-purin-8yl)phenoxy]-acetamide), respectively (Tocris Bioscience, Park
Ellisville, MO, USA), were added at the moment of DC infection
as described in the figure legends. Both ZM241385 and MRS1754
were diluted in dimethylsulfoxide (DMSO), which was added to
the control cultures.
Isolation of lymph nodes DCs
C57BL/6J mice were inoculated on ears with 1 × 105 CFSElabelled metacyclic promastigotes. Draining lymph nodes were
isolated after 20 h and homogenised in Dulbecco’s modified Eagle’s medium (DMEM), pH 7.2. Lymph node cells were stained
and analysed by flow cytometry as described below.
U
4
5
6
Proliferation assay
C57BL/6J mice were inoculated on the left hind footpad with 1
× 107 L. amazonensis promastigotes. On the tenth week of infection, mice were euthanised and their spleens were harvested and
ground in DMEM (pH 7.2). Red blood cells were lysed with ammonium chloride lysis buffer and the cells were washed with PBS
(pH 7.2). Spleen cells were then labelled with biotinylated-GK1.5
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
For the MLR, spleen cells from uninfected BALB/c mice were labelled with CFSE as described previously. Leukocytes (5 × 105
cells) were co-cultured with uninfected or infected DCs (5 × 104
cells) in 48-well plates in a total volume of 500 µL/well. Cocultures were incubated at 37◦ C in a 5% CO2 atmosphere for 4
days; the cells were then collected and analysed using flow cytometry. The proliferation of CD3+ cells was assessed.
Flow cytometry
Cells at a concentration of 1 × 107 cells/mL in PBS with 1%
bovine serum albumin (BSA) were submitted to FcγR blocking in
the presence of anti-mouse CD16/CD32 (eBioscience, San Diego,
CA, USA). For each stain, 25 µL of the cell suspension was incubated with a combination of desired antibodies at 4◦ C for 30
min in the dark. The following antibodies were used: anti-mouse
CD11c (HL3 clone), anti-mouse CD40 (3/23 clone; BD Pharmingen, San Diego, CA, USA), anti-mouse CD39 (24DMS1 clone),
anti-mouse MHCII (M5 114.15.2 clone), anti-mouse CD86 (GL1
clone), anti-mouse CD73 (TY/23 clone; eBioscience), anti-mouse
CD3 ε(145–2C11 clone; BioLegend, San Diego, CA, USA) and their
respective isotype controls. The suspensions were centrifuged and
the cells were washed in PBS (pH 7.2) and resuspended in a solution of 1% paraformaldehyde, 47.7 mM sodium cacodylate and
113 mM NaCl, pH 7.2. The samples were analysed using a BD
FACSCaliburTM flow cytometer. Cell acquisition was performed
using BD CellQuestTM Pro software. Data analysis was performed
using FlowJo software (Tree Star, Ashland, OR, USA).
Statistical analysis
Student’s t-test and a one-way ANOVA analysis with Tukey’s
post-test were performed using Prism 5.0 software (GraphPad
www.eji-journal.eu
11
121
Eur. J. Immunol. 2012. 42: 1–13
Amanda B. Figueiredo et al.
2
3
Software, La Jolla, CA, USA). A p value of <0.05 was considered
statistically significant.
mune responsiveness. Nat. Med. 2002. 8: 358–365.
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
innate immune system with therapeutic potential. Eur. J. Pharmacol. 2009.
616: 7–15.
14 Berchtold, S., Ogilvie, A. L., Bogdan, C., Muhl-Zurbes, P., Ogilvie,
A., Schuler, G. and Steinkasserer, A. Human monocyte derived den-
dritic cells express functional P2X and P2Y receptors as well as ectonucleotidases. FEBS Lett. 1999. 458: 424–428.
15 Ben Addi, A., Lefort, A., Hua, X., Libert, F., Communi, D., Ledent, C.,
Macours, P. et al., Modulation of murine dendritic cell function by ade-
nine nucleotides and adenosine: involvement of the A(2B) receptor. Eur.
J. Immunol. 2008. 38: 1610–1620.
Y., Tikhomirov, O. Y., Blackburn, M. R. et al., Adenosine receptors in
Conflict of interest: The authors declare no financial or
commercial conflicts of interest.
regulation of dendritic cell differentiation and function. Blood 2008. 112:
TE
D
27
28
29
13 Kumar, V. and Sharma, A., Adenosine: an endogenous modulator of
16 Novitskiy, S. V., Ryzhov, S., Zaynagetdinov, R., Goldstein, A. E., Huang,
1822–1831.
17 Wilson, J. M., Ross, W. G., Agbai, O. N., Frazier, R., Figler, R. A., Rieger,
J., Linden, J. et al., The A2B adenosine receptor impairs the maturation and immunogenicity of dendritic cells. J. Immunol. 2009. 182:
References
4616–4623.
1 Afonso, L. C. C. and Scott, P., Immune responses associated with suscep-
EC
24
25
26
Med. 2007. 204: 1257–1265.
Acknowledgements: This work was supported by grants
from CAPES, FAPEMIG, CNPq and Rede Mineira de Bioterismo/FAPEMIG. L.C.C.A. is a fellow researcher from CNPq.
The authors wish to thank Leandro H. Santos and Marcorelio D. Souza for technical assistance, Dr. Milton A. P.
de Oliveira and Dr. Fátima R. Dias for support with DC differentiation, Dr. David Mosser and Dr. Ricardo Gonçalves
for helpful discussions, Dr. Leda Q. Vieira for providing the
anti-mouse CD40 antibody and PKH26, and Dr. David Sacks
for providing the 1B1.3a antibody.
tibility of C57BL/10 mice to Leishmania amazonensis. Infect. Immun. 1993.
61: 2952–2959.
2 Maioli, T. U., Takane, E., Arantes, R. M. E., Fietto, J. L. R. and Afonso,
L. C. C., Immune response induced by New World Leishmania species in
RR
21
22
23
expressed on regulatory T cells mediates immune suppression. J. Exp.
C57BL/6 mice. Parasitol. Res. 2004. 94: 207–212.
3 Marques-da-Silva, E. A., Oliveira, J. C., Figueiredo, A. B., Lima-Junior,
D. S., Carneiro, C. M., Fietto, J. L. R. and Afonso, L. C. C., Extracellular nucleotide metabolism in Leishmania: influence of adenosine in the
CO
18
19
20
Chen, J. F. et al., Adenosine generation catalyzed by CD39 and CD73
establishment of infection. Microbes Infect. 2008. 10: 850–857.
4 Barral, A., Costa, J. M., Bittencourt, A. L., Barral-Netto, M. and Carvalho,
E. M., Polar and subpolar diffuse cutaneous leishmaniasis in Brazil: clinical and immunopathologic aspects. Int. J. Dermatol. 1995. 34: 474–479.
5 Banchereau, J. and Steinman, R. M., Dendritic cells and the control of
N
15
16
17
12 Deaglio, S., Dwyer, K. M., Gao, W., Friedman, D., Usheva, A., Erat, A.,
immunity. Nature 1998. 392: 245–252.
18 La Sala, A., Ferrari, D., Corinti, S., Cavani, A., Di Virgilio, F. and
Girolomoni, G., Extracellular ATP induces a distorted maturation of dendritic cells and inhibits their capacity to initiate Th1 responses. J. Immunol.
2001. 166: 1611–1617.
19 Schnurr, M., Then, F., Galambos, P., Scholz, C., Siegmund, B., Endres,
S. and Eigler, A., Extracellular ATP and TNF-alpha synergize in the activation and maturation of human dendritic cells. J. Immunol. 2000. 165:
4704–4709.
20 Hofer, S., Ivarsson, L., Stoitzner, P., Auffinger, M., Rainer, C., Romani, N.
and Heufler, C., Adenosine slows migration of dendritic cells but does
not affect other aspects of dendritic cell maturation. J. Invest. Dermatol.
2003. 121: 300–307.
21 Panther, E., Corinti, S., Idzko, M., Herouy, Y., Napp, M., La Sala,
A., Girolomoni, G. et al., Adenosine affects expression of membrane
molecules, cytokine and chemokine release, and the T-cell stimulatory
capacity of human dendritic cells. Blood 2003. 101: 3985–3990.
6 Granucci, F., Zanoni, I. and Ricciardi-Castagnoli, P., Central role of den-
22 Favali, C., Tavares, N., Clarencio, J., Barral, A., Barral-Netto, M. and
dritic cells in the regulation and deregulation of immune responses. Cell
Brodskyn, C. I., Leishmania amazonensis infection impairs differenti-
U
12
13
14
Enjyoji, K. and Takashima, A. CD39 is the dominant Langerhans cellassociated ecto-NTPDase: modulatory roles in inflammation and im-
7
8
9
10
11
11 Mizumoto, N., Kumamoto, T., Robson, S. C., Sevigny, J., Matsue, H.,
PR
O
O
F
4
5
6
Mol. Life Sci. 2008. 65: 1683–1697.
7 Brandonisio, O., Spinelli, R. and Pepe, M., Dendritic cells in Leishmania
infection. Microbes. Infect. 2004. 6: 1402–1409.
8 Borsellino, G., Kleinewietfeld, M., Di, M. D., Sternjak, A., Diamantini, A.,
Giometto, R., Hopner, S. et al., Expression of ectonucleotidase CD39 by
Foxp3+ Treg cells: hydrolysis of extracellular ATP and immune suppression. Blood 2007. 110: 1225–1232.
9 Bours, M. J., Swennen, E. L., Di Virgilio, F., Cronstein, B. N. and Dagnelie,
P. C., Adenosine 5’-triphosphate and adenosine as endogenous signaling
molecules in immunity and inflammation. Pharmacol. Ther. 2006. 112:
358–404.
10 La Sala, A., Ferrari, D., Di Virgilio, F., Idzko, M., Norgauer, J. and
Girolomoni, G., Alerting and tuning the immune response by extracellular nucleotides. J. Leukoc. Biol. 2003. 73: 339–343.
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
ation and function of human dendritic cells. J. Leukoc. Biol. 2007. 82:
1401–1406.
23 Prina, E., Abdi, S. Z., Lebastard, M., Perret, E., Winter, N. and Antoine,
J. C., Dendritic cells as host cells for the promastigote and amastigote
stages of Leishmania amazonensis: the role of opsonins in parasite uptake
and dendritic cell maturation. J. Cell Sci. 2004. 117: 315–325.
24 Qi, H., Popov, V. and Soong, L., Leishmania amazonensis-dendritic cell interactions in vitro and the priming of parasite-specific CD4(+) T cells in
vivo. J. Immunol. 2001. 167: 4534–4542.
25 Xin, L., Li, K. and Soong, L., Down-regulation of dendritic cell signaling
pathways by Leishmania amazonensis amastigotes. Mol. Immunol. 2008. 45:
3371–3382.
26 Carvalho, L. P., Pearce, E. J. and Scott, P., Functional dichotomy of dendritic cells following interaction with Leishmania braziliensis: infected cells
www.eji-journal.eu
1
Eur. J. Immunol. 2012. 42: 1–13
Immunity to infection
2
3
4
5
6
produce high levels of TNF-alpha, whereas bystander dendritic cells are
activated to promote T cell responses. J. Immunol. 2008. 181: 6473–6480.
27 Liu, D., Kebaier, C., Pakpour, N., Capul, A. A., Beverley, S. M., Scott, P. and
41 Schulte, G. and Fredholm, B. B., Signalling from adenosine receptors to mitogen-activated protein kinases. Cell Signal. 2003. 15: 813–
827.
7
8
9
Uzonna, J. E., Leishmania major phosphoglycans influence the host early
42 Torres-Aguilar, H., Aguilar-Ruiz, S. R., Gonzalez-Perez, G., Munguia, R.,
immune response by modulating dendritic cell functions. Infect. Immun.
Bajana, S., Meraz-Rios, M. A. and Sanchez-Torres, C. Tolerogenic den-
2009. 77: 3272–3283.
dritic cells generated with different immunosuppressive cytokines in-
10
11
28 Suzue, K., Kobayashi, S., Takeuchi, T., Suzuki, M. and Koyasu, S., Critical
15
16
17
18
19
20
nia major infection. Int. Immunol. 2008. 20: 337–343.
latory activity of autocrine IL-10 on dendritic cell functions. J. Immunol.
2001. 166: 4312–4318.
30 Vasquez, R. E., Xin, L. and Soong, L. Effects of CXCL10 on dendritic cell
and CD4+ T-cell functions during Leishmania amazonensis infection. Infect.
Immun. 2008. 76: 161–169.
31 Hasko, G. and Pacher, P., A2A receptors in inflammation and injury:
lessons learned from transgenic animals. J. Leukoc. Biol. 2008. 83: 447–
455.
33 Soong, L., Modulation of dendritic cell function by Leishmania parasites.
44
45
46
Tafuri, W. L., A sensitive flow cytometric methodology for studying the
binding of L. chagasi to canine peritoneal macrophages. BMC. Infect. Dis.
45 Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani,
N. and Schuler, G., An advanced culture method for generating large
Immunol. Methods 1999. 223: 77–92.
46 Meyer-Fernandes, J. R., Dutra, P. M., Rodrigues, C. O., Saad-Nehme, J. and
J. Immunol. 2008. 180: 4355–4360.
TE
D
Lopes, A. H., Mg-dependent ecto-ATPase activity in Leishmania tropica.
Arch. Biochem. Biophys. 1997. 341: 40–46.
47 Ekman, P. and Jager, O., Quantification of subnanomolar amounts of
34 Boggiatto, P. M., Jie, F., Ghosh, M., Gibson-Corley, K. N., Ramer-Tait, A.
phosphate bound to seryl and threonyl residues in phosphoproteins us-
E., Jones, D. E. and Petersen, C. A., Altered dendritic cell phenotype in
ing alkaline hydrolysis and malachite green. Anal. Biochem. 1993. 214:
response to Leishmania amazonensis amastigote infection is mediated by
138–141.
MAP kinase, ERK. Am. J. Pathol. 2009. 174: 1818–1826.
EC
35 Buates, S. and Matlashewski, G., General suppression of macrophage
48 Quah, B. J., Warren, H. S. and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye car-
gene expression during Leishmania donovani infection. J. Immunol. 2001.
boxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2007. 2: 2049–
166: 3416–3422.
2056.
36 Neves, B. M., Silvestre, R., Resende, M., Ouaissi, A., Cunha, J., Tavares,
RR
J., Loureiro, I. et al., Activation of phosphatidylinositol 3-kinase/Akt and
impairment of nuclear factor-kappaB: molecular mechanisms behind the
Abbreviations: 5’-nucleotidase: 5’-nucleoside monophosphate phosphohydrolase · BMDC: bone marrow-derived dendritic cell · DC: den-
arrested maturation/activation state of Leishmania infantum-infected den-
dritic cell · ENTPDase: ectonucleoside triphosphate diphosphohydro-
dritic cells. Am. J. Pathol. 2010. 177: 2898–2911.
lase · La: Leishmania amazonensis; · Lb: Leishmania braziliensis · Lm: Leish-
37 Belkaid, Y., Hoffmann, K. F., Mendez, S., Kamhawi, S., Udey, M. C., Wynn,
mania major; · MRS1754: N-(4-cyanophenyl)-2-[4-(2,3,6,7-tetrahydro-2,6-
T. A. and Sacks, D. L., The role of interleukin (IL)-10 in the persistence of
dioxo-1,3-dipropyl-1H-purin-8-yl)phenoxy]-acetamide · Pi : inorganic
CO
41
42
43
263–270.
Leishmania major in the skin after healing and the therapeutic potential
of anti-IL-10 receptor antibody for sterile cure. J. Exp. Med. 2001. 194:
1497–1506.
38 Pellegatti, P., Falzoni, S., Pinton, P., Rizzuto, R. and Di Virgilio, F., A novel
N
38
39
40
sine receptors in immunity and inflammation. Trends Immunol. 2009. 30:
recombinant plasma membrane-targeted luciferase reveals a new pathway for ATP secretion. Mol. Biol. Cell 2005. 16: 3659–3665.
U
35
36
37
activation. Cell Immunol. 2010. 265: 91–96.
44 Goncalves, R., Vieira, E. R., Melo, M. N., Gollob, K. J., Mosser, D. M. and
quantities of highly pure dendritic cells from mouse bone marrow. J.
24
25
26
32
33
34
P., Schmitt, E. et al., Cyclic adenosine monophosphate and IL-10 coordinately contribute to nTreg cell-mediated suppression of dendritic cell
2005. 5: 39.
32 Hasko, G., Csoka, B., Nemeth, Z. H., Vizi, E. S. and Pacher, P., A(2B) adeno-
30
31
T cells. J. Immunol. 2010. 184: 1765–1775.
43 Fassbender, M., Gerlitzki, B., Ullrich, N., Lupp, C., Klein, M., Radsak, M.
29 Corinti, S., Albanesi, C., la, S. A., Pastore, S. and Girolomoni, G., Regu-
21
22
23
27
28
29
duce antigen-specific anergy and regulatory properties in memory CD4+
PR
O
O
F
12
13
14
role of dendritic cells in determining the Th1/Th2 balance upon Leishma-
39 Chaves, S. P., Torres-Santos, E. C., Marques, C., Figliuolo, V. R., Persechini, P. M., Coutinho-Silva, R. and Rossi-Bergmann, B., Modulation of P2X(7) purinergic receptor in macrophages by Leishmania ama-
47
48
zonensis and its role in parasite elimination. Microbes. Infect. 2009. 11:
49
50
51
40 Abbracchio, M. P. and Ceruti, S., P1 receptors and cytokine secretion.
842–849.
Purinergic. Signal. 2007. 3: 13–25.
phosphate
·
ZM241385: 4-(2-[7-amino-2-(2-furyl)[1,2,4]triazolo[2,3-
α][1,3,5]triazin-5-ylamino]ethyl)phenol
Full correspondence: Dr. Luı́s Carlos Crocco Afonso, Laboratório de
Imunoparasitologia, Departamento de Ciências Biológicas,
ICEB/NUPEB, Universidade Federal de Ouro Preto, Campus do Morro do
Q1
Cruzeiro, 35400–000 Ouro Preto, Minas Gerais, Brazil
Fax: +55 31 3559 1680
e-mail: [email protected]
Received: 6/7/2011
Revised: 17/1/2012
Accepted: 24/1/2012
52
53
54
55
56
57
58
°
C 2012 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
www.eji-journal.eu
13