18/11/2011
UFPR :: Universidade Federal do Paraná
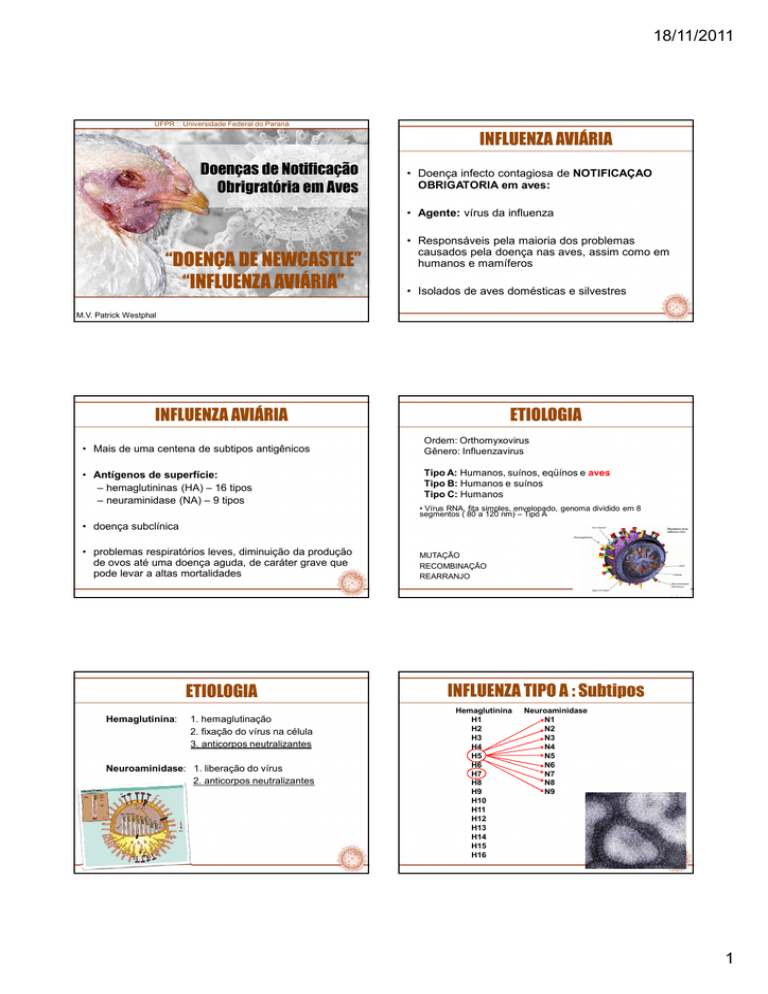
INFLUENZA AVIÁRIA
Doenças de Notificação
Obrigratória em Aves
• Doença infecto contagiosa de NOTIFICAÇAO
OBRIGATORIA em aves:
• Agente: vírus da influenza
“DOENÇA DE NEWCASTLE”
“INFLUENZA AVIÁRIA”
• Responsáveis pela maioria dos problemas
causados pela doença nas aves, assim como em
humanos e mamíferos
• Isolados de aves domésticas e silvestres
M.V. Patrick Westphal
INFLUENZA AVIÁRIA
ETIOLOGIA
• Mais de uma centena de subtipos antigênicos
Ordem: Orthomyxovirus
Gênero: Influenzavirus
• Antígenos de superfície:
– hemaglutininas (HA) – 16 tipos
– neuraminidase (NA) – 9 tipos
Tipo A: Humanos, suínos, eqüínos e aves
Tipo B: Humanos e suínos
Tipo C: Humanos
• Vírus RNA, fita simples, envelopado, genoma dividido em 8
segmentos ( 80 a 120 nm) – Tipo A
• doença subclínica
• problemas respiratórios leves, diminuição da produção
de ovos até uma doença aguda, de caráter grave que
pode levar a altas mortalidades
ETIOLOGIA
Hemaglutinina:
1. hemaglutinação
2. fixação do vírus na célula
3. anticorpos neutralizantes
Neuroaminidase: 1. liberação do vírus
2. anticorpos neutralizantes
MUTAÇÃO
RECOMBINAÇÃO
REARRANJO
INFLUENZA TIPO A : Subtipos
Hemaglutinina
H1
H2
H3
H4
H5
H6
H7
H8
H9
H10
H11
H12
H13
H14
H15
H16
Neuroaminidase
N1
N2
N3
N4
N5
N6
N7
N8
N9
1
18/11/2011
IA – Identificação das Amostras
1. Tipo do antígeno
2. Espécie isolada
3. Localização geográfica
4. Número da amostra (opcional)
5. Ano do isolamento
6. Subtipo H e N (Vírus tipo A)
Ex.: A/galinha/Brasil/1 /2009 (H9N3)
IMPORTÂNCIA
• Virus de baixa patogenicidade (LPAI)
• Vírus altamente patogênico (HPAI)*
• Grande impacto econômico
• Perdas
• Mortalidade
• Embargos de comercialização de aves
• Medidas de erradicação da enfermidade no país
RESISTÊNCIA – QUÍMICO/FÍSICA
1.
Vírus envelopado - lipídios (detergentes).
2.
Sensível no ambiente (exceto: secreções e MO).
3.
Partículas instáveis, inativados: luz (UV) e calor.
4.
Inativados por pH extremos.
5.
Sensível a desinfetantes (amônia, formalina,
oxidantes)
IMPORTÂNCIA
• EUA, surto nos anos 1983/1984, Pennsylvania,
Virgínia e Nova Jersey
• > 60 milhões de dólares para erradicar um HPAI (H5N2)
• abater > 17 milhões de aves
• Austrália, em 1985
• > 2 milhões de dólares surto em um único produtor
• Conservação de aves silvestres
• É uma Zoonose!
CLASSIFICAÇÃO POR PATOGENIA - OIE
• OIE – Classificação das Amostras HPAI:
a. Qualquer vírus de influenza que seja letal para seis, sete ou
oito galinhas de oito susceptíveis de quatro a seis semanas
de idade, inoculadas intravenosamente com 0,2ml de uma
diluição de 1:10 de liquido cório-alantóide, livre de bactérias,
e observadas durante 10 dias;
b. Qualquer amostra de vírus H5 ou H7 que não se incluam
nos critérios do item “a” mas, que a sequência de
aminoácidos do sítio de clivagem da hemaglutinina seja
compatível com o vírus da influenza aviária de alta
patogenia;
c. Qualquer vírus de influenza que não seja H5 ou H7 e que
mate de uma a cinco galinhas quando inoculados e que
cresça em cultivo celular na ausência de tripsina.
HISTÓRICO
• 1878, “Peste Aviária” - descrita Perroncito - ≠
bactérias
• 1901, Centanni & Savunozzi - agente filtrável (vírus)
• 1918, maior surto documentado de influenza –
“Gripe Espanhola” – 25% da população mundial
2
18/11/2011
HISTÓRICO
HISTÓRICO
– Característica zoonótica da enfermidade
– Recentemente associada a uma adaptação de
um vírus aviário no ser humano com alto índice
de patogenia
• 1924, EUA/NY - doença em frangos de corte,
disseminando-se por vários estados americanos
• 1955, “Peste Aviária” – Vírus Influenza tipo A
– Ambiente, geografia e manejo de convivência
entre mamíferos “inferiores”, aves e o homem
• Nos anos seguintes, vários surtos HPAI descritos
em muitos lugares do mundo
– América do Sul e do Norte, Norte da África,
Oriente Médio e na Europa, incluindo a Inglaterra
e o leste Europeu
CASOS 59-07
CASOS 2011
– Surto surgiu assim como hoje na Ásia
ESPÉCIE AVIÁRIA
PAÍS
SUBTIPO
ANO
NÚMERO APROXIMADO DE AVES ENVOLVIDAS
Frango
Peru
Peru
Frango
Frango
Peru
Frango
Peru
Frango
Peru
Frango
Frango
Frango
Frango
Frango
Frango
Frango e peru
Frango e peru
Frango e peru
Frango e peru
Escócia
Inglaterra
Canadá
Austrália
Alemanha
Inglaterra
EUA
Irlanda
Austrália
Inglaterra
Austrália
Austrália
México
Paquistão
Austrália
Hong Kong
Itália
Itália
Chile
Holanda
H5N1
H7N3
H5N9
H7N7
H7N7
H7N7
H5N2
H5N8
H7N7
H5N1
H7N3
H7N3
H5N2
H7N3
H7N4
H5N1
H5N2
H7N1
H7N3
H7N7
1959
1963
1966
1976
1979
1979
1983
1983
1985
1991
1992
1994
1994
1994
1997
1997
1997
1999
2002
2003
Uma pequena fazenda
29.000
8.000
58.000
Duas fazendas
9.000
17.000.000
307.000
240.000
8.000
18.000
22.000
Desconhecido (milhões)
> 6.000.000
160.000
3.000.000
8.000
14.000.000
≈ 700.000
> 25.000.000
≠ espécies
≠ países da Ásia
H5N1
2003-2004
> 100.000.000
Frango
Frango
Frango
Canadá
EUA
África
≠ países Europa,
África, Ásia e
Oriente Médio
H7N3
H5N2
H5N2
2004
2004
2004
16.000.000
6.600
30.000
H5N1
2005-2007
aumentando ainda
≠ espécies
ESPÉCIE AVIÁRIA
PAÍS
SUBTIPO
ANO
NÚMERO APROXIMADO DE AVES
ENVOLVIDAS
não relat.
Vietnam
H5N1
2011
144.347 / destruídas 207.246
≠ espécies
África do Sul
H5N2
2011
11.822
não relat.
Território Palestino
H5N1
2011
2.000
≠ espécies (com)
Myanmar
H5N1
2011
56.237
Aves selvagens
Mongolia
H5N1
2011
3
≠ espécies (com)
Coréia
H5N1
2011
39.569 / destruídas 1396.376
2.268 / destruídas 1858.854
Japão
H5N1
2011
Aves selvagens
≠ espécies
Israel
H5N1
2011
1
não relat.
Indonesia
H5N1
2011
710
3.721
Frangos caipiras
India
H5N1
2011
≠ espécies (com/sel)
Hong Kong
H5N1
2011
8
não relat.
Camboja
H5N1
2011
48 – 1 vila
≠ espécies (com)
Bangladesh
H5N1
2011
404.605 / destruídas 2004.790
Fonte: OIE, (2011)
Fonte: Moraes et al, (2009)
CADEIA EPIDEMIOLÓGICA
DISSEMINAÇÃO
Vírus da IA
Humanos e
Aves
Agente
Etiológico
Aves e
Mamíferos
Fatores gerais
• Aumento do Número de Aves
• Aumento do Tráfego (Imp./Exp.)
• Preservação das Espécies (Migrações)
Fatores específicos
• Vírus difunde-se facilmente
Via de
Transmissão
TR e TGI
Horizontal
• Endêmico em aves aquáticas
Secreções respiratórias
Fezes/2 dias – 37ᵒC
3
18/11/2011
TRANSMISSÃO
• Modo de difusão: Ave – Humano
– Vírus de aves, usualmente não infecta humanos
– Difusão entre humanos não está confirmada
– Aves excretam vírus pelas secreções nasais e
oculares e pelas fezes
IMPORTÂNCIA DAS AVES SILVESTRES
• Aves aquáticas reservatórios
• Rotas de migração
Anas acuta
• Contaminação: material fecal, oronasal e ocular
IMPORTÂNCIA DAS AVES SILVESTRES
IMPORTÂNCIA DAS AVES SILVESTRES
• Os vírus H5N1 têm sido causa de morte em grande
número de aves selvagens
• Rotas de migração
• Pesquisas intensivas na Europa, América do Norte,
Ásia e África abrangendo cerca de 750.000
amostras
• poucas aves saudáveis hospedando o vírus
H5N1
• Elas não são consideradas reservatórios deste tipo
de vírus
<www.oie.int - www.who.int - www.fao.org>
SITUAÇÃO MUNDIAL 10-11
JAN – JUN/2010
SITUAÇÃO MUNDIAL 10-11
JUL – DEC/2010
4
18/11/2011
SITUAÇÃO MUNDIAL 11
SITUAÇÃO MUNDIAL 03-11
JAN – JUN/2011
SITUAÇÃO MUNDIAL 11
SITUAÇÃO - HUMANOS
•
H5N1 (HPAI)
•
H9N2 (LPAI) 99-2003
•
H7N7 (HPAI) 83-2003
•
Cepas do vírus da influenza aviária, LPAI, podem produzir
mutações (6 - 9 meses) para uma HPAI <Portal da Saúde>;
•
NÃO ESTÁ ESCLARECIDO A TRANSMISSÃO HUMANO-HUMANO
LINHA DO TEMPO 2011
Data
Jan 2011
Fev/2011
Eventos em Animais
- Coréia relata casos de H5N1 em aves selvagens e em aves
comerciais.
- FAO reporta incidência de HPAI na Indonésia (0,6 por 1000
vilarejos).
- Bangladesh relata H5N1 em aves comerciais, o primeiro relato
neste pais desde maio de 2010.
- Egito relata H5N1 em frangos.
- Myanmar reporta H5N1 em frangos.
- Japão relata H5N1 em aves selvagens.
- Hong Kong relata H5N1 em aves selvagens.
- Hong Kong relata H5N1 em carcaças de frango.
Eventos em Humanos
- Egito confirma seu 116, 117, 118, 119, 120 e
121 casos em humanos.
- Egito confirma seu 122, 123, 124, 125 casos
em humanos.
- FAO reporta aumento da incidência de HPAI na Indonésia (1,2 - Camboja confirma seu 11, 12, 13 caso em
por 1000 vilarejos sob vigilância).
humanos, 1º caso em humanos desde
mai/2010.
- Myanmar relata H5N1 em frangos.
- Japão reporta surtos de H5N1 em frangos e aves selvagens.
- Camboja relata H5N1 em frangos coloniais.
- Bangladesh relata H5N1 em frangos.
- Coréia reporta surto de H5N1 em frangos.
- Índia reporta H5N1 em frangos.
- Vietnam reporta H5N1 em frangos.
Fonte: adaptado de WHO, 2011
LINHA DO TEMPO 2011
Data
Mar/2011
Eventos em Animais
- West Bank/Faixa de Gaza reporta H5N1 em frangos, 1º relato de
H5N1 desde abr/2006.
- Bangladesh reporta mais surtos de H5N1 em frangos.
Eventos em Humanos
- Indonésia confirma seu 172, 173, 174, 175
caso em humanos, 1º caso desde dez/2010.
- Egito confirma seu 126, 127, 128, 129, 130,
131, 132, 133 casos em humanos.
- FAO reporta aumento da incidência de HPAI na Indonesia (1,9- - Bangladesh confirma seu 2 caso em humanos,
2,5 por 1000 vilarejos sob vigilância), depois de 12 meses relata 1º caso desde mai/2008
incidência de 15,7 por 1000 vilarejos.
- Hong Kong relata H5N1 em frangos.
- Coréia relata 5 surtos de H5N1 em frangos.
- Índia relata H5N1 em frangos.
- Vietnam relata H5N1 em frangos.
- Japão relata H5N1 em aves selvagens.
- Myanmar relata surtos de H5N1.
- FAO reporta surtos no Egito.
Abr/2011
- FAO relata surtos de H5N1 em frangos no Egito.
- Indonésia confirma seu 176 caso em humanos.
- Indonésia relata surtos de H5N1 em frangos. Indonésia fica - Egito confirma seu 134, 135, 136, 137, 138,
considerada como endêmica para H5N1.
139, 140, 141, 142, 143 casos em humanos.
- Mongolia reporta H5N1 em aves selvagens, 1º relato de H5N1 - Camboja confirma seu 14, 15 caso em
desde mai/2010.
humanos.
- Coréia reporta surtos de H5N1 em frangos.
- Bangladesh confirma seu 3 caso em humanos.
- Vietnam reporta surtos de H5N1 em frangos.
- Bangladesh relata surtos de H5N1 em frangos.
- Japão relata H5N1 em alves selvagens.
Fonte: adaptado de WHO, 2011
5
18/11/2011
LINHA DO TEMPO 2011
Eventos em Animais
Eventos em Humanos
- FAO reporta surtos de H5N1 em frangos no Egito.
- Indonésia confirma seu 177 caso em humanos.
- Bangladesh reporta surtos de H5N1 em frangos.
- Japão reporta H5N1 em aves selvagens.
- Coréia relata surto de H5N1 em frangos.
- FAO reporta aumento da incidência de HPAI na Indonesia (3,3
por 1000 vilarejos sob vigilância), em abril.
- Vietnam relata surtos de H5N1 em frangos.
Jun/2011
- Vietnam relata surtos adicionais de H5N1 em frangos coloniais. - Egito confirma seu 144, 145, 146, 147, 148,
149, 150 caso em humanos.
- FAO reporta surtos de H5N1 em frangos no Egito.
- Indonesia confirma seu 178 caso em humanos.
- Camboja confirma seu 16 caso em humanos.
Jul/2011
- Bangladesh reporta surto de H5N1 em frangos
- FAO reporta surtos de H5N1 em frangos no Egito.
Fonte: adaptado de WHO, 2011
CONTROLE
Data
Mai/2011
• Países considerados endêmicos para HPAI
H5N1: China, Vietnã, Bangladesh, Indonésia,
Índia e Egito.
Formas de difusão do vírus da IA
55%
Homem
4
Equipamentos
3
25%
12%
2
8%
1
0
10
20
30
40
50
60
Fonte: Pennsylvania - 1983-84
CONTROLE & PREVENÇÃO
CONTROLE & PREVENÇÃO
• Prevenção e ALERTA
permanente
• Biosseguridade
• Inquéritos Sorológicos em
aves silvestres e de fundo de
quintal
• Vigilância constante (?)
VACINAÇÃO
• Utilizada em regiões endêmicas –
controle/prevenção
• Recentemente - grupo 2.3.2.1 de H5N1 evoluiu do
grupo 2.3.2 circulante entre aves no leste da Ásia
desde 2005
• Evolução de H5N1 - Impacto no desenvolvimento de
vacinas e testes diagnósticos para humanos e aves
• Atualização de vacinação para melhoria da eficácia
e atualização nos ensaios diagnósticos para sua
detecção
TRATAMENTO
• Não viável em aves de produção
• ABATE SANITÁRIO em surtos confirmados
Canadá, aves eliminadas em camâra
de gás devido a Influenza aviária
Indonesia, aves queimadas vivas
para destruir os “espíritos” da
Influenza
6
18/11/2011
DOENÇA DE NEWCASTLE
DOENÇA DE NEWCASTLE
Definição: É uma infecção de aves causada por um
paramixovirus aviário sorotipo 1 (APMV-1), que pode
apresentar-se patogênico, utilizando um dos seguintes
critérios de virulência:
Exotic Newcastle Disease
Pseudo-Fowl Pest
Pseudovogel-Pest
Atypical Geflugelpest
Pseudo-Poultry Plague
Avian Distemper
Ranikhet Disease
Tetelo Disease
Korean Fowl Plague
Avian Pneumoencephalitis
In vivo
Apresentar Índice de Patogenicidade
Intracerebral – IPIC maior ou igual a 0,7;
DOENÇA DE NEWCASTLE
DOENÇA DE NEWCASTLE
Possuem 5 patotipos:
- Família Paramyxoviridae
-Entérica assintomática : subclínico
-Lentogênica: infecções respirtatórias brandas
- 9 sorotipos APMV-1 - APMV-9
- Doença de Newcastle é APMV-1
-Mesogênica: sinais respiratórios e nervosos
-Velogênico neurotrópico: alta mortalidade, sinais
nervosos e respiratórios
-Velogênico viscerotrópico: alta mortalidade,
lesões intestinais e respiratórias hemorrágicas
DOENÇA DE NEWCASTLE
- RNA vírus
- Presença de envelope
natureza lipoproteica oriundo
da membrana da célula hospedeira
RESISTÊNCIA – QUÍMICO/FÍSICA
- Sobrevive por semanas fora do hospedeiro
•
Distribuição cosmopolita
•
Endêmica
•
Difusão rápida
•
Período de incubação variável
•
Complexo respiratório das aves
•
Zoonose
- Inativado à temperatura de 100ºC, por 1 minuto
- Inativados à temperatura de 37ºC, durante horas a dias
- Inativados à temperatura de 56ºC, durante 5 minutos a 6 horas
de 2 a 15 dias
(média 5 a 6 dias)
- Sobrevive meses e anos às temperaturas de 8ºC e 20ºC
- Inativado pelos raios de luz ultravioleta
7
18/11/2011
HOSPEDEIRO
Aves (241 espécies)
3 GRANDES PANZOOTIAS
•
1926: Java (Indonésia) e Newcastle (Inglaterra)
•
Asia, OM, Europa, África e Américas
Répteis (serpentes)
Mamíferos (humanos)
•
1960 (final): Oriente Médio (comércio psitacídeos)
•
•
1970: Oriente Médio – pigeon type (PPMV-1)
•
•
Maior disseminação – todos os continentes até 73
20 países – comércio de pombos
1981: Inglaterra – 20 surtos – pombos x ração farelada
SITUAÇÃO MUNDIAL 11
DOENÇA DE NEWCASTLE
•
•
•
•
•
•
EUA, Set/2002 - Califórnia, Nevada, Arizona e
Texas.
Rússia: Surtos - Nov/2002 (Kursk)
Austrália: Set/2002
México: focos da DN
Noruega: Out/2003
Suécia: Out/2003
JAN – JUN/2011
DN NO BRASIL
DN NO BRASIL
1953: Belém e Macapá – PA. Importação de carnes dos
EUA
1971-80: DN já foi 3ᵒ e 2ᵒ maior problema em frequência
na avicultura brasileira – MG e outros 14 estados.
1983-93: focos registrados em diversos estados entre
eles PR, MG, RS, entre outros.
2003: Brasil declara avicultura comercial livre da DNC
em oito Estados além do DF
Legenda:
2006: Rio Grande do Sul
<Fonte: OIE, (2011)>
8
18/11/2011
MODOS DE DIFUSÃO
1. Contato direto entre aves susceptíveis
2. Aerossóis - TR/ Fezes – TGI (água/ração)
3. Fômites contaminados
4. Formas de difusão indireta:
- Veículos
- Importação – Resistência ao congelamento
- Pessoas
- Pragas (Roedores, Artropodes)
- Equipamentos
SINAIS CLÍNICOS
SINAIS CLÍNICOS
• Não existem lesões patognomônicas para IA e DN
• Em geral estirpes patogênicas podem causar:
• Sinais Gerais: anorexia, depressão, lacrimejamento,
conjuntivite, diarréia esverdeada e/ou hemorrágica,
redução de crescimento e queda de postura e
qualidade do ovo
• Sinais Respiratórios: descarga nasal, rinite,
estertores, dispnéia
•Sinais Nervosos: ataxia, paresia, convulsões,
paralisia de pernas e asas, tremores, opistótono,
comportamento anormal
SINAIS CLÍNICOS
Doretto Jr., L.
SINAIS CLÍNICOS
Doretto Jr., L.
9
18/11/2011
SINAIS CLÍNICOS
SINAIS CLÍNICOS
SINAIS CLÍNICOS
SINAIS CLÍNICOS
Doretto Jr., L.
SINAIS CLÍNICOS
Doretto Jr., L.
SINAIS CLÍNICOS
Doretto Jr., L.
10
18/11/2011
SINAIS CLÍNICOS
DOENÇA DE NEWCASTLE
PATOGENIA
NECROPSIA
Doretto Jr., L.
- Replicação viral:
- Trato respiratório
- Trato digestivo
LESÕES
Edema de cabeça e pescoço
Hemorragias e ulcerações de laringe
Aerossaculite
Inflamação da traquéia
Hemorragia no coração
Hemorragias petequiais no proventrículo e intestino
LESÕES
11
18/11/2011
LESÕES
LESÕES
DIAGNÓSTICO
DIAGNÓSTICO
Aves necropsiadas:
Baço
Cérebro
Coração
Fígado
Humor aquoso
Intestino
Proventrículo
Pulmão-Traquéia
Sacos aéreos
Swab oro-nasal
Tonsilas cecais
Aves vivas:
Soro
Swab de cloaca
Swab de traquéia
Fezes frescas.
DIAGNÓSTICO
1. Isolamento viral: Inoculação em ovos embrionados
Presuntivo: Histórico, manifestação clínica e
lesões
Confirmatório: Isolamento do vírus e
caracterização do vírus
No Brasil – Laboratório de Referência
•
•
•
–
LARA – Campinas/SP
DIAGNÓSTICO LABORATORIAL
COLHEITA DE MATERIAL
2. Titulação antigênica: teste de hemaglutinação – HA
3. Identificação antigênica: teste de inibição da
hemaglutinação – HI
4. Caracterização viral: IPIC e IPIV
12
18/11/2011
DIAGNÓSTICO LABORATORIAL
DIAGNÓSTICO LABORATORIAL
COLHEITA DE MATERIAL
CONSERVAÇÃO E ESTOCAGEM
• Virológico
Virológico::
-20°
20°C (até o processamento)
Doretto Jr., L.
DIAGNÓSTICO LABORATORIAL
DIAGNÓSTICO LABORATORIAL
INOCULAÇÃO EM OVOS
EMBRIONADOS SPF
PREPARO DO INÓCULO
Incubação 35-37ºC/4-7 dias
Solução Salina Tamponada (PBS) + Antibióticos
DIAGNÓSTICO LABORATORIAL
OVO EMBRIONADO
- Anatomia e vias de inoculação
Necrópsia dos ovos e HA rápida
Câmara de Ar
Inoculação Membrana
corioalantóide
1Cavidade Amniótica
3Membrana
Córioalantóide
Casca
2Cavidade Alantóica
Albumina
Inoculação Cavidade
Alantóica
Saco Vitelínico
Vírus:
Orthomyxovírus
Parainfluenzavirus
HerpesVirus
13
18/11/2011
DIAGNÓSTICO LABORATORIAL
DIAGNÓSTICO LABORATORIAL
Lesões nos embriões
Doretto Jr., L.
DIAGNÓSTICO LABORATORIAL
INFLUENZA AVIÁRIA
Caracterização viral
IPIV > 1,2
BAIXA PATOGENICIDADE
ENFERMIDADE LEVE
ALTA PATOGENICIDADE
AGUDA, ENFERMIDADE SISTÊMICA
IA : IPIV ≥ 1,2
Sinais Clínicos
Normal
Doente
Paralítico
Morto
Dias após inoculação
Total
Resultado
0
12x0
0
0
6x1
6x2
76x3
6
12
228
2
3
4
5
6
7
8
9
10
10 2
0
0
0
0
0
0
0
0
4
2
0
0
0
0
0
0
0
2
2
2
0
0
0
0
0
0
0
2
6
8 10 10 10 10 10 10
1
IPIV = 246÷
÷100 = 2,46
Total = 246
Doretto Jr., L.
DIAGNÓSTICO LABORATORIAL
DIAGNÓSTICO LABORATORIAL
Caracterização viral
Caracterização viral - IPIC
NC : IPIC ≥ 0,7
Sinais Clínicos
Dias após inoculação
1
Resultado
0
10x0
0
0
8x1
62x2
8
124
3
4
5
6
7
8
Normal
10 0
0
0
0
0
0
Doente
Morto
0
8
0
0
0
0
0
0
2 10 10 10 10 10 10
Total = 132
Doretto Jr., L.
Total
2
IPIC = 132÷
÷80 = 1,65
Doretto Jr., L.
14
18/11/2011
DIAGNÓSTICO LABORATORIAL
SOROLOGIA:
MONITORIA DE PLANTEL
SERVE DE ALERTA
DIAGNÓSTICO DIFERENCIAL
IA x DN:
Bronquite infecciosa
Laringotraqueíte
Coriza infecciosa
Micoplasmose
Problemas de manejo
ISOLAMENTO VIRAL:
É O ÚNICO MÉTODO
SEGURO DE DIAGNÓSTICO
CONTROLE E PREVENÇÃO
VACINAÇÃO
PREVENÇÃO
• VACINAÇÃO
• BIOSSEGURIDADE
Tipo de vacina:
• Viva
• Inativada
Programa vacinal: Variados
Doretto Jr., L.
VACINAÇÃO
VACINAÇÃO
IPIC
Estirpes: Ulster
VG-GA
B1
LaSota
0,00 - 0,10
0,11 - 0,25
0,26 - 0,45
Clone 30
<Nunes et al., 2002>
Doretto Jr., L.
15
18/11/2011
MEDIDAS DE CONTROLE
NÃO QUEREMOS VER!!!
O FUTURO
• O vírus HPAI (H5N1) continua a circular em
frangos e causar doença, e permanece como
uma ameaça para saúde humana e animal
• Os setores de saúde pública e animal nos
níveis nacionais, regionais e internacionais
devem manter vigilância e regularmente
detectar, relatar e caracterizar os vírus da
influenza aviária, e avaliar e gerenciar casos
envolvendo riscos a saúde associados a esse
vírus
<www.oie.int>
O FUTURO
OBRIGADO!
• GISRS – Global Influenza Surveillance and
Response
• Estudos - vírus da influenza animal e humano
que podem causar impacto na saúde humana a
serem considerados para inclusão em futuras
vacinas humanas inter-pandêmicas do vírus
H5N1, caso necessário
Patrick Westphal – [email protected]
<www.oie.int - www.who.int - www.fao.org>
16