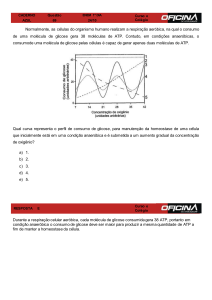
Aulas de grupo 2001-02; Rui Fontes
Gliconeogénese e Metabolismo do Glicogénio
1- Gliconeogénese
1-
A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
pode converter substâncias não glicídicas (como aminoácidos, lactato, piruvato, glicerol e propionato)
em glicose ou glicogénio.
2-
Durante o jejum aumenta a actividade lipolítica (hidrólise dos triacilgliceróis em glicerol e ácidos
gordos) no tecido adiposo e a maioria dos órgãos do organismo (nomeadamente os músculos e o
fígado) começam a usar como combustível preferencial os ácidos gordos. Contudo, os eritrócitos e, em
grande medida, os neurónios dependem do catabolismo da glicose para a síntese de ATP. Embora a
glicogenólise hepática (formação de glicose a partir do glicogénio armazenado no fígado) seja,
durante as primeiras horas de jejum, a principal fonte da glicose que é vertido no sangue, à medida que
o tempo de jejum aumenta a gliconeogénese vai sendo cada vez mais importante.
3-
Quer na glicogenólise quer na gliconeogénese forma-se glicose-6-P e a formação de glicose só pode
ocorrer por hidrólise da glicose-6-P. Porque a enzima responsável por este processo (glicose-6fosfátase) só existe no fígado e no rim são estes os órgãos responsáveis pela manutenção de níveis de
glicemia compatíveis com a actividade dos neurónios e dos eritrócitos durante o jejum. O fígado tem,
neste contexto, um papel mais importante que o rim.
4-
Três das enzimas da glicólise [(1) cínase da glicose: ATP + glicose → glicose-6-P + ADP; (2) cínase
1 da frutose-6-P: ATP + frutose-6-P → ADP + frutose-1,6-bisfosfato; (3) cínase do piruvato: ADP +
fosfoenolpiruvato → ATP + piruvato] catalisam reacções fisiologicamente irreversíveis. Na
gliconeogénese, também são fisiologicamente irreversíveis as reacções catalisadas pelas enzimas que
permitem as conversão de piruvato em fosfoenolpiruvato [(3a) carboxílase do piruvato: ATP + H2O
+ piruvato + CO2 → ADP + Pi + oxalacetato; (3b) carboxicínase do fosfoenolpiruvato: GTP +
oxalacetato → GDP + fosfoenolpiruvato + CO2], da frutose-1,6-bisfosfato em frutose-6-P [(2) frutose1,6-bisfosfátase: frutose-1,6-bisfosfato + H2O → frutose-6-P + Pi] e da glicose-6-P em glicose [(1)
glicose-6-fosfátase: glicose-6-P + H2O → glicose + Pi]. A actividade relativa das enzimas envolvidas
nas transformações referidas determina a velocidade e o sentido (anabólico ou catabólico) no
metabolismo da glicose.
5-
Muitas das enzimas envolvidas na gliconeogénese também participam na glicólise: catalisam reacções
fisiologicamente reversíveis e o seu papel (anabólico ou catabólico) depende das concentrações dos
compostos (reagentes e produtos) envolvidos nessas reacções. De notar que a reacção catalisada pela
cínase do 3-fosfoglicerato (ATP + 3-fosfoglicerato ↔ 1,3-bisfosfoglicerato + ADP) funciona no
sentido da conversão de ATP em ADP durante a gliconeogénese mostrando claramente que, em jejum,
não existe no fígado déficit de ATP. A oxidação hepática dos ácidos gordos libertados no tecido
adiposo fornece ao fígado a energia necessária para a síntese de ATP.
6-
A lipólise no tecido adiposo também liberta glicerol para o sangue. Ao contrário do que acontece em
muitos tecidos (nomeadamente no tecido adiposo) no fígado (e rim) existe uma enzima que é capaz de
catalisar a transformação do glicerol em glicerol-3-P (cínase do glicerol: glicerol + ATP → glicerol-3P + ADP) iniciando o processo de conversão do glicerol em glicose. A transformação do glicerol-3-P
(3C) em glicose (6C) envolve a actividade das seguintes enzimas: desidrogénase do glicerol-3-P
(glicerol-3-P + NAD+ ↔ dihidroxiacetona-P + NADH), isomérase das trioses-P (dihidroxiacetona-P
↔ gliceraldeído-3-P), aldólase (dihidroxiacetona-P + gliceraldeído-3-P ↔ frutose-1,6-bisfosfato),
frutose-1,6-bisfosfátase (frutose-1,6-bisfosfato + H2O → frutose-6-P + Pi), isomérase das hexoses-P
(frutose-6-P ↔ glicose-6-P) e glicose-6-fosfátase (glicose-6-P + H2O → glicose + Pi). A equação
soma relativa à transformação que ocorre no fígado (e rim) pode ser escrita:
2 glicerol + 2 NAD+ + 2 ATP + 2 H2O → glicose + 2 NADH + 2 ADP + 2 Pi
7-
Os eritrócitos produzem continuamente lactato e os músculos, mesmo em jejum, dependem da
glicólise anaeróbia para realizarem esforços que consomem ATP a uma velocidade maior que a
velocidade de formação de ATP na fosforilação oxidativa. O lactato vertido no sangue pode, no fígado
e no rim, ser convertido em glicose e por isso se diz que o lactato é um composto glicogénico. As
Página 1 de 5
Aulas de grupo 2001-02; Rui Fontes
enzimas envolvidas na transformação do lactato em glicose são a desidrogénase do lactato, a
carboxílase do piruvato, a carboxicínase do fosfoenolpiruvato, a enólase, a mútase do fosfoglicerato, a
cínase do 3-fosfoglicerato, a desidrogénase do gliceraldeído-3-P, a isomérase das trioses-P, a aldólase,
a frutose-1,6-bisfosfátase, a isomérase das hexoses-P e a glicose-6-fosfátase. O conjunto de reacções
pode ser resumido na seguinte equação soma
2 lactato (C3H6O3) + 2 GTP + 4 ATP + 6 H2O → glicose (C6H12O6) + 2 GDP +4 ADP + 6 Pi
A formação da glicose a partir de lactato (processo endergónico) só é possível porque está acoplada
com a hidrólise de ATP e do GTP (processo exergónico).
8-
Mais importantes que o lactato como fonte de carbono para a gliconeogénese são os aminoácidos.
Em jejum aumenta a hidrólise das proteínas e o esqueleto carbonado da maioria dos aminoácidos
libertados no processo hidrolítico pode gerar glicose no fígado. Neste contexto são particularmente
importantes a alanina e o glutamato. A alanina pode por transaminação gerar piruvato (alanina + αcetoácido-X ↔ piruvato + α-aminoácido-X) e o piruvato pode, através da acção da carboxílase do
piruvato, gerar um intermediário do ciclo de Krebs, concretamente o oxalacetato. O glutamato
também pode, por transaminação (glutamato + α-cetoácido-X ↔ α-cetoglutarato + α-aminoácido-X),
gerar um intermediário do ciclo de Krebs, concretamente o α-cetoglutarato que pode gerar
oxalacetato.
9-
No homem, a maioria dos ácidos gordos têm um número par de carbonos (cadeia par) e geram no seu
catabolismo acetil-CoA que reage com o oxalacetato por acção catalítica da síntase do citrato. Nesta
reacção não há formação de intermediários do ciclo de Krebs e os ácidos gordos de cadeia par não
são glicogénicos. Pelo contrário, os ácidos gordos de cadeia ímpar podem dar origem (para além de
acetil-CoA) a propionil-CoA (o grupo propionil contém 3 carbonos). O propionil-CoA pode por acção
de uma sintétase (carboxílase do propionil-CoA: propionil-CoA + CO2 + ATP + H2O → D-metilmalonil-CoA + ADP + Pi) e de duas isomérases gerar succinil-CoA que é um intermediário do ciclo
de Krebs. Para além do glicerol, do lactato, do piruvato, da alanina e do glutamato também os
ácidos gordos de cadeia ímpar são glicogénicos.
10-
Sendo parte importante nos processos homeostáticos as enzimas que catalisam as reacções
fisiologicamente irreversíveis na glicólise e na gliconeogénese são, no fígado e rim, reguladas de tal
forma que quando a glicemia está elevada as primeiras estão activadas e as segundas inibidas. O
contrário acontece quando a glicemia está diminuída. A regulação da actividade destas enzimas pode
envolver a (i) indução ou a repressão dos genes codificadores dessas enzimas, (ii) variação na
concentração intracelular de substratos ou (iii) reguladores alostéricos assim como (iv) activação
ou inibição por fosforilação reversível.
11-
Os mecanismos que condicionam a regulação da actividade das enzimas que catalisam os passos
irreversíveis da glicólise e da gliconeogénese hepáticas e renais são complexos envolvendo também a
acção de hormonas que se libertam noutros tecidos. Assim, são parte importante nos processos
homeostáticos a insulina (que aumenta no sangue em resposta a aumentos na glicemia e tem acção
hipoglicemiante) e a glicagina (que aumenta no caso inverso e tem acção hiperglicemiante). Estas
hormonas pancreáticas exercem os seus efeitos regulando a actividade de enzimas e de
transportadores.
12-
Em jejum a hipoglicemia estimula as células α dos ilhéus pancreáticos a produzir glicagina. A
glicagina liga-se ao seu receptor na face externa da membrana dos hepatócitos estimulando a cíclase
do adenilato (ATP → AMPc + PPi) que tem como consequência a acumulação de AMP cíclico
(AMPc) no citosol. O AMPc é um estimulador alostérico da “cínase de proteídos dependente do
AMPc” (PKA). A PKA é uma cínase que tem como substrato aceitador de fosfato múltiplas enzimas
(ATP + proteído → ADP + proteído-P) que, dependendo da enzima concreta, podem ser activadas ou
inibidas por essa fosforilação. A glicagina induz os processos que levam à formação de glicose porque
os processos de fosforilação catalisados pela PKA activam as enzimas chave das vias metabólicas
envolvidas na formação de glicose. A glicagina prejudica o consumo de glicose porque os processos
de fosforilação catalisados pela PKA inibem as enzimas chave das vias metabólicas envolvidas no seu
consumo. Pelo contrário, a insulina, que está diminuída durante o jejum, prejudica os processos de
fosforilação estimulados pela glicagina.
Página 2 de 5
Aulas de grupo 2001-02; Rui Fontes
13-
Dois dos substratos da PKA são a cínase do piruvato hepática e uma enzima “bifuncional” envolvida
na regulação do par fosfátase da frutose-1,6-bisfosfato/cínase 1 da frutose-6-P. Em concordância com
o papel da cínase do piruvato na glicólise a forma fosforilada desta enzima é menos activa.
Também em concordância com o papel da fosfátase da frutose-1,6-bisfosfato na gliconeogénese e da
cínase 1 da frutose-6-P na glicólise a fosforilação da enzima “bifuncional” vai implicar a activação da
fosfátase da frutose-1,6-bisfosfato e a inibição da cínase 1 da frutose-6-P. A enzima “bifuncional”
regula a concentração intracelular de um composto – a frutose-2,6-bisfosfato – que é,
simultaneamente, activador da cínase 1 da frutose-6-P e um inibidor da fosfátase da frutose-1,6bisfosfato. A enzima “bifuncional” tem duas actividades: cínase 2 da frutose-6-P (ATP + frutose-6-P
→ ADP + frutose-2,6-bisfosfato) e fosfátase da frutose-2,6-bisfosfato (frutose-2,6-bisfosfato + H2O
→ frutose-6-P + Pi). Via frutose-2,6-bisfosfato a activação da cínase 2 da frutose-6-P implica
activação da cínase 1 da frutose-6-P e, pelo contrário, a activação da fosfátase da frutose-2,6bisfosfato implica a activação da fosfátase da frutose-1,6-bisfosfato. Em concordância com isto a
fosforilação pela PKA da enzima “bifuncional” tem como consequência a diminuição da concentração
intracelular da frutose-2,6-bisfosfato porque na sua forma fosforilada a enzima “bifuncional” tem
predominantemente uma actividade hidrolítica: ou seja, na forma fosforilada anula-se a actividade
de cínase 2 da frutose-6-P e fica estimulada a actividade de fosfátase da frutose-2,6-bisfosfato.
14-
Resumindo os dois pontos anteriores:
glicemia↓ ⇒ glicagina ↑ ⇒ AMPc↑ ⇒ frutose-2,6-bisfosfato↓ ⇒ gliconeogénese↑
glicemia↑ ⇒ insulina ↑ ⇒ AMPc↓ ⇒ frutose-2,6-bisfosfato↑ ⇒ glicólise↑
15-
No jejum ocorre também hidrólise dos triacilgliceróis endógenos. O resíduo glicerol é, como
primeiro passo da sua transformação em glicose, fosforilado no fígado (cínase do glicerol: ATP +
glicerol → ADP + glicerol-3-P). Os ácidos gordos de cadeia par (os mais abundantes) não são
substratos da gliconeogénese mas tem um importante papel no processo. A sua oxidação leva à
formação de acetil-CoA e ATP. (i) A acetil-CoA é, simultaneamente, um activador alostérico da
carboxílase do piruvato (gliconeogénese) e, via activação da cínase do desidrogénase do piruvato
(ATP + desidrogénase do piruvatoactiva → ADP + desidrogénase do piruvato-Pinactiva), um inibidor da
oxidação do piruvato e, consequentemente, da glicose. Embora a fosforilação da desidrogénase do
piruvato (piruvato + CoA + NAD+ → acetil-CoA + CO2 + NADH + H+) não esteja dependente da
acção da PKA também aqui a hipoglicemia tem como consequência a fosforilação de uma enzima. (ii)
O ATP gerado no catabolismo dos ácidos gordos fornece energia necessária para a gliconeogénese e
para as outras actividades do hepatócito.
16-
Para além dos mecanismos alostéricos e de fosforilação reversível já apontados também têm
importância na regulação da glicólise e na gliconeogénese a regulação da síntese dessas enzimas ao
nível da transcrição. Em geral a insulina estimula a síntese das enzimas próprias da glicólise e inibe a
síntese das enzimas próprias da gliconeogénese. A glicagina tem efeitos opostos.
17-
Por si só, o valor da glicemia tem importância na regulação da cínase da glicose (ATP + glicose →
ADP + glicose-6-P) pois esta enzima hepática, porque tem um Km elevado (de cerca de 8-10 mM), é
sensível às variações fisiológicas da glicemia (4-12 mM na veia porta).
2- Metabolismo do glicogénio
18-
O glicogénio é um polímero de tamanho variável que contém resíduos glicose ligados por ligações α1,4 e, nos locais de ramificação, α-1,6. A formação deste polímero permite a acumulação de glicose
nas células sem aumentar a pressão osmótica dentro destas. O glicogénio existe no citosol de todas as
células do organismo mas é mais importante no fígado e músculo esquelético.
19-
A glicogénese é a via metabólica pela qual as moléculas de glicogénio crescem por transferência de
resíduos glicose para os grupos 4-OH livres dos resíduos glicose das extremidades. Esta transferência
é catalisada pela síntase do glicogénio e o dador de glicose é a UDP-glicose. A UDP-glicose forma-se
a partir da glicose-1-P (pirofosforílase da UDP-glicose: glicose-1-P + UTP → UDP-glicose + PPi),
por sua vez formado por isomerização da glicose-6-P (mútase da hexoses-P: glicose-6-P ↔ glicose1-P). A ramificação do glicogénio é catalisado pela enzima ramificante, que catalisa a transferência
Página 3 de 5
Aulas de grupo 2001-02; Rui Fontes
de uma cadeia com cerca de 7 resíduos glicose de uma extremidade para um grupo 6-OH de uma
cadeia vizinha.
20-
A glicogenólise é a via catabólica. A fosforílase do glicogénio catalisa a fosforólise do glicogénio; ou
seja, catalisa a transferência de resíduos glicose das extremidades com grupos 4-OH livres para o Pi
formando glicose-1-P (glicogénio(n) + Pi → glicogénio(n-1) + glicose-1-P). De seguida a glicose-1-P
sofre isomerização gerando glicose-6-P. A desramificação do glicogénio é catalisada por uma enzima
(enzima desramificante) com duas actividades: transferência intra-molecular de maltotriose e
hidrólise da ligação α-1,6.
21-
No fígado, a glicogénese está activada quando, durante a absorção intestinal de glicídeos, a glicemia
aumenta. A descida da glicemia leva ao desencadear de mecanismos homeostáticos que levam à
activação da glicogenólise. A presença de glicose-6-fosfátase neste órgão permite a formação de
glicose que é vertida na corrente sanguínea sendo consumida pelos tecidos extra-hepáticos. O fígado é
um órgão central no metabolismo da glicose: acumula glicose na forma de glicogénio quando a
glicemia é elevado e, através da glicogenólise e da gliconeogénese, forma glicose que verte para o
sangue e, em última análise, para os outros tecidos quando a glicemia baixa durante o jejum. De
recordar que, no jejum, o ATP formado no fígado é uma consequência da oxidação dos ácidos gordos.
22-
Nos músculos esqueléticos, o papel do glicogénio é muito distinto do do fígado. Nos músculos
esqueléticos, o glicogénio aumenta durante o repouso e a sua degradação é uma consequência da
actividade muscular. A glicose-6-P formada durante a glicogenólise é consumida na fibra muscular
onde se formou. Aquando do exercício muscular intenso o consumo de ATP pode exceder a
capacidade de síntese da fosforilação oxidativa e, nestas circunstâncias, a glicólise anaeróbia é muito
importante como mecanismo de formação de ATP. No músculo (e noutros tecidos) a degradação do
glicogénio serve as necessidades energéticas da célula onde foi armazenado.
23-
As enzimas reguladoras da velocidade da glicogénese e da glicogenólise são, respectivamente, a
síntase do glicogénio e a fosforílase do glicogénio. Na regulação da actividade destas enzimas
participam mecanismos de fosforilação reversível assim como mecanismos alostéricos. A síntase do
glicogénio é menos activa na forma fosforilada o contrário acontecendo no caso da fosforílase do
glicogénio. Várias cínases, como, por exemplo: a PKA, a cínase-3 da síntase do glicogénio e a
cínase da fosforílase do glicogénio, estão envolvidas na fosforilação e consequente inactivação da
síntase do glicogénio. A fosforilação e consequente activação da fosforílase do glicogénio é o
resultado da acção catalítica da cínase da fosforílase do glicogénio. Esta enzima, catalisando a
fosforilação quer da síntase quer da fosforílase, inactiva a síntese de glicogénio e activa a sua
fosforólise. A desfosforilação da síntase de glicogénio (activação) e da fosforílase do glicogénio
(inactivação) é o resultado da acção catalítica de uma mesma fosfátase: a fosfátase-1 de proteínas. O
AMP, um nucleotídeo que aumento na célula quando o consumo de ATP é elevado, é um activador
alostérico da fosforílase do glicogénio. A ligação do AMP à forma desfosforilada (supostamente
inactiva) da fosforílase activa esta enzima.
24-
Estimuladas pela hipoglicemia as células α dos ilhéus pancreáticos libertam glicagina durante o
jejum. Na membrana dos hepatócitos existem receptores para esta hormona. A ligação da glicagina
aos seus receptores induz a activação da cíclase do adenilato que leva ao aumento da concentração de
AMP cíclico no citoplasma do hepatócito. O AMP cíclico activa a PKA (enzima.alvo + ATP →
enzima.alvo-P + ADP) que é uma cínase capaz de catalisar a fosforilação de muitos proteídos. Dentre
estes são de destacar a cínase da fosforílase, a síntase do glicogénio, a fosfátase-1 de proteínas e o
inibidor-1. A fosforilação destes proteídos leva à estimulação da glicogenólise e à libertação de
glicose para o sangue.
25-
A fosforilação da cínase da fosforílase activa esta enzima; a actividade catalítica da cínase da
fosforílase leva à fosforilação da fosforílase do glicogénio e da síntase do glicogénio e,
consequentemente, à activação da fosforílase e à inactivação da síntase. A fosfátase-1 catalisa a
hidrólise dos resíduos fosfato ligados nestas três enzimas mas a sua fosforilação pela PKA inactiva-a.
Para esta inactivação também contribui a fosforilação do inibidor-1 que fosforilado funciona como
inibidor da fosfátase-1. Assim, da activação da PKA pelo AMP cíclico resultam a activação da
cínase da fosforílase, da fosforílase do glicogénio e do inibidor-1 e a inactivação da síntase do
glicogénio e da fosfátase-1.
Página 4 de 5
Aulas de grupo 2001-02; Rui Fontes
26-
Quando a glicemia é elevada ocorre acumulação de glicogénio no fígado. A própria glicose estimula
a fosfátase-1 na sua acção inactivadora sobre a fosforílase do glicogénio. O mecanismo de activação
envolve a ligação da glicose à fosforílase do glicogénio modificando a sua conformação de tal forma
que os resíduos fosfato a ela ligados ficam acessíveis à acção hidrolítica da fosfátase-1. A glicemia
elevada estimula as células β dos ilhéus pancreáticos a produzir insulina. As acções da insulina são
opostas às da glicagina e envolvem a diminuição da concentração do AMP cíclico e a activação da
fosfátase-1.
27-
A glicogenólise muscular é estimulada durante o trabalho muscular mas, preparando este trabalho,
pode também ter lugar por acção da adrenalina, uma hormona produzida na medula da glândula
supra-renal. Os receptores adrenérgicos β que existem no músculo quando estimulados pela
adrenalina levam a uma cascata de reacções em tudo semelhante à discutida para o caso da acção da
glicagina no fígado.
28-
Na origem da contracção muscular está um estímulo nervoso que induz aumento na concentração
citosólica do ião cálcio. Este aumento leva à contracção muscular mas também à estimulação directa
da cínase da fosforílase com a consequente estimulação da glicogenólise e inibição da glicogénese. O
trabalho muscular pode levar à diminuição da concentração de ATP e leva ao aumento do AMP; o
AMP é um activador alostérico da fosforílase do glicogénio muscular podendo estimular a forma
desfosforilada da fosforílase muscular que é activa na sua presença.
Página 5 de 5