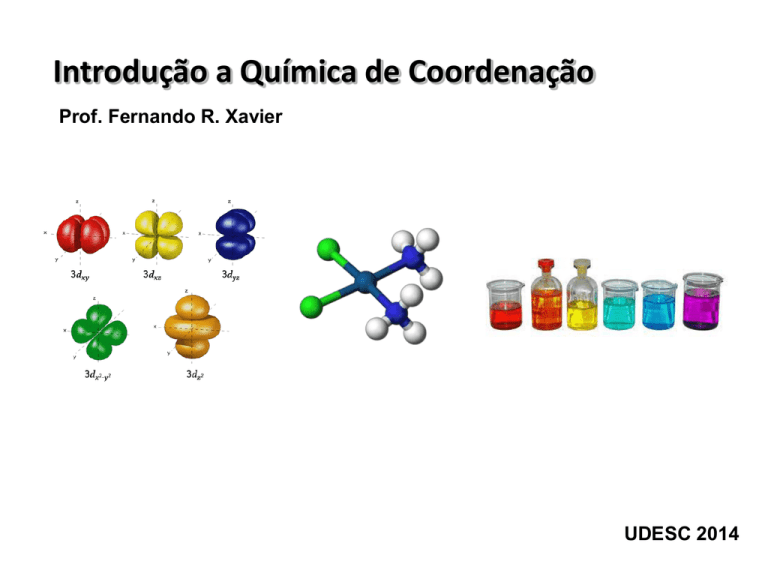
Introdução a Química de Coordenação
Prof. Fernando R. Xavier
UDESC 2014
Histórico
té o fim do século XIX, os compostos de coordenação não tinham suas
estruturas completamente elucidadas. Suas propriedades “estranhas” tais
como desafiar as leis de valência empregadas na época, lhes conferiram o
As idéias propostas por Werner foram melhor aceitas
nome usual de íons complexos.
pela comunidade científica da época e assim, em 1913
foi o primeiro químico inorgânico laureado com o
Um estudo sistemático e aprofundado sobre o assunto recebeu a atenção de dois
Prêmio Nobel de Química.
cientistas que trabalharam de forma independente: Alfred Werner (alemão) e
Sophus Jørgensen (dinamarquês).
Werner
Jørgensen
Histórico
Ao fim do séc. XIX, era sabido entre os químicos que:
Alguns elementos eram tidos com valências fixas.
ex.: Na (1+); O (2-); dentre outros.
Alguns elementos podiam exibir duas ou três valências distintas.
ex.: Cu (1+ ou 2+); P (3-, 3+ ou 5+); dentre outros.
Alguns elementos entretanto, exibiam “poderes de combinação” que eram difíceis
de conciliar com suas valências usuais. Ex.: compostos de cromo e de platina.
Histórico
O Cromo (3+) e íons platina (2+ e 4+) reagiam com íons cloreto (Cl-) para
completar suas respectivas camadas de valência porém, ainda assim, reagiam
com moléculas de amônia que já possuia todos seus átomos satisfeitos
eletronicamente.
Com base nestes experimentos, Jørgensen tentou expressar uma possível
fórmula estrutural usando princípios da química orgânica:
Histórico
Já Werner estudando compostos de cobalto(III)
com amônia e íons cloreto foi capaz de isolar 4
espécies com cores distintas.
Mas apesar da mesma composição química, as propriedades destes compostos
eram distintas. Exemplo: Teste de precipitação com nitrato de prata.
Histórico
Werner conclui que compostos M(NH3)5X3 (onde M = Cr ou Co e X = Cl ou Br) são
derivados dos compostos M(NH3)6X3 pela perda de uma molécula de amônia.
Postulados de Werner
1. A referida série de compostos de cobalto exibem um constante número de
coordenação (6), onde as moléculas de amônia podem ser substituídas por íons
cloreto que se ligam covalentemente ao metal.
2. A química complexa do cobalto deve levar em conta não só o NOX do metal, mas
também seu número de coordenação.
Histórico
Desta forma Werner reescreveu as fórmulas químicas dos compostos estudados
como:
Outra importante observação de Werner foi analisar a condutividade elétrica dos
compostos em solução aquosa.
Fórmula empírica
Condutividade
Razão dos eletrólitos
Fórmula de Werner
PtCl4 . 2 NH3
-
-
[Pt(NH3)2Cl4]
PtCl4 . 3 NH3
96,8 μS
1:1
[Pt(NH3)Cl3]Cl
CoCl3 . 5 NH3
261,3 μS
2:1
[Co(NH3)5Cl]Cl2
CoCl3 . 6 NH3
431,6 μS
3:1
[Co(NH3)6]Cl3
Histórico
Com relação ao arranjo espacial destas moléculas ao redor do átomo central,
Werner propos três modelos:
Porém devido a falta de técnicas de análise estrutural na época, a real geometria
destes compostos foram reveladas muitos anos mais tarde.
Atualmente...
Íons complexos são formados por um átomo central rodeado por um grupo de
ligantes. E, um ligante é um íon ou molécula que pode ter sua existência
independente.
Exemplos:
O termo composto de coordenação é considerado mais completo e abrangente
uma vez que pode ser empregado para compostos que não são eletricamente
carregados. Ex.: [Ni(CO)4] ou Ni(CO)4
Quimicamente a ligação entre o íon metálico central e seu ligantes pode ser
explicada de um modo mais simplista como uma reação do tipo ácido-base de
Lewis, onde o metal (ácido) pode aceitar pares eletrônicos provenientes dos
ligantes (base).
Os ligantes
Os ligantes podem doar 1 (um) ou mais pares eletrônicos ao centro metálico.
Ligantes que doam mais de um par eletrônico são ditos polidentados.
Exemplos:
Ligantes são ditos ambidentados quando possuem mais de um átomo doador em
sua estrutura, podendo então se coordenar de diferentes maneiras ao centro
metálico.
Exemplos:
Nitrito-κN
Nitrito-κO
Os ligantes
Ligantes polidentados podem produzir compostos ditos quelatos que são
altamente estáveis devido a formação de anéis de 5 ou 6 membros e fatores
termodinâmicos (aumento de entropia do sistema).
Exemplo:
en = H2N-CH2-CH2-NH2
Efeito quelato
Os ligantes
A formação de anéis de 5 ou 6 membros (ângulos internos de 72 e 120°,
respectivamente) ajudam a estabilizar a coordenação deste ligante e dar
estabilidade ao complexo formado.
Exemplos:
acac = acetilacetonato
Os ligantes
Alguns ligantes (moléculas) podem receber nomes próprios que são comumente
utilizados em química de coordenação.
Exemplos:
Complexos - Nomenclatura
Dentro de um mesmo complexo, os ligantes são relacionados em ordem alfabética
e seus nomes podem sofrer alterações através do sufixo “o”.
Exemplos:
Complexos - Nomenclatura
Para compostos iônicos (sais), usa-se o nome do ânion seguido do nome do
cátion. Para compostos neutros, escreve-se os nomes dos ligantes em ordem
alfabética seguido do nome do metal. Em ambos os casos o nome do metal é
seguido pelo seu respectivo NOX entre parenteses.
O sufixo –ATO é adicionado no nome do metal se o complexo for um ânion.
Em caso de múltiplos ligantes de uma mesma espécie química, são usados os
seguintes prefixos gregos:
mono
tetra, tetrakis
di, bis
penta
tri, tris
hexa… etc…
Complexos - Nomenclatura
Ligantes que fazem ponte entre centros metálicos distintos são designados pela
letra grega “mi” – “μ”.
O uso de colchetes “[ ]” indicam quais os ligantes estão covalentemente ligados
ao centro metálico e devem ser usados quando o composto de coordenação é
carregado eletricamente. Usualmente, complexos neutros e oxoânions são
escritos sem o uso de colchetes.
Exercícios. Com base na fórmula química, fornecer o nome dos seguintes
compostos de coordenação:
Complexos - Nomenclatura
Exercícios (continuação)
Complexos - Nomenclatura
Exercícios. Com base no nome IUPAC do composto, fornecer sua respectiva
fórmula química:
Complexos – Constituição e geometria
O número de coordenação de um complexo indica quantos ligantes estão
diretamente ligados ao centro metálico em questão. São três os fatores que
gevernam sua magnitude:
Tamanho do átomo/íon central (raio atômico/iônico)
Impedimento estérico entre os ligantes
Interação eletrônica entre o átomo central e seus ligantes
Em linhas gerais, átomos grandes (maior raio) podem
aceitar mais ligantes em sua esfera de coordenação.
Porém, o uso de ligantes volumosos favorecem baixos
números de coordenação.
Complexos – Constituição e geometria
Complexos que apresentam poucos elétrons
nas suas camadas de valência podem aceitar
mais pares eletrônicos de ligantes e assim
formam
compostos
com
alto
número
de
coordenação. Ex.: Elementos das séries 4d e 5d
e elementos do bloco f.
Baixos números de coordenação são
encontrados para elemendos do bloco “d” no
limite direito da tabela periódica pois suas
camadas
de
valências
já
estão
praticamente completas. Ex.: Au, Ag, Pt
Complexos – Constituição e geometria
O número de coordenação 2
Podem ser obtidos em soluções diluídas de ligantes e metais. Sua geometria é
sempre do tipo linear (D∞h) e, metais do grupo 11 são exemplos típicos de
íons que formam este tipo de composto. Compostos do tipo organomercúrio
também comuns (H3C–Hg–CH3).
Complexos – Constituição e geometria
O número de coordenação 3
Complexos com número de coordenação 3 (trigonal planos – D3h) são bastante
raros, mas podem ocorrer quando ligantes volumosos são utilizados.
Complexos – Constituição e geometria
O número de coordenação 4
São inúmeros os compostos encontrados na literatura com número de
coordenação 4, sendo basicamente divididos entre os de geometria
tetraédrica (Td) ou quadrado-planares D4h)
Complexos
tetraédricos
são
favorecidos quando o átomo central é
pequeno e seus ligantes são volumosos
(Cl-, Br-, I-). Esta geometria é comum
para elementos da série 3d e elementos
do bloco “s”
tetraoxoânions.
e “p” e
ainda para
Complexos – Constituição e geometria
O número de coordenação 4
Complexos quadrado-planares são raramente encontrados quando o átomo
central é da série 3d (exceto o níquel “d8”) e elementos do bloco “s” e “p”. Já, para
todos os elementos do grupo 10 (Ni, Pd e Pt) e ainda Rh+, Ir+ e Au+ esta geometria
é extremamente favorável.
Complexos – Constituição e geometria
O número de coordenação 5
São menos comuns que os complexos tetra e hexacoordenados e,
normalmente, adotam dois tipos básicos de geometria: bipirâmide trigonal
(D3h) ou pirâmide de base quadrada (C4v).
Distorções nestas geometrias são comuns para que haja minimização de
energia. Em linhas gerais, compostos com arranjo de bipirâmide trigonal
(menor repulsão) são mais estáveis que complexos quadrado planares.
Complexos – Constituição e geometria
O número de coordenação 5
A geometria de pirâmide de base quadrada é de extrema relevância biológica.
Ligantes porfirínicos podem alojar o íon metálico e a quinta posição pode ser
ocupada por um histidina (aminoácido).
Complexos – Constituição e geometria
O número de coordenação 6
É o número de coordenação mais comum para os complexos metálicos do
bloco “d” podendo ainda ser encontrado em compostos dos blocos “s”, “p” e “f”.
Majoritariamente, os compostos hexacoordenados são octaédricos.
Complexos – Constituição e geometria
O número de coordenação 6
As geometrias de prisma e antiprisma trigonal são raras, mas podem ser
encontradas em compostos com centros metálicos de raio atômico significativo
(séries 4 e 5d).
[ReL6]3+
Complexos – Constituição e geometria
O número de coordenação 7
Complexos com número de coordenação 7 são encontrados para alguns
metais da série 3d porém são bastante comuns para metais das séries 4 e
5d, onde os átomos são maiores podendo acomodar mais que 6 ligantes.
Acima
temos:
bipirâmide
pentagonal
(esquerda),
octaédrica
monoencapuzada (centro) e prismatrigonal monoencapuzada (esquerda).
Complexos – Constituição e geometria
O número de coordenação 7
[Ta(OH2)(L)]3+
[W(CO)4Br3]-
[NbF7]-
As geometrias encapuzadas são mais comuns, porém a de menor energia
(menor repulsão) é a bipirâmide pentagonal.
Estas estruturas são altamente sensíveis a temperatura e podem se
interconverter dinamicamente.
Complexos – Constituição e geometria
O número de coordenação 8
Podem ocorrer quando não há rigidez estereoquímica e assim, podem assumir
a geometria antiprismática quadrada (esquerda) ou dodecaédrica (centro).
A geometria cúbica (direita) é rara.
Exemplos:
[Zr(ox)4]4-
[Mo(CN)8]3-
[CsCl]
Complexos – Constituição e geometria
O número de coordenação 9
Este número de coordenação é particularmente importante para os elementos
do bloco “ f ” pois seus raios significativamente grandes permitem a
acomodação de vários ligantes. A geometria é dita prismatrigonal
triencapuzada.
[ReH9]2-
Complexo de Térbio (Tb)
Complexos – Constituição e geometria
Números de coordenação 10 e 12
Estes números de coordenação podem ser encontrados tipicamente em
complexos do bloco “ f ” quando ligantes sem impedimento estérico
significativo estão presentes. Metais dos blocos s, p e d são muito raros com
esta geometria que recebe o nome de poliédrica.
Exemplos:
[Ce(NO3)6]2-
[Th(ox)4(OH2)2]4-