As Leis da Termodinâmica
Parte I
1. (Pucrj 2013) Um sistema termodinâmico recebe certa
quantidade de calor de uma fonte quente e sofre uma
expansão isotérmica indo do estado 1 ao estado 2,
indicados na figura. Imediatamente após a expansão inicial,
o sistema sofre uma segunda expansão térmica, adiabática,
indo de um estado 2 para o estado 3 com coeficiente de
Poisson γ =1,5.
Sabendo-se que a temperatura em A é 227 °C, que os
calores específicos molares do gás, a volume constante e a
pressão constante, valem, respectivamente, 2 3R e
5 2R e que R vale aproximadamente 8 J mol ⋅ K, o
rendimento dessa máquina, em porcentagem, está mais
próximo de
a) 12
b) 15
c) 18
d) 21
a) Determine o volume ocupado pelo gás após a primeira
expansão, indo do estado 1 ao estado 2.
b) Determine a pressão no gás quando o estado 3 é
atingido.
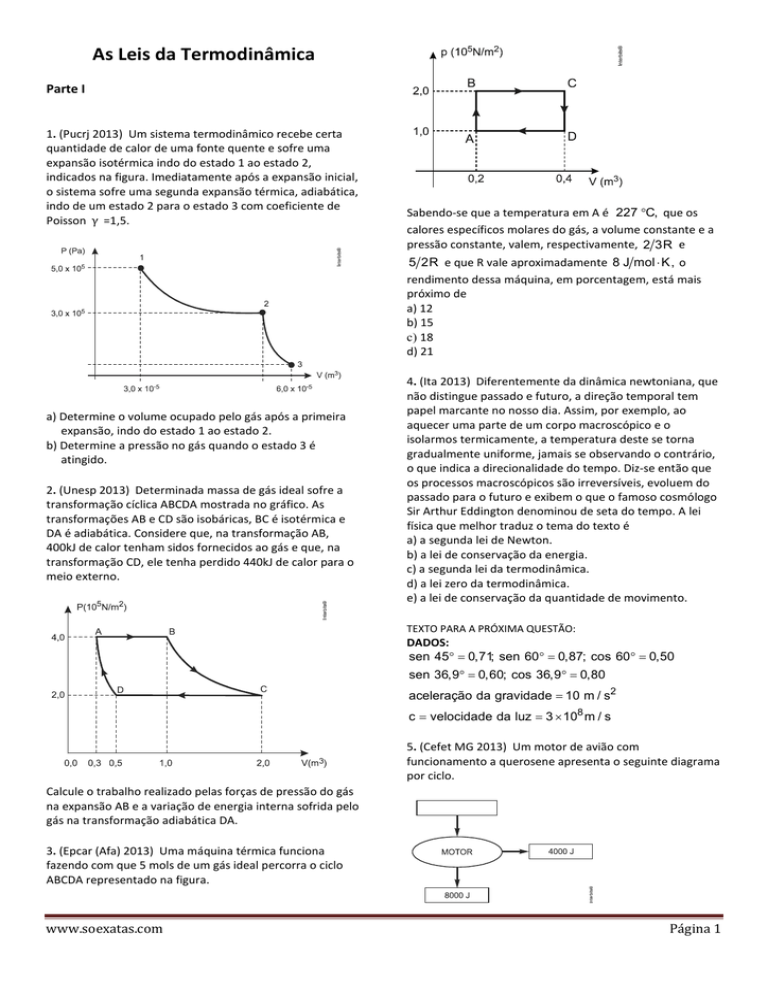
2. (Unesp 2013) Determinada massa de gás ideal sofre a
transformação cíclica ABCDA mostrada no gráfico. As
transformações AB e CD são isobáricas, BC é isotérmica e
DA é adiabática. Considere que, na transformação AB,
400kJ de calor tenham sidos fornecidos ao gás e que, na
transformação CD, ele tenha perdido 440kJ de calor para o
meio externo.
4. (Ita 2013) Diferentemente da dinâmica newtoniana, que
não distingue passado e futuro, a direção temporal tem
papel marcante no nosso dia. Assim, por exemplo, ao
aquecer uma parte de um corpo macroscópico e o
isolarmos termicamente, a temperatura deste se torna
gradualmente uniforme, jamais se observando o contrário,
o que indica a direcionalidade do tempo. Diz-se então que
os processos macroscópicos são irreversíveis, evoluem do
passado para o futuro e exibem o que o famoso cosmólogo
Sir Arthur Eddington denominou de seta do tempo. A lei
física que melhor traduz o tema do texto é
a) a segunda lei de Newton.
b) a lei de conservação da energia.
c) a segunda lei da termodinâmica.
d) a lei zero da termodinâmica.
e) a lei de conservação da quantidade de movimento.
TEXTO PARA A PRÓXIMA QUESTÃO:
DADOS:
sen 45° = 0,71; sen 60° = 0,87; cos 60° = 0,50
sen 36,9° = 0,60; cos 36,9° = 0,80
aceleração da gravidade = 10 m / s2
c = velocidade da luz = 3 × 108 m / s
5. (Cefet MG 2013) Um motor de avião com
funcionamento a querosene apresenta o seguinte diagrama
por ciclo.
Calcule o trabalho realizado pelas forças de pressão do gás
na expansão AB e a variação de energia interna sofrida pelo
gás na transformação adiabática DA.
3. (Epcar (Afa) 2013) Uma máquina térmica funciona
fazendo com que 5 mols de um gás ideal percorra o ciclo
ABCDA representado na figura.
www.soexatas.com
Página 1
A energia, que faz a máquina funcionar, provém da queima
4
do combustível e possui um valor igual a 6,0 × 10 J/kg. A
quantidade de querosene consumida em cada ciclo, em kg,
é
a) 0,070.
b) 0,20.
c) 5,0.
d) 7,5.
e) 15.
6. (Uff 2012) O ciclo de Stirling é um ciclo termodinâmico
reversível utilizado em algumas máquinas térmicas.
Considere o ciclo de Stirling para 1 mol de um gás ideal
monoatônico ilustrado no diagrama PV.
Os processos AB e CD são isotérmicos e os processos BC e
DA são isocóricos.
a) Preencha a tabela para a pressão, volume e temperatura
nos pontos A, B, C, D. Escreva as suas respostas em
função de PA , VA , PC , VC e de R (constante universal
dos gases).
Justifique o preenchimento das colunas P e T.
P
V
T
A
B
C
D
7. (Enem 2012) Aumentar a eficiência na queima de
combustível dos motores à combustão e reduzir suas
emissões de poluentes são a meta de qualquer fabricante
de motores. É também o foco de uma pesquisa brasileira
que envolve experimentos com plasma, o quarto estado da
matéria e que está presente no processo de ignição. A
interação da faísca emitida pela vela de ignição com as
moléculas de combustível gera o plasma que provoca a
explosão liberadora de energia que, por sua vez, faz o
motor funcionar.
Disponível em: www.inovacaotecnologica.com.br. Acesso
em: 22 jul. 2010 (adaptado).
No entanto, a busca da eficiência referenciada no texto
apresenta como fator limitante
a) o tipo de combustível, fóssil, que utilizam. Sendo um
insumo não renovável, em algum momento estará
esgotado.
b) um dos princípios da termodinâmica, segundo o qual o
rendimento de uma máquina térmica nunca atinge o
ideal.
c) o funcionamento cíclico de todo os motores. A repetição
contínua dos movimentos exige que parte da energia
seja transferida ao próximo ciclo.
d) as forças de atrito inevitável entre as peças. Tais forças
provocam desgastes contínuos que com o tempo levam
qualquer material à fadiga e ruptura.
e) a temperatura em que eles trabalham. Para atingir o
plasma, é necessária uma temperatura maior que a de
fusão do aço com que se fazem os motores.
8. (Ufu 2011) Certa quantidade de gás ideal ocupa
inicialmente um volume V0, à pressão p0 e temperatura T0.
Esse gás se expande à temperatura constante e realiza
trabalho sobre o sistema, o qual é representado nos
gráficos pela área sob a curva.
Assinale a alternativa que melhor representa a quantidade
de calor trocada com o meio.
b) Complete a tabela com os valores do calor absorvido
pelo gás ( Q ) , da variação da sua energia interna ( ∆U)
e do trabalho realizado pelo gás ( W ) , medidos em
joules, em cada um dos trechos AB, BC, CD e DA,
representados no diagrama PV.
Justifique o preenchimento das colunas para Q e ∆U.
São dados:
WAB = 300 J; WCD = −150 J e ∆UDA = 750 J.
Q(J)
AB
BC
CD
DA
www.soexatas.com
∆U(J)
a)
W(J)
b)
Página 2
c)
d)
9. (Unifesp 2011) Em um trocador de calor fechado por
paredes diatérmicas, inicialmente o gás monoatômico ideal
é resfriado por um processo isocórico e depois tem seu
volume expandido por um processo isobárico, como mostra
o diagrama pressão versus volume.
a) Indique a variação da pressão e do volume no processo
isocórico e no processo isobárico e determine a relação
entre a temperatura inicial, no estado termodinâmico a,
e final, no estado termodinâmico c, do gás monoatômico
ideal.
b) Calcule a quantidade total de calor trocada em todo o
processo termodinâmico abc.
10. (Epcar (Afa) 2011) O diagrama abaixo representa um
ciclo realizado por um sistema termodinâmico constituído
por n mols de um gás ideal.
Sabendo-se que em cada segundo o sistema realiza 40
ciclos iguais a este, é correto afirmar que a(o)
a) potência desse sistema é de 1600 W.
b) trabalho realizado em cada ciclo é - 40 J.
c) quantidade de calor trocada pelo gás com o ambiente em
cada ciclo é nula.
d) temperatura do gás é menor no ponto C.
11. (Ita 2011) A inversão temporal de qual dos processos
abaixo NÃO violaria a segunda lei de termodinâmica?
a) A queda de um objeto de uma altura H e subsequente
parada no chão.
b) O movimento de um satélite ao redor da Terra.
c) A freada brusca de um carro em alta velocidade.
d) O esfriamento de um objeto quente num banho de água
fria.
e) A troca de matéria entre as duas estrelas de um sistema
binário.
12. (Ufmg 1994) O gráfico da pressão p em função do
volume V de um gás ideal representa uma transformação
cíclica ocorrida em três fases. Inicia-se o ciclo por uma
transformação isobárica, seguida de uma transformação
isovolumétrica e finalmente, de uma transformação
isotérmica.
Com base nesses dados pode-se afirmar que
a) o trabalho realizado na transformação isotérmica é
calculado pela expressão p3(V1 - V3).
b) o trabalho realizado pelo gás é nulo durante a
transformação isotérmica.
c) o trabalho realizado pelo gás na transformação
isotérmica é igual ao calor que esse gás absorve.
d) o trabalho realizado sobre o gás durante a transformação
isovolumétrica é o mesmo que na transformação
isobárica.
e) o trabalho realizado sobre o gás, na transformação
isovolumétrica, é maior do que o trabalho realizado pelo
gás na transformação isotérmica.
13. (Unesp 1993) Uma esfera metálica homogênea,
inicialmente à temperatura T1, encontra-se em repouso
sobre uma superfície horizontal rígida (Figura 1). Ao
receber certa quantidade de calor Q, a temperatura da
esfera se eleva até T2 e, devido ao fenômeno da dilatação,
seu centro de massa sofre um deslocamento d (figura 2).
www.soexatas.com
Página 3
Utilizando a equação da Primeira Lei da Termodinâmica,
indique:
a) o trabalho realizado;
b) a variação da energia interna, ocorrida em consequência
da transferência da quantidade de calor Q à esfera.
(considere o sistema no vácuo e descarte as hipóteses de
perda de calor para a superfície e para o ambiente).
14. (Unesp 1992) Certa quantidade de gás está contida
num cilindro que tem um pistão de 1 kg. Transfere-se
Transfere ao
gás uma quantidade de calor Q1 = 7 joules e o pistão sobe
de uma altura h. A seguir, o pistão é travado e o gás é
resfriado até a mesma temperatura inicial T0, retirando
uma quantidade de calor Q2 = 5 joules.
Qual o valor de h? (Despreze o atrito do pistão com as
paredes do cilindro e as perdas de calor e considere a
2
aceleração da gravidade local igual a 10 m/s ).
15. (Fuvest-gv 1992) Uma pessoa fecha com a palma de
sua mão a extremidade de uma seringa e com a outra mão
puxa o êmbolo até as proximidades da outra extremidade,
mantendo a temperatura constante. O gráfico p × V, dentre
os apresentados nas alternativas a seguir, que melhor
representa este processo é:
16. (Unesp 1991) A primeira lei da termodinâmica diz
respeito à:
a) dilatação térmica
b) conservação da massa
c) conservação da quantidade de movimento
movi
d) conservação da energia
e) irreversibilidade do tempo
17. (Unicamp 1991) Um mol de gás ideal sofre a
transformação A → B → C indicada no diagrama pressão ×
volume da figura a seguir.
a) Qual é a temperatura do gás no estado A?
b) Qual é o trabalho realizado pelo gás na expansão A →
B?
c) Qual é a temperatura do gás no estado C?
Dado: R (constante dos gases) = 0,082 atm.ℓ/mol
atm.
K = 8,3
J/mol K
18. (Fuvest 1991) Uma certa
rta massa de gás ideal,
inicialmente à pressão p0, volume V0 e temperatura T0, é
submetida à seguinte sequência de transformações:
1) É aquecida a pressão constante até que a temperatura
atinja o valor 2T0.
2) É resfriada a volume constante até que a temperatura
temp
atinja o valor inicial T0.
3) É comprimida a temperatura constante até que atinja a
pressão inicial p0.
a) Calcule os valores da pressão, temperatura e volume no
final de cada transformação.
b) Represente as transformações num diagrama pressão x
volume.
19. (Unesp 1989) Um sistema termodinâmico é levado do
estado inicial A a outro estado B e depois trazido de volta
até A através do estado C, conforme o diagrama p - V da
figura a seguir.
www.soexatas.com
Página 4
Velocidade da luz no vácuo: c = 3,0 ⋅ 108 m/s
Pressão atmosférica: Patm = 1,0 ⋅ 105 N/m2
1 litro = 1 dm3 = 10−3 m3
1 ano - luz = 9,461⋅ 1015 m
Calor específico da água: c a = 1 cal/gºC = 4000 J/KgºC
1 eV = 1,6 ⋅ 1019 J
1 cal = 4,2 J
a) Complete a tabela atribuindo sinais (+) ou (-) às
grandezas termodinâmicas associadas a cada processo. W
positivo significa trabalho realizado pelo sistema, Q positivo
é calor fornecido ao sistema e ∆U positivo é aumento da
energia interna.
b) Calcule o trabalho realizado pelo sistema durante o ciclo
completo ABCA.
1. (Ufjf 2011) A figura abaixo mostra o diagrama P x V para
o ciclo de um sistema termodinâmico contendo um gás
ideal monoatômico.
20. (Unesp 1989) Um sistema termodinâmico, constituído
por um gás ideal que pode expandir-se, contrair-se,
produzir ou receber trabalho, receber ou fornecer calor,
descreve um ciclo que pode ser representado por ABCDA
ou ABEFA.
a) Calcule o trabalho total, em joules, realizado pelo gás no
ciclo completo.
b) Calcule a variação da energia interna, em joules, no
percurso AB.
c) Qual é a quantidade de calor, em joules, trocada pelo
sistema no percurso AB?
2. (Ufjf 2011) Uma lata de spray, com volume inicial
V0 = 400 ml , contém um gás que podemos considerar
como ideal, monoatômico com γ = Cp / Cv = 3 / 2 . A
a) Considere a evolução da energia interna do sistema em
cada trecho dos ciclos. Indique com um X, no quadro, o
resultado esperado.
b) Qual foi a lei ou princípio físico que você usou na questão
anterior?
c) No ciclo ABCDA, calcule o rendimento do ciclo em termos
do calor Q1 recebido e Q2 fornecido pelo sistema.
temperatura e pressão iniciais do gás são, respectivamente,
T0 = 26º C e P0 = 1,0 atm .
Considerando que o volume final da lata tenha sido
reduzido (lata amassada) para 25% de seu valor inicial, em
um processo adiabático, determine a temperatura e a
pressão final do gás.
a) 52,0 ºC e 8,0 atm.
b) 68,0 ºC e 7,0 atm.
c) 58,0 ºC e 6,0 atm.
d) 46,0 ºC e 9,0 atm.
e) 42,0 ºC e 10,0 atm.
Parte II
TEXTO PARA AS PRÓXIMAS 2 QUESTÕES:
Dados:
Aceleração da gravidade: g = 10 m/s2
Densidade da água: ρa = 1,0 g/cm3 = 1000 kg/m3
www.soexatas.com
Página 5
3. (Ufjf 2003) Um mol de gás ideal sofre uma expansão
isotérmica, representada no diagrama P-V da figura, do
estado inicial 1 ao estado final 2. Escolha a alternativa
correta. Durante este processo:
www.soexatas.com
a) o gás aumenta de volume e se resfria.
b) a temperatura do gás se mantém constante, mas é
preciso fornecer calor ao gás.
c) no processo isotérmico não há fluxo de calor.
d) a temperatura do gás diminui e o gás realiza trabalho.
e) o volume do gás aumenta, a pressão diminui e a
temperatura aumenta.
Página 6