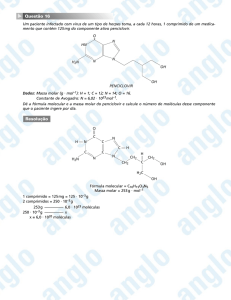
QUÍMICA — 1
GRUPO CV — 10/2009
RESOLUÇÕES E RESPOSTAS
QUESTÃO 1:
a) I = cetona; II = álcool; III = hidrocarboneto; IV = aldeído e cetona.
b)
H3 C
O
H2 C
C
OH
C
CH2 H3C — CH2 — MgI
H2 O
H2C
CH2
H2C
H3 C
H2SO4
CH2
H2C
I
H2 C
CH2
H2 C
C
II
CH
H2 C
CH2
H2 C
III
O3
Zn
ácido 7 oxonon-2-enóico
H3 C
O
—
—
O
H2 C
—
—
O
H3C — CH2 — C — CH2 — CH2 — CH2 — CH —
— CH — C — OH
C
VII
H
O
C
H2 C
H3 O+
CH2
H2 C
IV
O
—
—
Ph3P —
— CHCO2CH3
VI
CH3
aO
N
Ph3P —
—O
—
—
—
O
H3C — CH2 — C — CH2 — CH2 — CH2 — CH —
— CH — C — ONa
—
H
O
+
O—
—C
—
—
—
O
V
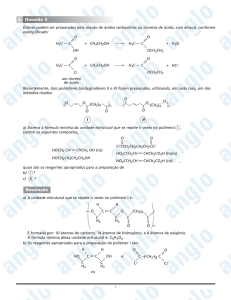
QUESTÃO 2:
a)
NH2
—
O—
fórmula estrutural
— C—
NH2
+4
número de oxidação do carbono
—
—
H3C — CH2 — C — CH2 — CH2 — CH2 — C —
—C
H
H
2 — ANGLO VESTIBULARES
H
—
b)
+
O—
—
H
H → O—
—C—
—O + 2
H
—
N—H
H
144444424444443
energia fornecida
N—
—
H
H
—
N—H
—
O—
— C—
1444442444443
energia liberada
1C—
— O = 800
2 C — N = 610 +
4 N — H = 1560
2 O — H = 920
3890 kJ
A reação é exotérmica e o ∆H = –50 kJ.
2C—
— O = 1600 +
6 N — H = 2340
3940 kJ
QUESTÃO 3:
a) Se a reação ocorresse numa única etapa a equação da velocidade seria:
v = k[ICl]2[H2]1
ordem da reação = 2 + 1 = 3 (3a ordem)
b) Equação da velocidade: v = k[ICl]x[H2]y
Nos experimentos 1 e 2 a [H2] não varia, portanto a variação da velocidade da
reação foi devida a variação das concentrações do [ICl].
123
[ICl]1 = 0,5 mol ⋅ L–1
[ICl]2 = 0,1mol ⋅ L–1
[ICl]1 = 5 ⋅ [ICl]2
123
v1 = 0,1mol ⋅ L–1 ⋅ s–1
v2 = 0,02 mol ⋅ L–1 ⋅ s–1
v1 = 5 ⋅ v2
Conclusão: v é proporcional à [ICl] ∴ v = k[ICl]1[H2]y
Nos experimentos 3 e 4 a [ICl] permanece constante, portanto, a velocidade da
reação é devida à variação de [H2]
123
[H2]3 = 0,2 mol ⋅ L–1
[H2]4 = 0,5 mol ⋅ L–1
[H2]4 = 2,5 ⋅ [H2]3
123
v3 = 0,016 mol ⋅ L–1 ⋅ s–1
v4 = 0,04 mol ⋅ L–1 ⋅ s–1
v4 = 2,5 ⋅ v3
Conclusão: v é proporcional à [H2] ∴ v = k[ICl]1[H2]1
Equação da velocidade: v = k[ICl]1[H2]1
ordem do ICl = 1 ∴ 1a ordem
ordem do H2 = 1 ∴ 1a ordem
ordem da reação = 1 + 1 = 2 (2a ordem)
QUESTÃO 4:
a) 3 (NH4)HCO3(s) + H3PO4(aq) → (NH4)3PO4(aq) + 3 CO2(g) + 3 H2O(l)
ou 3 HCO3–(aq) + 3 H+(aq) → 3 CO2(g) + 3 H2O(l)
∆
b) (NH4)HCO3(s)
→ NH3(g) + H2O(g) + CO2(g)
A liberação de gases é responsável pelo crescimento da massa dos pães e bolos.
QUÍMICA — 3
GRUPO CV — 10/2009
—
—
QUESTÃO 5:
a)
Cl Cl
H2C — CH — CH2 — CH3 + Zn → ZnCl2 + H2C —
— CH — CH2 — CH3
but-1-eno
Cl
—
Cl
—
b)
—
—
H2C — CH2 — CH2 — CH2 + Zn → ZnCl2 + H2C — CH2
H2C — CH2
ciclobutano
QUESTÃO 6:
a)
HClO
+
NaOH →
ác.
hidróxido
hipocloroso
de sódio
NaClO
+
H2O
b) 0,149 g NaClO –––––––– 1L
x –––––––– 4000 L
x = 596 g NaClO
596 g
=
74,5 g ⋅ mol–1 ⋅ 40000 L
2,0 ⋅ 10–4 mol/L NaClO
2,0 ⋅ 10–4 mol/L ClO–
123
m =
QUÍMICA — 1
GRUPO RV-RVS — 10/2009
RESOLUÇÕES E RESPOSTAS
QUESTÃO 1:
a) I = cetona; II = álcool; III = hidrocarboneto; IV = aldeído e cetona.
b)
H3 C
O
H2 C
C
OH
C
CH2 H3C — CH2 — MgI
H2 O
H2C
CH2
H2C
H3 C
H2SO4
CH2
H2C
I
H2 C
CH2
H2 C
C
II
CH
H2 C
CH2
H2 C
III
O3
Zn
ácido 7 oxonon-2-enóico
H3 C
O
—
—
O
H2 C
—
—
O
H3C — CH2 — C — CH2 — CH2 — CH2 — CH —
— CH — C — OH
C
VII
H
O
C
H2 C
H3 O+
CH2
H2 C
IV
O
—
—
Ph3P —
— CHCO2CH3
VI
CH3
aO
N
Ph3P —
—O
—
—
—
O
H3C — CH2 — C — CH2 — CH2 — CH2 — CH —
— CH — C — ONa
—
H
O
+
O—
—C
—
—
—
O
V
QUESTÃO 2:
a)
NH2
—
O—
fórmula estrutural
— C—
NH2
+4
número de oxidação do carbono
—
—
H3C — CH2 — C — CH2 — CH2 — CH2 — C —
—C
H
H
2 — SISTEMA ANGLO DE ENSINO
H
—
b)
+
O—
—
H
H → O—
—C—
—O + 2
H
—
N—H
H
144444424444443
energia fornecida
N—
—
H
H
—
N—H
—
O—
— C—
1444442444443
energia liberada
1C—
— O = 800
2 C — N = 610 +
4 N — H = 1560
2 O — H = 920
3890 kJ
A reação é exotérmica e o ∆H = –50 kJ.
2C—
— O = 1600 +
6 N — H = 2340
3940 kJ
QUESTÃO 3:
a) Se a reação ocorresse numa única etapa a equação da velocidade seria:
v = k[ICl]2[H2]1
ordem da reação = 2 + 1 = 3 (3a ordem)
b) Equação da velocidade: v = k[ICl]x[H2]y
Nos experimentos 1 e 2 a [H2] não varia, portanto a variação da velocidade da
reação foi devida a variação das concentrações do [ICl].
123
[ICl]1 = 0,5 mol ⋅ L–1
[ICl]2 = 0,1mol ⋅ L–1
[ICl]1 = 5 ⋅ [ICl]2
123
v1 = 0,1mol ⋅ L–1 ⋅ s–1
v2 = 0,02 mol ⋅ L–1 ⋅ s–1
v1 = 5 ⋅ v2
Conclusão: v é proporcional à [ICl] ∴ v = k[ICl]1[H2]y
Nos experimentos 3 e 4 a [ICl] permanece constante, portanto, a velocidade da
reação é devida à variação de [H2]
123
[H2]3 = 0,2 mol ⋅ L–1
[H2]4 = 0,5 mol ⋅ L–1
[H2]4 = 2,5 ⋅ [H2]3
123
v3 = 0,016 mol ⋅ L–1 ⋅ s–1
v4 = 0,04 mol ⋅ L–1 ⋅ s–1
v4 = 2,5 ⋅ v3
Conclusão: v é proporcional à [H2] ∴ v = k[ICl]1[H2]1
Equação da velocidade: v = k[ICl]1[H2]1
ordem do ICl = 1 ∴ 1a ordem
ordem do H2 = 1 ∴ 1a ordem
ordem da reação = 1 + 1 = 2 (2a ordem)
QUESTÃO 4:
a) 3 (NH4)HCO3(s) + H3PO4(aq) → (NH4)3PO4(aq) + 3 CO2(g) + 3 H2O(l)
ou 3 HCO3–(aq) + 3 H+(aq) → 3 CO2(g) + 3 H2O(l)
∆
b) (NH4)HCO3(s)
→ NH3(g) + H2O(g) + CO2(g)
A liberação de gases é responsável pelo crescimento da massa dos pães e bolos.
QUÍMICA — 3
GRUPO RV-RVS — 10/2009
—
—
QUESTÃO 5:
a)
Cl Cl
H2C — CH — CH2 — CH3 + Zn → ZnCl2 + H2C —
— CH — CH2 — CH3
but-1-eno
Cl
—
Cl
—
b)
—
—
H2C — CH2 — CH2 — CH2 + Zn → ZnCl2 + H2C — CH2
H2C — CH2
ciclobutano
QUESTÃO 6:
a)
HClO
+
NaOH →
ác.
hidróxido
hipocloroso
de sódio
NaClO
+
H2O
b) 0,149 g NaClO –––––––– 1L
x –––––––– 4000 L
x = 596 g NaClO
596 g
=
74,5 g ⋅ mol–1 ⋅ 40000 L
2,0 ⋅ 10–4 mol/L NaClO
2,0 ⋅ 10–4 mol/L ClO–
123
m =