Lista de Exercícios de Revisão para Prova Cumulativa
Profa.: Alessandra Fagundes- GABARITO
1. Por que os gases nobres são estáveis?
POSSUEM 2 OU 8 ELÉTRONS EM SUA ULTIMA CAMADA.
2. Explique a regra do octeto.
OS ÁTOMOS DOS DIFERENTES ELEMENTOS LIGAM-SE UNS AOS OUTROS, DOANDO,
RECEBENDO OU COMPARTILHANDO ELÉTRONS NA TENTATIVA DE ADQUIRIR UMA
CONFIGURAÇÃO ELETRÔNICA IGUAL A DE UM GÁS NOBRE (ESTÁVEL): 8 ELÉTRONS NA
CAMADA DE VALÊNCIA OU, ENTÃO, 2 ELÉTRONS SE A CAMADA DE VALÊNCIA FOR A
PRIMEIRA CAMADA
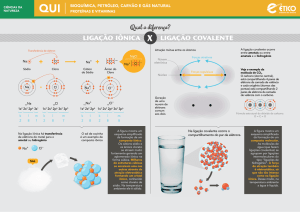
3. A ligação iônica baseia-se na DOAÇÃO de elétrons.
4. A ligação iônica ou ELETROVALENTE ocorre entre METAL e NÃO METAL.
5. A ligação covalente ou MOLECULAR ocorre entre
HIDROGÊNIO e HIDROGÊNIO . NÃO METAL e NÃO METAL. HIDROGÊNIO e NÃO METAL. ,
baseando-se no COMPARTILHAMENTE de elétrons.
6. O hidrogênio é considerado NÃO METAL e estabiliza com DOIS elétrons.
7. Qual a fórmula do composto formado entre os elementos genéricos 13A e 8B?
A2O3
8. Qual a fórmula do composto formado entre os elementos genéricos 12A e 8B?
AB
9. Assinale a alternativa correta. Assinale a provável fórmula do composto formado entre 19K e
53I
a) K2I b) K2I2 c) KI2 d) KI3 e) KI
10. Assinale a alternativa correta. A fórmula do composto formado pelos íons A+3 e B-3 é:
a) A3B3 b) A3B c) AB3 d) AB e) A2B2
11. Assinale a alternativa correta. As ligações químicas predominantes entre os átomos dos
compostos H2S, PH3 e AgBr são, respectivamente:
a) iônica, covalente e iônica b) covalente, iônica e iônica c) iônica, covalente e covalente
d) covalente, covalente e iônica e) iônica, iônica e covalente
12. Assinale a alternativa correta. Considerando suas posições na tabela periódica, o
hidrogênio e o oxigênio devem formar o composto de fórmula:
a) HO b) HO2 c) H2O d) H2O3 e) H3O2
13. Assinale a alternativa correta. Elementos alcalinos e alcalino-terrosos têm em comum o
fato de:
a) existirem livres na natureza; b) formarem cátions; c) ocuparem a região central na tabela
periódica; d) serem não-metálicos; e) serem pouco reativos;
14. Assinale a alternativa correta. Um elemento M da família dos metais alcalino-terrosos
forma um composto binário iônico com um elemento X da família dos halogênios. Assinale,
entre as opções abaixo, a fórmula mínima do respectivo composto:
a) MX b) MX2 c) M2X d) M2X7 e) M7X2
15. Assinale a alternativa correta. Os elementos P e Br podem combinar-se formando a
substância:
a) PBr, covalente b) PBr2, iônica c) PBr2, covalente
d) PBr3, iônica e) PBr3, covalente.
16. Assinale a alternativa correta. Dois elementos químicos X e Y combinam-se formando uma
substância molecular XY2. X e Y podem ter números atômicos, respectivamente:
a) 1 e 7 b) 2 e 9 c) 13 e 16 d) 15 e 35 e) 20 e 35
17. Assinale a alternativa correta. Uma substância iônica foi representada pela fórmula X2Y.
Sendo assim, na tabela periódica, é possível que X e Y se localizem, respectivamente, nas
colunas:
a) 1 e 2;b) 1 e 16; c) 2 e 1; d) 2 e 15; e) 2 e 17.
18. Assinale a alternativa correta. Qual dos compostos abaixo apresenta ligação iônica?
a) HNO3 b) C12H22O11 c) KBr d) N2 e) P2O5
19.Faça a fórmula dos compostos iônicos formados pelos seguintes elementos
a) Al e O Al2O3
b) Na e Cl NaCl
c) K e S K2S
d) Rb e I RbI
e) Ca e F CaF
f) Ga e O Ga2O3
g) Sr e P SrP
20.Quantos elétrons existem no último nível dos átomos dos gases nobres?
EXISTEM 2 OU 8 ELÉTRONS NA SUA ÚLTIMA CAMADA.
21.Quais as principais propriedades (características) dos metais?
22. Os pares de átomos abaixo formam ligação covalente simples. Para cada caso, qual a
fórmula molecular da substância formada?
a) H e Cl b) Br e Br c) H e S d) S e Cl e) N e H f) N e N g) H e H
A)HCl. B) Br2. C) H2S. D) SCl2. E) NH3. F) N2 G) H2
23. Qual a fórmula do composto iônico formado por um metal do grupo 13 e um não-metal do
grupo 17?
AlCl3
24. Das substâncias a seguir, diga se são formadas por ligação iônica ou por ligação covalente.
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
NaClIÔNICA
H2 COVALENTE
CO COVALENTE
MgO IÔNICA
Li2S IÔNICA
NO2= COVALENTE
SO3= COVALENTE DATIVA
CaCl2= IÔNICA
KI= IÔNICA
SrO= IÔNICA
BaO= IÔNICA
MnO2= IÔNICA
FeO = IÔNICA
ZnO= IÔNICA