Colégio GEO Patos – (83).3421.2325
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
Série:
2ª série do ensino médio
Título:
Orgânica e físico-química
Aluna(o):
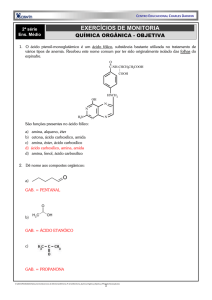
01 - (UFU MG)
O Estradiol, um hormônio esteróide de fundamental
importância no desenvolvimento dos caracteres sexuais
femininos e na própria fisiologia da reprodução, possui a
seguinte fórmula estrutural:
C
H
3
O
H
H
O
Estradiol
Com referência a esse composto, pode-se afirmar que
ele:
a) não possui átomos de carbono com geometria
tetraédrica.
b) possui fórmula molecular C17H22O2.
c) não apresenta interações do tipo ligação de
hidrogênio.
2
d) possui 6 átomos de carbono com hibridação sp .
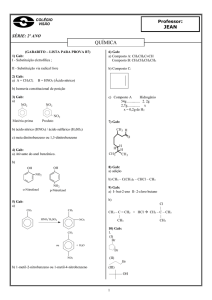
02 - (UECE)
A Ciência, ainda hoje, não sabe explicar o que
desencadeia o processo químico da paixão, isto é, por
que a Maria se apaixonou pelo José se o João era mais
bonito e tinha um salário melhor? O fato é que quando a
Maria encontrou José, seu corpo imediatamente
começou a produzir feniletilamina,
N
CH 2
CH 3
H
,
dando início ao delírio da paixão. Com relação a este
composto, pode-se afirmar, corretamente, que
a) sua cadeia carbônica é heterogênea
b) o anel benzênico possui carbono terciário
c) é uma amina terciária
d) as ligações entre os átomos de carbono do anel
benzênico são saturadas
03 - (UFC CE)
O processo
além da
participação
tais como
abaixo.
de formulação de medicamentos requer,
espécie farmacologicamente ativa, a
de compostos carreadores de fármacos,
as ciclodextrinas e , representadas
Quanto às ciclodextrinas e é correto afirmar:
a) apresentam unidades homocíclicas unidas por
ligações C–O–C.
b) apresentam ligações polarizadas do tipo C–C, C–O
e O–H.
c) são solúveis em água através de interações
covalentes.
d) são moléculas cíclicas, saturadas e heterogêneas.
e) são moléculas homólogas entre si.
04 - (UFES)
O chá da planta Bidens pilosa, conhecida vulgarmente
pelo nome de picão, é usado para combater icterícia de
recém-nascidos. Das folhas dessa planta, é extraída uma
substância química, cujo nome oficial é 1-fenilepta-1,3,5triino e cuja estrutura é apresentada abaixo. Essa
substância possui propriedades antimicrobianas e,
quando irradiada com luz ultravioleta, apresenta
atividade contra larvas de mosquitos e nematóides.
Sobre a estrutura dessa substância, pode-se afirmar que
a)
b)
c)
d)
e)
2
possui 12 átomos de carbono com hibridização sp .
possui 12 ligações σ carbono-carbono.
3
não possui carbonos com hibridização sp .
possui 3 átomos de carbono com hibridização sp.
possui 9 ligações π carbono-carbono.
05 - (UFPR)
O chocolate contém, além de gordura e açúcar, cafeína –
um estimulante do sistema nervoso central – cuja
molécula apresenta a seguinte forma estrutural:
O
H 3C
CH3
N
N
O
N
N
CH3
Com base na molécula apresentada e considerando que
o átomo de carbono apresenta Z = 6, o de hidrogênio Z =
1, o de oxigênio Z = 8 e o de nitrogênio Z = 7, considere
as afirmativas a seguir:
I. Os átomos de carbono que compõem os anéis
apresentam uma geometria plana entre suas
ligações químicas.
II. Os ângulos entre as ligações dos átomos de
o
nitrogênio são de aproximadamente 120 .
III. Os átomos de carbono que compõem os anéis
2
apresentam hibridização sp .
IV. O grupamento formado por carbono e oxigênio, na
molécula, é chamado de carboxila.
Assinale a alternativa correta.
_____________________________________________________________________________________________________________________________ ___________________________
[email protected]
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
a)
06 - (UEG GO)
b)
H
c)
H
H
H
H
Eteno
d)
Etano
Na figura acima, temos os modelos simplificados da
formação das ligações químicas de eteno e etano. De
acordo com os orbitais explícitos nessas moléculas, é
CORRETO afirmar que representam, respectivamente,
ligações do tipo:
a)
sp 3 - sp 3 e sp2 - sp2
b)
sp 2
c)
2 p
- 2p e sp3 - sp3
d)
2 p
- 2p e sp - sp
- sp2
e sp3
- sp3
_
_
_
o composto III apresenta seis ligações sigma e duas
pi;
o composto II apresenta duas ligações pi e seis
ligações sigma;
o composto I apresenta dez ligações sigma e três
ligações pi;
no composto I, os átomos de Carbono apresentam
hibrtidização tipo sp2;
no composto III, os átomos de Carbono apresentam
hibridização tipo sp3.
10 - (Mackenzie SP)
Das fórmulas abaixo, a única que possui cadeia
carbônica heterogênea, saturada e normal, é:
a) CH3CH2CH2 MgCl
b) CH2=CH – CH2OH
c) CH3COH
d) CH3 – CH2 – O – CH3
e) CH3 – C(CH3) – CO – CH3
11 - (INTEGRADO RJ)
Detergentes são agentes tensoativos, que são
constituídos por moléculas contendo uma parte orgânica
apolar e um grupo polar. Os primeiros destes
detergentes foram sintetizados na década 50 e eram os
alquilbenzeno-sulfonatos lineares de fórmula típica
representada abaixo:
_
_
_
_
_
_
_
_
_
_
_
CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH CH3
_
07 - (UCS RS)
A preocupação com o bem-estar e a saúde é uma das
características da sociedade moderna. Um dos recentes
lançamentos que evidenciam essa preocupação no setor
de alimentos é o leite com ômega-3. Essa substância
não é produzida pelo nosso organismo, e estudos
revelam que sua ingestão é importante para evitar
problemas cardiovasculares. A estrutura química do
ômega-3 pode ser assim representada:
O
e)
H
H
_ _ _
_C C C
H
H
(III)
_
H
H
H
H
H
H
H
_ _
_C C
H
H
(II)
_
H H
H_ C _ C _ H
H H
(I)
Somente as afirmativas I e III são verdadeiras.
Somente a afirmativa I é verdadeira.
Somente a afirmativa II é verdadeira.
Somente as afirmativas II e IV são verdadeiras.
Somente as afirmativas I, III e IV são verdadeiras.
_ _
_ _
a)
b)
c)
d)
e)
H3CCH2CH=CHCH2CH=CHCH2CH=CH(CH2)7
C
Com relação à estrutura química do ômega-3, é correto
afirmar que essa substância possui cadeia carbônica
a) alifática, homogênea, saturada e ramificada.
b) alicíclica, heterogênea, insaturada e ramificada.
c) alifática, homogênea, insaturada e normal.
d) homocíclica, heterogênea, saturada e normal.
e) alicíclica, homogênea, saturada e normal.
08 - (PUC RJ)
Observe a fórmula estrutural da aspirina, mostrada
abaixo:
_
_
O
_C
H3C O
_
_
_
O
_C
OH
Pode-se afirmar que a aspirina contém:
a) 2 carbonos sp2 e 1 carbono sp3
b) 2 carbonos sp2 e 7 carbonos sp3
c) 8 carbonos sp2 e 1 carbono sp3
d) 2 carbonos sp2, 1 carbono sp3 e 6 carbonos sp
e) 2 carbonos sp2, 1 carbono sp e 6 carbonos sp3
09 - (INTEGRADO RJ)
Observe os compostos abaixo e marque a altemativa
correta.
-
SO3 Na+
OH
considerando a fórmula acima, marque a afirmativa
correta:
a) existem somente 5 átomos de carbono com
hibridação do tipo sp3;
b) o átomo de enxofre se encontra com hibridação do
tipo sp;
c) existem somente 6 átomos de carbono com
hibridação do tipo sp2;
d) o carbono e o sódio têm percentualmente pesos
iguais;
e) o alquilbenzeno-sulfonato é insolúvel em água.
12 - (UERJ)
A nicotina, em mulheres grávidas fumantes, atravessam
a barreira da placenta, alcançando o embrião e
aumentando-lhe a freqüência cardíaca, isto é, o "embrião
fuma".
Observe a estrutura da nicotina, representada abaixo.
N
N
CH3
Os carbonos secundários presentes nessa estrutura são
em número de:
a) 2
b) 3
c) 5
d) 8
e) 10
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
13 - (UFF RJ)
Nos compostos C2H2, C2H6 e C2H4 as hibridizações dos
átomos de carbono são, respectivamente:
2
3
a) sp, sp , sp
2
3
b) sp , sp, sp
3
2
c) sp, sp , sp
3
2
d) sp , sp, sp
3
2
e) sp , sp , sp
14 - (UNIFICADO RJ)
A molécula de gás metano (CH4) apresenta quatro
ligações C – H ___________ em energia, graças à
formação de quatro orbitais ________ no átomo de
carbono, pela combinação de _______ com ________".
Assinale a opção que preenche corretamente as lacunas
da sentença acima.
a) mais fortes - tipos 3sp - 3 orbitais - 3 orbitais p
3
b) mais fracas - tipo s p - 3 orbitais 2s - 1 orbital 2p
c) equivalentes - tipo sp - 1 orbital 2s - 1 orbital 2p
3
d) equivalentes - híbridos sp - 1 orbital 2s - 3 orbitais
2p
e) equivalentes - híbridos 2s2p - 2 orbitais 2s - 2
orbitais 2p
15 - (UNIRIO RJ)
A umbeliferona é obtida da destilação de resinas
vegetais (umbelliferae) e é usada em cremes e loções
para bronzear.
HO
O
O
Classifica-se sua cadeia como:
a) cíclica, alicíclica, normal insaturada.
b) cíclica, aromática, mononuclear.
c) cíclica,
aromática
polinuclear
de
núcleos
condensados.
d) cíclica, alicíclica, ramificada, insaturada.
e) acíclica, aromática, polinuclear da núcleos isolados.
16 - (Mackenzie SP)
Relativamente ao composto de fórmula H2C=CHCH=CH2 , é INCORRETO afirmar que:
a) é um hidrocarboneto.
b) possui dois carbonos secundários em sua estrutura.
c) é um alceno.
d) sua fórmula molecular é C4H6.
e) é isômero do ciclobuteno
19 - (UESPI)
A qualidade da gasolina, que determina quão
suavemente ela queima, é medida pelo índice de
octanagem. Por exemplo, a molécula linear de octano
queima tão mal que tem octanagem -19, mas seu
isômero comumente chamado de isoctano tem
octanagem 100.
Sabendo que a fórmula estrutural do isoctano é:
CH3
H3C
C
CH3
CH2 CH
CH3
CH3
De acordo com as regras adotadas pela IUPAC, o
isoctano é denominado:
a) 1,1,3-dimetilhexano
b) 2,2,4- trimetiloctano
c) 1,1,3-metiloctano
d) 2,2,4-trimetilpentano
e) 2,2,4-metilpentano
20 - (UNESP SP)
Indique a afirmação INCORRETA referente à substância
química acetileno.
a) O acetileno é um gás utilizado nos maçaricos de
solda.
b) A fórmula molecular do acetileno é C2H4.
c) O nome oficial do acetileno é etino.
d) Na combustão total do acetileno, foram-se CO2 e
H2O.
e) Entre os átomos de carbono do acetileno há uma
tripla ligação.
21 - (UNESP SP)
São compostos orgânicos aromáticos:
a) n-butano e isopropanol.
b) n-heptano e ciclohexano.
c) éter etílico e butanoato de metila.
d) propanona e clorofórmio.
e) ácido benzóico e fenol.
22 - (UNIFICADO RJ)
A respeito dos hidrocarbonetos a seguir, assinale a
opção FALSA:
17 - (PUC RJ)
Se 7,5 gramas de um hidrocarboneto gasoso ocupam um
volume de 5,6 litros nas CNTP, concluímos que o
hidrocarboneto é um:
a) alceno
b) alcino
c) alcano
d) ciclano
e) cicleno
18 - (PUC RJ)
Se 7,5 gramas de um hidrocarboneto gasoso ocupam um
volume de 5,6 litros nas CNTP, concluímos que o
hidrocarboneto é um:
a) alceno
b) alcino
c) alcano
d) ciclano
e) cicleno
a)
b)
c)
São todos aromáticos.
Pertencem todos à mesma série homóloga.
Suas propriedades físicas variam de
previsível.
forma
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
d)
e)
São chamados respectivamente: benzeno; metilbenzeno;
1,2-dimetil-benzeno;
1,3,5-trimetilbenzeno; 1,2,3,4 – tetrametil-benzeno.
Possuem a mesma fórmula mínima (CH)n
23 - (UERJ)
Uma mistura de hidrocarbonetos e aditivos compõe o
combustível denominado gasolina. Estudos revelaram
que quanto maior o número de hidrocarbonetos
ramificados, melhor é a performance da gasolina e o
rendimento do motor.
Observe as estruturas dos hidrocarbonetos abaixo:
4, 1, 3, 2, 5
4, 3, 1, 5, 2
4, 1, 3, 2, 5
4, 3, 1, 2, 5
26 - (UNIUBE MG)
Considere as estruturas químicas simplificadas das
substâncias abaixo:
_
ANTRACENO
_
_
_
_ _
_
_
_
_ _
_ _
_
I
II
CH3
CH3
_
_
_
_ _
H3C CH CH CH2
H3C C CH2
_
CH3
CH2
H3C CH CH3
CH3
CH3
IV
III
_
_
CH2 CH2
H3C CH2 CH3
_
CH2 CH CH3
CH2 CH _ CH3
_
H3C CH2 CH3
CH2
b)
c)
d)
e)
FENANTRENO
O hidrocarboneto mais ramificado é o de número:
a) IV
b) III
c) II
d) I
24 - (UDESC SC)
A respeito do metano, são feitas as seguintes
afirmações:
I) O metano é o primeiro membro da série dos alcanos
e apresenta-se como um gás incolor e inodoro.
II) O metano pode formar-se pela fermentação de
material orgânico em depósitos de lixo e em esgotos
sanitários, podendo também ser encontrado no gás
natural (de 70 a 90%).
III) Uma das aplicações do metano, e que se tem
difundido em nosso país, é como combustível para
veículos automotivos, devido ao seu baixo custo.
IV) O metano é um composto orgânico de fórmula
molecular C2H2.
Assinale a alternativa CORRETA.
a) Somente as afirmativas II e III são verdadeiras.
b) Somente as afirmativas II, III e IV são verdadeiras.
c) Somente a afirmativa I é verdadeira.
d) Somente a afirmativa a II é verdadeira.
e) Somente as afirmativas I, II e III são verdadeiras.
25 - (UDESC SC)
Na coluna 1 abaixo encontram-se listadas as fórmulas de
diferentes substâncias químicas e, na coluna 2, estão
listados os possíveis nomes para elas.
Coluna 1
( 1 ) CH3 CH2 CH3
( 2 ) CH3 CH2 Cℓ
( 3 ) CH3 CH2 CH2 CH3
( 4 ) CH3 CH2 CH2 CH2 CH3
( 5 ) CH3 Cℓ
Coluna 2
( ) pentano
( ) butano
( ) propano
( ) cloreto de etila
( ) cloreto de metila
A alternativa que apresenta a associação CORRETA, de
cima para baixo, é:
a) 3, 4, 1, 2, 5
NAFTACENO
PIRENO
Com respeito a estas substâncias, pode-se afirmar que
as alternativas abaixo são verdadeiras, EXCETO:
a) Sofrem combustão com facilidade.
b) São hidrocarbonetos aromáticos.
c) São insolúveis em n-hexano, n-pentano e benzeno,
devido à baixa polaridade de suas moléculas.
d) Apresentam ligações do tipo pi() em suas
moléculas.
27 - (FURG RS)
A estrutura a seguir representa o farnaseno, um trieno,
terpeno encontrado no óleo de ervacidreira. Quando
tratado com três moles de hidrogênio (H2) em presença
do catalisador paládio, tem se a formação do alcano
correspondente.
CH3
C
H3C
CH
H2C
CH
H2C
H2C
CH2
CH2
C
CH3
C
H2C
CH3
O nome IUPAC do reagente e do produto são,
respectivamente:
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
a)
b)
c)
d)
e)
2,6,10-trimetil-1,6,10-dodecatrieno
trimetildecano.
3,7,11-trimetil-2,6,11-decatrieno
trimetildecano.
3,7,11-trimetil-2,6,11-decatrieno
trimetildecano.
3,7,11-trimetil-2,6,11-dodecatrieno
trimetildodecano.
2,6,10-trimetil-1,6,10-dodecatrieno
trimetildodecano.
e
2,6,10-
e
3,7,11-
e
2,6,11-
e
3,7,11-
e
2,6,10-
28 - (UFF RJ)
Analise a estrutura seguinte e considere as regras de
nomenclatura da IUPAC.
Assinale a opção que indica as cadeias laterais ligadas,
respectivamente, aos carbonos de números 4 e 5 da
cadeia hidrocarbônica principal.
a) propil e isobutil
b) metil e isobutil
c) terc-pentil e terc-butil
d) propil e terc-pentil
e) metil e propil
29 - (ITA SP)
Metano, também conhecido como gás de pântanos, pode
ser:
I. obtido por craqueamento do petróleo.
II. obtido por hidrogenação do carvão mineral.
III. formado por decomposição biológica em fundos de
lagos.
IV. extraído de reservas naturais, à semelhança do que
acontece com o petróleo.
V. formado na fermentação dos detritos domésticos,
estocados em lixões e aterros sanitários.
Das afirmações anteriores estão CORRETAS:
a) apenas I e II
b) apenas III e IV.
c) apenas I, II e IV
d) apenas I, III, IV e V.
e) Todas.
30 - (EFOA MG)
De acordo com as regras da IUPAC, o nome sistemático
do hidrocarboneto representado abaixo é:
encontra o antitussígeno dextrometorfano derivado da
morfina que apresenta atividade específica.
¨
N
OH
Assinale a opção que apresenta as funções e o número
de carbonos terciários e quaternários na estrutura
acima.
a) amida, éter, 4 carbonos terciários e 1 quaternário
b) amina, fenol, 3 carbonos terciários e 1 quaternário
c) amina, éter, 3 carbonos terciários e 2 quaternários
d) amina, fenol, 4 carbonos terciários e 2 quaternários
e) amina, fenol, 4 carbonos terciários e 1 quaternário
32 - (EFOA MG)
As estruturas abaixo representam algumas substâncias
usadas em protetores solares.
CO2H
O
OCH3
CH
CHCO2CH2CH(CH2)3CH3
CH2CH3
OCH3
A função que NÃO está presente em nenhuma dessas
estruturas é:
a) cetona.
b) éter.
c) éster.
d) amina.
e) álcool.
33 - (UFOP MG)
O acebutolol pertence a uma classe de fármacos
utilizada no tratamento da hipertensão.
CH3
O
O
31 - (UFMA)
Os agentes antitussígenos suprimem a tosse pelo
bloqueio dos impulsos nervosos envolvidos no reflexo da
tosse, alterando a quantidade e viscosidade do fluido no
trato respiratório. A maior parte dos narcóticos são
potentes supressores desse reflexo. Entre eles se
H3C
OH
N
H
Cl
4-cloroexano
4-cloro-hexila
hexano-4-cloro
3-cloroexano
hexano-3-cloro
OH
NH2
O
a)
b)
c)
d)
e)
CH3
N
CH3
CH3
H
Acebutolol
Estão presentes na estrutura do acebutolol as seguintes
funções:
a) éster, álcool, amina, amida, alqueno.
b) amida, alqueno, álcool, amina, fenol.
c) amina, fenol, aldeído, éter, álcool.
d) cetona, álcool, amida, amina, alqueno.
e) amida, cetona, éter, álcool, amina.
34 - (ITA SP)
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
Considere as seguintes afirmações a respeito da
aplicação do fenol: Fenol é utilizado
I. na síntese da baquelite
II. na produção de tintas
III. como agente bactericida
IV. na obtenção de explosivos
V. na síntese de ácido acetilsalicílico
Das afirmações feitas, estão CORRETAS
a) apenas I e II
b) apenas I, II, III e V
c) apenas II e III
d) apenas III e IV
e) todas
35 - (UNIMEP SP)
Na estrutura
H
C=O
HO
O - CH3
a)
b)
c)
d)
e)
álcool, éter e éster
álcool, ácido e fenol
aldeído, álcool e éter
aldeído, éster e álcool
aldeído, éter e fenol
39 - (UNIRIO RJ)
A procaína utilizada como um anestésico de ação local
apresenta a seguinte fórmula estrutural:
CH3-CH2
H2N-
As funções químicas presentes nessa molécula são:
a) éster e amina.
b) ácido carboxílico e fenol.
c) éter e amina.
d) aldeído e éster.
e) éster e nitrocomposto.
serotonina
HO
CH2 _ CH2 _ NH2
N
H
dopamina
_ CH _ CH _ NH
HO _
2
2
2
_
37 - (UFF RJ)
A adrenalina é um hormônio liberado na corrente
sangüínea dos seres humanos quando em situação de
perigo eminente. Sua fórmula estrutural é:
noradrenalina
_
_
_
HO
CH CH2 NH2
OH
HO
_
_
NH2
_
CH3
_
O
C O
40 - (UERJ)
Um dos episódios da final da Copa da França de 1998
mais noticiados no Brasil e no mundo foi “o caso
Ronaldinho”.
Especialistas
apontaram:
estresse,
depressão, ansiedade e pânico podem Ter provocado a
má atuação do jogador brasileiro. Na confirmação da
hipótese de estresse, teriam sido alteradas as
quantidades de três substâncias químicas excitatórias do
cérebro - a noradrenalina, a serotonina e a dopamina cujas estruturas estão abaixo representadas:
_
36 - (Mackenzie SP)
Alguns confeitos e balas contêm um flavorizante que dá
sabor e aroma de uva, de fórmula estrutural
Com base nessa fórmula estrutural, pode-se afirmar que
as funções orgânicas presentes nessa substância
são:
a) amina primária, cetona e éter
b) amina primária, amina terciária e éster
c) amina terciária, amida e éster
d) amida, cetona e éter
e) amida, éter e éster
_
encontramos o grupo funcional de um:
a) fenol
b) éter
c) aldeído
d) cetona
e) álcool
-C - O -CH2-CH2-N
O
CH3-CH2
HO
Os grupos funcionais I, II e III são, respectivamente:
a) álcool, amida, álcool
b) álcool, amina, álcool
c) fenol, amina, álcool
d) fenol, amida, álcool
e) álcool, amina, fenol
38 - (UNIFICADO RJ)
Em relação à molécula da vanilina, é correto afirmar que
as funções químicas encontradas são:
Essas substâncias têm em comum as seguintes funções
químicas:
a) amida e fenol
b) amina e fenol
c) amida e álcool
d) amina e álcool
41 - (GF RJ)
O efeito destrutivo dos CFC sobre a camada de ozônio
tem sido matéria muito discutida ultimamente. A sigla
CFC designa um grupo de compostos formados por
carbono, flúor e cloro, usados em aerossóis e
refrigeração. O mais usado, o freon -12, apresenta
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
fórmula molecular CF2Cl2. Em relação às funções
orgânicas, o freon -12 é um :
a) hidrocarboneto
b) haleto
c) fenol
d) aldeído
e) cloreto de ácido
tipos de anemia. Recebeu este nome comum por ter sido
originalmente isolado das folhas do espinafre.
O
C-NH-CHCH2CH2COOH
|
COOH
42 - (UNESP SP)
A asparagina, de fórmula estrutural:
O
H H
O
HNCH2
H2N - C - C - C - C -OH
H NH 2
apresenta o(s) grupo(s) funcional(is):
a) álcool
b) éster
c) éter e éster
d) amida, amina e ácido carboxílico
e) éter, amida e ácido carboxílico
43 - (UFPI)
Sobre os compostos:
I. H2C = CH - CONH2
II. CH3 - CH2 - CHO
III. H2C = CH - NH - CH2 - CH3
IV. O = N - O - CH2 - CH3
O
V. CH3 - CH2 - CH2OH
São feitas as afirmações abaixo. Assinale a única falsa:
a) I é amida
b) IV é nitrocomposto
c) V é álcool
d) II é aldeído
e) III é amina
44 - (PUC MG)
Considere as substâncias representadas pelas seguintes
fórmulas:
(anfetamina: antidepressor)
-CH2-CH-CH3
NH2
(adrenalina: acelera o
batimento cardíaco)
-CH -CH2-NH-CH3
OH
HO
OH
(corafenicol: antibiótico)
-CH -CH-CH2OH
OH NH2
Em relação às substâncias, todas as afirmativas são
corretas, EXCETO:
a) Todas possuem anel aromático.
b) Todas apresentam função amina.
c) Duas têm função fenol.
d) Uma tem função fenol.
e) Todas descoram solução de bromo em tetracloreto
de carbono.
OH
N
N
H2N
N
N
São funções presentes no ácido fólico:
a) amina, alqueno, éter
b) cetona, ácido carboxílico, amida
c) amina, éster, ácido carboxílico
d) ácido carboxílico, amina, amida
e) amina, fenol, ácido carboxílico
46 - (UFTM MG)
Observe a pilha galvânica.
Chave
Multímetro
NO3
Znº
NO3
Zn2+
NO3
Na+
+
Niº
NO3
NO3
Ni 2+
Dados: potenciais – padrão de redução dos eletrodos a
25 ºC
Semi-reação
Eº(volts)
2+
–
Zn (aq) + 2e Zn(s)
– 0,76
2+
–
Ni (aq) + 2e Ni(s)
– 0,25
Levando-se em conta os potenciais-padrão de redução
dos eletrodos a 25 ºC, são feitas as seguintes
afirmações:
I. ao se fechar o circuito, haverá um fluxo de elétrons
do eletrodo de níquel para o de zinco;
II. o eletrodo de níquel será o cátodo nesta pilha;
III. ao se fechar o circuito, o voltímetro deve acusar um
valor aproximado de 0,5 volt;
IV. os cátions da ponte salina migram para o recipiente
contendo a solução de Zn(NO3)2.
Das afirmações acima, está correto o contido em
a) I, somente.
b) II, somente.
c) I e IV, somente.
d) II e III, somente.
e) I, III e IV, somente.
47 - (ESCS DF)
Dentre as substâncias a seguir, aquela que corresponde
a uma substância simples é a substância:
45 - (UFV MG)
O ácido pteroil-monoglutâmico é um ácido fólico,
substância bastante utilizada no tratamento de vários
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
48 - (FUVEST SP)
Com a finalidade de niquelar uma peça de latão, foi
montado um circuito, utilizando-se fonte de corrente
contínua, como representado na figura.
No entanto, devido a erros experimentais, ao fechar o
circuito, não ocorreu a niquelação da peça. Para que
essa ocorresse, foram sugeridas as alterações:
I. Inverter a polaridade da fonte de corrente contínua.
II. Substituir a solução aquosa de NaC por solução
aquosa de NiSO4.
III. Substituir a fonte de corrente contínua por uma fonte
de corrente alternada de alta freqüência.
O êxito do experimento requereria apenas:
a) a alteração I.
b) a alteração II.
c) a alteração III.
d) as alterações I e II.
e) as alterações II e III.
49 - (PUC RS)
Considere as seguintes informações:
A prata, em presença de compostos sulfurados
existentes na atmosfera, forma um composto de cor
escura, o sulfeto de prata. Para remover essa cor,
envolve- se o objeto de prata em uma folha de alumínio,
e este sistema é colocado imerso em uma solução
diluída de bicarbonato de sódio, sendo aquecido
ligeiramente.
Com relação ao observado no processo de remoção da
cor escura do objeto de prata, são feitas as seguintes
afirmativas:
I. O potencial de oxidação da prata é maior do que o
do alumínio.
II. O potencial de redução do alumínio é menor do que
o da prata.
III. A reação que ocorre pode ser corretamente
representada por:
aquoso
2Al3+(aq) + 3S2–(aq)+ 6Ag(s)
2Al(s) + 3Ag2S(s)
IV. O alumínio está sofrendo uma oxidação e os íons
1+
2–
Ag e S estão sofrendo uma redução.
Pela análise das informações, somente estão corretas as
afirmativas:
a) I e II
b) II e III
c) III e IV
d) I, III e IV
e) II, III e IV
50 - (UFMS)
Considere as semi-reações, abaixo indicadas, com seus
respectivos potenciais padrão de redução, em volt (V).
+
e + Ag (aq) → Ag(s) Eºred = + 0,80V
2+
2e + Cu (aq) → Cu(s) Eºred = + 0,34V
A força eletromotriz da cela, cujos eletrodos padrão são
2+
+
Cu(s) / Cu (aq) // Ag (aq) / Ag(s), é:
a) - 4,6 V.
b) - 0,46 V.
c) + 0,46 V.
d) + 1,14 V.
e) - 1,14 V.
51 - (UEL PR)
Considere a tabela de potencial padrão de redução a
seguir.
0
Semi-reação
E (red) / V
3+
Al
+ 3 e Al
– 1,66
2+
Zn + 2 e Zn
– 0,76
2+
Fe + 2 e Fe
– 0,44
2+
Sn + 2 e Sn
– 0,14
2+
Cu + 2 e Cu
+ 0,34
+
Ag + 1 e Ag
+ 0,80
Os cascos de navios, normalmente feitos de ferro, são
protegidos da corrosão mediante a colocação de “metais
de sacrifício”, ou seja, metais que sofrem
preferencialmente a corrosão.
Com base no exposto acima, é correto afirmar:
a) A corrosão ocorre porque o oxigênio é oxidado e o
ferro se transforma em Fe(OH)3.
b) O “metal de sacrifício” deve ter um potencial padrão
de redução menor que o do metal que se deseja
proteger.
c) O “metal de sacrifício” deve ser um redutor mais
fraco que o ferro.
d) O “metal de sacrifício” atua doando elétrons como se
fosse o cátodo de uma pilha.
e) Da tabela, pode-se concluir que o melhor “metal de
sacrifício” é a prata.
52 - (UEL PR)
Considere a tabela de potencial padrão de redução a
seguir.
0
Semi-reação
E (red) / V
3+
Al
+ 3 e Al
– 1,66
2+
Zn + 2 e Zn
– 0,76
2+
Fe + 2 e Fe
– 0,44
2+
Sn + 2 e Sn
– 0,14
2+
Cu + 2 e Cu
+ 0,34
+
Ag + 1 e Ag
+ 0,80
Um agricultor, para tratar suas parreiras de uva que
estavam com fungos, preparou uma solução aquosa de
CuSO4 1 mol/L e quer guardá-la a 25ºC. Ele dispõe de
recipientes de:
I. ferro;
II. ferro galvanizado (ferro revestido com zinco);
III. lata comum (ferro revestido com estanho); e
IV. cobre.
Essa solução de CuSO4 pode ser guardada, sem reagir
com o material do recipiente, apenas em:
a) I, II e III.
b) II, III e IV.
c) III e IV.
d) III.
e) IV.
53 - (UFC CE)
Uma das fontes de produção do “combustível limpo”
H2 (considere o comportamento de um gás ideal) é
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
a reação de eletrólise da água que, na ausência de
oxigênio e em um ambiente fechado, gera um meio
alcalino. Sabendo que, ao final de uma eletrólise, o pH
da solução é 9,00, assinale a alternativa que indica o
volume (em L) ocupado por este gás a 1,0 atm e 30°C. R
= 0,0821 atmL/molK.
–7
a) 1,96 x 10
–6
b) 1,72 x 10
–5
c) 1,48 x 10
–4
d) 1,24 x 10
–3
e) 1,12 x 10
54 - (UFC CE)
Uma dada célula galvânica seca é constituída de um
eletrodo de grafite e óxido de manganês (IV), no
compartimento catódico, e de cloreto de amônium e
um eletrodo metálico, no compartimento anódico.
Durante a reação, verifica-se, nesta parte da célula,
2+
a formação do composto [M(NH3)4] . Sabendo que o
potencial da célula é 1,50V e baseado somente nas
informações abaixo, assinale a alternativa que indica
corretamente o metal que compõe o ânodo.
Potencial
Reação
de redução
M nO 2(s) H 2O(l) eM nO(OH)(s) OH -(l)
-M nO 4 (aq) 2H 2O(l) 2e
M nO 2(aq) 4 OH -(aq)
Cd(OH)2(aq) 2e
Cd(s) OH-(aq)
++
Zn (aq) 2e
Zn(s)
Cr++(aq) 2eCr(s)
Ag(aq) eAg(s)
a)
b)
c)
d)
e)
+0,74
+0,60
-0,81
-0,76
-0,90
55 - (FATEC SP)
Considere os seguintes dados sobre potenciais-padrão
de redução.
o
E /vol
Mg 2 (aq) 2e
Mg( s ) 2,37
Zn 2 (aq)
2e
Zn( s )
0,76
Fe (aq)
2e
Fe( s )
0,44
Cu 2 (aq)
2e
Cu ( s )
0,34
e
Ag( s )
0,80
2
Ag (aq)
(http://www.comciencia.br/comciencia/?section=8&edicao=32&id
=379,
acessado em 14.09.2009. Adaptado.)
Boa parte do lixo eletrônico é constituída pelas pilhas
comuns. São elas as principais fontes dos elementos
zinco e manganês presentes nesse tipo de lixo. A figura
mostra os principais componentes de uma pilha comum
nova e sem uso.
+0,80
Mn
Zn
Cr
Ag
Cd
Semirreação
principalmente, pelos metais pesados que os compõem,
altamente prejudiciais à saúde humana. Além disso,
faltam regras claras e locais apropriados para a
deposição desses equipamentos que, em desuso, vão
constituir o chamado lixo eletrônico ou e-lixo.
Faz parte desse grupo todo material gerado a partir de
aparelhos eletrodomésticos ou eletroeletrônicos e seus
componentes, inclusive pilhas, baterias e produtos
magnetizados. Quando as pilhas e os equipamentos
eletroeletrônicos são descartados de forma incorreta no
lixo comum, substâncias tóxicas são liberadas e
penetram no solo, contaminando lençóis freáticos e, aos
poucos, animais e seres humanos.
A tecnologia ainda não avançou o suficiente para que
essas substâncias sejam dispensáveis na produção
desses aparelhos. O que propõem cientistas,
ambientalistas e legisladores é que se procure reduzir,
reciclar e reutilizar esses equipamentos.
Uma tubulação de ferro pode ser protegida contra a
corrosão se a ela for conectada uma peça metálica
constituída por
a) magnésio ou prata.
b) magnésio ou zinco.
c) zinco ou cobre.
d) zinco ou prata.
e) cobre ou prata.
56 - (FATEC SP)
Resíduo eletrônico: redução, reutilização e
reciclagem
A popularização dos eletroeletrônicos e a rápida
obsolescência dos modelos cria o mito da necessidade
de substituição, que se torna quase obrigatória para os
aficionados em tecnologia e para algumas profissões
específicas. No entanto, o descarte desenfreado desses
produtos tem gerado problemas ambientais sérios, pelo
volume; por esses produtos conterem materiais que
demoram muito tempo para se decompor e,
O quadro seguinte mostra o que acontece com os
constituintes de uma pilha comum, logo após sua
utilização e depois de alguns meses exposta ao
ambiente.
COMP ONENTE
P ERÍODO LOGOAP ÓS
DA P ILHA
SUA UTILIZAÇÃO
Invólucrode aço
P apelãoque
separa o invólucro
de aço do copo
P ermanece intacto.
P ermanece intacto.
DEP OIS DE ALGUNS
MESES EXP OSTA
AO AMBIENTE
Torna - se enferrujado.
Fica manchado, úmido
e sem resistência.
de zinco
Boa parte do metal é
Copo de zinco
P ermanece aparente-
corroída,aparecendo
- mente intacto,
buracosno copo,o
mas com massa menor.
metal que resta fica
recobertopor ZnO.
P apelque separa o
copo de zinco
P ermanece intacto.
Desfaz - se.
da pasta úmida
Bastão de grafita
P astaúmida
P ermanece intacto.
Torna - se mais poroso
e quebradiço.
Diminuimais ainda a
Diminuia quantidadede
quantidadede MnO 2
MnO 2 e de NH 4 Cl,
e de NH 4 Cl ,
passa a conter também
passa a conter também
Mn 2 O 3 , ZnCl 2 , e NH3 .
ZnO, Mn(OH)2 e outras
substâncias.
Analisando-se essas informações, pode-se concluir que
I. ocorrem transformações químicas durante o uso da
pilha e após seu descarte no ambiente;
II. quanto antes uma pilha usada for encaminhada para
reciclagem, maiores serão as quantidades de
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
componentes
originais
que
poderão
ser
recuperadas;
III. quando depositadas no lixo comum, as pilhas
comuns não acarretam riscos para o ambiente, uma
vez que são biodegradáveis.
É correto o que se afirma apenas em
a) I.
b) II.
c) III.
d) I e II.
e) II e III.
57 - (FATEC SP)
Um dos grandes problemas do lixo eletrônico é o
pequeno número de empresas que conhecem a
tecnologia para a reciclagem de produtos como
monitores e placas de circuito impresso. Uma empresa,
com sede em Cingapura, conta como é seu processo de
reciclagem:
“Primeiramente separamos a sucata eletrônica por
classe, efetuamos a destruição através da moagem e
exportamos para a usina. Lá é feita uma desintoxicação
(processo de elevação de temperatura em câmara
selada a 1200°C e resfriamento em 4 segundos para
700°C), filtragem de dioxinas, liquidificação, separação
por densidade, separação por eletrólise, decantação,
refinagem e solidificação em barras.”
(http://lixoeletronico.org/blog/o-ciclo-do-lixo-eletr%C3%B4nico-3reciclagem,
acessado em 12.09.2009.Adaptado.)
De acordo com o processo de reciclagem exposto são
feitas as seguintes afirmações:
I. A decantação é um processo de separação.
II. A desintoxicação é um processo térmico com taxa
de variação térmica, em módulo, na ordem de 125ºC
por segundo.
III. A eletrólise consiste num processo químico.
É correto o que se afirma em
a) II, apenas.
b) I e III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
58 - (FATEC SP)
Praticamente todos os aparelhos eletrônicos contêm uma
ou mais placas de circuito impresso, nas quais são
soldados os componentes. As trilhas metálicas dessas
placas são de cobre, como mostra a figura a seguir.
Considere as seguintes informações, todas corretas,
referentes a procedimentos experimentais (I, II, III e IV),
que podem ser empregados para obtenção de cobre
puro, o mais rapidamente possível, a partir de placas de
circuito impresso.
I. Ao mergulhar uma mistura de cobre e polímero em
ácido nítrico, o cobre reage formando uma solução
aquosa de nitrato cúprico. O polímero se mantém
intacto.
II. Limpando-se a placa e depois a quebrando em
pequenos fragmentos, obtém-se um material com
maior superfície de contato e que, portanto, reage
mais rapidamente.
III. Submetendo-se uma solução de nitrato cúprico à
eletrólise, forma-se cobre metálico puro.
IV. Filtrando-se uma mistura de polímero e solução de
nitrato cúprico, a solução passa pelo filtro, mas o
polímero fica retido.
Com base nessas informações, pode-se concluir que,
para se obter cobre puro a partir de placas de circuito
impresso
usadas,
devem-se
realizar
esses
procedimentos na seguinte ordem:
a) II – I – IV – III.
b) III – II – IV – I.
c) I – III – II – IV.
d) III – IV – II – I.
e) II – IV – I – III.
59 - (UFES)
Em uma solução de CuSO4, de cor azulada, são
adicionados fragmentos de ferro metálico. Depois de
algum tempo, a solução perde sua cor azulada, e nota-se
que os fragmentos de ferro são recobertos de cobre
metálico.
A respeito desse fato, pode-se afirmar que o
a) ferro sofre oxidação; portanto, é o agente oxidante.
b) ferro sofre redução; portanto, é o agente redutor.
c) cobre sofre redução; portanto, é o agente oxidante.
d) cobre sofre oxidação; portanto, é o agente redutor.
e) ferro é agente oxidante, e o cobre é agente redutor.
60 - (UFPR)
Analise a figura da seguinte célula eletroquímica:
o
Considerando os potenciais-padrão de redução (E ) do
cádmio -0,402V e da prata +0,799V, é correto afirmar:
a) O eletrodo de prata é definido como catodo quando
essa célula estiver funcionando como célula
galvânica.
o
b) O potencial fornecido por essa célula é E = +0,397
V.
c) O fornecimento de uma d.d.p. de 0,400V para essa
célula faz com que ela funcione como célula
eletrolítica.
d) No eletrodo de cádmio dessa célula vai ocorrer uma
reação de redução, espontaneamente.
e) Na célula, a ponte salina tem por finalidade facilitar a
passagem de elétrons, fechando o curto-circuito da
célula galvânica.
61 - (UNESP SP)
Nas obturações dentárias, os dentistas não podem
colocar em seus pacientes obturações de ouro e de
amálgama muito próximas, porque os metais que
constituem a amálgama (uma liga de prata, zinco,
estanho, cobre e mercúrio) são todos mais
eletropositivos que o ouro e acabariam transferindo
elétrons para esse metal através da saliva, podendo
levar à necrose da polpa dentária. Das semi-reações dos
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
metais que constituem a amálgama, a que apresenta o
metal mais reativo é:
+
–
0
a) Ag (s) Ag (aq) + 1e
E = – 0,80 V
2+
–
0
b) Sn (s) Sn (aq) + 2e
E = + 0,14 V
2+
–
0
c) Hg (s) Hg (aq) + 2e
E = – 0,85 V
2+
–
0
d) Zn (s) Zn (aq) + 2e
E = + 0,76 V
2+
–
0
e) Cu (s) Cu (aq) + 2e
E = – 0,34 V
62 - (EFOA MG)
Considere o esquema de pilha e os potenciais de
redução:
Observa-se que a chave fica amarela por causa da
2+
a) redução dos íons Cu (aq).
2+
b) oxidação dos íons Cu (aq).
c) redução do Cu metálico.
d) oxidação do metal da chave.
e) redução do metal da chave.
A tabela abaixo mostra quatro conjuntos de metais e
soluções:
Apresentarão o fluxo de elétrons com o sentido mostrado
no esquema acima APENAS os seguintes conjuntos da
tabela:
a) I e II.
b) II e III.
c) I, II e IV.
d) I e III.
e) II e IV.
63 - (UFJF MG)
A equação abaixo representa a reação química que
ocorre em pilhas alcalinas que não são recarregáveis.
KOH
Zn + 2 MnO2 + H2O Zn(OH)2 + Mn2O3
Considere as afirmativas:
I.
O Zn é o agente redutor e, portanto, é oxidado no
processo.
II.
O MnO2 sofre redução para formar Mn2O3.
III. O KOH é o agente oxidante e a água é oxidada,
–
originando íons OH .
IV. Essa pilha é chamada de alcalina, pois a reação
ocorre em meio básico.
V. A pilha alcalina é um dispositivo que produz
corrente elétrica.
Pode-se afirmar que:
a)
I, III, IV e V estão corretas.
b)
apenas a IV está correta.
c)
I, II, IV e V estão corretas.
d)
apenas a III está correta.
e)
todas estão corretas.
64 - (UFG GO)
Uma chave, imersa em uma solução de sulfato de
cobre, é conectada a uma placa de cobre por meio de
uma pilha comum, como mostra a figura abaixo.
65 - (UFPE)
As pilhas de níquel-cádmio, que viabilizaram o uso de
telefones celulares e computadores portáteis, são
baseadas na seguinte reação:
Cd(s) + NiO2(s) + H2O(l) Cd(OH)2(s)+Ni(OH)2(s).
Considerando este processo, quantos mols de elétrons
são produzidos por mol de cádmio consumido?
a) 0,5
b) 1
c) 2
d) 3
e) 4
66 - (ITA SP)
Qual o valor da massa de sulfato de ferro (III) anidrido
que deve ser colocada em um balão volumétrico de 500
mL de capacidade para obter uma solução aquosa 20
milimol/L em íons férricos após completar o volume do
balão com água destilada?
a) 1,5 g
b) 2,0 g
c) 3,0 g
d) 4,0 g
e) 8,0 g
67 - (ITA SP)
Fazendo-se borbulhar gás cloro através de 1,0 litro de
uma solução de hidróxido de sódio, verificou-se ao final
do experimento que todo hidróxido de sódio foi
consumido, e que na solução resultante foram formados
2,5 mols de cloreto de sódio. Considerando que o
volume não foi alterado durante todo o processo, e que
na temperatura em questão tenha ocorrido apenas a
reação correspondente à seguinte equação química, não
balanceada:
OH-(aq) + Cl2(g) Cl-(aq) + ClO3 (aq) + H2O(L)
Qual deve ser a concentração inicial do hidróxido de
sódio?
a) 6,0 mol/L
b) 5,0 mol/L
c) 3,0 mol/L
d) 2,5 mol/L
e) 2,0 mol/L
68 - (ITA SP)
Uma
determinada
solução
contém
apenas
concentrações apreciáveis das seguintes espécies
iônicas: 0,10 mol/L de H+ (aq), 0,15 mol/L de Mg2+ (aq),
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
0,20 mol/L de Fe3+ (aq), 0,20 mol/L de SO42- (aq) e x
mol/L de Cl- (aq). Pode-se afirmar que o valor de x é
igual a:
a) 0,15 mol/L
b) 0,20 mol/L
c) 0,30 mol/L
d) 0,40 mol/L
e) 0,60 mol/L
nas diferenças de solubilidade de cada uma delas. Esse
processo consiste em evaporar o solvente, em condições
controladas de pressão, temperatura e concentração,
para obter a cristalização de cada soluto sob a forma
mais pura possível. Os dados de solubilidade de um
sólido em um líquido, quando representados
graficamente, permitem uma boa visualização do
processo de cristalização.
69 - (ESCS DF)
O gráfico a seguir representa a curva de solubilidade de
NaNO3 em função da temperatura.
Quatro misturas de nitrato de sódio, A, B, C e D, foram
preparadas, em diferentes temperaturas, misturando-se
diferentes massas de NaNO3 em água.
A partir da análise desse gráfico, é correto afirmar que:
a) as misturas A e C apresentam precipitado;
b) apenas a mistura A apresenta precipitado;
c) as misturas C e D formam soluções supersaturadas;
d) a mistura C apresenta a maior quantidade de sólido
precipitado;
e) as concentrações das soluções aquosas resultantes
das misturas A e D são iguais.
70 - (FUVEST SP)
Em um experimento, para determinar o número x de
grupos carboxílicos na molécula de um ácido carboxílico,
volumes de soluções aquosas desse ácido e de
–1
hidróxido de sódio, de mesma concentração, em mol L ,
à mesma temperatura, foram misturados de tal forma
que o volume final fosse sempre 60 mL. Em cada caso,
houve liberação de calor. No gráfico abaixo, estão as
variações de temperatura (T) em função dos volumes
de ácido e base empregados:
Nesse experimento, o calor envolvido na dissociação do
ácido e o calor de diluição podem ser considerados
desprezíveis.
Partindo desses dados, pode-se concluir que o valor de x
é:
a) 1
b) 2
c) 3
d) 4
e) 5
71 - (UEL PR)
A cristalização é um processo de separação de
substâncias dissolvidas em um solvente e está baseada
Considerando os conhecimentos sobre o assunto e as
informações contidas no gráfico de solubilidade acima,
assinale a afirmativa correta.
a) Se uma solução saturada de KNO3 for preparada a
50ºC e em seguida aquecida a 80ºC, será obtida
uma solução supersaturada desse sal.
b) O sal mais solúvel em água, a 50ºC, é o NaCl.
c) A menor quantidade de água necessária para
dissolver completamente 50 gramas de NaNO3 a
35ºC é 100 gramas.
d) Se a 250 gramas de KNO3 forem adicionados 200
gramas de água a 58ºC, será obtida uma solução
saturada com 100 gramas de KNO3 precipitado.
e) A curva de solubilidade representa a fronteira entre
as regiões insaturada e supersaturada, e qualquer
ponto dessa curva indica que a solução está
saturada.
72 - (UEL PR)
Uma dose inicial de um certo antibiótico é ingerida por
um paciente e, para que seja eficaz, é necessária uma
concentração mínima. Considere que a concentração do
medicamento, durante as 12 primeiras horas, medida em
miligramas por litro de sangue, seja dada pela função
cujo gráfico é apresentado a seguir:
Considere as afirmativas a seguir:
I. Se a concentração mínima for de 20 mg/L, então o
antibiótico deve ser ingerido novamente após 8
horas.
II. A concentração de antibiótico no sangue cresce
mais rápido do que decresce.
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
III. A concentração máxima de antibiótico ocorre
aproximadamente 3 horas após a ingestão.
IV. O gráfico da função, durante essas 12 horas,
representa uma função bijetora.
Assinale a alternativa correta.
a) Somente as afirmativas I e IV são corretas.
b) Somente as afirmativas II e III são corretas.
c) Somente as afirmativas III e IV são corretas.
d) Somente as afirmativas I, II e III são corretas.
e) Somente as afirmativas I, II e IV são corretas.
73 - (UEPA)
Inúmeras reclamações sobre produtos de supermercado
fora das especificações têm sido objeto de denúncias
junto ao PROCON. Técnicos do INMETRO, órgão
responsável por esse tipo de fiscalização, analisaram
duas marcas de Vinagre, A e B. Na análise, amostras
das duas marcas de vinagre foram tituladas com solução
aquosa de NaOH de mesma concentração. Os
resultados estão expressos no gráfico abaixo.
Vol. vinagre
A
76 - (Mackenzie SP)
Estudo realizado pela Faculdade de Odontologia da USP
de Bauru encontrou em águas engarrafadas,
comercializadas na cidade de São Paulo, níveis de flúor
acima do permitido pela lei.
Se consumido em grande quantidade, o flúor provoca
desde manchas até buracos nos dentes. A concentração
–
máxima de íons fluoreto na água para beber é de 4,2·10
5
mol/L,
quantidade
essa
que
corresponde
aproximadamente a
Dado: massa molar do flúor: 19 g/mol
–2
a) 4,2·10 mg/L.
–2
b) 2,2·10 mg/L.
–1
c) 1,6·10 mg/L.
–4
d) 1,9·10 mg/L.
–1
e) 8,0·10 mg/L.
77 - (Mackenzie SP)
As curvas de solubilidade têm grande importância no
estudo das soluções, já que a temperatura influi
decisivamente na solubilidade das substâncias.
Considerando as curvas de solubilidade dadas pelo
gráfico, é correto afirmar que
B
Vol. NaOH
Sabendo-se que o vinagre é uma solução aquosa de
ácido acético de concentração 4% a 6% em volume, a
análise do gráfico permite afirmar que
a) o vinagre A apresenta maior concentração do que o
B.
b) a reação que ocorre na titulação é uma reação de
síntese.
c) os vinagres A e B apresentam a mesma
concentração.
d) nos produtos da reação há formação de base e
água.
e) para o mesmo volume de vinagre, o B consume
mais base.
74 - (ESCS DF)
Durante a dosagem de uma determinada enzima, foi
necessário preparar uma solução adicionando 4 mL de
solução tampão a uma solução estoque com 0,005 mols
de piruvato de sódio dissolvidos previamente em 1 mL de
água destilada. A concentração de piruvato de sódio, em
mol/L, na solução final corresponde a:
a) 0,00022;
b) 0,001;
c) 0,022;
d) 1;
e) 10.
75 - (UFPR)
-1
Ao se misturar 100 mL de solução aquosa 0,15 mol.L
de cloreto de potássio com 150 mL de solução aquosa
-1
0,15 mol.L de cloreto de sódio, a solução resultante
apresentará,
respectivamente,
as
seguintes
+
+
concentrações de Na , K e Cl :
-1
-1
-1
a) 0,09 mol.L , 0,06 mol.L , 0,15 mol.L
-1
-1
-1
b) 0,05 mol.L , 0,06 mol.L , 1,1 mol.L
-1
-1
-1
c) 0,06 mol.L , 0,09 mol.L , 0,15 mol.L
-1
-1
-1
d) 0,09 mol.L , 0,09 mol.L , 0,09 mol.L
-1
-1
-1
e) 0,15 mol.L , 0,15 mol.L , 0,30 mol.L
a)
b)
c)
d)
e)
há um aumento da solubilidade do sulfato de cério
com o aumento da temperatura.
a 0ºC o nitrato de sódio é menos solúvel que o
cloreto de potássio.
o nitrato de sódio é a substância que apresenta a
maior solubilidade a 20ºC.
resfriando-se uma solução saturada de KClO3,
preparada com 100 g de água, de 90ºC para 20ºC,
observa-se a precipitação de 30 g desse sal.
dissolvendo-se 15 g de cloreto de potássio em 50 g
de água a 40ºC, obtém-se uma solução insaturada.
78 - (UNESP SP)
A quantidade máxima de soluto que pode ser dissolvida
numa quantidade padrão de solvente é denominada
Coeficiente de Solubilidade. Os valores dos Coeficientes
de Solubilidade do nitrato de potássio (KNO3) em função
da temperatura são mostrados na tabela.
Temperatura
Coeficiente de Solubilidade
(ºC)
(g de KNO3 por 100 g de H2O)
0
13,3
10
20,9
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
20
31,6
30
45,8
40
63,9
50
85,5
60
110,0
70
138,0
80
169,0
90
202,0
100
246,0
Considerando-se os dados disponíveis na tabela, a
quantidade mínima de água (H2O), a 30 ºC, necessária
para dissolver totalmente 6,87 g de KNO3 será de:
a) 15 g.
b) 10 g.
c) 7,5 g.
d) 3 g.
e) 1,5 g.
79 - (EFOA MG)
A concentração de íons fluoreto determinada em uma
–5
amostra de água para uso doméstico foi de 5,0 x 10
–1
mol L . Se uma pessoa tomou 2,0 L dessa água em um
dia, a massa de fluoreto, em gramas, que essa pessoa
ingeriu é igual a:
–3
a) 1,9 x 10
–4
b) 9,5 x 10
–5
c) 5,0 x 10
–4
d) 1,0 x 10
–5
e) 2,5 x 10
80 - (UFMA)
O dióxido de enxofre é considerado um dos maiores
poluentes industriais, e é adicionado freqüentemente em
sucos de frutas naturais, com a finalidade de eliminar
microorganismos e prevenir oxidações.
Assumindo que uma garrafa comum contém 500 mL de
-3
suco com um teor de 2,0 x 10 mol/L de SO2, qual a
massa de dióxido de enxofre no suco?
Dados: O=16u; S=32u
a) 64 mg
b) 1,0 g
c) 1,0 mg
d) 4,0 g
e) 4,0 mg
81 - (UFJF MG)
Para combater a dengue, as secretarias de saúde
recomendam que as pessoas reguem vasos de plantas
com uma solução de água sanitária. Um litro de água
sanitária contém 0,35 mol de hipoclorito de sódio
(NaClO). A porcentagem em massa de hipoclorito de
sódio na água sanitária, cuja densidade é 1,0 g/mL, é
aproximadamente:
a)
35,0.
b)
3,50.
c)
26,1.
d)
7,45.
e)
2,61.
82 - (UEG GO)
A água sanitária é um produto obtido pela diluição de
hipoclorito de sódio em água, numa proporção de 1 para
5 e estabilizado com cloreto de sódio (sal de cozinha).
Ela é conhecida, popularmente, pelas expressões: água
de lavadeira e cloro líquido, sendo comercializada junto
ao consumidor final, através de marcas que chegam a
definir o produto: Cândida, Globo, Q.Boa, etc. A água
sanitária contém entre 2,0% a 2,5% de cloro ativo e é
estável, no mínimo, por seis meses. Baseando-se nos
seus conhecimentos, marque a resposta CORRETA:
a)
b)
c)
d)
É de conhecimento popular que os recipientes que
armazenam a água sanitária são todos feitos de
materiais opacos, já que ela se decompõe quando há
incidência de luz diretamente na solução. Isso é
justificado pelo princípio fotoelétrico, o mesmo que
faz as portas automáticas abrirem quando uma
pessoa se aproxima.
Se fosse dissolvido 10 g de hipoclorito de sódio em
0,50 L de água, obter-se-ia uma solução com
concentração de 0,50 mol/L.
O cloro presente no hipoclorito de sódio apresenta
número de oxidação igual a +1.
NaClO4 representa a fórmula molecular do hipoclorito
de sódio.
83 - (UEL PR)
O cimento Portland apresenta composição predominante
de óxido de cálcio, além de sílica, alumina e óxido de
ferro. Em prédios construídos a beira mar, a maresia
provoca a substituição do hidróxido de cálcio por sulfato
de cálcio. O volume ocupado por 1 mol de CaSO 4 é 1,5
vezes maior que o volume ocupado por 1 mol de
Ca(OH)2.
Dados: Massas Molares: (g/mol) H = 1; O = 16; S = 32;
Ca = 40.
Solubilidade: (g/100 mL de água, 20º C ): CaSO4 = 0,
0021; Ca(OH)2 = 0, 173
Temperatura de fusão (º C): CaSO4 = 1460; Ca(OH)2 =
512
Com base no texto, nos dados e nos conhecimentos
sobre substâncias, analise as afirmativas.
I.
A densidade do CaSO4 (s) é 1,2 vezes menor que a
do Ca(OH)2 (s).
II. 136 g de CaSO4 (s) e 74 g de Ca(OH)2 (s)
apresentam igual número de átomos de cálcio.
III. À temperatura de 1000 ºC os estados físicos das
substâncias CaSO4 e Ca(OH)2 são iguais.
IV. 200 mL de soluções aquosas distintas, preparadas
dissolvendo-se 0, 1 g de CaSO4 (s) e 10 g de
Ca(OH)2 (s), à 20º C são saturadas.
Assinale a alternativa correta.
a) Somente as afirmativas I e II são corretas.
b) Somente as afirmativas II e IV são corretas.
c) Somente as afirmativas III e IV são corretas.
d) Somente as afirmativas I, II e III são corretas.
e) Somente as afirmativas I, III e IV são corretas.
84 - (UFOP MG)
Comprimidos de 0,10 g de permanganato de potássio
(KMnO4) são vendidos em farmácias para o tratamento
de erupções de pele causadas por doenças como a
catapora. Se um comprimido de KMnO4 for dissolvido
em 1,0 L de água, a concentração da solução resultante,
em mol/L, será:
-4
a) 6,3 x 10
-3
b) 1,3 x 10
-1
c) 1,0 x 10
2
d) 1,6 x 10
-1
e) 6,3 x 10
85 - (ITA SP)
Qual das substâncias abaixo (I a V), nas condições
ambiente e sob iluminação branca, terá uma tonalidade
mais intensa na sua cor?
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
_
_
_
H
H_
C __ C
__
_
__
__
_
C O
__ _
C C
H
H
IV. O _ C
_
_ _
F
__
_
_
_
_
_
_
_
H H H H H H
V. F_ C_ C_ C_ C_ C_ C_ F
H H H H H H
_
_
_
_
_
_
_
_ _
_
F
_
a)
b)
c)
d)
e)
_F
_
F
II.
_
O _ OH
C
H
_H
III.
_
H
H
N_
H H H
_
F
_
I.
88 - (UNESP SP)
Comparando-se os pontos de ebulição do éter dimetílico
(H3C–O–CH3) com o ponto de ebulição do álcool etílico
(H3C–CH2–OH), o éter dimetílico terá ponto de ebulição:
a) maior, porque apresenta forças de Van der Waals
entre suas moléculas.
b) maior, porque apresenta ligações de hidrogênio
entre suas moléculas.
c) menor, porque apresenta forças de Van der Waals
entre suas moléculas.
d) menor, porque apresenta ligações de hidrogênio
entre suas moléculas.
e) igual ao do álcool etílico, porque as duas
substâncias têm a mesma massa molar.
F
_
OH
_H
_
H
H
OH
H
I
II
III
IV
V
86 - (UFC CE)
Após a ingestão de bebidas alcoólicas destiladas,
uma das sensações do organismo humano é a
necessidade
de
saciar
a
sede,
uma
das
desagradáveis características da chamada “ressaca”.
Em parte, isto se deve ao elevado grau de
miscibilidade exotérmica do álcool etílico (C2H5OH)
em sistemas aquosos, que induz a desidratação do
organismo através da diurese.
Assinale a alternativa correta.
a) O processo de dissolução de C2H5OH em H2O
envolve a formação de ligações químicas O–O.
b) O calor liberado no processo descrito é resultante de
um fenômeno exclusivamente químico.
c) A elevada miscibilidade do C2H5OH em H2O é
atribuída à reação de desidratação do álcool.
d) A miscibilidade do C2H5OH em H2O é favorecida
pelas interações de hidrogênio.
e) A dissolução do álcool etílico em água ocorre
através da absorção de calor.
87 - (UFSCAR SP)
A sacarose (açúcar comum), cuja estrutura é mostrada
na figura, é um dissacarídeo constituído por uma unidade
de glicose ligada à frutose.
O
HO
HO
OH
HO
O
HO
HO
O
OH
OH
A solubilidade da sacarose em água deve-se:
a) ao rompimento da ligação entre as unidades de
glicose e frutose.
b) às ligações de hidrogênio resultantes da interação
da água com a sacarose.
c) às forças de van der Waals, resultantes da interação
da água com a unidade de glicose desmembrada.
d) às forças de dipolo-dipolo, resultantes da interação
da água com a unidade de frutose desmembrada.
e) às forças de natureza íon-dipolo, resultantes da
interação do dipolo da água com a sacarose.
89 - (UERJ)
Os motores dos carros a gasolina fabricados em nosso
país funcionam bem com uma mistura combustível
contendo 22% em volume de etanol. A adulteração por
adição de maior quantidade de álcool na mistura
ocasiona corrosão das peças e falhas no motor.
O teste de controle da quantidade de álcool na gasolina
vendida pelos postos autorizados é feito misturando-se
num frasco graduado e com tampa, 50mL da gasolina do
posto com 50mL de solução aquosa de cloreto de sódio.
Após agitação , esperam-se alguns minutos e observa-se
a separação das fases da mistura.
Num determinado posto, feito o teste, resultou que a fase
orgânica ocupou o volume de 39mL , e a fase aquosa
61mL, o que isentou o posto de multa.
Entre as alternativas abaixo, aquela que NÃO está de
acordo com o teste realizado é:
a) após agitação , o etanol ocupou totalmente a fase
orgânica.
b) a mistura água e gasolina pode ser separada por
decantação.
c) o etanol dissolve-se em gasolina devido às forças
intermoleculares de Van der Waals
d) o etanol dissolve-se em água devido a interações
por formação de pontes de hidrogênio
e) as pontes de hidrogênio são interações mais fortes
do que as forças intermoleculares de Van der Waals.
90 - (ITA SP)
Considere
as
afirmações
abaixo
relativas
a
hidrocarbonetos normais e saturados na temperatura de
o
25 C e pressão de 1 atm:
I. O estado físico mais estável de hidrocarbonetos
contendo de 1 a 4 átomos de carbono é o gasoso;
II. O estado físico mais estável de hidrocarbonetos
contendo de 5 a 12 átomos de carbono é o líquido;
III. O estado físico mais estável de hidrocarbonetos
contedo de 25 a 50 átomos de carbono é o sólido
cristalino;
IV. Hidrocarbonetos contendo de 25 a 50 átomos de
carbono são classificados como parafina;
V. Hidrocarbonetos contendo de 1000 a 3000 átomos
de carbono são classificados como polietileno.
Das afirmações feitas, estão CORRETAS:
a) penas I, II, IV e V
b) apenas I, II e V
c) apenas III, IV e V
d) apenas IV e V
e) todas
91 - (UEL PR)
O éter metílico e o álcool etílico apresentam a mesma
massa molecular, são formados pelo mesmo número de
átomos e também apresentam a mesma fórmula
molecular (C2H6O). Entretanto, as suas temperaturas de
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
ebulição são muito diferentes, isto é: éter metílico = –
25,0 °C e álcool etílico = 78,5 °C.
Assinale a alternativa que explica o fato do éter metílico
e o álcool etílico apresentarem diferenças na
temperatura de ebulição.
a) As moléculas do álcool etílico podem formar
interações do tipo pontes de hidrogênio entre si,
enquanto as moléculas do éter metílico não podem.
b) O álcool etílico contém água e portanto aumenta o
seu ponto de ebulição.
c) As moléculas do álcool etílico podem formar
interações fortes do tipo Van der Waals entre si,
enquanto as moléculas do éter metílico não podem.
d) As moléculas do álcool etílico podem formar
interações fortes do tipo forças de London entre si,
enquanto as moléculas do éter metílico não podem.
e) As moléculas do álcool etílico podem formar
interações fortes do tipo dipolos induzidos entre si,
enquanto as moléculas do éter metílico não podem.
92 - (UEL PR)
Analise a imagem
ciclodextrina.
a
seguir,
que
representa
a
Algumas substâncias, como as ciclodextrinas, estão
sendo utilizadas em formulações de produtos para a
pele, pois possibilitam a liberação do princípio ativo
“hóspede”, de forma gradual e controlada, maximizando
a sua biodisponibilidade. As ciclodextrinas são
oligossacarídeos cíclicos obtidos de fonte natural
vegetal, de formato toroesférico cilíndrico e apresentam a
superfície externa com característica polar e a cavidade
interna com característica apolar. Dentre as moléculas
representadas a seguir, a “hóspede” favorável a ocupar a
cavidade da ciclodextrina é:
p-xileno
a)
CH3
OH
93 - (ITA SP)
Assinale a alternativa ERRADA relativa à comparação
do ponto de ebulição de algumas substâncias orgânicas.
a) a etilamina tem ponto de ebulição maior que a do
éter metílico.
b) o n-butanol tem ponto de ebulição maior que o do
etanol.
c) o éter metílico tem ponto de ebulição maior que o do
etanol
d) o etanol tem ponto de ebulição maior que o do
etanal.
e) o butanol tem ponto de ebulição maior que o do éter
etílico
94 - (ITA SP)
Assinale a opção CORRETA em relação à comparação
das temperaturas de ebulição dos seguintes pares de
substâncias:
a) Éter dimetílico > etanol; propanona > ácido etanóico;
naftaleno < benzeno;
b) Éter dimetílico < etanol; propanona < ácido etanóico;
naftaleno > benzeno;
c) Éter dimetílico > etanol; propanona < ácido etanóico;
naftaleno > benzeno;
d) Éter dimetílico > etanol; propanona > ácido etanóico;
naftaleno > benzeno;
e) Éter dimetílico < etanol; propanona < ácido etanóico;
naftaleno < benzeno;
95 - (UERJ)
A sigla BTEX faz referência a uma mistura de
hidrocarbonetos
monoaromáticos,
poluentes
atmosféricos de elevada toxidade.
Considere a seguinte mistura BTEX:
Cl
H3C
c)
glicerol
H 2C
CH
CH 2
OH OH
OH
d)
b)
o-diclorobenzeno
Cl
e) resorcinol OH
ácido p-amino
benzóico
COOH
H 2N
Etilbenzeno
Xileno
Tolueno
Benzeno
Ao fim de um experimento para separar, por destilação
fracionada, essa mistura, foram obtidas três frações. A
primeira e a segunda frações continham um composto
distinto cada uma, e a terceira continha uma mistura dos
outros dois restantes.
Os compostos presentes na terceira fração são:
a) xileno e benzeno
b) benzeno e tolueno
c) etilbenzeno e xileno
d) tolueno e etilbenzeno
96 - (FUVEST SP)
Examinando-se as estruturas moleculares do álcool
benzílico e do tolueno,
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
CH2OH
CH3
Álcool
Benzílico
TEXTO: 1 - Comum à questão: 99
A fermentação da sacarose da cana-de-açúcar produz
etanol, que entre os combustíveis alternativos é o mais
viável do ponto de vista econômico e ambiental,
principalmente se comparado a combustíveis fósseis,
etanol obtido do milho e outros.
Estudos mostram que, para fornecer a mesma
quantidade de energia, no ciclo de produção e uso do
álcool obtido a partir da cana-de-açúcar, a massa de gás
carbônico liberada para a atmosfera é aproximadamente
dez vezes menor do que a emitida no ciclo de produção e
uso da gasolina. Dos 600 bilhões de litros de
combustível, utilizados em 2007 no mundo, 9% foram de
etanol, dos quais 39% foram produzidos pelo Brasil na
última safra.
Tolueno
pode-se afirmar corretamente que
a) o álcool benzílico deve ter ponto de ebulição maior
do que o tolueno, ambos sob mesma pressão.
b) o álcool benzílico deve ser menos solúvel em água
do que o tolueno, ambos à mesma temperatura.
c) o álcool benzílico e o tolueno, ambos à mesma
temperatura, têm a mesma pressão de vapor.
d) o álcool benzílico e o tolueno possuem moléculas
associadas por ligações de hidrogênio.
e) o álcool benzílico apresenta atividade óptica,
enquanto o tolueno não.
97 - (ITA SP)
Considere os seguintes álcoois:
I. Etanol
II. n-propanol
III. n-butanol
IV. n-pentanol
V. n-hexanol
Assinale a opção CORRETA em relação a comparação
das solubilidades em água, a 25ºC, dos seguintes
álcoois:
a) Etanol > n-propanol > n-butanol > n-pentanol >
n-hexanol.
b) Etanol n-propanol > n-butanol > n-pentanol >
n-hexanol.
c) Etanol n-propanol > n-butanol n-pentanol > nhexanol.
d) Etanol > n-propanol > n-butanol > n-pentanol <
n-hexanol.
e) Etanol < n-propanol < n-butanol < n-pentanol <
n-hexanol.
Revista Veja (adaptado)
Nota:
No ciclo do etanol, consideraram-se as seguintes etapas:
• plantação, crescimento e colheita da cana.
• fabricação do etanol e combustão em motores.
99 - (Mackenzie SP)
Do total de etanol produzido na última safra brasileira, 3
bilhões de litros foram exportados. Assim, para o
consumo
interno,
sobraram,
dessa
safra,
aproximadamente
14
a) 2,1·10 litros.
10
b) 1,8·10 litros.
10
c) 2,1·10 litros.
10
d) 5,1·10 litros.
11
e) 1,8·10 litros.
TEXTO: 2 - Comum à questão: 100
As mudanças de temperaturas provocadas pela chegada
de períodos frios ou chuvosos estão entre as principais
responsáveis pelo aumento do número de casos de
problemas respiratórios. E na mira dessas doenças estão
principalmente crianças e idosos. Atualmente o uso de
corticóides é considerado como um dos procedimentos
mais eficazes para o tratamento dessas doenças. Entre
os corticóides mais utilizados inclui-se o dipropionato de
beclometasona (DBec), que possui solubilidade em água
de aproximadamente 49,39 mg/L e sua estrutura
molecular está representada na figura abaixo.
98 - (FATEC SP)
O gráfico a seguir mostra a temperatura de ebulição à
pressão de 1 atm em função da massa molar de alguns
alcanos.
O
120 ( C)
90
60
30
0
-30
-60
-90
-120
-150
-180
0
20
O
O
H3C
CH3
CH3
HO
O
O
O
CH3
CH3
Cl
O
40
60
80
100 120
M g/mol
Com base nesse gráfico, pode-se prever que o ponto de
ebulição do butano, à pressão de 1 atm, é,
aproximadamente Massa molar (g/mol): C =12; H =1
o
a) 100 C
o
b) 69 C
o
c) 58 C
o
d) 0 C
o
e) 20 C
100 - (UEPB)
Julgue as afirmativas a seguir:
I. A ausência de elementos químicos tóxicos, como os
metais pesados, na estrutura da DBec, assegura
que esta
substância é inofensiva aos seres
humanos.
II. A substância DBec pode ser utilizada em
nebulizações por qualquer pessoa e em qualquer
quantidade, até mesmo sem prescrição médica,
devido a sua baixa solubilidade em água, único fator
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
determinante para a concentração desta substância
nos vapores expelidos.
III. A DBec possui em sua estrutura oxigênios de
grupos ésteres e álcoois. Estes grupos são os
principais responsáveis pela solubilidade desta
substância em água.
Está(ão) correta(s)
a) todas
b) I e II
c) II e III
d) I e III
e) apenas a III
GABARITO:
1) Gab: D
2) Gab: A
3) Gab: D
4) Gab: E
5) Gab: A
6) Gab: C
7) Gab: C
8) Gab: C
9) Gab: A
10) Gab: D
11) Gab: C
12) Gab: C
13) Gab: C
14) Gab: D
15) Gab: B
16) Gab: C
17) Gab: C
18) Gab: C
19) Gab: D
20) Gab: B
21) Gab: E
22) Gab: E
23) Gab: D
24) Gab: E
25) Gab: E
26) Gab: A
27) Gab: E
28) Gab: A
29) Gab: D
30) Gab: D
31) Gab: E
32) Gab: E
33) E
34) Gab: E
RESOLUÇÃO
I – Verdadeiro a baquelite é obtida na reação do fenol com o
metanal
II – Verdaeiro as tintas fenólicas são fabricadas com a
participação do fenol
III – Verdadeiro os fenóis têm ação antisséptico. Um produto que
pode ser citado são os cresolatos de sódio (creolina) que tem ação
bactericida.
IV – Verdadeiro o 2,4,6-trinitrofenol (ácido pícrico) tem ação
explosiva.
V – Verdadeiro
OH
OH
COOH
NaOH
CO2 ,H+
O
O - C-CH 3
HOOC
Anidrido
Acético
Aspirina
ácido acetilsalicílico
35) Gab: E
36) Gab: A
37) Gab: C
38) Gab: E
39) Gab: B
40) Gab: B
41) Gab: B
42) Gab: D
43) Gab: B
44) Gab: E
45) Gab: D
46) Gab: D
47) Gab: E
48) Gab: D
49) Gab: B
50) Gab: C
51) Gab: B
52) Gab: E
53) Gab: D
54) Gab: B
55) Gab: B
56) Gab: D
57) Gab: E
58) Gab: A
59) Gab: C
60) Gab: A
61) Gab: D
62) Gab: A
63) Gab: C
64) Gab: A
65) Gab: C
Justificativa:
Esta reação possui as seguintes semi-reações balanceadas:
(I) Cd(s) + 2 H2O(l) Cd(OH)2(s) + 2 H+(aq) + 2 e(II) NiO2(s) + 2 H+(aq) + 2 e- Ni(OH)2(s),
pois a variação do número de oxidação do cádmio é de 0 para +2
(perda de 2 elétrons), e a do níquel é de +4 para +2 (ganho de 2
elétrons). Logo, de acordo com a semi-reação (I), são produzidos 2
mols de elétrons por mol de cádmio consumido.
66) RESOLUÇÃO
Fe2(SO4)3 2Fe2+ + 3SO42- Cálculo da massa de Fe2+:
m1=mol . V . M m1= 20 . 10-3 . 56 . 0,5 m1= 0,56g Fe2+
- Cálculo da massa do sal:
400g Fe2(SO4)3------------------- 2.56g Fe2+
X--------------------- 0,56g Fe2+
X = 2g Fe2(SO4)3
67) Gab:C
RESOLUÇÃO
xOH + 3Cl2 5ClO3 + H2O
- Cloro varia por auto-oxi-redução
de zero------------------- para -1
de zero------------------- para +5
Lei das cargas:
-x = -6 x = 6
6OH- + 3Cl2 5ClO3- + 3H2O, como toda a hidroxila é proveniente
do NaOH e todo Cl- é proveniente do NaCl, temos:
6mols OH ----------------------- 5 mols Cl
X------------------------ 2,5 mols de ClX = 3mols de OH V = 1L
M = 3 mols/L
68) Gab: E
RESOLUÇÃO
H+ = 0,10 mol/L
Mg2+ = 0,15 mols/L
Fe3+ = 0,20 mols/L
SO42- = 0,20 mols/L
Cl- = X
- Pela lei das cargas, temos:
0,10 + 0,30 + 0,60 - 0,40 - X = 0 X = 0,60 mols/L
69) Gab: A
70) Gab: C
71) Gab: E
72) Gab: B
73) Gab: E
74) Gab: D
75) Gab: A
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
76) Gab: E
77) Gab: E
78) Gab: A
79) Gab: A
80) Gab: A
81) Gab: E
82) Gab: C
83) Gab: B
84) Gab: A
85) Gab: D
RESOLUÇÃO
Devido à presença de duplas ligações na forma conjugada.
86) Gab: D
87) Gab: B
88) Gab: C
89) Gab: A
90) GAB: E
RESOLUÇÃO
I-Verdadeiro são os componentes do gás natural, como o metano
e etano e o GLP (gás liquefeito do petróleo)
II - verdadiro com o aumento da massa molecular os
hidrocarbonetos aumentam o ponto de ebulição e se apresentam na
fase líquida
III-verdadeiro são sólidos e sob determinadas condições podem
constituir retículos cristalinos
IV- verdadeiro são formadores das ceras parafínicas ou
simplesmente parafinas, considerando que o temo seja empregado
apenas para designar o sólido industrialmente derivado do petróleo,
não se referindo à pouca reatividade dos alcanos como é de comum
uso.
V - verdadeiro os polietilenos são hidrocarbonetos saturados de
cadeia normal e contendo entorno de 1600 átomos de carbono sendo
derivados do etileno.
91) Gab: A
92) Gab: A
93) Gab: C
RESOLUÇÃO
Devido a presença de pontes de hidrogênio (ligações de hidrogênio)
entre as moléculas do etanol o seu ponto de ebulição será maior que
o do éter metílico que apresenta interações do tipo dipolo-dipolo.
94) Gab: B
RESOLUÇÃO:
Etanol Interações do tipo pontes de hidrogênio PE = (78,3ºC)
Éter dimetílicoInterações do tipo dipolo-dipolo PE = (-24,9ºC)
Propanona Interações do tipo dipolo-dipolo PE = (56ºC)
Ácido etanóicoInterações do tipo pontes de hidrogênio PE =
(118ºC)
Naftaleno Sofre sublimação com facilidade (PE = 217,9ºC)
Benzeno Não sofre sublimação com facilidade (PE = 80ºC)
95) Gab: C
96) Gab: A
Para moléculas de massas moleculares próximas, o ponto de
ebulição depende diretamente da intensidade da interação entre as
moléculas; como entre as moléculas de álcool benzílico ocorrem
atrações fortes por pontes de hidrogênio devido à
existência de ligação O — H muito polar, este terá um ponto de
ebulição superior ao do tolueno.
97) Gab: B
RESOLUÇÃO:
- Quanto mais polar for a cadeia, maior será a solubilidade do álcool
em água.
- O aumento da cadeia carbônica, aumenta a apolaridade da
molécula, logo, diminui a sua solubilidade.
- As solubilidade do Metanol, Etanol, e Propanol são infinitas em
água.
98) Gab: D
O butano (C4H10) possui massa molar igual a 58, logo, pelo gráfico,
seu ponto de ebulição à pressão de 1 atm é aproximadamente 0oC.
99) Gab: B
100) Gab: E
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br