Plano de Recuperação Ensino Médio – 2° ano UNIDADE PARQUE
Série
Disciplina
Professor
2
ano
Biologia
Wildner
Conteúdos da
prova
00 a 8,0 pontos
Escala
evolutiva seres
vivos
primitivos
protozoários e
invertebrados
primitivos
ciclos da
matéria
Trabalho 00 a 2,0 pontos
Pesquise as características evolutivas que diferenciaram os
invertebrados primitivos celenterados platelmintos nematelmintos e
anelídeos. O trabalho deverá ser digitado, norma ABNT, índice,
capa, referencia bibliográfica, conclusão.
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
1A2AP
Espanhol
Conteúdo
Pretérito indefinido regular;
Pretérito imperfecto regular;
Presente de indicativo
irregular;
Pretérito pluscuamperfecto;
.Verbos irregulares en
presente de indicativo,
pretérito indefinido irregular e
regular ;
Confección de una
muestra cultural
Pesquisar cinco danças
Latino- Americanas ou
espanholas..O trabalho
deve conter informações,
fotos, ilustrações,
vestuário e canções.
Entregar o trabalho de
acordo com as normas
da ABNTem espanhol no
dia da prova de
recuperação.
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
• Teoria Política
Filosofia
DISCIPLINA
Nilson
NOME DO
PROFESSOR
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
PESQUISA:
• Ação Social - Max Weber
Filosofia
Nilson
• Movimentos estudantis de 1968 e os cara pintadas de
1992
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
Geografia
DISCIPLINA
Geografia
NOME DO
PROFESSOR
Danilo
Rocha
NOME DO
PROFESSOR
Danilo
Rocha
CONTEÚDO:
- Urbanização e conceitos
- Estrutura da população
- EUA
- Japão
TRABALHO DE RECUPERAÇÃO:
- Teorias demográficas
Aplicar normas da ABNT
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
NOME
DPROFESSO
R
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Ap.1 – Advento da República no Brasil;
Brasil Republicano
História
Nilson
Ap.2 – Paz Armada;
Primeira Guerra Mundial;
Getúlio Vargas
Ap.3 - Período Entreguerras;
Crise de 1929 e Grande Depressão;
Nazifascismo
DISCIPLINA
NOME DO
PROFESSOR
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
PESQUISA:
História
Nilson
• Neocolonialismo (Imperialismo)
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
NOME DE
PROFESSOR
Inglês
Klésia
DISCIPLINA
NOME DO
PROFESSOR
Inglês
Klésia
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Present Perfect
Past Perfect
Simple Past
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
Fazer uma pesquisa manuscrita do conteúdo acima.
Contendo, capa impressa e conteúdo totalmente manuscrito
com a bibliografia
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
CONTEÚDO:
Parnasianismo;
Simbolismo;
Português
Marcia
Pré- Modernismo;
Correntes de vanguarda europeia;
Semana de Arte Moderna.
DISCIPLINA
NOME DO
PROFESSOR
Português
Marcia
TRABALHO DE RECUPERAÇÃO:
Copiar e responder exercícios adicionais (parte A – literatura )
das apostilas 1,2,3,e 4
MANUSCRITO , com capa em folha de almaço
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
Série
Disciplina
Professor
2º
ano
Química
Wanderlei
A. Pirolo
Conteúdos da prova
00 a 8,0 pontos
Módulo 1:
Aula 1: reações Endotérmicas e Exotérmicas;Pag:
275
Aula 2 e 3: Calores de Reações Entalpia (ΔH);Pag:
(
278
Aula 4 e 5: Lei de Hess;Pag: 281
Aula 6: Energias de ligação; 283
Aula 7, 8 e 9: Velocidade de uma reação Química (
Lei das velocidades);Pag:302
Aula 10: Teoria das colisões e energia de
Ativação;Pag:306
Aula 11 e 12: Fatores que afetam a velocidade da
reação química;Pag:308
Aula 15 e 16: Introdução a Química
Orgânica;Pag:Pag:331
Aula 17 e 18: Classificação de cadeias
carbônicas;Pag:333
Módulo 2:
Aula 19, 20 e 21: Reações reversíveis e irreversíveis
(KC);Pag:206
Aula 22,23 e 24: Constante Equilíbrio (KP);Pag: 209
Aula 25 e 26: Princípio
Princípi de Le ChatelierDeslocamento de equilíbrio;Pag: 212
Aula 27: Introdução à nomenclatura e formulação de
compostos orgânicos.Pag:228
Aula 28 e 29: Nomenclatura de hidrocarbonetos
insaturados normaise ramificados;Pag: 230
Aula 30: Nomenclatura de Hidrocarbonetos
Hidrocarb
aromáticos;Pag:232
Trabalho 00 a 2,0 pontos
Trabalho será lista de exercícios
do conteúdo selecionado
selecionado.
Anexo.
TRABALHO DE RECUPERAÇÃO SEMESTRAL DE QUÍMICA
Lista de exercícios de Química 2º ano E.M.
NOME: ______________________________________________________________________
TURMA: 2 Ano E.M.
Nº___________
___________
TRABALHO DE: _Química
PROFESSOR: _Wanderlei
rlei A. Pirolo_
1º SE
SEMESTRE
NOTA: ________
LEIA ATENTAMENTE AS INSTRUÇÕES:
1. Preencha corretamente o cabeçalho com caneta. Na falta do mesmo a prova será cancelada.
2. Este trabalho tem o valor de zero até dois pontos.
3. A resposta final deverá ser à tinta esferográfica azul ou preta.
4. Resolução obrigatória das questões dissertativas.
5. Registro obrigatório do
o raciocínio lógico matemático nos testes que apresentam cálculos para chegar à alternativa correta.
6. Esta lista de exercícios traz a base para elaboração da prova de recuperação semestral.
Módulo -1
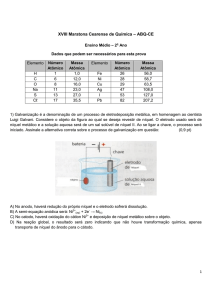
1) Observando o diagrama a seguir, é correto afirmar que: [Dadas as massas molares (g/mol):
H = 1 e O = 16]
a) para vaporizar 18 g de água são liberados 10,5 kcal.
b) o calor de reação, na síntese da água líquida, é igual ao da água gasosa.
c) a entalpia para a vaporização de 36 g de água líquida é + 21 kcal.
d) a síntese da água gasosa libera mais calor que a da água líquida.
e) o ∆H na síntese de 1 mol de água gasosa é igual a -126,1 kcal/mol
2) Reações em que a energia dos reagentes é inferior à dos produtos, à mesma temperatura,
são:
a) endotérmicas.
b) lentas.
c) espontâneas.
d) catalisadas.
e) explosivas.
3) Em um texto encontramos a seguinte frase: “Quando a água funde, ocorre uma reação
exotérmica”. Na frase há:
a) apenas um erro, porque a água não funde.
b) apenas um erro, porque a reação quími
química
ca é endotérmica. c) apenas um erro, porque não se
trata de reação química mas de processo físico.
d) dois erros, porque não se trata de reação química nem o processo físico é exotérmico.
e) três erros, porque a água não sofre fusão, não ocorre reação qu
química
ímica e o processo físico é
endotérmico.
4) A reação 2 CO2→ 2 CO + O2 apresenta ∆H positivo. Assim, pode-se
se afirmar que essa
reação:
a) ocorre com contração de volume.
b) libera energia térmica.
c) é catalisada.
d) é endotérmica.
e) é espontânea.
5)) Os maçaricos são empregados na obtenção de temperaturas elevadas por meio de reações
de combustão. Sabendo-se que:
∆H de formação do CO2 = - 94 kcal/mol
∆H de formação do H2O = - 68 kcal/mol
∆H de formação do CH4 = - 18 kcal/mol
∆H de formação do C2H2 = + 54 kcal/mol
e dispondo-se
se de mesmo número de mols de C2H2 e de CH4, assinale a alternativa que indica
corretamente qual dessas substâncias deverá ser empregada em um maçarico para se obter
maior quantidade de calor e quais os valores de ∆H de combustão do C2H2 e do CH4.
6) Sejam os dados abaixo:
I) Entalpia de formação da H2O(ℓ) = - 68 kcal/mol
II) Entalpia de formação do CO2(g) = - 94 kcal/mol
III) Entalpia de combustão do C2H5OH(ℓ) = - 327 kcal/mol Calcule a entalpia de formação do
etanol e assinale a alternativa correta.
a) 15,5 kcal/mol
b) 3,5 kcal/mol
c) - 28 kcal/mol
d) - 45 kcal/mol
e) - 65 kcal/mol
7) Sendo o ΔH de formação
ção do óxido de cobre II igual a
–37,6 kcal/mol e o ΔH de formação
ção do óxido de cobre I igual a –40,4
40,4 kcal/mol, o ΔH da
reação:
Cu2O(s) + 1/2 O2(g) 2 CuO(s), será:
a) –34,8 kcal.
b) –115,6 kcal.
c) –5,6 kcal.
d) +115,6 kcal.
e) +34,8 kcal.
8) Considere as seguintes equações termoquímicas:
9) O dióxido de carbono pode ser obtido por diferentes reações, três das quais estão expressas
nas equações:
O calor de formação (∆Hf)
∆Hf) do dióxido de carbono é determinado pela variação
variação de entalpia:
a) da reação 1.
b) da reação 2.
c) da reação 3.
d) de qualquer uma das três reações.
e) de uma outra reação diferente de 1, 2 e 3.
10) São dadas as seguintes variações de entalpia de combustão.
C(s) + O2(g) CO2(g) H1= – 94,0 kcal H2(g) + ½ O2(g) H2O(
O(ℓ)
H2 = – 68,0 kcal
CH4(g) + 2 O2(g) CO2 + 2H2O(
O(ℓ) H3 = – 212,0 kcal
Considerando a formação do metano, segundo a equação:
C(s) + 2 H2(g) CH4(g)
Calcule a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de
metano, e assinale a alternativa correta:
a) 442
b) 50
c) 18
d) 254
e) 348
11) São dadas as equações termoquímicas a 25 °C e 1 atm:
a) Aplique a lei de Hess para a determinação do H
H da reação de hidrogenação do acetileno,
de acordo com a equação: C2H2(g) +2 H2(g) C2H6(g)
b) Calcule H
H da reação de hidrogenação do acetileno
12) A fermentação que produz o álcool das bebidas alcoólicas é uma reação exotérmica
representada pela equação:
Considerando-se
se as equações que representam as combustões da glicose e do etanol:
Calcule o valor de x em kJ/mol de glicose e assinale a alternativa correta:
a) 140
b) 280
c) 1490
d) 4330
e) 5540
13) O metanol, um combustível líquido, tem sido utilizado como substituto da gasolina, e
pode ser produzido
duzido a partir do metano, conforme a reação representada a seguir:
a) Calcule a variação de entalpia (
H°) da reação I, a partir dos dados fornecidos.
b) Determine o calor liberado na reação III, quando 280 gramas de monóxido de carbono são
consumidos.
14) Sejam as seguintes afirmações, que representam consequências importantes da lei de
Hess:
I) Invertendo-se
se uma equação termoquímica, o calor ou a entalpia de reação permanecerá
inalterado.
II) Multiplicando-se ou dividindo-se uma equação termoquímica, o calor da reação permanece
inalterado.
III) Podemos somar algebricamente equações termoquímicas.
a) Nenhuma é correta
b) Todas são corretas
c) Somente I é correta
d) Somente II é correta
e) Somente III é correta
15) De acordo com os seguintes dados:
Calcule , aproximadamente, a energia necessária para decompor 1 mol de hidrazina (H2N–
NH2) em seus átomos constituintes e assinale a alternativa correta.
a) 39 kcal b) 93 kcal c) 132 kcal d) 411 kcal e) 450 kcal
16) Calcule a variação de entalpia na reação:
Conhecendo-se
se as seguintes energias de ligação todas nas mesmas condições de pressão e
temperatura:
E assinale a alternativa correta.
a) –149,2 kcal
b) –19,6 kcal
c) +145,3 kcal
d) +232,7 kcal
e) +19,6 kcal
17) Com base nos dados da tabela:
Calcule o ∆H da reação
ão representada por:
Dado em kJ por mol de H2O(g), e assinale a alternativa correta.
a) + 239.
b) + 478.
c) + 1 101.
d) – 239.
e) – 478.
Cinética Química
variação na concentração de X, em função do tempo, é:
18) Seja a reação: X → Y + Z. A variação
Calcule a velocidade média da reação, no intervalo de 2 a 5 minutos, e assinale a alternativa
correta.
a) 0,3 mol/L·min
b) 0,1 mol/L·min
c) 0,5 mol/L·min
d) 1,0 mol/L·min
e) 2,0 mol/L·min
19) A destruição da camada de ozônio pode, simplificadamente, ser representada pela
equação química:
O3(g) + O(g) → 2 O2(g).
Com base nessa equação, a velocidade de aparecimento do oxigênio
oxig
molecular é:
a) o dobro da velocidade de desaparecimento do ozônio.
b) o triplo da velocidade de desaparecimento do ozônio.
c) igual à velocidade de desaparecimento do ozônio.
d) a metade da velocidade de desaparecimento do ozônio. e) um terço da velocidade de
desaparecimento do ozônio.
20) Dado o gráfico da concentração em mol/L de uma reação irreversível em função do tempo
(minutos) das substâncias X, Y e Z.
A equação balanceada que representa a reação do gráfico é:
a) Y + Z 2X
b) 2X Y + Z
c) X 2Y + 2Z
d) 2X 2Y + Z
e) 2Y + Z 2X
21) Não se observa reação química visível com a simples mistura de vapor de gasolina e ar
atmosférico à pressão e temperatura ambientes, porque
a) a gasolina não reage com o oxigênio à pressão ambiente.
b) para que a reação seja iniciada, é necessário o fornecimento de energia adicional aos
reagentes.
c) a reação só ocorre na presença de catalisadores heterogêneos.
d) o nitrogênio do ar, por estar presente em maior
maior quantidade no ar e ser pouco reativo, inibe a
reação.
e) a reação é endotérmica.
22) Um palito de fósforo não se acende, espontaneamente, enquanto está guardado. Porém,
basta um ligeiro atrito com uma superfície áspera para que ele imediatamente ent
entre
re em
combustão, com emissão de luz e calor. Considerando-se
Considerando se essas observações, é correto afirmar
que a reação:
a) é endotérmica e tem energia de ativação maior que a energia fornecida pelo atrito.
b) é endotérmica e tem energia de ativação menor que a energia fornecida pelo atrito.
c) é exotérmica e tem energia de ativação maior que a energia fornecida pelo atrito.
d) é exotérmica e tem energia de ativação menor que a energia fornecida pelo atrito.
23) Observe o diagrama e os dados abaixo a 298 k.
Dados:
HCA = -170 kcal
HR = -200 kcal
HP = -300 kcal
CA → complexo ativado Calcule:
a) o ∆H da reação a 298 k;
b) a energia de ativação na mesma temperatura.
c) a Energia de ativação do processo.
24) Dados os gráficos representativos do
d caminho das reações (C.R.):
a) Explique qual das reações exige maior energia de ativação (E).
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
_______________________________
___________________________________________________________________________
____________________________________________
___________________________________________________________________________
___________________________________________________________________________
__________________________________________________________________________
b) Qual das reações é, provavelmente, a mais rápida?
___________________________________________________________________________
_____________________________________________________________________
__________________________________________________________________
___________________________________________________________________________
____________________________________________
__________________________________________________________________
______________________
25) Considere o gráfico abaixo, referente ao diagrama energético da reação:
N2(g) + 3 H2(g) → 2 NH3(g) sob a ação de um catalisador.
A seguir, responda:
a) A reação inversa do processo é endotérmica ou exotérmica? Justifique.
b) Calcule a energia de ativação (Ea) da reação sem catalisador. Dados
c) Calcule a energia de ativação com catalisador (Ea/cat) da reação.
d) Explique o efeito provocado no processo pela presença do catalisador na reação.
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
_______________________________
_________________________________
Classifique as alternativas como verdadeiras (V) ou falsas(F):
( ) A reação é exotérmica, pois apresenta ∆H = -22
22 kcal. ( ) A energia de ativação da
reação sem catalisador é igual a 80 kcal.
( ) A energia de ativação da reação com catalisa
catalisador é igual a 39 kcal.
( ) A presença do catalisador diminuiu o valor de ∆H da reação de zero para - 22 kcal.
( ) Nas condições-padrão,
padrão, a entalpia de formação do gás amoníaco (NH3) é igual a -11
kcal/mol de NH3.
26) Com relação a um fogão de cozinh
cozinha,
a, que utiliza mistura de hidrocarbonetos gasosos como
combustível, é correto afirmar que:
a) a chama se mantém acesa, pois o valor da energia de ativação para ocorrência da
combustão é maior que o valor relativo ao calor liberado.
b) a reação de combustão
ão do gás é um processo endotérmico.
c) a entalpia dos produtos é maior que a entalpia dos reagentes na combustão dos gases.
d) a energia das ligações quebradas na combustão é maior que a energia das ligações
formadas.
e) se utiliza um fósforo para acender
acender o fogo, pois sua chama fornece energia de ativação para
a ocorrência da combustão.
27) A velocidade de uma reação química depende:
I. do número de colisões entre as moléculas na unidade de tempo.
II. da energia cinética das moléculas envolvidas na re
reação.
ação. III. da orientação das moléculas.
Estão corretas as alternativas:
a) I, II e III
b) somente I
c) somente II
d) somente I e II
e) somente I e III
28) No diagrama abaixo estão representados os caminhos de uma reação na presença e na
ausência de um catalisador. Com base neste diagrama, é correto afirmar que:
(01) A curva II refere-se
se à relação catalisada e a curva I refere-se
refere se à reação não catalisada.
(02) Se a reação se processar pelo caminho II, ela será mais rápida.
(04) A adição de um catalisador
alisador à reação diminui seu valor de ∆H.
(08) O complexo ativado da curva I apresenta a mesma energia do complexo ativado da curva
II.
(16) A adição do catalisador transforma a reação endotérmica em exotérmica.
Somatória das alternativas corretas: _________________
___
29) "Nas madeireiras, o pó de madeira (serragem) pode ser queimado por uma faísca ou
chama e produzir incêndios de proporções incalculáveis."
a) Quais os fatores que têm influência na velocidade da reação que justificam a afirmação
acima? Justifique.
___________________________________________________________________________
_______________________________________________________________________
___________________________________________________________________________
__________________________________
_______________________________________________________________________
_________________________________________
_____________________________________
___________________________________________________________________________
__________
30) Na preparação de hidrogênio, realizaram-se
realizaram se cinco experiências entre magnésio e ácido
clorídrico,
o, nas condições abaixo especificadas. Escolha a alternativa correspondente à reação
com maior velocidade.
31) Num laboratório foram efetuadas diversas experiências para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
Com os resultados das velocidades iniciais obtidos, montou-se
montou a seguinte tabela:
Baseando-se
se na tabela anterior, calcule a ordem de reação de cada componente e escreva a
equação da lei de velocidade para a reação:
Assinale a alternativa correta.
a) v = K · [H2]
b) v = K · [NO]
c) v = K · [H2] · [NO]
d) v = K · [H2] 2 · [NO]
e) v = K · [H2] · [NO]2
Equilíbrio químico.
32) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e
reagentes:
a equação química que pode ser representada por essa expressão é:
a) 2 NO2(g) ⇌ 2 NO(g) + O2(g)
b) 2 NO(g) + O2(g) ⇌ 2 NO2(g)
c) NO2(g) ⇌ 2 NO(g) + O2(g)
d) 2 NO2(g) ⇌ NO(g) + O(g)
e) NO(g) + O2(g) ⇌ 2 NO2(g)
33) O gráfico a seguir representa a evolução de um sistema em que uma reação reversível
ocorre até atingir o equilíbrio.
Sobre o ponto t1, neste gráfico, pode
pode-se afirmar que indica:
a) uma situação anterior ao equilíbrio, pois as velocidades das reações
reações direta e inversa são
iguais.
b) um instante no qual o sistema já alcançou equilíbrio.
c) uma situação na qual as concentrações de reagentes e produtos são necessariamente iguais.
d) uma situação anterior ao equilíbrio, pois a velocidade da reação direta
direta está diminuindo e a
velocidade da reação inversa está aumentando.
e) um instante no qual o produto das concentrações dos reagentes é igual ao produto das
concentrações dos produtos.
34) Com relação ao equilíbrio químico, afirma
afirma-se:
I. O equilíbrio químico
uímico só pode ser atingido em sistema fechado (onde não há troca de matéria
com o meio ambiente).
II. Num equilíbrio químico, as propriedades macroscópicas do sistema (concentração,
densidade, massa e cor) permanecem constantes.
III. Num equilíbrio químico,
co, as propriedades microscópicas do sistema (colisões entre as
moléculas, formação de complexos ativados e transformações de umas substâncias em outras)
permanecem em evolução, pois o equilíbrio é dinâmico.
É (são) correta(s) a(s) afirmação(ões):
a) Somente I e II.
b) Somente I e III.
c) Somente II e III.
d) Somente I.
e) I, II e III.
35) Sabendo-se que Kc = 69 para a reação:
N2 + 3 H2 ⇌ 2 NH3
a 500°C e que a análise de um recipiente de 7 L mostrou que a 500°C se encontravam
presentes, no estado de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amônia, então o
número de mols de nitrogênio presentes no recipiente é:
a) 0,144
b) 0,288
c) 0,414
d) 0,510
e) 0,653
36) Para a reação 3 H2(g) + N2(g) ⇌ 2 NH3(g), as pressões parciais de H2 e N2 no equilíbrio
são, respectivamente, 0,400 e 0,800 atm. A pressão total do sistema é 2,80 atm. Qual é o valor
de Kp quando as pressões são dadas em atmosferas?
a) 1,00
b) 3,13
c) 5,00
d) 50,0
e) 153,0
37) Escreva as constantes de equilíbrio Kc e Kp para cada um dos sistema sem equilíbrio:
a) H2(g) + I2(g) ⇌ 2 HI(g)
Kc = ______________________
Kp = ______________________
b) 2 SO2(g) + O2(g) ⇌ 2 SO3(g)
Kc = ______________________
Kp = ______________________
c) NH4OCONH2(s) ⇌ 2 NH3(g) + CO2(g)
Kc = ______________________
Kp = ______________________
38) O Prêmio Nobel de Medicina de 1988 foi concedido a três pesquisadores que mostraram a
ação do óxido nítrico (NO) no organismo humano. Ele é formado pela decomposição do
trióxido de nitrogênio, conforme o seguinte equilíbrio:
N2O3(g) ⇌ NO2(g) + NO(g)
Sobre esta reação afirma-se o seguinte:
I. O aumento da pressão desloca o equilíbrio para a esquerda.
II. O aumento da concentração de NO desloca o equilíbrio para a esquerda.
III. O aumento da pressão não altera o equilíbrio.
IV. O aumento da pressão desloca o equilíbrio para a direita. Assinale a alternativa correta.
a) Somente I está correta.
b) Somente I e II estão corretas.
c) Somente II está correta.
d) Somente III está correta.
e) Somente III e IV estão corretas
39) Indique em qual das reações abaixo o aumento de pressão deslocará o equilíbrio para a
direita:
1. 2 H2(g) + O2(g) ⇌ 2 H2O(g)
2. NH3(g) + HCℓ(g) ⇌ NH4Cℓ(s)
3. CaCO3(s) ⇌ CaO(s) + CO2(g)
a) 1, 2, 3
b) 1, 2
c) 1, 3
d) 2, 3
e) Todas as reações estarão deslocadas à esquerda.
Justifique a sua escolha.
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
40) O equilíbrio gasoso representado pela equação:
N2 + O2 ⇌ 2 NO ∆H =+ 88kJ
Sobre o sistema em equilíbrio, dê o sentido (direita / esquerda) ocorrerá o deslocamento do
equilíbrio causado por:
a) aumento
nto da temperatura: (sentido) ________________
b) diminuição da pressão: (sentido) __________________
c) aumento da concentração de O2 : (sentido) ___________
d) a retirada de NO : (sentido) ___________________
e) Explique qual a consequência da adição de um catalizador no sistema em equilíbrio em
relação às concentrações dos gases oxigênio e nitrogênio representado pelo sistema em
equilíbrio acima.
______________________________________________________________
___________________________________________________________________________
_____________
___________________________________________________________________________
___________________________________________________________________________
_________________________________________________________
Química Orgânica:
41) O inseticida dicloro-difenil-tricloroetano
tricloroetano (DDT), cuja fórmula estrutural é apresenta:
a) três carbonos terciários.
b) somente carbonos secundários.
c) um carbono quaternário.
d) somente carbonos primários.
e) somente um carbono terciário
42) Na fórmula do veronal
onal abaixo (um barbitúrico), os números de carbonos primários,
secundários, terciários e quaternários são, respectivamente:
a) 5, 2, 0, 1
b) 4, 2, 0, 1
c) 4, 2, 1, 1
d) 2, 2, 2, 1
e) 3, 4, 0, 0
43) O composto de fórmula estrutural:
apresenta compostos primários, secundários, terciários e quaternários, respectivamente:
a) 7, 3, 1, 1
d) 5, 4, 1, 1
b) 7, 4, 1, 1
e) 7, 4, 1, 3
c) 6, 3, 1, 1
44) Classifique as cadeias carbônicas segundos os critérios:
critérios: normal, ramificada, saturada,
insaturada, homogênea e heterogênea.
45) A cadeia carbônica abaixo é:
a) aberta, normal, insaturada e homogênea.
b) alifática, ramificada, insaturada e homogênea.
c) acíclica, ramificada, insaturada e heterogênea.
d) alifática, ramificada, saturada e homogênea.
e) fechada, ramificada, insaturada e homogênea.
46) O citral, composto de fórmula: tem forte sabor de limão e é empregado em alimentos para
dar sabor e aroma
oma cítricos. Sua cadeia carbônica é classificada como:
a) homogênea, insaturada e ramificada.
b) homogênea, saturada e normal.
c) homogênea, insaturada e aromática.
d) heterogênea, insaturada e ramificada.
e) heterogênea, saturada e aromática.
47)
7) O octano é um dos principais constituintes da gasolina, que é uma mistura de
hidrocarbonetos. Faça a fórmula estrutural e a molecular do octano:
48) Escreva o nome oficial dos hidrocarbonetos normais:
49) Escreva o nome oficial dos hidrocarbonetos normais circulando e numerando os carbonos
da cadeia principal:
50) Faça a formula estrutural palna dos hidrocarbonetos ramificados a partir de seus nomes
oficiais:
a) 3-isopropil-2-metilpentano.
b) 2-isopropil-2,4-dimetilbutano.
c) 2,3,3-trimetilexano.
d) 2,2,4-trimetilpentano.
e) 3,3-dimetil-5-metilpentano.
Bom Trabalho!
Prof.: Wanderlei A. Pirollo
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
TÉCNICA
DE
REDAÇÃO
DISCIPLINA
NOME DO
PROFESSOR
Fátima Rex
CONTEÚDO DA PROVA
Leitura e interpretação de textos em gêneros diversos;
Tipos textuais: apostila 1
Técnicas de introdução do texto dissertativo
dissertativo- tipos de
parágrafos introdutórios (5) : apostila 3
TRABALHO DE RECUPERAÇÃO:: (2,0)
NOME DO
PROFESSOR
TÉCNICA
DE
REDAÇÃO
(8,0)
Fátima Rex
Atividade de “ Atualidades”- capa, atualidade grifada e
produção de um texto dissertativo com o tema da
atualidade lida;
Pesquisa com os cinco tipos de parágrafos introdutórios
introdutóriosdefinição e dois exemplos de cada um deles.
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
NOME DO
PROFESSOR
Matemática
Rodrigo
DISCIPLINA
NOME DO
PROFESSOR
Matemática Rodrigo
CONTEÚDO DA PROVA
(8,0)
Trigonometria , matrizes e sistemas lineares
TRABALHO DE RECUPERAÇÃO:: (2,0)
ANEXO
Atividade de Recuperação de Matemática
2º ano - ENSINO MÉDIO
NOME: __________________________________
_________________________________ TURMA: ___________________
1) Determine os valores de x, y,
y w e z em cada caso:
2) Em um triângulo retângulo, determine as medidas dos ângulos agudos e da
hipotenusa, sabendo que um dos catetos mede 3 cm e o outro mede √3 cm.
3) (Cesgranrio) Uma rampa plana, de 36 m de comprimento, faz ângulo de 30° com
o plano horizontal. Uma pessoa que sobe a rampa inteira eleva-se
eleva se verticalmente de:
4) (UFAM) Se um cateto e a hipotenusa de um triângulo retângulo medem 2a e 4a,
respectivamente, então a tangente do ângulo oposto ao menor lado é:
5) Demonstre que o triângulo de vértices A(8 , 2), B(3 , 7) e C(2 , 1) é isósceles. Em
seguida, calcule seu perímetro.
6) Quais são os possíveis valores de c para que os pontos (c , 3), (2 , c) e (14, -3)
sejam colineares?
7) . Determine o valor de x para que o ponto M(2 , 3) seja o ponto médio do
segmento de extremos A(x , 5) e B(3 , x).
8) Se (m+2n , m – 4) e (2 – m , 2n) representam o mesmo ponto do plano cartesiano,
então mn é igual a:
9) Num sistema de coordenadas cartesianas são dados os pontos A(0 , 0) e P(3 , h).
Assinale a alternativa cuja expressão representa a distância do ponto P ao ponto A
em função de h.
10) Dadas as matrizes
,
determine a matriz D resultante da operação A + B – C.
e
,
11) Os elementos de uma matriz M quadrada de ordem 3 x 3 são dados por aij,
onde:
i + j, se i ≠ j
0, se i = j
Determine M + M.
12) (PUC–SP–Adaptada) São dadas as matrizes A = (aij) e B = (bij), quadradas de
ordem 2, com aij = 3i + 4j e bij = – 4i – 3j. Considerando C = A + B, calcule a matriz
C.
13) Seja A = (aij)3x3, com aij = i + j, e B = (bij)3x3, com bij = j – i, determine a matriz C,
tal que C = A.B.
14) (UFU) Considere a matriz
a) A6
b) A8
c) A10
d) A5
. Então A4 + 2A3 + 4A2 + 8A é igual a:
15) Resolver o sistema abaixo pela Regra de Cramer.
16) Resolver o sistema abaixo pela Regra de Cramer.
17) Calcular a característica da matriz abaixo e calcule:
18) O sistema abaixo:
a) só apresenta a solução trivial;
b) é possível e determinado não tendo solução trivial;
c) é possível e indeterminado;
d) é impossível;
e) admite a solução (1; 2; 1)
19) Escalonar e resolver os sistemas abaixo:
a)
b)
Plano de Recuperação
ecuperação Ensino Médio – 2° ANO UNIDADE PARQUE
DISCIPLINA
Educação
Física
NOME DO
PROFESSOR
Jorge Keinti
Fugita
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 0 a 10.0 pontos
Os trabalhos podem ser digitados ou manuscritos.
O trabalho que não tiver uma fonte de pesquisa confiável
(exemplo WIKIPÉDIA) ou trabalhos iguais, serão
desconsiderados.
O TRABALHO DEVE CONTER: CAPA,INTRODUÇÃO,
ÍNDICE,BIBLIOGRAFIA,CONCLUSÃO.
Temas :
Benefícios e Importância da Atividade Física Durante a
Vida (Infância,Adolescência,Fase Adulta e Melhor Idade).
Doping no Esporte.
Projeto de Recuperação Ensino Médio
UNIDADE PARQUE
TURMA:2º ano
DISCIPLINA
NOME DO
PROFESSOR
Física
Fernanda
DISCIPLINA
NOME DO
PROFESSOR
Física
Fernanda
CONTEÚDO A SER ESTUDADO PARA AVALIAÇÃO
Valor da avaliação: de 00 a 8.0 pontos.
Apostila 1: Aulas 1 a 10
Apostila 2: Aulas 19 a 25
Apostila 3: Aulas 31 a 37
TRABALHO DE RECUPERAÇÃO
Valor do Trabalho: de 00 a 2.0 pontos.
Fazer resumo dos conteúdos:
Apostila 1: Aulas 1 a 10
Apostila 2: Aulas 19 a 25
Apostila 3: Aulas 31 a 37
O trabalho deverá ser manuscrito