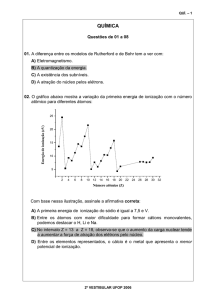
QUÍMICA
UERGS/2006 (FFFCMPA)
PROFESSOR ARAUJO
1. A configuração eletrônica do íon fluoreto é representada, 6. Quando 200 mL de uma solução de cloreto de sódio de
corretamente, por
concentração igual a 2,5 mol.L-1 são misturados com 100 mL de
2
2
4
a) 1s 2s 2p
outra solução de cloreto de sódio de concentração é igual a 1,0
b) 1s2 2s2 2p5
mol.L-1, resulta uma solução cuja concentração, em mol.L-1 é igual
c) 1s2 2s2 2p6
a
d) 1s2 2s2 3s4
a) 0,60
e) 1s2 2s4 3s6
b) 1,00
c) 1,75
RESPOSTA C – Ao receber um elétron, o flúor que contém 9 d) 2,00
elétrons ficará com 10 elétrons (íon fluoreto F -), 2e- no primeiro e) 3,50
nível e 8e- no último nível. Pelo Diagrama de Pauling, 10 elétrons
RESPOSTA D – A concentração de uma mistura de soluções é a
são acomodados em: 1s2 2s2 2p6.
média ponderada das concentrações misturadas, tendo como
2. O método de separação de misturas que se baseia na “pesos” os volumes de cada uma:
C1.V1 + C2.V2
(2,5 x 200) + (1,0 x 100)
granulometria é a
Cmist=
=
= 2,0 mol.L-1
a) decantação
V1 + V 2
200 + 100
b) sublimação
c) destilação
d) filtração
e) peneiração
RESPOSTA E – A palavra granulometria não é conhecida da
maioria dos estudantes e deveria ser trocada por “tamanho das
partículas sólidas”. A idéia é separar areia grossa da areia fina, por
exemplo, o que pode ser feito por peneiração (ou tamização).
7. O resultado de um exame de sangue, realizado em laboratório
clínico, foi de 0,195 mg de colesterol por mL de sangue.
Considerando que a massa molar do colesterol é igual a 390
g.mol-1, a concentração de colesterol nesse sangue, expressa em
mol.L-1, é igual a
a) 0,0002
b) 0,0005
c) 0,002
d) 0,005
e) 0,02
3. Das alternativas abaixo, a que corresponde a sólidos cujas
ligações entre as suas unidades estruturais são do tipo covalente e
iônica, respectivamente, é
RESPOSTA B – A massa de 0,195 mg de colesterol por mL de
a) diamante e cloreto de sódio.
sangue significa matematicamente o mesmo que 195 mg (195 x
b) óxido de cálcio e cloreto de sódio.
10 -3g) de colesterol por litro de sangue. Assim,
c) gelo e prata.
1 mol de colesterol 390 g
e) prata e carbonato de cálcio.
-3
-1
x
195 x 10 g
e x = 0,0005 mol.L
RESPOSTA A – O diamante é um sólido formado exclusivamente
por átomos de carbono tetraedricamente ligados por ligações 8. Considere a célula galvânica representada a seguir.
+
solução de KCl
–
covalentes; o NaCl, cloreto de sódio é um composto iônico
Cu
Fe
formado pelo catíon Na+ e pelo ânion Cl . CaO, óxido de sódio é
iônico; CaCO3 é iônico (com ligações covalentes no íon
carbonato); gelo é H2O, molécula formada por ligações covalentes
interatômicas e por pontes de hidrogênio intermoleculares; a prata
CuSO4
FeSO4
é formada por átomos com ligação metálica.
4. Uma certa massa de He ocupa um volume de 5,0 L na
temperatura de 25°C. Se esse gás for esfriado a –195°C, mantida
constante a pressão, o volume aproximado do mesmo, em litros,
será igual a
a) 1,3
b) 2,7
c) 3,6
d) 5,0
e) 6,7
Nessa célula galvânica o ferro sofre corrosão porque
a) está imerso em um eletrólito.
b) é reduzido a Fe2+.
c) está parcialmente exposto ao ar.
d) o sulfato de ferro II sofre hidrólise ácida.
e) possui potencial de redução menor do que o do cobre.
RESPOSTA E – A corrosão do ferro indica a sua oxidação durante
o processo, enquanto o cobre sofre redução. Oxidando-se, o ferro
possui maior potencial de oxidação do que o cobre, o que significa
a mesma coisa que dizer que o ferro possui menor potencial de
RESPOSTA A – Trata-se de uma transformação gasosa isobárica e redução do que o cobre.
que obedece à equação V1/T1 = V2/T2, temperaturas na escala
Kelvin ( 25°C + 273 = 298 K; –195°C + 273 = 78 K). Assim:
9. Dos compostos orgânicos representados a seguir, o que
5,0/298 = V2/78 e, então, V2 = 1,308 L.
pertence à função cetona é o
5. A variação do número de oxidação do cromo na reação
K2Cr2O7 + 6FeSO4 + 7H2SO4 Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
é igual a
a) –2
b) –3
c) –4
d) –5
e) –6
RESPOSTA B – No K2Cr2O7 o NOX do cromo é +6 e no Cr2(SO4)3 o
NOX do cromo é +3. A variação é NOX = (+3) – (+6) = –3. Não
esqueça que a variação é sempre o estado final – estado inicial.
a) CH3 – C – NH2
||
O
b) CH3 – C – OH
||
O
c) CH3 – C –
||
O
d) CH3 – C – O=H
||
O
e) CH3 – C – O – C2H5
||
[email protected]
QUÍMICA
O
UERGS/2006 (FFFCMPA)
RESPOSTA C – Uma cetona apresenta o grupo funcional carbonila
– CO – , como em CH3 – C –
.
||
O
O composto de (a) é uma amida; de (b) é um ácido carboxílico;
de (d) é um aldeído; e de (e) é um éster.
10. Gás natural, gasolina e parafina são derivados do petróleo que
se caracterizam por apresentar diferentes
a) funções orgânicas.
b) ligações intramoleculares.
c) tipos de ligações intermoleculares.
d) tamanho da cadeia carbônica.
e) elementos químicos na constituição da cadeia carbônica.
RESPOSTA D - Gás natural, gasolina e parafina são todos
compostos da função hidrocarboneto, possuindo ligações
covalentes entre os seus átomos de carbono e hidrogênio e
ligações de van der Waals entre as suas moléculas. A diferença
entre estes compostos é o tamanho da cadeia carbônica, isto é,
do número de carbonos de cada um: gás natural (CH 4, um
carbono), gasolina (mistura de alcanos de 7 e 8 carbonos) e
parafina (mistura de alcanos com mais de 20 carbonos).
[email protected]
PROFESSOR ARAUJO