1
Catabolismo de Lipídios
Digestão e Armazenamento dos Lipídios.
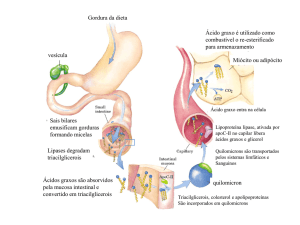
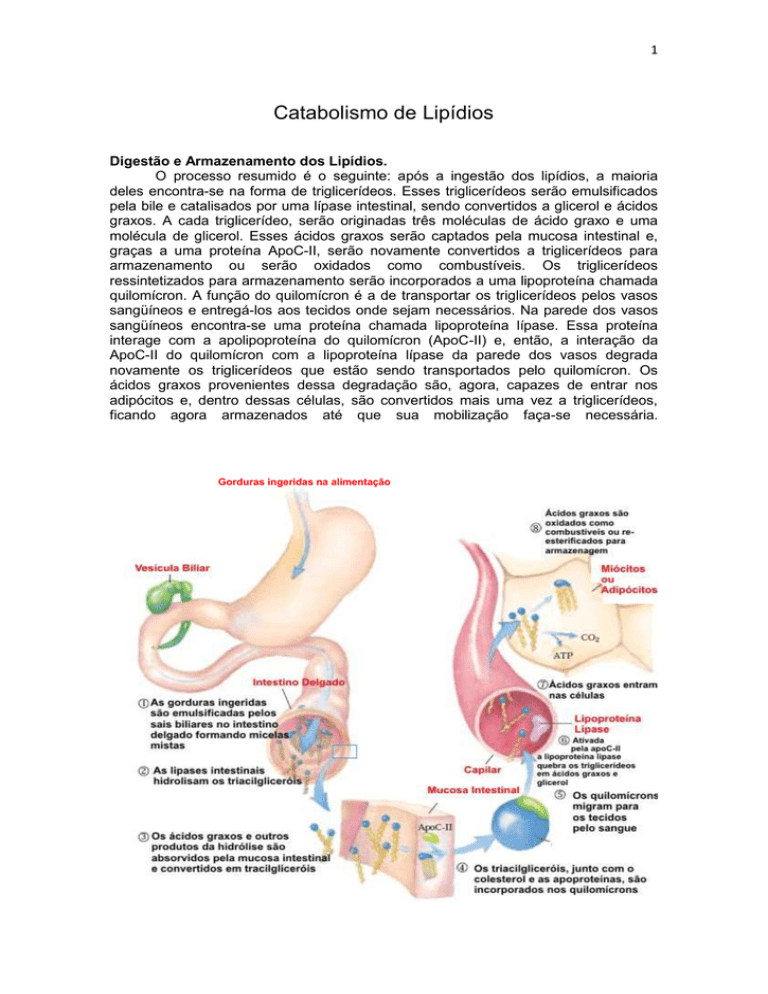
O processo resumido é o seguinte: após a ingestão dos lipídios, a maioria
deles encontra-se na forma de triglicerídeos. Esses triglicerídeos serão emulsificados
pela bile e catalisados por uma lípase intestinal, sendo convertidos a glicerol e ácidos
graxos. A cada triglicerídeo, serão originadas três moléculas de ácido graxo e uma
molécula de glicerol. Esses ácidos graxos serão captados pela mucosa intestinal e,
graças a uma proteína ApoC-II, serão novamente convertidos a triglicerídeos para
armazenamento ou serão oxidados como combustíveis. Os triglicerídeos
ressintetizados para armazenamento serão incorporados a uma lipoproteína chamada
quilomícron. A função do quilomícron é a de transportar os triglicerídeos pelos vasos
sangüíneos e entregá-los aos tecidos onde sejam necessários. Na parede dos vasos
sangüíneos encontra-se uma proteína chamada lipoproteína lípase. Essa proteína
interage com a apolipoproteína do quilomícron (ApoC-II) e, então, a interação da
ApoC-II do quilomícron com a lipoproteína lípase da parede dos vasos degrada
novamente os triglicerídeos que estão sendo transportados pelo quilomícron. Os
ácidos graxos provenientes dessa degradação são, agora, capazes de entrar nos
adipócitos e, dentro dessas células, são convertidos mais uma vez a triglicerídeos,
ficando agora armazenados até que sua mobilização faça-se necessária.
Gorduras ingeridas na alimentação
2
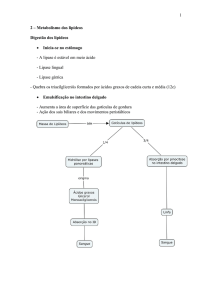
Mobilização dos Lipídios
Após o processo de armazenamento dos triglicerídeos no tecido adiposo, este
pode ser mobilizado a qualquer momento em que haja demanda energética. Dessa
forma ele será quebrado e fornecerá energia para o metabolismo celular. Esse
processo se chama “mobilização dos triglicerídeos”.
Quando mobilizados, os triglicerídeos serão quebrados no tecido adiposo onde
estão armazenados por uma enzima chamada de triacilglicerol-lipase. Para que essa
reação aconteça, hormônios como glucagon e epinefrina, que sinalizam quebra de
reservas, vão se ligar a seus receptores na membrana do adipócito e, com uma
cascata de reações cujo segundo mensageiro é o AMPc, vão ativar a PKA. A PKA
ativa fosforila a triacilglicerol-lipase, que, agora fosforilada, também ficará ativa.
Finalmente, a triacilglicerol-lipase degradará os triglicerídeos em ácidos graxos e
glicerol. Os ácidos graxos serão transportados pelos tecidos através da corrente
sangüínea, onde se associam à proteínas transportadoras de lipídios como a
albumina. O destino final dos ácidos graxos será, então, os tecidos que vão utilizá-los
como fonte energética, principalmente músculos e fígado. Dentro desses tecidos, os
ácidos graxos sofrerão uma série de reações que os converterão a diversas moléculas
de acetil-CoA. Essa via de degradação dos ácidos graxos a acetil-CoA para produção
de energia é chamada de β-oxidação. O glicerol, por outro lado, pode ser utilizado no
adipócito para a glicólise, visto que o glicerol pode ser convertido a di-hidróxi-cetona
fosfato, um dos intermediários da glicólise. Caso o glicerol seja transportado até o
fígado, ele poderá participar da gliconeogênese. De qualquer forma, esse glicerol será
utilizado, mais cedo ou mais tarde, como fonte de energia, assim como os ácidos
graxos que, juntamente com ele, compunham o triglicerídeo degradado.
Sistema Carnitina Acil-Transferase
A via de β-oxidação acontece dentro da mitocôndria. Dessa forma, os ácidos
graxos mobilizados precisam entrar na mitocôndria para serem oxidados a acetil-CoA
e gerar energia. Ácidos graxos com poucos carbonos em sua cadeia graxa são
capazes de entrar livremente na mitocôndria, difundindo-se por sua membrana
lipofílica. Entretanto, ácidos graxos de cadeias mais longas não são capazes de entrar
diretamente na mitocôndria. Assim, para que possam entrar na mitocôndria, esses
ácidos graxos terão que ser transportados.
O sistema de transporte de ácidos graxos para dentro da mitocôndria envolve
duas enzimas e um transportador, sendo chamado de Sistema Carnitina AcilTransferase. Durante esse sistema, o ácido graxo deve ser ligado à carnitina,
transportado para dentro da mitocôndria e, dentro dela, deve ser desligado da
carnitina. Entretanto, o ácido graxo não consegue se ligar diretamente à carnitina: para
ser capaz de realizar essa ligação, ele deve sofrer um processo chamado de “ativação
do ácido graxo”. Essa ativação consiste na transformação de uma molécula de ácido
graxo a uma molécula de acil-CoA graxo. Esse processo acontece através da ligação
da porção graxa do ácido graxo à coenzima A, gastando ATP e sendo mediado pela
enzima acil-CoA graxo sintase. Primeiramente, a acil-CoA graxo sintetase adicionará
um grupamento AMP ao oxigênio do ácido graxo, formando um ácil-adenilato graxo e
gastando uma molécula de ATP. Depois, a enzima vai retirar esse AMP e colocar, em
seu lugar, a coenzima A, formando então o acil-CoA graxo. Como subprodutos
formam-se o pirofosfato (dois fosfatos ligados entre si) e o AMP (adenosina ligada a
apenas um fosfato).
Depois de formado o acil-CoA graxo, este pode enfim ser transportado para
dentro da mitocôndria através da carnitina. A enzima carnitina aciltransferase-I vai
retirar o grupamento CoA do acil-CoA e vai ligar esse acil a uma molécula de carnitina.
O complexo acil-carnitina é capaz de passar pela membrana da mitocôndria. Dentro
da matriz mitocondrial, o complexo acil-carnitina é desfeito através da ação da enzima
carnitina aciltransferase-II, que vai condensar ao complexo um grupamento CoA,
3
liberando uma carnitina livre e, novamente, o acil-CoA graxo inicial. Os esquemas a
seguir representam a ativação de um ácido graxo (conversão de ácido graxo a acilCoA graxo) e o transporte feito através do Sistema Carnitina Acil-Transferase:
Algumas pessoas tomam carnitina achando que, dessa forma, aumentarão a
degradação de ácidos graxos, entretanto essa relação ainda não foi comprovada e é
bastante duvidosa.
A molécula de malonil-CoA inibe a enzima carnitina aciltransferase-I. O malonilCoA é muito importante durante a biossíntese de ácidos graxos. Dessa forma, o
malonil-CoA vai diminuir a degradação de ácidos graxos, afinal, se ele é importante
para a síntese dos ácidos graxos significa que, enquanto ele estiver no meio, não deve
haver degradação destes.
β-oxidação
a) Ácidos graxos saturados e pares
A β-oxidação é a degradação dos ácidos graxos para formar acetil-CoA que,
após passar pelo Ciclo de Krebs e pela cadeia respiratória, vai fornecer uma grande
quantidade de energia na forma de ATP para a célula. Trata-se de uma repetição de
4
quatro reações bioquímicas: desidrogenação, hidratação, oxidação e tiólise. Os ácidos
graxos de número par são totalmente transformados em moléculas de acetil-CoA (2C).
Por exemplo: tendo-se um ácido graxo inicial com 14 carbonos, formar-se-ão durante
a β-oxidação, 7 moléculas de acetil-CoA a partir dele. A cada ciclo da β-oxidação, é
gerada uma molécula de acetil-CoA. Dessa forma, esse mesmo ácido graxo de 14
carbonos precisaria de 7 voltas na β-oxidação para ser totalmente degradado. As
reações são as seguintes:
1) DESIDROGENAÇÃO
Trata-se de uma reação catalisada por uma enzima chamada acil-CoAdesidrogenase. A oxidação é chamada de β-oxidação porque serão retirados da
molécula de ácido graxo inicial o carbono α e o carbono ligado à CoA, sendo esses
dois os formadores da acetil-CoA final. Dessa forma, ao final de um ciclo de βoxidação, o carbono β é quem vai se ligar à CoA para reiniciar o ciclo.
Durante a desidrogenação, ocorre a redução de um FAD a FADH2, visto que
para oxidar o ácido graxo é necessário reduzir alguém. O produto gerado após a
desidrogenação é o trans-Δ²-enoil-CoA.
2) HIDRATAÇÃO
É uma reação catalisada pela enzima enoil-CoA-hidratase. Essa enzima vai
condensar uma molécula de H2O ao produto da primeira reação: o trans-Δ²-enoil-CoA.
Dessa forma, haverá a conversão do trans-Δ²-enoil-CoA à L-β-hidroxiacil-CoA.
3) OXIDAÇÃO
É uma reação catalisada pela enzima β-hidroxil-CoA-desidrogenase. Durante
essa reação o produto da segunda reação, L-β-hidroxiacil-CoA, será oxidado a βCetoacil-CoA, havendo a redução de um NAD+ a NADH + H+.
4) TIÓLISE
Catalisada pela enzima acil-CoA-acetil-transferase (tiolase), a última reação da
β-oxidação converterá o produto da terceira reação, β-Cetoacil-CoA, a acetil-CoA +
acil-CoA graxo (proveniente do restante da cadeia carbônica graxa que não foi
degradada durante esse ciclo). Todas as reações anteriores à catalisada pela tiolase
servem, simplesmente, para deixar a ligação entre os carbonos da cadeia graxa mais
lábeis e adaptador ao sítio ativo da tiolase, visto que esta tiolase não seria capaz de
simplesmente degradar essa cadeia no estado original.
Em um balanço final, teríamos: a cada ciclo da β-oxidação, há formação de um
acetil-CoA, um NADH + H+, um FADH2 e um acil-CoA graxo. A β-oxidação não forma
diretamente ATP, ao contrário da glicólise. A quebra dos ácidos graxos fornece
coenzimas reduzidas (FADH2 e NADH + H+) e acetil-CoA. O acetil-CoA entrará no
Ciclo de Krebs, onde, através de várias reações bioquímicas, originará ainda mais
coenzimas reduzidas. Dessa forma, as coenzimas reduzidas formadas durante o Ciclo
de Krebs e durante a β-oxidação vão formar ATP ao entrarem na cadeia de transporte
de elétrons, ou cadeia respiratória. Assim, indiretamente, a quebra de ácidos graxos
forma muitos ATPs. Comparativamente à glicólise, a degradação de ácidos graxos
gera muito mais energia para a célula. Entretanto o uso da glicose é, ainda, vantajoso,
visto que sua mobilização é muito mais rápida que a mobilização dos ácidos graxos e
a glicólise pode acontecer em anaerobiose, o que não é possível durante a β-oxidação
5
dos ácidos graxos. De forma geral, um esquema simples da β-oxidação de ácidos
graxos saturados e pares seria o seguinte:
1- Esquema geral com as enzimas, subprodutos e produtos da β-oxidação para
um ácido graxo de 18 carbonos (ácido palmítico).
2- O fim do processo iniciado em 1, de maneira resumida e cíclica. O balanço
energético da β-oxidação do ácido palmítico (18C) seria de 108 ATPs.
3- A formação de ATP através da β-oxidação.
b) Ácidos graxos insaturados e pares
No caso da β-oxidação de ácidos graxos insaturados com apenas uma
insaturação, a molécula será degradada normalmente, conforme visto no item a. Essa
degradação normal acontece até que a dupla ligação esteja próxima do carbono ligado
à coenzima A. A partir de então, uma enzima adicional: a enoil-CoA-isomerase. Esta
enzima vai transformar uma dupla cis em trans, visto que a β-oxidação só consegue
processar duplas ligações do tipo trans. O processo vai se dar através da mudança da
ligação cis do carbono três para uma ligação trans no carbono dois. A partir de então a
molécula poderá seguir normalmente na β-oxidação.
6
A seguir, o esquema da β-oxidação do ácido oléico (na forma de oleoil-CoA),
ácido graxo monoinsaturado de 18C:
No caso de ácidos graxos poliinsaturados, será preciso de mais de uma
enzima. Dessa forma, além da enoil-CoA-isomerase, a β-oxidação dos ácidos graxos
poliinsaturados contará, ainda, com a presença da enzima 2,4-dienoil-CoA-redutase.
Ambas as enzimas possuem a função de manter a dupla ligação em uma forma trans
e manter essa dupla ligação no carbono dois da molécula. Só assim esse ácido graxo
poliinsaturado poderá se tornar substrato para as enzimas da β-oxidação.
c) Ácidos graxos ímpares
Durante a β-oxidação de ácidos graxos com um número de carbonos ímpar,
formam-se várias moléculas de acetil-CoA (2C) e uma de propionil-CoA (3C). Por
exemplo, um ácido graxo com 15 carbonos em sua cadeia formaria, após a βoxidação, 6 moléculas de acetil-CoA e 1 molécula de propionil-CoA, totalizando 15C.
Assim, para a degradação completa desses ácidos graxos com número ímpar de
carbono, haverá a necessidade de degradar, ainda, o propionil-CoA formado no fim da
β-oxidação. Para isso, há a participação de três outras enzimas: propionil-CoAcarboxilase, metilmalonil-CoA-epimerase e metilmalonil-CoA-mutase. Através da
atuação dessas três enzimas, o propionil-CoA será convertido em succinil-CoA, que é
facilmente convertido em oxalacetato. Esse oxalacetato pode seguir tanto no Ciclo de
Krebs para formação de coenzimas reduzidas e posteriormente ATP, quanto pode
seguir na gliconeogênese, formando glicose.
Oxidação ω
Alguns tecidos especializados fazem esse tipo especial de oxidação. Ao
contrário da β-oxidação, a oxidação ω começa pelo último carbono (o carbono mais
distante do COOH, chamado carbono ω) e não é uma degradação completa. A
oxidação ω começa e algumas moléculas distantes do COOH são oxidadas, mas não
todas. Após um certo tempo, a oxidação ω vai parar e gerar um subproduto. Esse
subproduto terminará sua oxidação com a β-oxidação, que é completa. Várias enzimas
participam desta reação: uma oxidase de função mista, a álcool-desidrogenase e a
aldeído-desidrogenase. Durante essa via, há a formação de NADH + H+. Após a
oxidação ω, podem ser formadas as moléculas de succinato e de ácido adípico, que
7
têm funções sinalizadoras no organismo. Nos tecidos especializados, como por
exemplo o fígado e o rim onde a oxidação ω acontece dentro do retículo
endoplasmático dessas células, há a necessidade da presença dessas duas
moléculas sinalizadoras. A oxidação ω funciona, dentre outras funções, para
detoxificação do organismo.
Regulação do Catabolismo de Lipídios
Aumentando a mobilização e degradação dos triglicerídeos, sempre haverá
cascatas iniciadas pelos hormônios epinefrina, cortisol e glucagon. A triacilglicerollipase é, portanto, sensível às cascatas realizadas por esses hormônios. A insulina,
por sua vez, terá efeito contrário: estimulará a síntese de triglicerídeos e seu
armazenamento dentro dos adipócitos.
Pessoas acham que, ao fazer exercícios físicos, primeiro deve-se consumir
toda a reserva de carboidratos (principalmente glicogênio) para, somente então,
começar a consumir as reservas de ácidos graxos. Entretanto, isso não é verdade: o
organismo vai oxidar lipídios e carboidratos ao mesmo tempo. O que varia entre a
mobilização de lipídios e de carboidratos é a proporção entre eles: exercícios leves e
rápidos levam à mobilização de poucos ácidos graxos e muitos carboidratos.
Exercícios mais pesados e duradouros mobilizam muitos ácidos graxos e um pouco
menos de carboidratos. Assim, tanto em exercícios leves ou pesados haverá
mobilização de triglicerídeos, mas essa mobilização será muito maior após 1h ou mais
de exercício físico.
Um dos métodos para se regular a degradação dos ácidos graxos é através do
controle da entrada de ácidos graxos na mitocôndria. Esse controle é feito inibindo-se
ou estimulando-se a enzima carnitina-acetiltransferase-I. Essa enzima, como já dito, é
inibida pela presença de malonil-CoA.
Corpos Cetônicos
Quando o organismo encontra-se em um processo fisiológico de degradação
intensa de ácidos graxos, ocorre um acúmulo de acetil-CoA no fígado, visto que ele
não consegue ser totalmente absorvido pelo Ciclo de Krebs. Esse excesso de acetilCoA vai ser transformado em três moléculas, os chamados Corpos Cetônicos:
acetoacetato, o D-β-hidroxibutirato e a acetona. O fígado produz os corpos cetônicos
porque o acetil-CoA não pode ser enviado, via corrente sangüínea, para outros órgãos
para ser utilizado, mas os corpos cetônicos podem. Dessa forma, o fígado pega seu
excedente de acetil-CoA e converte a corpos cetônicos, enviando-os depois de
sintetizados, para outros órgãos que deles precisem (por exemplo, coração, músculo
esquelético, rins e cérebro). Quando esses corpos cetônicos estão dentro destes
tecidos, eles são novamente convertidos a acetil-CoA, que vai entrar no Ciclo de
Krebs, formando as coenzimas reduzidas e conseqüente produção de ATP.
O hepatócito realiza a gliconeogênese intensamente. Dessa forma, ele vai
utilizar muito do oxalacetato que seria enviado para o Ciclo de Krebs para realizar a
gliconeogênese. O Ciclo de Krebs não vai parar porque há outras reações que o
mantém funcionando, mas sua velocidade será cada vez mais lenta a cada ciclo. Essa
é a razão pela qual o hepatócito não é capaz de utilizar todo o acetil-CoA no Ciclo de
Krebs, já que esse ciclo está cada vez mais lento e “fraco”. Assim, o acetil-CoA
excedente será convertido a corpos cetônicos. Esse acetil-CoA não será utilizado para
a síntese de ácidos graxos novamente porque o estado metabólico do corpo encontrase em catabolismo, degradando reservas e impedindo a síntese de novas reservas.
Pessoas com diabetes mellitus possuem um hálito de acetona. Isso acontece
porque os níveis de insulina caem demais e, então, o glucagon estimula a degradação
de ácidos graxos, que culminará na formação dos corpos cetônicos. Muitas vezes a
pessoa até possui glicose para degradar, mas não é capaz, visto que os receptores de
glicose não estão conseguindo captá-la para músculos e hepatócitos.