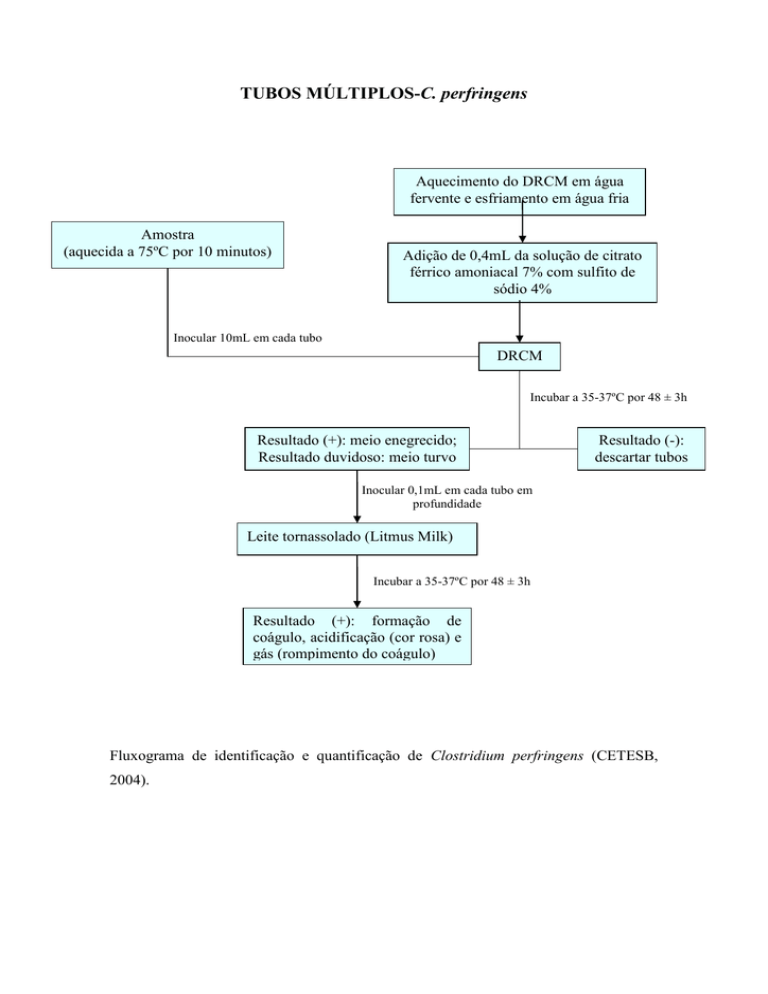
TUBOS MÚLTIPLOS-C. perfringens
Aquecimento do DRCM em água
fervente e esfriamento em água fria
Amostra
(aquecida a 75ºC por 10 minutos)
Adição de 0,4mL da solução de citrato
férrico amoniacal 7% com sulfito de
sódio 4%
Inocular 10mL em cada tubo
DRCM
Incubar a 35-37ºC por 48 ± 3h
Resultado (+): meio enegrecido;
Resultado duvidoso: meio turvo
Resultado (-):
descartar tubos
Inocular 0,1mL em cada tubo em
profundidade
Leite tornassolado (Litmus Milk)
Incubar a 35-37ºC por 48 ± 3h
Resultado (+): formação de
coágulo, acidificação (cor rosa) e
gás (rompimento do coágulo)
Fluxograma de identificação e quantificação de Clostridium perfringens (CETESB,
2004).
MEMBRANA FILTRANTE
Preparo de diluições
decimais:
-1
(10 ; 10-2; outras)
Amostra
Filtração de 1mL de cada tubo de cada diluição
Filtração de 1mL ou mais
m-FC
Incubação por 24 ± 2h a 44,5 ± 0,2ºC
Resultado (+): Colônias azuis (Coliformes termotolerantes)
Selecionar três colônias para repicagem em tubos específicos
EC-MUG
Incubação por 24 ± 2h a 44,5 ±
0,2ºC
Fluorescência-UV (365nm): Presença de E. coli
Fluxograma de identificação e quantificação de coliformes termotolerantes e
Escherichia coli pela técnica da membrana filtrante (APHA, 1998; CETESB, 2004).
COLILERT
Amostra
Adicionar 100mL de cada recipiente
de cada diluição
Preparo de diluições decimais:
(10-1; 10-2; outras)
Adicionar 100mL de cada recipiente
de cada diluição
Mistura do substrato Colilert com a amostra e
diluições em recipiente estéril
Adicionar nas cartelas e selar rapidamente
Incubação por 24h a 35-37ºC
Coloração amarela intensa: Coliformes totais.
Calcular o NMP/100mL na tabela
Fluorescência-UV (365nm): Escherichia coli.
Calcular o NMP/100mL na tabela
Fluxograma de identificação e quantificação de coliformes totais e Escherichia coli pela
técnica do substrato cromogênico (APHA, 1998; CETESB, 2004).
CONTAGEM PADRÃO DE BACTÉRIAS HETERÓTROFAS
TÉCNICA DE VERTIDO EM PLACA (POUR PLATE)
Preparo de diluições decimais:
(10-1; 10-2; outras)
Amostra
Fundir e manter a 45ºC em banhomaria os tubos com Agar para
contagem padrão
Inocular 1mL de cada diluição
Inocular 1mL da amostra
Despejar o conteúdo
de um tubo
em uma placa
Placas de Petri com Agar para contagem padrão
(duplicata da amostra e de cada diluição)
Homogeneizar fazendo movimentos circulares
em forma de 8. Esperar solidificar
Inverter as placas e incubar por 48 ± 3h a 35-37ºC
Contagem das colônias. Determinação da
Média e Cálculo dos resultados (UFC/mL).
Fluxograma de identificação e quantificação de bactérias heterotróficas pela técnica de
Pour Plate (CETESB, 2004).
MEMBRANA FILTRANTE-Salmonella sp
Amostra (5L)
Filtração em membrana de
0,45µm e 142mm de diâmetro
APT (200mL)
24h/35-37ºC
Inocular 1mL
Caldo Rappaport-Vassiliadis (100mL)
Incubar por 24-48h 35-37ºC. Em cada período de
tempo desse realizar as etapas seguintes
Agar Verde Brilhante
(colônias rosas e vermelhas)
Incubar 24h/37ºC
Agar XLD
(colônias vermelhas com ou sem H2S)
Incubar 24h/37ºC
Agar nutriente (24h/37ºC)
Provas bioquímicas (Agar TSI e caldo lisina)
Incubar por 24h a 37ºC
Fluxograma de isolamento e identificação de Salmonella sp em amostras de água pela
técnica da membrana filtrante (CETESB, 1993).
CONTAGEM PADRÃO DE BACTÉRIAS HETERÓTROFAS
TÉCNICA DE ESPALHAMENTO EM PLACA (SPREAD PLATE)
Preparo de diluições decimais:
(10-1; 10-2; outras)
Amostra
Inocular 0,5mL de cada diluição
em placas distintas
Inocular 0,5mL da amostra
Placas de Petri com Agar para contagem padrão
(duplicata da amostra e de cada diluição)
Homogeneizar com a alça de
Drigalski fazendo movimentos
circulares. Esperar secar
Inverter as placas e incubar por 48 ± 3h a 35-37ºC
Contagem das colônias. Determinação da
Média e Cálculo dos resultados (UFC/mL).
Fluxograma de identificação e quantificação de bactérias heterotróficas pela técnica de
Spread Plate (APHA, 1998).
TUBOS MÚLTIPLO- COLIFORMES TOTAIS –
TERMOTOLERANTES E E.COLI
Amostra
Preparo de diluições decimais:
(10-1; 10-2; outras)
Inoculação de 1mL de cada tubo de cada diluição
Inoculação de 10mL e 1mL
Caldo lactosado (com púrpura de
bromocresol ou tubos de Durham):
cinco tubos de cada volume e
diluição adotados
Incubação por 24 ± 2h a 35 ± 0,5ºC
Resultado (-): Reincubar por mais 24 ± 2h
a 35 ± 0,5ºC
Resultado (+): Turvação com
acidificação do meio (mudança de
roxo para amarelo: púrpura de
bromocresol) e produção ou não
de gás (nos tubos de Durham).
Inocular duas alçadas de cada
tubo em um tubo especifico
Resultado (+)
Caldo lactosado verde
brilhante bílis a 2%
48 ± 3h a 35 ± 0,5ºC
Inocular duas alçadas de cada
tubo em um tubo especifico
Resultado (-):
descartar tubos
Inocular duas alçadas de cada
tubo em um tubo especifico
Resultado (-):
descartar tubos
Resultado (+): Turvação e produção
ou não de gás (nos tubos de Durham).
Presença de Coliformes Totais
Inocular duas alçadas de cada
tubo em um tubo especifico
EC-MUG por 24 ± 2h/44,5 ± 0,2ºC
Turvação: Presença de Coliformes
Termotolerantes
Fluorescência sob 365nm: Presença
de E. coli
Fluxograma de identificação e quantificação de coliformes totais, coliformes
termotolerantes e Escherichia coli pela técnica dos tubos múltiplos (APHA, 1998;
CETESB, 2004).