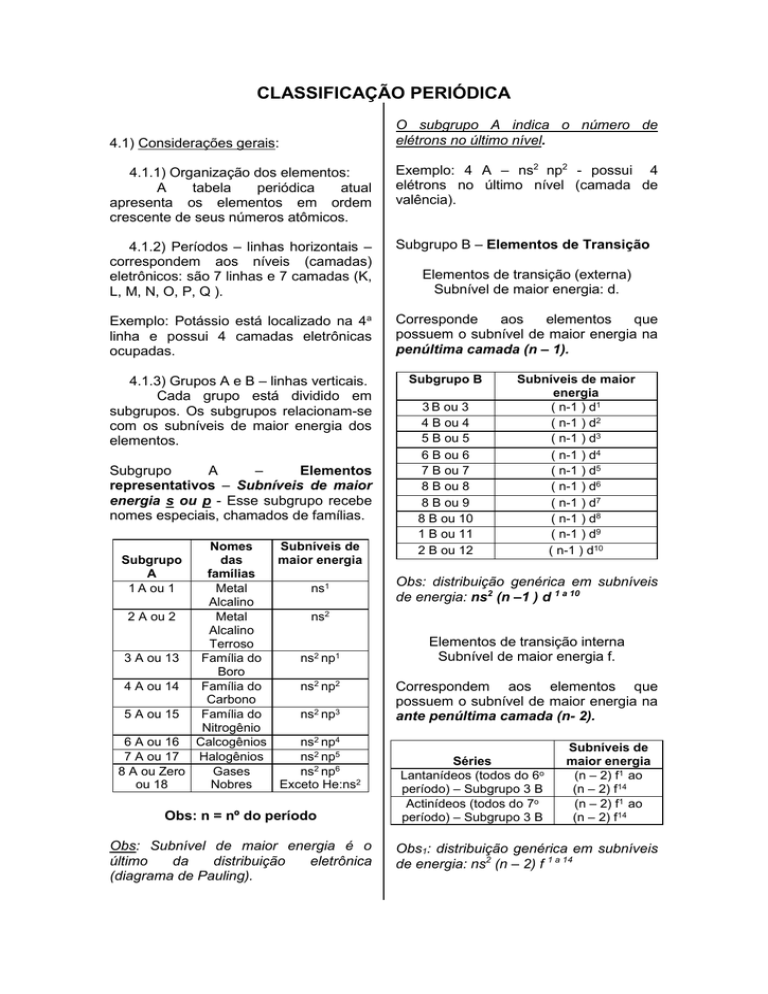
CLASSIFICAÇÃO PERIÓDICA
4.1) Considerações gerais:
O subgrupo A indica o número de
elétrons no último nível.
4.1.1) Organização dos elementos:
A
tabela
periódica
atual
apresenta os elementos em ordem
crescente de seus números atômicos.
Exemplo: 4 A – ns2 np2 - possui 4
elétrons no último nível (camada de
valência).
4.1.2) Períodos – linhas horizontais –
correspondem aos níveis (camadas)
eletrônicos: são 7 linhas e 7 camadas (K,
L, M, N, O, P, Q ).
Subgrupo B – Elementos de Transição
Exemplo: Potássio está localizado na 4a
linha e possui 4 camadas eletrônicas
ocupadas.
Corresponde
aos
elementos
que
possuem o subnível de maior energia na
penúltima camada (n – 1).
4.1.3) Grupos A e B – linhas verticais.
Cada grupo está dividido em
subgrupos. Os subgrupos relacionam-se
com os subníveis de maior energia dos
elementos.
Subgrupo
A
–
Elementos
representativos – Subníveis de maior
energia s ou p - Esse subgrupo recebe
nomes especiais, chamados de famílias.
Nomes
Subníveis de
das
maior energia
famílias
Metal
ns1
Alcalino
2 A ou 2
Metal
ns2
Alcalino
Terroso
3 A ou 13
Família do
ns2 np1
Boro
4 A ou 14
Família do
ns2 np2
Carbono
5 A ou 15
Família do
ns2 np3
Nitrogênio
6 A ou 16 Calcogênios
ns2 np4
7 A ou 17
Halogênios
ns2 np5
8 A ou Zero
Gases
ns2 np6
ou 18
Nobres
Exceto He:ns2
Subgrupo
A
1 A ou 1
Obs: n = nº do período
Obs: Subnível de maior energia é o
último
da
distribuição
eletrônica
(diagrama de Pauling).
Elementos de transição (externa)
Subnível de maior energia: d.
Subgrupo B
3 B ou 3
4 B ou 4
5 B ou 5
6 B ou 6
7 B ou 7
8 B ou 8
8 B ou 9
8 B ou 10
1 B ou 11
2 B ou 12
Subníveis de maior
energia
( n-1 ) d1
( n-1 ) d2
( n-1 ) d3
( n-1 ) d4
( n-1 ) d5
( n-1 ) d6
( n-1 ) d7
( n-1 ) d8
( n-1 ) d9
( n-1 ) d10
Obs: distribuição genérica em subníveis
de energia: ns2 (n –1 ) d 1 a 10
Elementos de transição interna
Subnível de maior energia f.
Correspondem aos elementos que
possuem o subnível de maior energia na
ante penúltima camada (n- 2).
Séries
Lantanídeos (todos do 6o
período) – Subgrupo 3 B
Actinídeos (todos do 7o
período) – Subgrupo 3 B
Subníveis de
maior energia
(n – 2) f1 ao
(n – 2) f14
(n – 2) f1 ao
(n – 2) f14
Obs1: distribuição genérica em subníveis
de energia: ns2 (n – 2) f 1 a 14
Obs2: Exceções – Lu e Lr não possuem o
elétron diferenciador no subnível f e sim,
no subnível d.
mas tem comportamento químico
semelhante ao de um ametal.
Metais: são bons condutores de
calor, eletricidade, maleáveis,
dúcteis, sólidos, possuem brilho
metálico e elevadas temperaturas
de fusão e ebulição.
Ametais:
isolantes.
Exceções:
Obs3: Os elementos de transição
possuem a camada de valência ns2.
4.2) Relações entre as configurações
eletrônicas e as posições na Tabela
Periódica:
são
usados
como
Bi – metal, não condutor de corrente
elétrica.
C grafite – ametal, condutor de
corrente elétrica.
Iodo sólido e Carbono diamante
possuem brilho.
4.3)
Classificação dos elementos em:
Metais, Semimetais, Ametais,
Hidrogênio e Gases Nobres.
Obs: Na atualidade os elementos são
classificados em H, metais, ametais e
gases nobres. Os semi-metais foram
reclassificados em metais ou ametais,
conforme
as
suas
principais
características
físico-químicas.
Embora esta alteração já tenha
ocorrido há bastante tempo, alguns
vestibulares continuam citando os
semi-metais.
4.5) Estados físicos dos elementos:
Temperatura: 25oC e Pressão: 1 atm
Líquidos: Hg e Br.
Gasosos: H, F, O, N, Cl e gases nobres.
Sólidos: os demais.
4.4) Características dos elementos:
Elementos artificiais:
Cisurânicos Tc, Pm, At e Fr.
Transurânicos todos depois do
Urânio.
Elementos radioativos: todos a
partir do Polônio (Z 84), Tc e
Pm.
Um metalóide (ou semimetal) tem
aparência física de um metal,
4.6)
Propriedades
elementos químicos:
periódicas
dos
4.6.1) Raio atômico ( ):
Em uma família, o raio atômico
aumenta de cima para baixo, conforme
aumenta o número atômico e o número
de camadas eletrônicas (1a avaliação a
ser feita).
Em um período, o raio aumenta da
direita para a esquerda, conforme diminui
o número atômico e, com isso, diminui a
atração núcleo – eletrosfera.
a) Raio do Átomo x Raio do Cátion:
O raio do átomo sempre é maior
que o seu respectivo cátion.
Ex: 13 Al 13Al 3+.
b) Raio do Átomo x Raio ao Ânion:
O raio do átomo sempre é menor
que o seu respectivo ânion.
Ex: 16 S 16 S 2-.
c) Série de íons isoeletrônicos:
Numa série de íons isoeletrônicos,
terá maior raio o íon que tiver o menor
número atômico.
Ex: 11 Na+ 13 Al 3+.
Obs: 1a avaliação No de camadas
2a avaliação quanto coincidir o
o
n de camadas Z Z·, raio
4.6.2) Eletropositividade ou Caráter
metálico ( ):
É a capacidade que um átomo possui
de doar elétrons, em comparação a outro
átomo.
Quanto maior for o raio atômico, maior
será a eletropositividade.
4.6.3) Eletronegatividade ou Caráter
não – metálico ():
É a capacidade que um átomo possui
de atrair elétrons, em comparação a
outro átomo.
Será mais eletronegativo o elemento
que tiver o menor raio atômico (maior a
atração núcleo – eletrosfera).
O responsável pela capacidade do
átomo atrair elétrons é o núcleo.
O núcleo irá atrair elétrons para a
camada de valência do átomo, uma vez
que as camadas internas já estão
completas.
4.6.4) Energia
ionização ():
ou
Potencial
de
É a energia necessária para retirar um
elétron de um átomo (ou íon) isolado, na
fase gasosa.
X (g) + energia X + (g) + e
A energia de ionização aumenta
conforme o raio diminui.
Os gases nobres são os elementos de
maiores valores de energia de ionização
e os metais alcalinos os de menores
potenciais.
A energia necessária para retirar dois
ou mais elétrons de um mesmo átomo é
chamada de 2º potencial de ionização (2º
PI), 3º potencial de ionização (3º PI), e
assim sucessivamente. Os valores são
crescentes em decorrência da diminuição
do raio e do aumento da atração núcleo
– eletrosfera. Assim, podemos resumir:
1ºPI 2ºPI 3ºPI 4ºPI ....
4.6.5)
Afinidade
Eletroafinidade ():
eletrônica
ou
É a energia liberada quando um
átomo isolado (na fase gasosa) captura
um elétron.
X (g) + e X - (g) + energia
A afinidade eletrônica aumenta
conforme diminui o raio atômico.
EXERCÍCIOS DE CLASSIFICAÇÃO
PERIÓDICA
QUESTÕES OBJETIVAS
1) (UNI-RIO/1995) Quando ocorrer
distribuição eletrônica nas envolventes
de um átomo de um elemento químico e
o subnível mais energético for do tipo d
e, teoricamente, apresentar quatro
orbitais completos e um incompleto, na
realidade, um dos elétrons do subnível
anterior estará situado neste orbital
incompleto. O grupo da Classificação
Periódica em que se encontra este
elemento é:
(a) IB
(b) IIB
(c) IIIB
(d) VB
(e) VIIIB
2) (UNI-RIO/1995) O diagrama a seguir
representa átomos de elementos com
elétrons distribuídos em quatro níveis
energéticos e que se situam nos blocos
s, p e d da Classificação Periódica.
(c) os átomos situados em X têm
números atômicos que variam de 19 a
36.
(d) os átomos situados em R têm
números atômicos que variam de 21 a
30.
(e) os átomos situados em R são
elementos classificados como metais.
3)
(UFF/1997)
Analisando-se
a
classificação periódica dos elementos
químicos, pode-se afirmar que:
(a) O raio atômico do nitrogênio é maior
que o do fósforo.
(b) A afinidade eletrônica do cloro é
menor que a do fósforo.
(c) O raio atômico do sódio é menor que
o do magnésio.
(d) A energia de ionização do alumínio é
maior que a do enxofre.
(e) A energia de ionização do sódio é
maior que a do potássio.
4) (UERJ/1999) Um dos elementos
químicos que tem se mostrado muito
eficiente no combate ao câncer de
próstata é o Selênio (Se).
Com base na Tabela de Classificação
Periódica dos Elementos, os símbolos de
elementos com propriedades químicas
semelhantes ao Selênio são:
(a) Cl, Br, I
(c) P, As, Sb
Considerando que s, p e d são conjuntos
de
átomos
que
apresentam,
respectivamente, orbitais s no último
nível, orbitais p no último nível e orbitais
d no penúltimo nível e que formam os
subconjuntos R, X e Q, só não podemos
afirmar corretamente que:
(a) um átomo situado em Q pertence ao
subgrupo A, do grupo 1 ou 2 da
Classificatória Periódica.
(b) um átomo situado em Q tem número
atômico 19 e 20.
(b) Te, S, Po
(d) As, Br, Kr
5) (UFRRJ/1999) O elemento "X", do
terceiro período, que tem maior afinidade
eletrônica, combina-se com o elemento
"Z", do quarto período, que possui menor
energia de ionização. A fórmula do
composto resultante será:
(a) ZX.
(d) ZX3.
(b) ZX2.
(e) Z2X3.
(c) Z3X.
6) (PUCRJ/1999) O gráfico a seguir
mostra a variação do potencial de
ionização (eixo das ordenadas) em
função do número atômico (eixo das
abscissas). Considerando que a escala
no eixo das abscissas não começa
necessariamente de zero, os números
atômicos dos elementos A, B e C só
podem ser, respectivamente:
(a) I, II, III e IV
(c) I e II
(e) II e IV
(b) I e IV
(d) II e III
9) (UFRRJ/2000) A semelhança de
comportamento químico, na formação de
íons, que se observa em um certo grupo
(família) da tabela periódica deve-se:
(a) 1; 9; 10.
(c) 10; 19; 20.
(e) 2; 10; 11.
(b) 11; 18; 19.
(d) 12; 17; 18.
7) (UFF/2000) Conhece-se, atualmente,
mais de cem elementos químicos que
são, em sua maioria, elementos naturais
e, alguns poucos, sintetizados pelo
homem. Esses elementos estão reunidos
na Tabela Periódica segundo suas
características e propriedades químicas.
Em
particular,
os
Halogênios
apresentam:
(a)
o
elétron
diferenciador
no
antepenúltimo nível.
(b) subnível f incompleto.
(c) o elétron diferenciador no penúltimo
nível.
(d) subnível p incompleto.
(e) subnível d incompleto.
8) (UFV/2000) Considere as afirmativas
abaixo:
I - A primeira energia de ionização é a
energia necessária para remover um
elétron de um átomo neutro no estado
gasoso.
II - A primeira energia de ionização do
sódio é maior do que a do magnésio.
III - Nos períodos da tabela periódica, o
raio atômico sempre cresce com o
número atômico.
IV - A segunda energia de ionização de
qualquer átomo é sempre maior do que a
primeira.
São afirmativas corretas:
(a) ao número de camadas.
(b) ao número de elétrons da última
camada.
(c) ao número total de prótons.
(d) à mesma estrutura nuclear.
(e) ao número de massa dos elementos.
10) (UFF/2001) Dois ou mais íons ou,
então, um átomo e um íon que
apresentam o mesmo número de
elétrons
denominam-se
espécies
isoeletrônicas.
Comparando-se
as
espécies
isoeletrônicas F-, Na+, Mg2+ e Al3+,
conclui-se que:
(a) a espécie Mg 2+ apresenta o menor
raio iônico;
(b) a espécie Na+ apresenta o menor raio
iônico;
(c) a espécie F- apresenta o maior raio
iônico;
(d) a espécie Al 3+ apresenta o maior raio
iônico;
(e) a espécie Na+ apresenta o maior raio
iônico.
11)
(PUCRJ/2001)
Considere
as
afirmações sobre elementos do grupo IA
da Tabela Periódica:
I- São chamados metais alcalinos.
II- Seus raios atômicos crescem com o
número atômico.
III- Seu potencial de ionização aumenta
com o número atômico.
IV- Seu caráter metálico aumenta com o
número atômico.
Dentre as afirmações, são verdadeiras:
(a) I e II.
(c) I, II e IV.
(e) I, II, III e IV.
(b) III e IV.
(d) II, III e IV.
12) (UFRN/2001) As fotocélulas (ver
esquema abaixo), utilizadas em circuitos
elétricos, são dispositivos que geram e
permitem a passagem da corrente
elétrica
apenas
quando
recebem
iluminação. Funcionam, portanto, como
interruptores de corrente acionados pela
luz, sendo usadas em máquinas
fotográficas, alarmes antifurto, torneiras
automáticas e portas de supermercados.
No pólo negativo da fotocélula, existe
uma camada metálica que facilmente
libera elétrons pela ação da luz.
O metal mais indicado para a construção
dessa camada é:
(a) bário
(b) sódio
(c) estrôncio
(d) potássio
(d) O magnésio possui menor número de
prótons.
(e) O magnésio e o alumínio, na
configuração eletrônica, pertencem ao
bloco d.
14)
(UERJ/2002)
A
tabela
de
Mendeleiev, ao ser apresentada à
Sociedade Russa de Química, possuía
espaços em branco, reservados para
elementos ainda não descobertos.
A tabela foi assim organizada a partir
da crença de Mendeleiev na existência
de relações periódicas entre as
propriedades
físico-químicas
dos
elementos.
Dois
dos
elementos,
então
representados pelos espaços em branco,
hoje são conhecidos como gálio (Ga) e
germânio (Ge).
Mendeleiev havia previsto, em seu
trabalho original, que tais elementos
teriam
propriedades
químicas
semelhantes, respectivamente, a:
(a) estanho (Sn) e índio (In)
(b) alumínio (Al) e silício (Si)
(c) cobre (Cu) e selênio (Se)
(d) zinco (Zn) e arsênio (As)
13) (UNIRIO/2002) "Quando o relógio
soar à meia-noite de hoje, a explosão de
13.480 bombas espalhadas ao longo da
Praia de Copacabana produzirá um show
de luzes e cores no céu carioca, abrindo
as portas para o novo milênio. (...)
Partículas de óxidos de MAGNÉSIO e
ALUMÍNIO, resultantes da queima de
fogos, flutuarão na atmosfera podendo
ser aspiradas por algumas pessoas. A
inalação dessas substâncias poderá
desencadear acessos de tosse e
espirros, além de reações alérgicas..."
("Jornal do Brasil" / 2000)
Em relação aos dois elementos
químicos assinalados no texto acima,
qual a opção correta:
(a) O alumínio possui maior raio atômico.
(b)
O
magnésio
possui
maior
eletronegatividade.
(c) O alumínio é um ametal.
15) (UNIRIO/2004) A presença da
cianobactéria 'Microcystis' em um corpo
d'água é indesejável, pois além de ser
um sinal de eutrofização, ela libera
substâncias tóxicas ao homem, o que faz
com que o tratamento da água seja
bastante dispendioso.
Por outro lado, numa determinada
pesquisa,
foi
verificado
que
a
'Microcystis' retira metais pesados da
água
e,
quanto
maior
a
eletronegatividade do metal estudado,
maior foi a capacidade de absorção
deste pela cianobactéria.
Considerando os dados acima,
assinale a alternativa que indica o
número atômico do metal estudado que
apresentou a maior capacidade de
absorção pela cianobactéria.
(a) Z = 29
(d) Z = 23
(b) Z = 27
(e) Z = 21
(c) Z = 25
16) (UFF/2004) Vários óxidos anfóteros
(óxidos que reagem com ácidos e bases
e não reagem com a água) apresentam
importância econômica, tais como: Al2O3
é matéria prima da qual se extrai o
alumínio; Cr2O3 é fonte de cromo usado
na fabricação de aço inox; ZnO utilizado
em pomadas medicinais; PbO em
baterias e o MnO2 em pilhas e nas
baterias alcalinas.
Dentre os elementos químicos
constituintes dos óxidos mencionados
acima, assinale os de transição externa:
(a) Al, Pb, Zn
(c) Cr, Pb, Mn
(e) Al, Pb, Cr
tem implicações diretas sobre outras
propriedades periódicas importantes, tais
como
energias
de
ionização
e
eletronegatividade. A figura a seguir
ilustra a variação dos raios atômicos para
os elementos representativos (excluídos
os metais de transição):
(b) Cr, Zn, Mn
(d) Mn, Al, Pb
17) (UFF/2004) Os elementos químicos
prestam-se a inúmeras aplicações
relacionadas ao nosso cotidiano. Para se
montar, por exemplo, uma célula
fotoelétrica - dispositivo capaz de gerar
uma corrente ou tensão elétrica, quando
excitado por luz - são utilizados para
constituir o anodo, metais como o
Rubídio (Rb) e o Césio (Cs), sobre os
quais a luz incidirá.
A utilização desses elementos está no
fato de apresentarem:
(a) pequenos raios atômicos.
(b) elevados potenciais de ionização.
(c) elevada eletroafinidade.
(d) elevada eletronegatividade.
(e) baixos potenciais de ionização.
Analisando a figura acima, assinale a
afirmativa incorreta:
(a) O elemento césio tem energia de
ionização bem menor que o elemento
flúor.
(b) O oxigênio é mais eletronegativo que
o alumínio.
(c) As energias de ionização diminuem,
nas colunas, com o aumento dos raios
atômicos.
(d) A eletronegatividade aumenta nos
períodos com a diminuição dos raios
atômicos.
(e) Os átomos de cloro perdem elétrons
mais facilmente do que os de cálcio.
20) (FGV/2005) A figura apresenta uma
parte da tabela periódica:
18)
(UERJ/2004)
Dois
íons
monoatômicos hipotéticos, formados por
um mesmo elemento químico, são
identificados como A e B. Se o raio do
íon A é maior que o raio do íon B, A e B
podem
ser,
respectivamente,
classificados como:
(a) ânion bivalente e ânion trivalente
(b) cátion bivalente e ânion bivalente
(c) ânion trivalente e cátion monovalente
(d) cátion bivalente e cátion monovalente
19) (UFV/2004) O raio atômico é uma
propriedade periódica fundamental, pois
Dentre os elementos considerados,
aquele que apresenta átomo com maior
raio atômico e aquele que apresenta a
primeira energia de ionização mais alta
são, respectivamente:
(a) Ge e O.
(d) P e C.
(b) Ge e Br.
(e) C e Se.
(c) Br e Se
21)
(UFRRJ/2006)
Os
telefones
celulares, telefones sem fio, relógios,
controles remotos, são alguns dos
equipamentos que funcionam com
baterias à base de Lítio (Li).
Considerando o íon Li+ e a posição do
elemento na tabela periódica, é incorreto
afirmar que esse íon:
(a) apresenta 1 nível completamente
preenchido.
(b) tem um núcleo com 3 prótons.
(c) tem a mesma configuração eletrônica
que o átomo de Hélio.
(d) apresenta números iguais de prótons
e elétrons.
(e) quando se liga com o íon cloreto,
forma um composto iônico.
22) (UERJ/2006) Na Tabela de
Classificação Periódica, as fileiras
horizontais correspondem aos períodos,
e as colunas verticais, aos grupos ou
famílias. Nos períodos, os elementos são
dispostos em ordem crescente de seus
números atômicos.
Considere três elementos químicos
cujos
números
atômicos
são
representados por x, y e t.
Na equação 2x + 2y + 2t = 7×164, y é o
número atômico de um elemento químico
da família denominada:
(a) alcalinos
(b) halogênios
(c) calcogênios
(d) gases nobres
24) (PUCRJ/2006) Assinale a alternativa
falsa sobre o elemento sódio.
(a) O sódio é um elemento metálico da
família dos elementos alcalinos.
(b) O sódio reage com a água
produzindo um hidróxido cuja fórmula é
NaOH, que é uma base forte.
(c) O pH de uma solução aquosa de
hidróxido de sódio tem valor maior do
que 7.
(d) O sódio é um elemento mais
eletronegativo que o oxigênio.
(e) A distribuição eletrônica do sódio é
1s2 2s2 2p6 3s1.
25) (UERJ/2007) Um estudante observou
algumas
propriedades
de
um
determinado metal Me:
- reagir facilmente com os halogênios;
- formar peróxido do tipo Me2O2;
- apresentar elevada eletropositividade.
Esse elemento, na Tabela de
Classificação Periódica, está localizado
na seguinte coluna:
23) (FGV/2006) A tabela apresenta três
propriedades
relacionadas
a
três
elementos.
As propriedades X, Y e
correspondem, respectivamente, a:
(a) raio atômico, primeira energia de
ionização e raio iônico.
(b) raio atômico, eltronegatividade e
afinidade eletrônica.
(c) raio iônico, afinidade eletrônica e raio
atômico.
(d) raio iônico, primeira energia de
ionização e raio atômico.
(e) eletronegatividade, raio atômico e
afinidade eletrônica.
Z
(a) 1
(b) 2
(c) 6
(d) 8
26) (UERJ/2007) Um átomo do elemento
químico x, usado como corante para
vidros, possui número de massa igual a
79 e número de nêutrons igual a 45.
Considere um elemento y, que possua
propriedades químicas semelhantes ao
elemento x.
Na Tabela de Classificação Periódica, o
elemento y estará localizado no seguinte
grupo:
(a) 7
(b) 9
(c) 15
(d) 16
27) (CFTMG/2007) Sobre os elementos
A, B e C de números atômicos
consecutivos e localizados em um
mesmo período da tabela periódica, é
correto afirmar que:
(a) A é o elemento de maior raio atômico.
(b) A será um gás nobre, se B for um
halogênio.
(c) C será um calcogênio, se A for um
metal alcalino.
(d) C apresenta a primeira energia de
ionização menor.
28) (PUCRS/2007) Com relação à
classificação periódica dos elementos,
pode-se afirmar que:
(a) o rubídio é o elemento de menor raio
do 5º período.
(b) o silício é mais eletronegativo que o
enxofre.
(c) o xenônio é o elemento de maior
energia de ionização do 5º período.
(d) o chumbo é mais eletropositivo que o
bário.
(e) o magnésio é menos reativo que o
alumínio.
29) (UNIFESP/2007) Na tabela a seguir,
é reproduzido um trecho da classificação
periódica dos elementos.
A partir da análise das propriedades
dos elementos, está correto afirmar que:
(a) a afinidade eletrônica do neônio é
maior que a do flúor.
(b)
o
fósforo
apresenta
maior
condutividade elétrica que o alumínio.
(c) o nitrogênio é mais eletronegativo que
o fósforo.
(d) a primeira energia de ionização do
argônio é menor que a do cloro.
(e) o raio do íon Al3+ é maior que o do íon
Se2-.
30) (PUCRS/2008) Diuréticos são
substâncias que estimulam a excreção
de íons como Na+, K+, Cl- e HCO3-. É
correto afirmar que:
(a) o íon sódio tem raio maior que o
átomo que lhe deu origem.
(b) o íon potássio tem raio maior que o
íon cloreto.
(c) o íon hidrogeno-carbonato, ao se
combinar com o íon sódio, dá origem a
um composto ácido.
(d) o íon potássio e o íon cloreto são
espécies isoeletrônicas.
(e) o íon cloreto tem raio menor que o
átomo que lhe deu origem.
GABARITO
EXERCÍCIOS DE CLASSIFICAÇÃO
PERIÓDICA
QUESTÕES OBJETIVAS
1–A
2–C
3–E
4–B
5–A
6–B
7–D
8–B
9–B
10 – C
11 – C
12 – D
13 – D
14 – B
15 – A
16 – B
17 – E
18 – C
19 – E
20 – A
21 – D
22 – B
23 – A
24 – D
25 – A
26 – D
27 – A
28 – C
29 – C
30 – D
EXERCÍCIOS
CLASSIFICAÇÃO PERIÓDICA
QUESTÕES DISCURSIVAS
1) (UERJ/1998) As
fotocélulas são
dispositivos largamente empregados
para acender lâmpadas, abrir portas,
tocar campainhas etc. O seu mecanismo
baseia-se
no
chamado
"efeito
fotoelétrico", que é facilitado quando se
usam metais com energia de ionização
baixa. Os metais que podem ser
empregados para esse fim são: sódio,
potássio, rubídio e césio.
a) De acordo com o texto anterior, cite o
metal mais eficiente para fabricação das
fotocélulas, indicando o nome da família
a que ele pertence, de acordo com a
Tabela de Classificação Periódica.
_________________________________
_________________________________
b) Escreva a fórmula mínima e o nome
do composto formado pelo ânion O2- e o
cátion potássio.
_________________________________
_________________________________
_________________________________
b) Escreva a fórmula e o nome do sal
composto pelos elementos lítio, carbono
e oxigênio, sabendo que o carbono se
encontra no seu mais alto grau de
oxidação.
_________________________________
_________________________________
3) (UFRJ/2000) O desenvolvimento da
ciência depende tanto da formulação de
teorias
quanto
de
experimentos
rigorosamente realizados; por esse
motivo, a produção e a interpretação de
dados obtidos experimentalmente deve
ser o fundamento básico do ensino da
Química.
A tabela a seguir fornece valores
experimentais das 1ª, 2ª e 3ª energias de
ionização dos cinco únicos metais
localizados no segundo e no terceiro
períodos da classificação periódica,
representados pelas letras A, B, C, D e
E.
_________________________________
_________________________________
2) (UFRJ/1999) A tabela a seguir
complementa as informações contidas no
primeiro e segundo períodos da tabela
periódica e mostra os raios atômicos, em
picômetros, de alguns elementos:
a) Identifique o elemento representado
pela letra C e apresente a equação da
sua reação com o ácido clorídrico.
_________________________________
_________________________________
Note que, nas colunas verticais, os raios
atômicos crescem de cima para baixo e,
nas linhas horizontais, os raios atômicos
crescem da direita para a esquerda.
a) Explique por que o raio atômico do
elemento sódio é maior do que o raio
atômico do elemento cloro.
b) Escreva a fórmula e classifique o
óxido do elemento representado pela
letra A.
_________________________________
_________________________________
4) (UFRJ/2001) O quadro a seguir
relaciona em ordem crescente os raios,
em
picômetros,
dos
íons
correspondentes aos elementos do 2º e
3º períodos da tabela periódica
pertencentes aos grupos 1A, 2A, 6A e
7A.
Observe que os metais alcalinos
formam íons 1+, os alcalino-terrosos 2+,
os halogênios 1- e os calcogênios 2-.
a) Escreva a fórmula molecular e o nome
da substância formada pelos elementos
IV e VI.
a capacidade de substituir o cálcio em
seus compostos.
a) A partir da estrutura atômica dos dois
elementos, explique por que o estrôncio
pode ser utilizado no lugar do cálcio.
_________________________________
_________________________________
_________________________________
_________________________________
b) Uma alternativa a sais de estrôncio no
procedimento anterior para estudar a
osteoporose é utilizar sais de cálcio
radioativo. O isótopo 47 desse elemento,
por exemplo, decai emitindo uma
partícula beta e formando um elemento
X. Baseado na equação de decaimento
apresentada a seguir, dê o número
atômico e o número de massa do
elemento X.
20
_________________________________
_________________________________
b) Identifique, com base nas diferenças
de eletronegatividades, o tipo de ligação
existente entre os átomos do composto
formado pelos elementos III e VII.
Justifique sua resposta.
_________________________________
_________________________________
5) (UFRJ/2001) Cálcio é um dos
elementos principais da estrutura óssea
dos seres humanos. Uma doença muito
comum
em
pessoas
idosas,
principalmente em mulheres após a
menopausa, é a osteoporose, que
consiste na desmineralização óssea
causada pela perda de Ca+2, provocando
fraturas freqüentes e encurvamento da
coluna vertebral.
Uma das formas utilizadas pelos médicos
para estudar a osteoporose consiste em
administrar aos pacientes uma dieta
contendo
sais
de
estrôncio
e
acompanhar a taxa de absorção do
mesmo pelo organismo. O estrôncio tem
Ca 47 X +
-1
e0
_________________________________
_________________________________
_________________________________
6) (UFRRJ/2001) Considere as seguintes
configurações eletrônicas dos átomos
dos elementos químicos genéricos (X, Y,
Z, T e V), no estado fundamental:
X → 1s2.
Y → 1s2 2s2 2p6 3s2 3p64s2.
Z → 1s2 2s2 2p6 3s2
T → 1s2 2s2 2p6
V → 1s2 2s2 2p5
a) Indique o elemento que apresenta a
maior energia de ionização e o elemento
que apresenta a menor energia de
afinidade. Justifique.
_________________________________
_________________________________
_________________________________
_________________________________
b) Estabeleça a ordem crescente de
raios das espécies isoeletrônicas: V-1, Z2+
e T. Justifique.
_________________________________
_________________________________
_________________________________
_________________________________
c) Qual dentre os elementos (X, Y, Z, T e
V) é o mais eletronegativo? Justifique.
_________________________________
_________________________________
d) Dentre os elementos (X, Y, Z, T e V),
quais apresentam, para o elétron mais
energético,
o
número
quântico
secundário igual a 1. Explique.
_________________________________
_________________________________
7) (UERJ/2002) Há alguns anos já estão
disponíveis no comércio os compact
discs - cd - regraváveis, que permitem
até 1000 utilizações. O material metálico
do cd tradicional de áudio é o alumínio
(Al), e o dos regraváveis é uma liga
metálica contendo os elementos prata
(Ag), índio (In), antimônio (Sb) e telúrio
(Te).
a) Represente o íon do índio que é
isoeletrônico da prata e escreva,
segundo a regra do octeto, a fórmula do
óxido formado pelo elemento alumínio.
_________________________________
_________________________________
b) Dentre os elementos químicos citados
no texto, indique o número atômico
daquele que apresenta o menor número
de camadas eletrônicas e a família a que
pertence o de maior raio atômico.
_________________________________
_________________________________
8) (UFRJ/2003) O carbono apresenta
diferentes formas cristalinas alotrópicas.
O diamante, de ocorrência natural rara,
tem a mesma estrutura cristalina do
silício e do germânio, os quais podem ser
empregados
na
fabricação
de
dispositivos
semicondutores.
Recentemente, foi descoberto como
produzir diamante com pureza suficiente
para, também, ser utilizado na fabricação
de semicondutores.
Identifique, entre os três elementos
químicos mencionados, aquele que
pertence ao terceiro período da tabela
periódica. Escreva seu símbolo e o
número total de elétrons do seu nível
mais energético.
_________________________________
_________________________________
9) (UFRJ/2004) As telas de televisão
plana e de telefones celulares usam
como visores os chamados OLED, que
são equivalentes a "microlâmpadas"
coloridas, formadas por camadas de
compostos metalorgânicos depositadas
entre dois eletrodos.
Um dos metais mais utilizados
como emissor de fótons é o alumínio,
ligado a um composto orgânico, a
quinolina [Al(quinolina)3].
a) Em sistemas semelhantes, pode-se
variar a cor da luz emitida substituindo-se
o alumínio por outro metal de mesma
valência.
Escreva a configuração eletrônica do íon
Al3+ e indique, entre os íons a seguir,
qual poderia substituir o alumínio nesses
sistemas.
K+, Ca2+, Sc2+, Ti4+, V5+, Mn4+,
Fe3+, Co2+, Ni2+ e Cu2+.
_________________________________
_________________________________
_________________________________
b) A emissão de luz nesses dispositivos
pode ser explicada pelo modelo de Bohr.
O diagrama de energia (figura 1) referese ao OLED de [Al(quinolina)3].
Com base no diagrama de energia
referente ao OLED de [Al(quinolina)3] e
utilizando o gráfico de conversão e a
escala de cores (figura 2), determine o
comprimento de onda — e a cor da luz
emitida pelo OLED de [Al(quinolina)3].
efeitos de som, luz, cor e forma
planejados, é necessária uma seleção
precisa dos produtos químicos que serão
utilizados.
A cor da luz emitida durante a queima
depende das substâncias usadas nos
fogos de artifício.
A tabela a seguir apresenta algumas
dessas substâncias e suas respectivas
cores:
_________________________________
_________________________________
10) (UFRJ/2005) Um professor decidiu
decorar seu laboratório com um "relógio
de Química" no qual, no lugar das horas,
estivessem alguns elementos, dispostos
de acordo com seus respectivos
números atômicos, como mostra a figura.
Indique a hora que o relógio do professor
marca quando:
a) o ponteiro dos minutos aponta para o
elemento de menor número atômico e o
ponteiro das horas aponta para o
elemento mais eletronegativo.
_________________________________
b) O ponteiro dos minutos aponta para o
metal alcalino terroso de menor raio
atômico e o ponteiro das horas aponta
para o gás nobre do segundo período.
_________________________________
11) (UFRJ/2005) Fogos de artifício são
muito utilizados em grandes eventos ao
ar livre. Para que os fogos produzam os
Num espetáculo de queima de fogos de
artifício, quatro foguetes estouram em
seqüência. A substância escolhida,
dentre as apresentadas nessa tabela,
para se obter a cor desejada, pode ser
assim descrita:
1º foguete: sal de cozinha;
2º foguete: sal de um metal de transição;
3º foguete: substância cujo metal
pertença ao quinto período;
4º foguete: substância metálica cuja
configuração eletrônica é 1s2 2s2 2p6 3s2
3p1
Indique a substância usada em cada
foguete.
_________________________________
_________________________________
_________________________________
_________________________________
12) (UFRJ/2006) Vamos preencher as
quatro primeiras quadrículas a seguir
com símbolos de elementos químicos.
O elemento da quinta quadrícula é o
enxofre. Os outros são:
Quadrícula 1: o elemento de transição
interna cuja configuração eletrônica é:
[Rn] 5f2 6d1 7s2.
Quadrícula 2: o metal alcalino terroso
com maior raio atômico.
Quadrícula 3: o elemento do bloco s, do
segundo
período,
com
maior
eletronegatividade.
Quadrícula 4: o elemento do grupo 15
cujo estado físico de ocorrência natural é
gasoso.
Preencha
as
quadrículas
correspondentes.
13) (UFRJ/2007) Considere as espécies
químicas apresentadas a seguir.
S2-; Ar; Fe3+; Al3+; Cl-
I - É metal alcalino.
II - É líquido na temperatura ambiente.
III - É o de menor potencial de ionização
do grupo 15.
IV - É radioativo, usado em usinas
nucleares.
V - Aparece na natureza na forma de gás
monoatômico.
VI - É lantanídeo.
I-
III -
V-
II -
IV -
VI -
15) (UERJ/2008) Observe, na tabela a
seguir, alguns minerais e suas fórmulas
químicas.
a) Identifique, com o auxílio da Tabela
Periódica, as espécies isoeletrônicas,
apresentando-as em ordem decrescente
de raio.
_________________________________
_________________________________
b) Identifique, dentre as espécies
químicas cujos elementos pertencem ao
terceiro período, aquela que apresenta o
menor potencial de ionização. Justifique
sua resposta.
_________________________________
_________________________________
_________________________________
14)
(UFRJ/2008) O livro
"A Tabela
Periódica", de Primo Levi, reúne relatos
autobiográficos e contos que têm a química
como denominador comum. Cada um de
seus 21 capítulos recebeu o nome de um dos
seguintes elementos da tabela periódica:
Argônio, Hidrogênio, Zinco, Ferro, Potássio,
Níquel, Chumbo, Mercúrio, Fósforo, Ouro,
Cério, Cromo, Enxofre, Titânio, Arsênio,
Nitrogênio, Estanho, Urânio, Prata, Vanádio,
Carbono.
Escreva o símbolo do elemento que dá
nome a um capítulo e corresponde a
cada uma das seis descrições a seguir.
Esses minerais foram separados em dois
grupos:
grupo X - minerais cuja fórmula química
contém um elemento do quarto período
da tabela periódica;
grupo Y - minerais que não apresentam
essa característica.
Escreva a equação química completa e
balanceada da reação entre o ácido
clorídrico e o mineral do grupo X cujo
cátion corresponde ao elemento de
menor eletronegatividade. Em seguida,
relacione os minerais do grupo Y em
ordem crescente de raio atômico dos
elementos correspondentes a seus
cátions.
_________________________________
_________________________________
_________________________________
GABARITO
1) a) Metal: Césio ou Cs
Nome da família: Metais Alcalinos
b) Fórmula mínima: K2O
Nome do composto: óxido de potássio
2) a) Ambos apresentam elétrons em 3
níveis de energia. Como o sódio tem
uma carga nuclear menor, ele atrai
menos os elétrons, resultando em um
raio atômico maior.
b) Li2CO3 (Carbonato de Lítio)
3) a) 12Mg e Mg + 2 HCl MgCl2 + H2
b) Al2O3 óxido anfótero.
4) a) Na2O óxido de sódio
b) MgCl2 E= 3,0 – 1,2 = 1,8
ligação iônica (E 1,7)
5) a) Cálcio e estrôncio são elementos
representativos da mesma coluna da
tabela periódica (ou mesma família),
apresentando,
portanto
a
mesma
distribuição eletrônica na camada de
valência
e
conseqüentemente,
propriedades químicas semelhantes.
fica menor. Quando um átomo recebe
elétrons, os elétrons já existentes
provocam uma certa repulsão. Portanto,
o raio fica maior.
Logo, o T como não recebe nem cede
elétrons ficará entre Z e V.
c) O elemento mais eletronegativo é o
V porque tem maior facilidade de receber
elétron para atingir a configuração de gás
nobre.
d) Os elementos que apresentam para
o elétron mais energético o número
quântico secundário=1 são: o T e o V,
porque o elétron mais energético está no
subnível p.
7) a) In 2+ e Al2O3 b) Z = 13 e 1B ou 11
8) Silício (Si). Número de elétrons no
nível mais energético: 4
9) a) Al3+ = 1s2 2s2 2p6 ou [Ne]
O Fe3+ apresenta a mesma valência
do Al3+, logo o íon ferro pode substituir o
íon alumínio.
b) O comprimento de onda é de 520
nm o que corresponde ao verde.
10) a) 9h 05min. b) 10h 20min.
b) Com a emissão de uma partícula
beta há o acréscimo de uma unidade no
número atômico, sem, contudo acarretar
mudanças no número de massa. Ou
seja, o elemento X terá número de
massa 47, e número atômico 21.
Consultando a tabela periódica revela ser
este elemento o Escândio.
11) 1º foguete: cloreto de sódio;
2º foguete: cloreto de cobre (I);
3º foguete: carbonato de estrôncio;
4º foguete: alumínio.
6) a) O elemento que apresenta a maior
energia de ionização é o X e o elemento
de menor energia de afinidade é o Y.
Pois X possui o menor raio atômico e Y
apresenta maior raio atômico com
apenas 2 elétrons na última camada.
13) a) Espécies isoeletrônicas: S2-, Ar,
Ca2+, Cl-; ordem decrescente de raio: S2> Cl- > Ar > Ca2+.
b) Ordem crescente de raio: Z, T, V
ou Z2+, T, V -1.
Quando um átomo cede elétrons os
elétrons restantes serão mais atraídos
pelo núcleo (contração). Portanto, o raio
14)
12)
b) S2-. Quanto maior o raio, maior a
facilidade de retirar o elétron.
I–K
III – As
V – Ar
II – Hg
IV – U
VI – Ce
15) CaCO3 + 2 HCl→ CaCl2 + H2O + CO2
Quartzo, galena e barita.