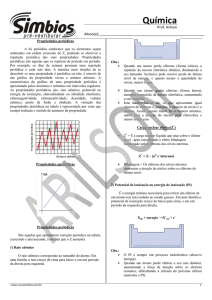
A TABELA PERIÓDICA
MODERNA
Henry G.J. Moseley (1913)
As propriedades físicas e
químicas dos elementos
variam periodicamente em ordem
crescente de seus
números atômicos.
Estrutura da Tabela Periódica
A tabela periódica relaciona os elementos em linhas chamadas
períodos e colunas chamadas grupos ou famílias, em ordem
crescente de seus números atômicos.
Períodos
Os elementos de um mesmo período têm o mesmo número de
camadas eletrônicas, que corresponde ao número do
período.Existem sete períodos, cada um correspondendo a uma das
camadas eletrônicas da eletrosfera.
Os períodos são:
(1ª) Camada K
(2ª) Camada L
(3ª) Camada M
(4ª) Camada N
(5ª) Camada O
(6ª) Camada P
(7ª) Camada Q
Grupos
Antigamente, chamavam-se "famílias".
Os elementos do mesmo grupo têm o mesmo número de
elétrons na camada de valência (camada mais externa).
Assim, os elementos do mesmo grupo possuem
comportamento químico semelhante.
Existem 18 grupos sendo que o elemento químico
hidrogênio é o único que não se enquadra em nenhuma
família e está localizado em sua posição apenas por ter
número atômico igual a 1, isto é, como tem apenas um
elétron na última camada, foi colocado no Grupo 1,
mesmo sem ser um metal.
METAIS - mais de 70%
• sólidos a 25ºC e 1 atm ( exceto o Hg )
• em geral duros
• brilho metálico
• densos
• PF e PE altos
• bons condutores de calor
• bons condutores de eletricidade
• maleáveis
• dúcteis
• formam íons positivos
AMETAIS – 11 %
• propriedades opostas aos metais
• mais abundantes na natureza
• sólidos C, P, S, Se e I
• líquidos Br
• gasosos H, N, O, F e Cl
SEMIMETAIS
• propriedades intermediárias entre os metais
e os não metais
• todos são sólidos em condições ambientes
• B, Si, Ge, As, Sb, Te e Po
GASES NOBRES
• POUCO REATIVOS
( ESTABILIDADE QUÍMICA )
• POSSUEM OITO ELÉTRONS NA CAMADA
DE VALÊNCIA, EXCETO
O HÉLIO QUE POSSUI DOIS ELÉTRONS
• He, Ne, Ar, Kr, Xe e Rn
CLASSIFICAÇÃO DOS ELEMENTOS
(de acordo com sua configuração eletrônica)
Elementos representativos:
Pertencentes aos grupos 1, 2 e dos grupos de 13 a 17.
Elementos de transição externa:
Pertencentes aos grupos de 3 a 12.
Elementos de transição interna:
Pertencentes às séries dos lantanídeos e dos actinídeos.
Gases nobres:
Pertencentes ao grupo 18.
CLASSIFICAÇÃO DOS ELEMENTOS
1 – ELEMENTOS TÍPICOS, CARACTERÍSTICOS
OU REPRESENTATIVOS ( subgrupo A )
• possuem camadas internas completas
• possuem seus elétrons de diferenciação em :
Subníveis s ( colunas 1 e 2 )
Subníveis p ( colunas 13 a 18 )
• o número de elétrons na última camada eletrônica
É igual ao próprio número da coluna.
Na (Z = 11) - 1s22s22p63s1
F (Z = 9 ) - 1s22s22p5
2 – ELEMENTOS DE TRANSIÇÃO ( Subgrupo B )
• TRANSIÇÃO
SIMPLES OU EXTERNA
Elétrons de diferenciação em subnível “ d ” da penúltima
camada.
Pertencentes aos grupos de 3 a 12.
Fe (Z=26) - 1s22s22p63s23p64s23d6
•TRANSIÇÃO INTERNA
( Lantanídeos e Actinídeos )
Elétrons de diferenciação em subnível “ f ”
da antepenúltima camada
La(Z=57) 1s22s22p63s23p64s23d104p65s24d105p66s24f1
CISURÂNICOS E TRANSURÂNICOS
• Elementos cisurânicos – elementos
artificiais com
números atômicos menores que a do urânio.
( Tc, Pm, At e Fr )
• Elementos transurânicos – elementos
artificiais com
números atômicos maiores que a do urânio.
PROPRIEDADES APERIÓDICAS DOS
ELEMENTOS
São as propriedades cujos valores só aumentam ou só
diminuem com o número atômico, são propriedades que não
se repetem em ciclos ou períodos.
MASSA ATÔMICA
Cresce à medida que o número atômico aumenta (massa atômica
é a massa do átomo medida em unidades de massa atômica, u);
PROPRIEDADES PERIÓDICAS
DOS ELEMENTOS
São propriedades que variam em
função do número atômico, atingindo
valores máximos e mínimos, de acordo
com o período ocupado pelos
elementos.
1. RAIO ATÔMICO
2. ENERGIA DE IONIZAÇÃO
3. ELETROAFINIDADE
4. ELETRONEGATIVIDADE
5. ELETROPOSITIVIDADE
6. DENSIDADE
7. VOLUME ATÔMICO
8. PF e PE
O raio atômico aumenta
da direita para a esquerda ao longo dos períodos
e de cima para baixo ao longo dos grupos.
O volume atômico corresponde ao volume de
6,02 x 1023 átomos do elemento no estado sólido mais
o volume dos espaços vazios entre esses átomos.
Nos períodos, a densidade aumenta das
extremidades para o centro;
nos grupos, ela aumenta de cima para baixo.
O PF e PE nos grupos aumenta de cima para baixo,
exceto 1A e 2A ; nos períodos
das laterais para o centro.
Ao longo dos períodos, o potencial de ionização
aumenta da esquerda para a direita;
ao longo dos grupos, ele aumenta de baixo para
cima.
Eletroafinidade ou afinidade eletrônica é a
energia liberada por um átomo
no estado gasoso, quando este recebe
elétrons.
Eletronegatividade é a capacidade que um átomo
tem, de atrair elétrons de
outro átomo quando os dois formam uma ligação
química.
01) Entre os diagramas a seguir, relacionados com a
tabela periódica, quais estão corretos?
a) II e V
b) II e III
c) I e V
d) II e IV
e) III e IV
X
02) Em um bate-papo na Internet, cinco estudantes de química
decidiram não revelar seus nomes, mas apenas as duas primeiras
letras, por meio de símbolos de elementos químicos. Nas
mensagens, descreveram algumas características desses
elementos.
- É produzido, a partir da bauxita, por um processo que consome muita
energia elétrica. Entretanto, parte do que é produzido, após utilização, é
reciclado.
- É o principal constituinte do aço. Reage com água e oxigênio, formando
um óxido hidratado.
- É o segundo elemento mais abundante na crosta terrestre. Na forma de
óxido, está presente na areia. É empregado em componentes de
computadores.
- Reage com água, desprendendo hidrogênio. Combina-se com cloro,
formando o principal constituinte do sal de cozinha.
- Na forma de cátion, compõe o mármore e a cal.
Os nomes dos estudantes, na ordem em que estão apresentadas as
mensagens, podem ser:
Al
Fe
Si
Na
Ca
03) Para melhorar a tenacidade, a resistência à
corrosão e também a resistência mecânica,
costuma-se colocar Vanádio como constituinte
do aço.
O Vanádio (Z = 23) é um elemento de transição,
pois:
a) é gasoso à temperatura e pressão ambientes.
b) sua camada de valência pode ser
representada por ns 2np 3.
c)
X apresenta o elétron mais energético no
subnível d.
d) apresenta grande afinidade eletrônica.
e) Na classificação periódica, situa-se no 3Ž
período.
04) Qual das opções abaixo apresenta a comparação
ERRADA relativa aos raios de átomos e de íons?
a) raio do Na + 1 < raio do Na.
b) raio do Na + 1 < raio do F - 1.
c) raio do Mg + 2 < raio do O - 2.
d) raio do F - 1 < raio do O - 2.
X
e) raio do F - 1 < raio do Mg + 2.
05) Assinale a(s) alternativa(s) correta(s).
1) Na tabela periódica, as famílias 1 ou IA, 2 ou IIA, 17 ou
VIIA são conhecidas como alcalinos, alcalino-terrosos
e calcogênios, respectivamente.
02) Os átomos 1H, 2H e 3H são isótopos e conhecidos
como hidrogênio ou prótio, deutério e trítio,
respectivamente.
04) Sublimação é a passagem direta do estado sólido
para o gasoso e vice-versa.
08) Na tabela periódica, os elementos químicos são
agrupados em ordem crescente de número atômico,
observando-se a repetição periódica de várias
propriedades.
16) Os íons 13J+ 3 e 9G - 1, com seus
respectivos números atômicos, possuem a
distribuição eletrônica de um gás nobre.
32) Na tabela periódica, de modo geral, a
eletronegatividade aumenta de baixo para cima
nas famílias; aumenta da esquerda para a
direita nos períodos e a eletroafinidade varia da
mesma forma.
62
06) Um astronauta foi capturado por habitantes de um
planeta hostil e aprisionado numa cela, sem seu
capacete espacial. Logo começou a sentir falta de ar. Ao
mesmo tempo, notou um painel como o da figura
em que cada
quadrado era uma
tecla. Apertou duas
delas, voltando a
respirar bem. As
teclas apertadas
foram
a) 1 e 2
b) 2 e 3
c) 3 e 4
d) 4 e 5
e) 5 e 6
X
07) Considere os átomos X, Y e Z. O átomo X é um
metal alcalino, Y representa um elemento do grupo VA
(ou 15) da tabela periódica e Z é um halogênio.
Considere que todos os três átomos pertençam ao
mesmo período (2° ou 3°). A partir destas informações
julgue as afirmativas a seguir:
F
( ) o átomo X possui maior afinidade eletrônica que
o átomo Z
( ) dos três átomos, o átomo Z possui a maior
energia de ionização
( ) os átomos X e Z formarão sólidos cristalinos
iônicos
( ) o íon X + 1 possui raio maior que o íon Y - 3
( ) os átomos Y e Z formam moléculas com ligações
covalentes polares
V
V
F
V
08) A energia de ionização dos elementos químicos é
uma propriedade periódica, isto é, varia regularmente
quando os mesmos estão dispostos num sistema em
ordem crescente de seus números atômicos. O gráfico, a
seguir, mostra a variação da energia de ionização do 1º
elétron, em e.V, para diferentes átomos.
Assinale a(s) proposição(ões) CORRETA(S)
(1) A carga nuclear é o único fator determinante da
energia de ionização.
(02) Selecionando-se três átomos com maior
dificuldade para formarem cátions monovalentes,
teríamos os átomos de He, Li e Na.
X
(04) O potássio é o metal que apresenta o menor
potencial de ionização, entre os elementos
representados.
X
(08) No intervalo Z = 3 a Z = 10, observa-se que o
aumento da carga nuclear tende a aumentar a força
de atração do elétron pelo núcleo.
X
(16) Os elevados valores da energia de ionização para
os gases He, Ne e Ar são evidências de que "camadas
eletrônicas completas" são um arranjo estável.
(32) Considerando os elementos que formam um
período da tabela periódica, a tendência da energia de
ionização é diminuir com o aumento do número
atômico.
X
(64) As menores energias de ionização correspondem
aos metais alcalinos.