Monitorização de drogas terapêuticas
A monitorização de drogas terapêuticas é a medida do nível sérico de uma
droga de forma a garantir uma concentração dentro do intervalo
terapêutico.
O intervalo terapêutico sérico de uma droga é o intervalo de concentrações
no qual se sabe que a droga é eficaz e não causa efeitos tóxicos no
paciente.
Monitorização de drogas terapêuticas
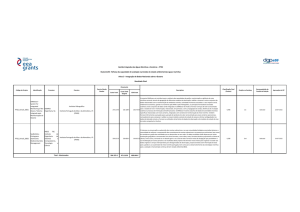
As dez drogas mais frequentemente monitorizadas
Droga
Efeito
1
Cristina V. Almeida
Digoxina
Glicosídeo cardíaco
2
Fenitoina
Antiepilético
3
Ácido valproico
Antiepilético
4
Teofilina
Broncodilatador
5
Vancomicina
Antibiótico
6
Carbamazepina
Antiepilético
7
Gentamicina
Antibiótico
8
Fenobarbital
Antiepilético
9
Lítio
Antidepressivo
10
Tobramicina
Antibiótico
Monitorização de drogas terapêuticas
Razões pelas quais é importante monitorizar a concentração de
determinadas drogas:
Necessidade de manter a concentração da droga dentro do estreito
intervalo terapêutico
Semelhança entre os sintomas de toxicidade e a situação clínica para a
qual a droga é utilizada
Farmacocinética (variações de paciente para paciente)
Confirmação da conformidade do paciente
Monitorização de drogas terapêuticas
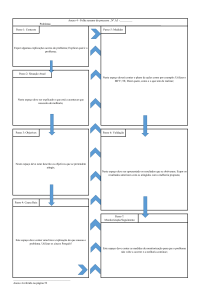
Intervalo terapêutico – representa a relação entre a concentração
mínima efectiva (MEC) e a concentração mínima tóxica (MTC).
Num ciclo terapêutico óptimo, a concentração gamela (a
concentração mais baixa encontrada antes da dose seguinte) não
deve ser inferior à MEC, e o pico de concentração sanguínea
(maior concentração obtida durante um ciclo terapêutico) não
deve ultrapassar a MTC.
Toxicidade ou sintomas da doença? – exemplos de drogas cujos
sintomas de toxicidade são semelhantes aos sintomas clínicos
para os quais são usados, são a digoxina e digotoxina. Os
sintomas de overdose podem incluir taquicardia atrial paroxística,
contracção ventricular prematura, taquicardia ventricular,...
Farmacocinética – é necessário um ajuste da dosagem por causa da
diferente farmacocinética dos pacientes; isto é, a variação de
paciente para paciente na velocidade de absorção, distribuição,
metabolismo, clearence hepática, biotransformação e excreção de
drogas.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Farmacocinética –
Absorção – o processo de absorção depende da dissociação da
droga da sua forma terapêutica, dissolução nos fluídos
gastrointestinais e da difusão através das membranas biológicas
para a corrente sanguínea. A velocidade e extensão da absorção
pode variar consideravelmente dependendo da droga, da matriz
na qual esta presente, e do ambiente fisiológico. A fracção da
droga que é absorvida da corrente sanguínea é referida como
a quantidade biodisponível.
Distribuição – uma vez a droga ter entrado no sistema circulatório, é
distribuída e fica em equilíbrio com muitos dos compostos
sanguíneos. Um grupo importante são as proteínas plasmáticas.
Existe um equilíbrio entre a droga livre e ligada a proteínas. É
geralmente aceite que apenas a fracção livre da droga está
disponível para a distribuição e eliminação.
Drogas acídicas são primariamente ligadas à albumina e as
drogas básicas às globulinas.
Monitorização de drogas terapêuticas
Farmacocinética –
Metabolismo – as drogas são metabolizadas quer por cinéticas de
ordem-um (linear) quer por cinéticas de ordem-zero
(capacidade-limite ou não linear).
As cinéticas de ordem-um são características da maioria das
drogas, e a relação segurança vs dose é fácil de caracterizar.
Cinéticas de ordem-zero requerem uma monitorização mais
apertada dado que pequenas alterações nas dosagens
podem causar alterações desproporcionais na concentração
da droga.
Clearence hepática – as drogas que contam apenas com a clearence
hepática normalmente têm baixa biodisponibilidade.
Qualquer alteração na função hepática (como problemas no
fluxo sanguíneo ou hepatite) pode alterar a clearence dessa
droga e torna a monitorização mais importante.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Farmacocinética –
Biotransformação – o orgão primariamente responsável pelo
metabolismo da maioria das drogas terapêuticas é o fígado. A
molécula da droga pode ser alterada por reacções de fase I, como
oxidação, redução e hidrólise; ou fase II, como glucuronidação e
sulfonação.
A administração terapêutica de drogas pode causar a indução ou
inibição num sistema microssomal hepático individual. O facto de
ser ou não afectado depende de muitos factores, entre os quais os
genéticos desempenham o papel mais importante.
No caso de indução, a droga terapêutica administrada aumenta os
níveis de citocromo P450 e liberta as suas isoenzimas, causando
um aumento na actividade dessas isoenzimas. O resultado é o
aumento do metabolismo de certas drogas terapêuticas e uma
diminuição da sua concentração. Fenobarbital e teofilina são
exemplos de indutores, cada afectando diferentes isoenzimas do
citocromo P450 e logo diferentes drogas terapêuticas.
Monitorização de drogas terapêuticas
Farmacocinética –
Biotransformação –
No caso de inibição das isoenzimas do citocromo P450, os
pacientes que recebem multiplas drogas podem experimentar um
inesperado aumento da concentração de uma droga terapêutica
causada por outra co-administração. Isto deve ser devido à
competição pela mesma isoenzima ou uma redução da isoenzima
devido à co-administração. Exemplos de drogas conhecidas como
inibidores são o cloranfenicol, cimetidina, halopurinol,
eritromicina e ácido valpróico.
Tal como nos indutores de enzimas, a adição ou delecção de uma
droga inibidora num paciente em terapia com drogas requer uma
apropriada monitorização e um ajuste da dose da droga afectada.
Excreção –
A excreção de drogas pode ocorrer através do fígado, intestino,
pulmão ou rins. A excreção renal é a forma principal de excreção
da maioria das drogas hidrófilas e os seus metabolitos. Alterações
na função renal (clearence da creatinina) afectará profundamente
a clearence das drogas. Exemplos de drogas que a sua dosagem é
ajustada atendendo às alterações da clearence da creatinina são
gentamicina, tobramicina, digoxina, vancomicina, amicacina e
ciclosporina.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Conformidade –
A monitorização da conformidade é muito importante, dado muitos
pacientes necessitarem de uma terapia prolongada com drogas.
Pacientes como os epiléticos, asmáticos ou aqueles com doença
cardíaca moderada podem pensar ao sentirem-se melhores que não
necessitam mais da medicação. Como consequência final da não
conformidade é a exacerbação do problema existente e falha no
tratamento.
Monitorização de drogas terapêuticas
Cristina V. Almeida
Monitorização de drogas terapêuticas
Aminoglicosídeos –
São antibióticos bactericidas potentes usados no tratamento de
infecções graves causadas por bacilos aeróbios gram-negativos,
como:
Klebsiella
Serratia
Proteus
Enterobacter
Citrobacter
Actinobacter
A Escherichia coli e Pseudomonas aeruginosa são igualmente
susceptíveis aos aminoglicosídeos.
Os dois aminoglicosídeos mais utilizados são a gentamicina e
tobramicina.
Monitorização de drogas terapêuticas
Aminoglicosídeos –
- Devido à sua elevada polaridade são pouco absorvidos por via
gastrointestinal, sendo normalmente administrados por via
intravenosa e intramuscular de forma a se obter uma maior
biodisponibilidade
- Excreção renal
- t1/2 = 2 a 3 horas
Gentamicina – é usado frequentemente devido à sua eficaz acção
contra gram-negativos e baixo custo.
Os intervalos terapêuticos para a gentamicina são:
- 5 a 8 µg/mL para infecções menos severas
- 8 a 12 µg/mL para infecções mais severas
Toxicidade está associada a concentrações > 12 µg/mL
efeitos tóxicos: nefrotoxicidade e ototoxicidade
Cristina V. Almeida
Monitorização de drogas terapêuticas
Aminoglicosídeos –
Tobramicina – droga de escolha para Pseudomonas aeruginosa.
Os intervalos terapêuticos para a tobramicina são:
- 5 a 8 µg/mL para infecções menos severas
- 8 a 12 µg/mL para infecções mais severas
Toxicidade está associada a concentrações > 12 µg/mL
efeitos tóxicos: nefrotoxicidade e ototoxicidade
Monitorização de drogas terapêuticas
Glicopéptidos –
- Os glicopeptidos são antibióticos de espectro-estreito, activos contra
cocos de gram-positivo e bacilos.
- O glicopeptido mais utilizado é a vancomicina.
- t1/2 = 5 a 6 horas
Vancomicina – é usada no tratamento de infecções graves causadas
por cocos de gram-positivos e bacilos. Devido ao problema das
resistências dos organismos à vancomicina, é recomendado que o
seu uso seja restringido ao tratamento:
• Staphylococcus aureus meticilino-resistente ou infecção
por staphylococcus epidermidis
• Infecções por enterococcus ampicilino-resistente
• Infecções causadas por organismos susceptíveis apenas
à vancomicina como o Corynebacterium jeikium
Os intervalos terapêuticos para a vancomicina são: 5 a 10 µg/mL
Toxicidade está associada a concentrações > 40 µg/mL
efeitos tóxicos: nefrotoxicidade e ototoxicidade
Cristina V. Almeida
Monitorização de drogas terapêuticas
EPILEPSIA
A epilepsia é um grupo de problemas neurológicos caracterizados por
episódios recorrentes ataques, distúrbios sensoriais, comportamento
anormal, perda de consciência ou a combinação de algumas ou de todas as
características citadas.
O que é comum a todos os tipos de epilepsia são:
- descargas eléctricas excessivas dos nervos (células nervosas) do
córtex cerebral
Esta hiperactividade dos nervos pode ocorrer em várias áreas do cérebro e
os efeitos variarão conforme essa localização.
Embora a maioria dos casos de epilepsia não terem causa conhecida, deve
estar associada com uma danificação dos nervos ou problemas com
neurotransmissores.
O neurotransmissor ácido gama aminobutírico (GABA) parece ser
particularmente importante na supressão dos ataques. Existe, igualmente,
evidência experimental que deficiências de outro neurotransmissor, a
serotonina, pode ajudar a promover o ataque epilético.
Monitorização de drogas terapêuticas
EPILEPSIA (cont.)
Existem duas categorias principais da epilepsia:
parcial
generalizada
A medicação a usar difere consoante a categoria.
As 4 drogas citadas a seguir têm monopolizado a terapêutica de prevenção
de ataques epiléticos:
Fenitoina
Ácido valproico
Carbamazepina
Fenobarbital
Por causa da grande variabilidade nas reacções do paciente e a sua
capacidade de metabolização de cada droga, torna a monitorização
essencial para garantir que os níveis séricos permanecem dentro do
intervalo terapêutico.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Carbamazepina –
É usada para tratar ataques simples, parcialmente complexos e
generalizados; ...
É usado sozinho ou em combinação com outras drogas epiléticas.
Apesar do seu mecanismo de acção não ser totalmente conhecido, é
sabido que esta droga bloqueia as respostas pós-sinápticas nas
células nervosas do cérebro.
O intervalo terapêutico para a carbamazepina é 4 a 12 µg/mL
- longo tempo de semi-vida (18 horas)
Amostra – pode ser colhida entre o intervalo de duas doses
(zona da gamela). No entanto, no caso de suspeita de
intoxificação, o pico da concentração correlaciona-se
melhor com a toxicidade.
Colheita 4 a 8 horas após a administração oral da
droga.
Níveis superiores a 15 µg/mL são considerados tóxicos (visão,
parastesias)
Monitorização de drogas terapêuticas
Fenitoina –
É usada para tratar todos os tipos de ataque, excepto a ausência. É
também usado como profilático a seguir a um problema cerebral.
É o antiepilético mais frequentemente usado.
É administrado oralmente ou por injecção intramuscular (fosfenitoina).
A conversão a fosfenitoina a fenitoina completar-se-à entre 2 a 4 horas.
O intervalo terapêutico para a fenitoina é de 10 a 20 µg/mL
A altura da colheita depende do motivo da monitorização. Se
o paciente tem sinais de intoxificação, tem interesse obter o
pico de concentração (4 a 5 horas após a administração da
dose e pode ir até 8 horas se for dado em conjunto com
drogas que aumentem a acidez gástrica).
Níveis superiores a 20 µg/mL são considerados tóxicos, contudo o
nível preciso de toxicidade individual varia dependendo da sua
resposta clínica à droga. Os níveis tóxicos estão associados com
neurotoxicidade, náuseas, vómitos, dificuldade de coordenação,...
Cristina V. Almeida
Monitorização de drogas terapêuticas
Fenobarbital –
É usado para tratar ataques, normalmente em combinação com outras
drogas epiléticas como a carbamazepina, ácido valpróico e fenitoína.
O fenobarbital reduz as transmissões sinápticas, logo diminui a
excitabilidade de toda a célula nervosa.
A tolerância pode aparecer em tratamentos prolongados.
O intervalo terapêutico para o fenobarbital é de 15 a 40 µg/mL
- pico de concentração plasmática ocorre após 4 a 10 horas
- tempo de semi-vida ocorre após 70 a 100 horas
amostragem – devido ao longo t1/2, as concentrações não
se alteram rapidamente, de forma que uma amostra de
soro colhida na zona da gamela é representativa de todo
o efeito.
Níveis superiores a 40 µg/mL são considerados tóxicos.
Monitorização de drogas terapêuticas
Ácido valpróico –
É usado para tratar ataques simples e complexos com ausências;...
É igualmente usado na profilaxia da enxaqueca.
O ácido valpróico pode ser administrado sozinho ou em combinação
com outras drogas antiepiléticas como o fenobarbital ou fenitoína.
O ácido valpróico aumenta a concentração de GABA por inibição das
transaminases GABA.
O GABA é um potente inibidor das descargas pré- e pós-sinápticas no
sistema nervoso central.
O intervalo terapêutico para o ácido valpróico é de 50 a 100 µg/mL
T1/2=12 h (tratamento prolongado)
T1/2=8 h (crianças)
amostra – a amostra ideal é a colhida imediatamente antes da
dose seguinte, normalmente logo pela manhã, de forma
a confirmar se a dose ingerida antes de deitar era a
correcta.
Níveis superiores a 100 µg/mL são considerados tóxicos.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Teofilina –
É um membro de uma classe de drogas designadas como
metilxantinas, e é um dos diversos agentes terapêuticos usados em
situações respiratórias como a asma, doença pulmonar obstrutiva
crónica e apneia neonatal (embora a cafeína seja considerada a droga
de escolha para a apneia neonatal devido à sua baixa toxicidade)
A teofilina exerce o seu efeito por relaxamento dos músculos liso do
tubo bronquial, logo abrindo os brônquios no pulmão facilitando a
respiração. Dilata igualmente os vasos sanguíneos, causando um
aumento dos batimentos cardíacos; o que estimula a respiração.
Pacientes com os mesmos níveis de teofilina não têm necessariamente
os mesmos efeitos terapêuticos ou tóxicos:
•
Dado que a teofilina é excretada primariamente via metabólica
no fígado, factores que afectam o metabolismo hepático
podem levar a um nível sub-terapêutico ou tóxico num
paciente que recebe uma dose que deveria ser efectiva. Estes
factores incluem o tabaco, a idade avançada, outras
terapêuticas, álcool e dieta.
Monitorização de drogas terapêuticas
Teofilina –
•
Variação no tipo de formulação e na via de administração. A
teofilina é administrada intravenosamente como aminofilina, a
qual tem uma grande solubilidade, enquanto que as
preparações orais podem ter uma libertação progressiva
O intervalo terapêutico para a teofilina é de 10 a 20 µg/mL ,
embora níveis entre 5 e 10 µg/mL possam ser eficientes em certos
indivíduos.
- Pico conc. = 2 h (oral, sem comida); pico conc.= 3-5 h (comida)
- t1/2= 4 a 6 h (crianças e fumadores); t1/2= 5 a 9 h (não fumadores)
Níveis superiores a 20 µg/mL são considerados tóxicos. Os efeitos
tóxicos incluem distúrbios gastrointestinais, taquicardia, arritmia
cardíaca e coma.
Cristina V. Almeida
Monitorização de drogas terapêuticas
Digoxina e digitoxina –
São glicosídeos digitálicos usados no tratamento da falha cardíaca
congestiva, taquicardia, fibrilação atrial e palpitações. São usados
devido ao efeito inotrópico positivo (atuam no miocárdio para
aumentar a força e a regularidade das contracções) e a sua capacidade
para alterar conduções através do nódulo atrioventricular (ajuda a
restaurar o ritmo).
Digoxina é normalmente administrada por via oral, mas pode ser
administrada por via intravenosa.
O intervalo terapêutico para a digoxina é de 0,8 a 2,0 ng/mL
(concentrações determinadas no pico das concentrações
tecidulares).
Após administração oral o pico de concentração plasmática
ocorre após 2 a 3 horas e nos tecidos após 6 a 10 horas.
A amostra deve ser colhida após 8 horas ou mais após a
administração da droga de forma a correlacionar com a
concentração tecidular.
Monitorização de drogas terapêuticas
Níveis superiores a 2,0 ng/mL são considerados tóxicos.
Digitoxina tem efeitos e aplicações semelhantes à digoxina. A
digitoxina não é usada com frequência nos Estados Unidos mas é
usada extensivamente na Europa.
O intervalo terapêutico para a digitoxina é de 20 a 35 ng/mL.
Níveis superiores a 35 ng/mL são considerados tóxicos.
- Sintomas de sobredosagem são semelhantes à situação
clínica para que a digitoxina e digoxina são usadas. Pode
incluir taquicardia atrial paroxística,...
Cristina V. Almeida
Monitorização de drogas terapêuticas
Drogas antipsicóticas –
Porque normalmente a resposta a estas drogas é imprevisível e é
difícil de controlar estes pacientes, a monitorização sérica de drogas
pode ajudar no ajuste da terapêutica.
Lítio
- É usado para tratar a fase maníaca de distúrbios afectivos, manias e
doença maníaco-depressiva.
- Aumentam o re-uptake das catecolaminas, reduzindo as suas
concentrações nas junções neuronais.
- A absorção gastrointestinal é completa e o pico da concentração
plasmática é atingido após 2 a 4 horas da administração oral
- Eliminação bifásica: 1ª fase (30 a 40% da dose, t1/2=22h) e 2ª fase
(t1/2=48-72h, Li dentro das células)
Monitorização de drogas terapêuticas
Lítio (cont.)
O intervalo terapêutico para o lítio não está relacionado com a
concentração sérica específica; contudo, a toxicidade está
relacionada com a concentração sérica.
A concentração é monitorizada para assegurar o cumprimento do
paciente e prevenir toxicidade.
Intervalo terapêutico é de 1,0 a 1,2 mmol/L
amostragem: 12 h após a administração
Níveis superiores a 1,5 mmol/L são considerados tóxicos
Cristina V. Almeida
Monitorização de drogas terapêuticas
TÉCNICAS ANALÍTICAS
A evolução da monitorização das drogas terapêuticas (TDM) está
dependente do desenvolvimento de técnicas analíticas rápidas, sensíveis e
específicas.
Estes incluem métodos instrumentais e imunoensaios.
MÉTODOS INSTRUMENTAIS
Cromatografia gás-liquida (GLC) –
vantagem: permite a separação da droga mãe dos metabolitos e a
diferenciação de drogas coadministradas e compostos
endógenos.
desvantagem: complexidade da instrumentação e a necessidade de um
grande volume de amostra (hoje em dia já não é verdade).
Cromatografia líquida de alta eficiência (HPLC) e Electroforese capilar (CE)–
vantagem: elevada versatilidade com uma preparação mínima da
amostra. Alta especificidade e sensibilidade.
Monitorização de drogas terapêuticas
IMUNOENSAIOS
Radioimunoensaios (RIA) –
vantagem: permitem a quantificação da concentração de drogas em
microlitros de soro, numa concentração de nanogramas por
mililitro.
desvantagem: complexidade, falta de técnicas RIA para uma série de
drogas.
Imunoensaios não isotópicos –
vantagem: microcapacidade, especificidade, rapidez, fácil manipulação
e adaptável a analisadores automáticos.
A maioria do TDM é feita usando estas técnicas
Cristina V. Almeida
Monitorização de drogas de abuso
O abuso de drogas ilícitas (substâncias ilícitas), pode ser definido como o
uso de um produto químico para conseguir um efeito farmacológico
desejado mas inapropriado (efeitos psíquicos, dependência, tentativas de
suicídio), originando um padrão patólogico de uso e uma deterioração da
actividade social ou laboral.
O uso compulsivo destas drogas de abuso conduz a :
•
dependência psicológica (satisfação e desejo veemente de
consumir),
•
dependência fisiológica (sintomas de privação) e
•
tolerância (necessidade de aumentar a dose para obter os
efeitos desejados).
Monitorização de drogas de abuso
INTOXICAÇÃO POR ETANOL
O álcool (CH3CH2OH) é provavelmente a droga mais antiga que se conhece
INTOXICAÇÃO POR OPIACEOS
As propriedades do ópio são conhecidas à centenas de anos.
Nos jeroglíficos Egipcios e nos papiro de Ebers menciona-se o jogo de ópio
como analgésico e para acalmar os bébés. A morfina começou a utilizar-se
como potente analgésico nas guerras civil americana e na franco-prussiana
de 1870
O seu maior efeito indesejável é o desenvolvimento de tolerância e produzir
dependência física e psíquica.
Fentanilo
Heroína
Metadona
Naloxona
Propoxifeno
Cristina V. Almeida
Monitorização de drogas de abuso
INTOXICAÇÃO POR OPIACEOS (cont.)
As determinações analíticas podem-se fazer antes das 72-96 horas com exame
de urina por enzimo-imunoensaio (semi-quantitativo) e por cromatografia gasosaespectrometria de massa para a determinação qualitativa e quantitativa. A
heroína dado o seu curto t1/2 é praticamente indetectável em amostras biológicas
INTOXICAÇÃO POR PSICOESTIMULANTES
São drogas que têm a capacidade de aumentar o tónus geral do organismo, a
capacidade de trabalho, de concentração e diminui a sensação de cansaço.
Agrupam-se em três grandes grupos farmacológicos:
•
Anfetaminas
•
Cocaína
•
Metilxantinas
Monitorização de drogas de abuso
INTOXICAÇÂO POR ALUCINOGENOS
São um grupo heterogéneo de compostos químicos, que produzem ilusões ou
alterações da percepção sensoriais, alterações dos processos do pensamento e
alterações de humor.
Também são conhecidas como psicodélicos, psicomiméticos,
pseudoalucinógenos, dislépticos.
Incluem-se nesta categoria um amplo grupo de compostos
•
•
•
Cristina V. Almeida
LSD
FENILALQUILAMINAS (PEYOTE / MESCALINA)
TETRAHIDROCANNABINOL