Classificação da
matéria
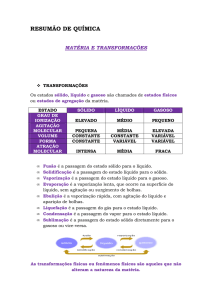
•Substância
química (pura) e classificações
•Mistura e classificações
•Diferenças entre as misturas e as substâncias
puras
•SEPARAÇÃO DE MISTURAS
Substância química
Substância química ou substância pura é uma porção da matéria que
tem propriedades bem definidas e que lhe são características.
•
Duas substâncias diferentes, raramente, apresentam
específicas iguais.
•
Em toda a sua extensão, a substância química apresenta apenas um tipo
de unidade estrutural que se repete.
Exemplo: água (H2O)
Aspectos macroscópico: propriedades específicas constantes.
Aspecto microscópico:
propriedades
Classificação das substâncias
Substância simples: o seu componente é constituído de apenas um
tipo de átomo.
Exemplos
•
•
•
•
•
Gás oxigênio (O2)
Gás hidrogênio (H2)
Ferro metálico (Fe)
Gás hélio (He)
Gás ozônio (O3)
Substância composta: o seu componente é constituído de dois ou
mais tipos de átomos.
Exemplos
•
•
•
•
•
Gás cabônico (CO2)
Cloreto de sódio (NaCl)
Água (H2O)
Ácido clorídrico (HCl)
Óxido de cálcio (CaO)
Mistura
Mistura é uma porção da matéria que tem mais de um componente..
•
As propriedades específicas da matéria não são definidas para uma
substância. Depende, por exemplo da massa de soluto.
•
A mistura apresenta duas ou mais substâncias e, portanto, dois ou mais
tipos de unidades estruturais diferentes que se repetem.
Exemplo: água salgada (H2O e NaCl – principal componente do sal)
Aspectos macroscópico: propriedades específicas não são constantes.
Aspecto microscópico:
•
Os componentes são as diferentes substâncias que formam a mistura.
Classificação das misturas
Mistura homogênea: apresenta apenas uma fase (solução).
Exemplos
•
•
•
•
•
Água e sal dissolvido.
Mistura de gases.
Ouro 24 quilates.
Solução de ácido sulfúrico.
Tintura de iodo.
Aspecto:
Fase é uma porção uniforme da matéria. Em toda a sua extensão, a
composição e as propriedades são iguais.
Mistura heterogênea: apresenta duas ou mais fases.
Exemplos
Aspecto:
•
•
Água e óleo.
Areia e cascalho.
Átomo de
oxigênio
Substância pura
simples
Mistura homogênea
Átomo de
hidrogênio
Substância pura
simples
Substância pura
composta
Mistura homogênea
Átomo de
carbono
Substância pura composta
Diferenças entre as
substâncias puras e as
misturas
•Temperatura de fusão e de ebulição
• Densidade
A temperatura de fusão e de ebulição de substâncias puras é
constante durante toda a mudança de estado físico. Já as
misturas apresentam uma faixa de temperatura (não é
constante).
90
80
70
60
50
40
30
20
10
0
1
2
3
4
5
6
7
8
9
10 11
tempo (minuto)
140
Gráfico
2
120
temperatura (ºC)
temperatura (ºC)
Gráfico
1
100
100
80
60
40
20
0
1
2
3
4
5
6
7
tempo (minuto)
8
9
10 11
A densidade de substâncias puras é constante e de
misturas não é constante porque depende da massa de
componentes.
d=0,8g/ml
d=1,0g/ml
Processos de separação de
misturas heterogêneas
Decantação: separa dois líquidos
imiscíveis.
Filtração:Utiliza uma parede
porosa para reter os sólidos
DISSOLUÇÃO FRACIONADA
Utilizado para separar os
componentes de uma mistura sólida,
sendo que um dos componentes seja
dissolvido no líquido. Ex: areia + sal
ATRAÇÃO MAGNÉTICA
Consiste na separação de dois sólidos
por um imã na qual atrai alguns
metais (ferro, níquel e cobalto). Ex:
limalha de ferro e enxofre
MISTURA HOMOGÊNEA
EVAPORAÇÃO- Separação pelo processo natural
- evaporação da água ou cristalização do sal.
DESTILAÇÃO SIMPLESmistura homogênea de
líquidos de sólidos não
voláteis.Ex:água + sais
dissolvidos
DESTILAÇÃOFRACIONADA
Separa líquidos miscíveis de temperaturas
de ebulição não muito próximas.
Ex:água+álcool etílico, petróleo, cana de
açúcar.