VOLUME 1 | QUÍMICA 1
Resoluções das Atividades
Sumário
Capítulo 1 – Introdução ao estudo da Química orgânica....................................1
Capítulo 5 – Funções orgânicas – Sinopse, reconhecimento e nomenclatura .. 5
Capítulo 2 – Hibridização do carbono ............................................................... 2
Capítulo 6 – Ressonância e aromaticidade ........................................................ 7
Capítulo 3 – Estudo das cadeias carbônicas ...................................................... 3
Capítulo 7 – Estudo dos hidrocarbonetos ......................................................... 8
Capítulo 4 – Regras básicas de nomenclatura orgânica .................................... 4
Introdução ao estudo da Química
Capítulo 1 orgânica
05 E
Atividades para Sala
A síntese da ureia in vitro, a partir de cianeto de amônio, por Wöhler, deu
outro sentido ao termo “Química orgânica”. A partir desse experimento,
abandona-se a ideia de relacionar os compostos orgânicos com a vida.
01 E
Atividades Propostas
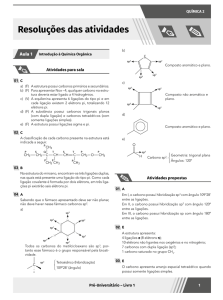
01 B
Legenda:
Carbono primário
Carbono secundário
Carbono terciário
A nicotina possui fórmula molecular C10H14N2 e é uma cadeia heterocíclica com apenas um carbono terciário. No anel aromático, existem três
ligações pi.
02 D
02 e
Legenda:
Legenda:
Carbono secundário
Carbono primário
Carbono terciário
03 E
Carbono terciário
03 e
Lembre-se de que cada átomo de carbono faz quatro ligações e o de
nitrogênio, três.
04 D
Todos os carbonos e hidrogênios são secundários.
04 a
O composto possui quatro carbonos secundários, seis hidrogênios
secundários, uma ligação pi e 10 ligações sigma.
Legenda:
Carbono primário
Carbono secundário
Carbono terciário
A molécula possui 14 ligações sigma e uma pi; três carbonos primários,
um secundário e um terciário. É uma molécula insaturada, cuja fórmula
molecular é C5H10.
05 A
Legenda:
Carbono primário
Carbono secundário
O composto não possui ligação pi.
2a Série – Ensino Médio | 1
VOLUME 1 | QUÍMICA 1
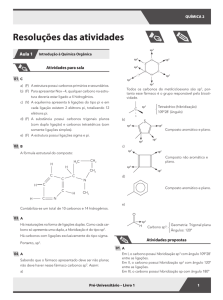
06 E
02 D
sp2
sp2
sp2
sp2
Legenda:
Carbono secundário
03 B
Carbono terciário
07 B
Os átomos de carbono são hibridizados sp2, com ângulo
entre as ligações de 120º, o que torna a molécula plana.
A fórmula estrutural da molécula é:
04 A
sp3
sp3
sp
3
Existem 7 ligações sigma e 3 ligações pi, a fórmula molecular é C4H4.
sp3
08 B
sp
3
sp3
sp2
sp2
sp3
05 C
Legenda:
Carbono primário
Na hibridização sp3, ocorre fusão de um orbital s com três orbitais p, de
modo que os híbridos se situam nos vértices de um tetraedro regular.
Na hibridização sp2, ocorre fusão de um orbital s com dois orbitais p,
formando uma estrutura de maior simetria, com ângulo de 120º.
Na hibridização sp, ocorre a fusão de um orbital s com um orbital p,
formando uma molécula linear de ângulo igual a 180º.
Carbono quaternário
09 C
Os compostos orgânicos não são estáveis em altas temperaturas, formam moléculas com grande quantidade de átomos e são encontrados
em plantas e outros seres vivos, podendo ser sintetizados em laboratório. Em suas moléculas, predominam as ligações covalentes.
Atividades Propostas
01 C
10 B
Trata-se de uma cadeia carbônica saturada, homogênea, com carbonos
primários, sendo um deles hibridizado sp3 e o outro, sp2.
sp3
sp2
02 E
Capítulo 2 Hibridização do carbono
Existem duas ligações pi, cada uma formada por um par de elétrons.
Terciário sp3
p
p
Atividades para Sala
Terciário sp3
01 B
O carbono possui duas formas alotrópicas:
No diamante, ele se encontra hibridizado na forma sp e no grafite, na
forma sp2.
Terciário sp3
3
2 | 2a Série – Ensino Médio
Legenda:
Carbono quaternário sp­3
VOLUME 1 | QUÍMICA 1
03 E
Capítulo 3 Estudo das cadeias carbônicas
O composto possui 3 ligações duplas no anel benzeno, totalizando 3
ligações pi. Na parte linear da cadeia, existem 3 ligações triplas (uma em
cada), totalizando 6 ligações pi (duas em cada).
sp2
sp2
Atividades para Sala
01 B
sp2
sp
sp
sp
sp2
Heteroátomo
sp2
Insaturação
sp2
Anel benzeno
04 E
O composto possui 4 ligações duplas, totalizando 8 elétrons pi; 5 pares
de elétrons não ligantes; e 7 átomos de carbono da molécula são hibridizados sp2.
A cadeia possui uma parte cíclica, representada pelo anel benzeno, e
uma parte acíclica, caracterizando-se como uma cadeia mista.
02 E
Ligação dupla
CH3(CH2)4(CH)2CH2(CH)2(CH2)7COOH
Carbono saturado
Trata-se de uma cadeia aberta, normal (sem ramificações), insaturada
(presença de ligação dupla entre os carbonos) e homogênea.
03 D
05 D
sp2
sp2
sp3
A cadeia I possui o anel benzeno, sendo, portanto, aromática.
A cadeia II possui ligação dupla, sendo, portanto, insaturada.
04 E
A cadeia é formada por 5 anéis benzeno condensados, e sua fórmula
molecular é C20H12.
Cada carbono sp2 possui três ligações sigma e uma pi.
05 C
06 D
A cadeia possui uma parte cíclica (benzeno) e uma parte acíclica, apresentando o oxigênio e o nitrogênio como heteroátomos.
sp3
sp
3
sp2
sp2
sp3
Atividades Propostas
sp3
sp2
sp2
sp3
01 B
Insaturação
sp3
O carbono sp2 possui geometria trigonal e o carbono sp3 possui geometria
tetraédrica.
07 B
Todos os 18 carbonos da molécula são hibridizados sp2 com ângulos de
ligação iguais a 120º.
08 c
Ramificação
Insaturação
Ramificação
Trata-se de uma cadeia aberta (acíclica), ramificada, insaturada e homogênea.
02 D
Cada anel benzeno possui 6 átomos de carbono; assim, temos:
Em cada ligação dupla, uma é sigma e a outra é pi, logo, existem 9 ligações pi.
09 B
A: Carbono sp2: 120º
B: Carbono sp3: 109º28’
C: Carbono sp3: 109º28’
10 C
Todos os carbonos da molécula se encontram hibridizados sp3.
2a Série – Ensino Médio | 3
VOLUME 1 | QUÍMICA 1
03 C
02 C
A cadeia possui o nitrogênio como heteroátomo, sendo fechada, saturada e
ramificada.
1
Heteroátomo
Metil
Metil
2
Metil
3
Metil
Ramificações
4
5
Ramificações
Fenil
Heteroátomo
04 B
2,2,3,4-tetrametil-3-fenil-pentano.
As cadeias que possuem o anel benzeno em sua estrutura são aromáticas. O cicloexeno e o ciclobuteno, portanto, não são aromáticos.
03 D
05 E
Trata-se de uma cadeia mista, com duas insaturações, sem o anel benzeno.
06 d
A fórmula molecular do non-3,5-dieno é C9H16.
Ramificações
04 C
É uma cadeia acíclica, homogênea, saturada e ramificada.
8 átomos de hidrogênio.
05 B
07 D
A cadeia é saturada, acíclica, homogênea e normal (sem ramificação).
08 D
São acíclicos os compostos 1 e 2, são monocíclicos os compostos 4 e 5 e
são bicíclicos os compostos 3 e 6.
Etil
1
2
4
3
09 E
5
A cadeia é aberta, homogênea e insaturada.
Etil
10 D
3,3-dietilpentano
Atividades Propostas
Heteroátomo
A cadeia é acíclica, heterogênea e ramificada.
Regras básicas de nomenclatura
Capítulo 4 orgânica
5
4
Atividades para Sala
01 C
01 A
6
3
CH3
1
5
CH
2
4
CH3
Isopropilciclopropano
3-metil-1-cicloexeno
Metil
Metil
5
4
3
Metil
2
Metil
6
1
7
Etil
3,3,4,5-tetrametil-4-etil-heptano.
4 | 2a Série – Ensino Médio
Legenda:
Carbono primário
3
CH3
1
2
3-metil-1,4-cicloexadieno
02 C
Metil
6
CH3
Carbono terciário
VOLUME 1 | QUÍMICA 1
09 B
03 B
Sendo n o número de átomos de carbono na estrutura, temos como fórmula geral para os alcanos: CnH2n + 2.
Metil
9
7
8
10
5
6
04 D
1
3
4
2
Metil
Metil
Etil
6-etil-5,5-dimetildecano
1
2
3
4
Metil
5
10 D
Metil
Metil
2,2,4-trimetil-pentano
1
05 A
Metil
Propil
2
3
4
6
5
8
7
9
10
Etil
Butano
⇒
5-etil-6-metildecano
06 A
Funções orgânicas –
Capítulo 5 Sinopse, reconhecimento e
Ramificação
I.
nomenclatura
Atividades para Sala
01 B
Ramificação
II.
Éter
Álcool
02 C
Ramificação
III.
I. Ácido etanoico (ácido carboxilico).
II. Propanol-1 (álcool).
III.Metanoato de propila (éster).
03 C
Ramificação
IV.
A substituição de um ou mais átomos de hidrogênio por átomos(s) de
halogênio(s) caracteriza a função haleto orgânico.
04 B
V.
Cetona
Ácido
carboxílico
I. 4 ramificações.
II. 2 ramificações.
III. 1 ramificação.
IV. 1 ramificação.
V. Sem ramificação.
Amina
07 B
6
7
5
4
3
2
ø
Haleto
Amina
1
Ácido
carboxílico
Isopropil
5-fenil-3-isopropil-2-hepteno
Cetona
Esparfloxacina
08 E
1,2–dimeteilpentil
Éter
2
1
3
4
5
6
7
8
9
10
11
12
Metil
Etil
6-(1,2-dimetilpentil)-5-etil-3,3-dimetiltridecano
Amina
13
Ácido
carboxilico
Haleto
Cetona
2a Série – Ensino Médio | 5
VOLUME 1 | QUÍMICA 1
05 B
06 D
Ácido
carboxílico
Éter
Aldeído
Fragrância de
canela
Atividades Propostas
01 A
Aldeído
4
1
2
1
3
2
3
e
Fragrância de
jasmim
Álcool
Metil
2-propanol
3-metil-1-butino
02 D
Cetona
Fenol
Aldeído
Éter
Fragrância de
espinheiro-branco
Éter
07 A
03 B
Cetona
O sabão é um sal de ácido orgânico resultante de uma reação de neutralização. A tripalmitina é um éster, e o glicerol é um álcool.
Amina
08 C
Metil
Éster
2
1
6
09 B
Cetona
Éster
05 D
Aroma de banana: etanoato de pentila.
Aroma de abacaxi: butanoato de etila.
10 D
Cetona
Éter
Metil
IV.
I.
3
4
II.
5
4-cloro-2-metil-hexano
04 B
4
3
Álcool
V.
Ácido
Carboxílico
5
2
1
6
7
8
Aldeido
III.
6 | 2a Série – Ensino Médio
Metil
3,7-dimetil-6-octeno-1-ol
VOLUME 1 | QUÍMICA 1
Capítulo 6 Ressonância e aromaticidade
Sendo:
→ Carbonos sp3 são 13;
→ Carbonos sp2 são 7;
( ) → Elétrons não-ligantes são 14;
p → Ligações pi são 4, logo, 8 elétrons pi.
Atividades para Sala
Após análise da estrutura da pentaxiverina, conclui-se que ela apresenta
8 elétrons pi, 14 elétrons não ligantes, 7 carbonos sp2 e 13 carbonos sp3.
01 A
05 d
sp3
Não é aromático, pois a inserção de um carbono tetraédrico
sp3 impede a circulação dos elétrons pi.
a) (F) Possui uma cadeia heterogênea com quatro heteroátomos.
sp2
b) (F) Possui dois anéis, mas somente um é anel benzênico.
c) (F)É uma substância aromática, pois os nitrogênios não impedem a
ressonância.
d)(V)É uma substância aromática, visto que toda substância com anel
benzênico é aromática.
sp3
Não é aromático, pois a inserção de um carbono tetraédrico
sp3 impede a circulação dos elétrons pi.
Após análise da estrutura da adenina, conclui-se que:
e) (F) É uma amina.
Não é aromático. Aplicando a regra de Hückel, temos 8
elétrons pi, logo 4n + 2 = 8 ⇒ n = 3 .
2
Não é aromático. Aplicando a regra de Hückel, temos 4
elétrons pi, logo 4n + 2 = 4 ⇒ n = 0,5.
Atividades Propostas
01 d
Após analisarmos as estruturas dos compostos A e B, concluímos que:
a) (F) B é um hidrocarboneto.
02 B
b) (F) Somente A é composto aromático.
c) (F) O composto A é aromático e o B é alicíclico.
Após a análise das estruturas dos compostos A e B, concluímos que o
composto da estrutura B é mais estável, pois apresenta ressonância,
enquanto o composto da estrutura A não apresenta. Vale ressaltar
também que nenhuma das estruturas é aromática.
03 B
d) (V) O composto A apesenta aromaticidade, visto que contém um anel
benzênico.
e) (F) O composto B não apresenta anel aromático.
02 A
sp2
p
Após analisarmos a estrutura do benzopireno, concluímos que se trata de
um hidrocarboneto insaturado, aromático e com núcleos condensados.
p
p
120º
p
sp
2
p
sp2
03 C
Na estrutura do antraceno, há sete ligações pi (p) e, consequentemente,
14 elétrons pi. Através da regra de Hückel, 4n + 2 = número de elétrons
p
pi (p), podemos encontrar o seguinte valor para n:
4n + 2 = 14
4n =12
12
n=
4
n=3
p
p
p
FM=C18H18
Após análise da estrutura do composto, conclui-se que sua fórmula molecular é C18H18, todos os carbonos apresentam-se hibridizados em sp2, o
ângulo de ligação entre os carbonos é 120º e há 9 ligações pi (p).
04 C
Dentre os compostos dados, somente o ciclobutadieno não é aromático,
sendo ele, portanto, o mais reativo, isto é, o mais instável.
04 d
05 A
p
p
p
O composto 1,3,5-cicloexatrieno é, na verdade, o benzeno. Portanto, o
composto é aromático.
p
ou
1,3,5–cicloexatrieno
Benzeno
2a Série – Ensino Médio | 7
VOLUME 1 | QUÍMICA 1
06 E
d)
Devido à presença do anel benzênico, o composto é aromático.
Anel
benzênico
e)
Pela análise das estruturas, percebe-se que o metano é o hidrocarboneto
de menor massa molecular.
02 A
07 D
O composto possui fórmula molecular C4H5N com os átomos de carbono
hibridizados sp2. Em sua estrutura, podemos observar o deslocamento
dos elétrons não ligantes:
p=6
4n + 2 = 6
n=1
O segundo composto da série dos alcenos possui dois carbonos (n = 3),
logo, possui fórmula geral CnH2n = C3H6.
ou
Propeno
03 E
Pirrol
A fórmula geral dos alcanos é CnH2n+2. Para 64 átomos de hidrogênio,
temos:
2n+2 = 64 ⇒ n = 31. A fórmula do composto em questão é C31H64.
Aromático
08 D
04 B
C8H16 possui n = 8, e o número de átomos de hidrogênio é o dobro do de
carbonos, obedecendo a fórmula geral dos alcenos CnH2n.
O ciclooctatetraeno possui 8 elétrons p e, ao testarmos a regra de Hückel,
3
, vemos que ela não é obedecida.
4n + 2 = 8 ⇒ n =
2
05 C
09 A
Para alcanos com o mesmo número de átomos de carbono, quanto maior
for o número de ramificações, menor será o ponto de ebulição. Logo, a
ordem crescente do ponto de ebulição é C, B, A.
Atividades Propostas
e
o–xileno
01 D
m–cresol
Tratam-se de duas estruturas aromáticas, devido à presença do anel
benzeno.
10 C
O acetileno é um alcino utilizado como combustível para instrumentos de
solda. CaC2(s) + 2H2O(l) ⇒ Ca(OH)2(aq) + C2H2(aq).
02 A
O eteno é um alceno usado no amadurecimento de frutas.
03 E
I.Benzeno.
Tolueno
,
Anilina
e
II. Tolueno (metil benzeno).
Fenol
III. Xileno (dimetil benzeno nas formas orto, meta e para.).
Como todas as estruturas possuem o anel benzeno, elas apresentam o
fenômeno da ressonância.
04 A
I.
Capítulo 7 Estudo dos hidrocarbonetos
(V) O alceno possui, pelo menos, uma ligação dulpa.
II. (F) São duas ramificações iguais (metil) e uma diferente (isopropil).
III. (F) Possui fórmula molecular C11H22 e, por possuir apenas átomos
Atividades para Sala
de carbono e hidrogênio, pertence à função hidrocarboneto.
01 A
IV.(V)
a)
b)
c)
8 | 2a Série – Ensino Médio
Legenda:
Carbono terciário
VOLUME 1 | QUÍMICA 1
05 D
⇒
Benzeno
Fenil
1,5-dicloro-antraceno
10 B
⇒
Tolueno
O petróleo é formado, principalmente, por uma mistura de alcanos.
Benzil
06 D
O
(tolueno) e a
(naftalina) são hidro-
carbonetos aromáticos.
(propeno) e o
O
são hidrocarbonetos acíclicos insaturados.
(2–butino)
07 A
Os compostos pertencem à mesma função (hidrocarbonetos) e são diferenciados pela presença de um ou mais grupos CH2, tratando-se de compostos homólogos.
a)
b)
c)
08 B
a)(F)Os alcanos, por serem compostos apolares, são insolúveis em água.
b)(V)As ligações intermoleculares nos alcanos são mais fracas do que as da
água, o que deixa suas moléculas mais afastadas, tornando sua densidade menor do que a da água.
c)(F) Devido à presença da insaturação, os alcenos são um pouco mais solúveis que os alcanos.
d)(F)Os alcinos são mais reativos que os alcenos e os alcanos.
e)(F)Os alcenos são conhecidos como oceofinas.
09 D
8
9
1
2
7
6
3
5
10
4
Antraceno
2a Série – Ensino Médio | 9