REVISÃO – 2º ANO - QUÍMICA
1- A água oxigenada é empregada, frequentemente,
como agente microbicida de ação oxidante local. A
liberação do oxigênio, que ocorre durante a sua
decomposição, é acelerada por uma enzima presente
no sangue. Na limpeza de um ferimento, esse
microbicida liberou, ao se decompor, 1,6 g de oxigênio
por segundo.
Dado: H2O2(aq)→ H2O(ℓ) + ½O2(g)
Nessas condições, determine a velocidade de
decomposição da água oxigenada, em mol/min.
2- A penicilina, antibiótico natural derivado de um
fungo e descoberto por Alexander Fleming, está
disponível como fármaco desde a década de 40,
quando foi desenvolvida técnica de congelamento e
preparação industrial. Este antibiótico sofre uma
deterioração com o tempo, conforme o gráfico
apresentado a seguir:
Com base nas informações apresentadas, calcule a
velocidade de deterioração da penicilina nas primeiras
dez semanas.
3- Considere o gráfico a seguir, no qual estão
representados o tempo e a evolução das concentrações
das espécies B, C, D e E, que participam de uma reação
química.
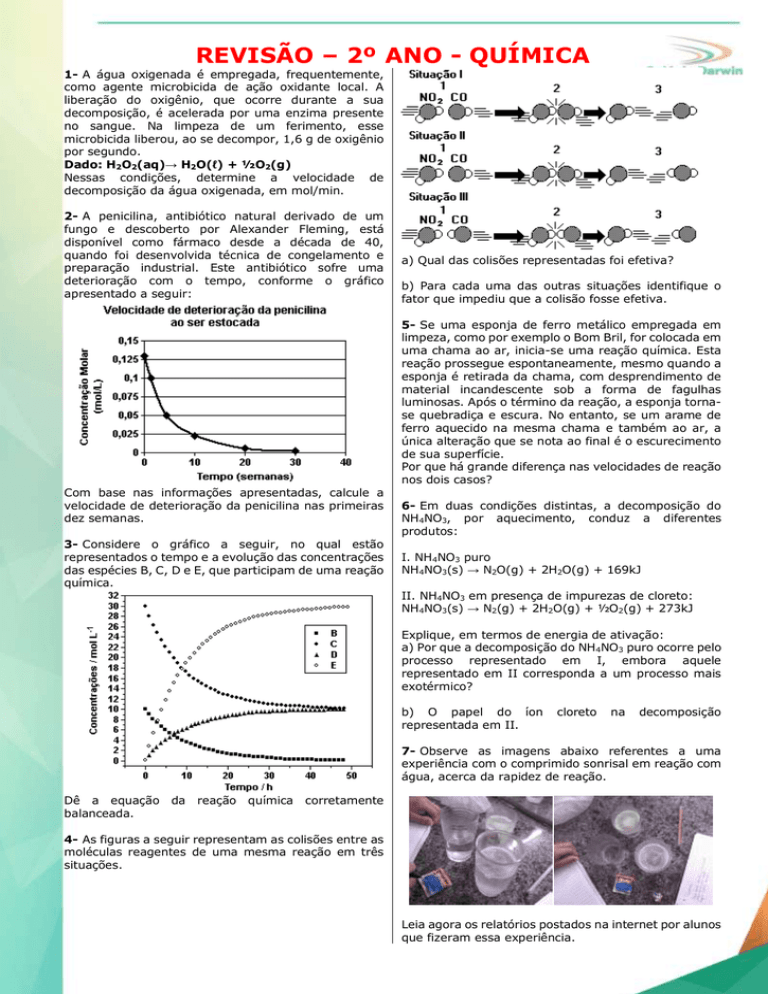
a) Qual das colisões representadas foi efetiva?
b) Para cada uma das outras situações identifique o
fator que impediu que a colisão fosse efetiva.
5- Se uma esponja de ferro metálico empregada em
limpeza, como por exemplo o Bom Bril, for colocada em
uma chama ao ar, inicia-se uma reação química. Esta
reação prossegue espontaneamente, mesmo quando a
esponja é retirada da chama, com desprendimento de
material incandescente sob a forma de fagulhas
luminosas. Após o término da reação, a esponja tornase quebradiça e escura. No entanto, se um arame de
ferro aquecido na mesma chama e também ao ar, a
única alteração que se nota ao final é o escurecimento
de sua superfície.
Por que há grande diferença nas velocidades de reação
nos dois casos?
6- Em duas condições distintas, a decomposição do
NH4NO3, por aquecimento, conduz a diferentes
produtos:
I. NH4NO3 puro
NH4NO3(s) → N2O(g) + 2H2O(g) + 169kJ
II. NH4NO3 em presença de impurezas de cloreto:
NH4NO3(s) → N2(g) + 2H2O(g) + ½O2(g) + 273kJ
Explique, em termos de energia de ativação:
a) Por que a decomposição do NH4NO3 puro ocorre pelo
processo representado em I, embora aquele
representado em II corresponda a um processo mais
exotérmico?
b) O papel do íon
representada em II.
cloreto
na
decomposição
7- Observe as imagens abaixo referentes a uma
experiência com o comprimido sonrisal em reação com
água, acerca da rapidez de reação.
Dê a equação da
balanceada.
reação química
corretamente
4- As figuras a seguir representam as colisões entre as
moléculas reagentes de uma mesma reação em três
situações.
Leia agora os relatórios postados na internet por alunos
que fizeram essa experiência.
REVISÃO – 2º ANO - QUÍMICA
O acetileno é um poderoso combustível, como se pode
ver nas imagens abaixo:
Ainda hoje as lanternas de carbureto são usadas em
espeleologia porque, além de fonte de luz, são
importantes indicativos da presença de oxigênio no
ambiente de cavernas.
a) Há erros conceituais graves nesses relatórios.
Identifique-os.
b) Explique a diferença na rapidez da reação
b.1) no primeiro experimento.
b.2) no segundo experimento.
8- Considere a seguinte informação: ”quando a
temperatura é aumentada de 10ºC, a velocidade da
reação é duplicada.“ Se o período de conservação de
um alimento fora de geladeira, a 35ºC, é de 2 dias,
qual será seu tempo de conservação em uma câmara
frigorífica a –5ºC? Demonstre seu raciocínio.
9- Considere a transformação química representada
por:
A+B→C
Para determinar os valores das ordens de reação α e β,
foram feitos vários experimentos, variando-se as
concentrações dos reagentes A e B e medindo-se a
rapidez inicial da transformação em cada experimento.
A tabela a seguir mostra os resultados obtidos:
Em duas lanternas idênticas, carregadas com a mesma
massa de carbureto, goteja-se água, na mesma vazão,
sobre o reagente. Na lanterna I, ele se encontra na
forma de pedras e, na lanterna II, finamente
granulado.
a) Monte a equação de reação completa e balanceada
de:
I) produção do acetileno.
II) combustão do acetileno.
b) Indique qual das lanternas apresentará a chama
mais intensa.
c) Indique qual delas se apagará primeiro. Justifique
sua resposta, com base em seus conhecimentos de
cinética química.
A partir desses dados, pede-se:
a) Determine a expressão de velocidade da reação.
b)
Determine
o
valor
da
proporcionalidade para a reação.
constante
de
Capítulo 4. Como alterar a rapidez das reações
químicas
10- O carbureto de cálcio ou carbeto de cálcio (CaC 2)
reage com água e produz acetileno (C 2H2), conhecido
como gás de maçarico.
11- Para se estudar a reação que ocorre entre
magnésio e ácido clorídrico, três experimentos foram
feitos:
Experimento I - adicionou-se certa massa de magnésio
a excesso de solução de ácido clorídrico, a 25°C,
medindo-se o volume de hidrogênio produzido a cada
30 segundos.
Experimento II - a massa de magnésio utilizada foi
igual à metade da usada no experimento I, mantendose todas as outras condições inalteradas (volume do
ácido, temperatura, tempo de recolhimento do gás).
REVISÃO – 2º ANO - QUÍMICA
Experimento III
- utilizaram-se
as
mesmas
quantidades de magnésio e de ácido do experimento I,
aquecendo-se a solução de ácido a 35°C.
Os resultados obtidos foram colocados em um gráfico:
15- O magnésio reage com solução aquosa de ácido
clorídrico produzindo gás hidrogênio. A velocidade
dessa reação pode ser determinada medindo-se o
volume total do gás formado, V, em função do tempo
de reação, t. Em um experimento, utilizou-se magnésio
e excesso de uma solução diluída de HCℓ aquoso. Todo
o magnésio foi consumido. O gráfico a seguir ilustra o
resultado obtido.
Relacione cada experimento à curva correspondente e
justifique sua resposta.
12- A sequência das reações I e II é proposta para
explicar a destruição do ozônio da estratosfera. Os
átomos de Cℓ se formam pela ação de radiação de alta
energia sobre os clorofluorocarbonos (CFC).
a) Pode-se dizer que os átomos de cloro atuam como
catalisadores na destruição do ozônio. Explique por
quê.
b) A destruição do ozônio representada pela equação
III é favorecida por baixas ou altas temperaturas?
Justifique com base no ΔH da reação.
13- Observe o gráfico abaixo, que indica a ocorrência
de uma reação em 3 etapas:
1ª) I → II
2ª) II → III
3ª) III → IV
Indique qual das etapas é mais rápida e justifique sua
resposta.
14- Em duas condições distintas, a decomposição do
NH4NO3, por aquecimento, conduz a diferentes
produtos:
I. NH4NO3 puro
NH4NO3(s) → N2O(g) + 2H2O(g) + 169kJ
II. NH4NO3 em presença de impurezas de cloreto:
NH4NO3(s) → N2(g) + 2H2O(g) + ½O2(g) + 273kJ
Explique, em termos de energia de ativação:
a) Por que a decomposição do NH 4NO3 puro ocorre pelo
processo representado em I, embora aquele
representado em II corresponda a um processo mais
exotérmico?
b) O papel do íon
representada em II.
cloreto
na
decomposição
16- Se a temperatura do sistema fosse aumentada,
INDIQUE o que ocorreria com o volume de hidrogênio
produzido no tempo t=2,0 min. JUSTIFIQUE sua
resposta.
17- INDIQUE o que ocorreria com o volume de
hidrogênio
produzido
no
tempo
t=1,0min,
substituindo-se o ácido diluído por igual volume de
ácido concentrado. JUSTIFIQUE sua resposta.
18- INDIQUE o que ocorreria com o volume de
hidrogênio produzido no tempo t=5,0min na hipótese
considerada no item anterior. JUSTIFIQUE sua
resposta.
19- (UFSCar-SP) O primeiro veículo lançador de
satélites (VLS) desenvolvido no Brasil foi destruído por
um incêndio, em 22 de agosto de 2003, causando a
morte de 21 engenheiros e técnicos. O incêndio ocorreu
devido à combustão do combustível sólido da
aeronave, atingindo temperaturas da ordem de
3.000oC. Suponha que um ônibus espacial utilize um
combustível sólido constituído de alumínio em pó,
perclorato de amônio (NH4Cℓ04) e o catalisador óxido
de ferro III. Durante a decolagem, o Fe 2O3 catalisa a
reação entre NH4Cℓ04 e Aℓ, resultando nos produtos
sólidos, Aℓ2O3 e Aℓ2Cℓ3, e gasosos, NO e H2O.
a) Escreva a equação química, devidamente
balanceada, da reação que ocorre durante a decolagem
desse ônibus espacial.
b) O gráfico a seguir apresenta as curvas de uma
reação que ocorre na presença e na ausência de um
catalisador.
Relacione os segmentos A e B com as energias
correspondentes e a dependência dos mesmos com o
catalisador.
REVISÃO – 2º ANO - QUÍMICA
20- Se uma esponja de ferro metálico empregada em
limpeza, como por exemplo o Bom Bril, for colocada em
uma chama ao ar, inicia-se uma reação química. Essa
reação prossegue espontaneamente, mesmo quando a
esponja é retirada da chama, com desprendimento de
material incandescente sob a forma de fagulhas
luminosas. Após o término da reação, a esponja tornase quebradiça e escura. No entanto, se um arame de
ferro aquecido na mesma chama e também ao ar, a
única alteração que se nota ao final é o escurecimento
de sua superfície.
a) Por que há grande diferença nas velocidades de
reação nos dois casos?
qual será seu tempo de conservação em uma câmara
frigorífica a –5ºC? Demonstre seu raciocínio.
25- Considere a transformação química representada
por:
A+B→C
Para determinar os valores das ordens de reação α e β,
foram feitos vários experimentos, variando-se as
concentrações dos reagentes A e B e medindo-se a
rapidez inicial da transformação em cada experimento.
A tabela a seguir mostra os resultados obtidos:
b) Escreva a equação balanceada da reação de
formação de um possível produto da reação, com o
respectivo nome, para os dois casos.
21- A obtenção de SO3(g) pode ser representada pela
seguinte equação:
SO2(g) + ½O2(g) + catalisador → SO3(g)
A formação do SO3(g), por ser exotérmica, é favorecida
a baixas temperaturas (temperatura ambiente).
Entretanto, na prática, a obtenção do SO 3(g), a partir
do SO2(g) e O2(g), é realizada a altas temperaturas
(420°C). Justifique essa aparente contradição.
22- Para acender o fogo em um fogão a lenha as
pessoas normalmente utilizam duas artimanhas:
colocar gravetos e assoprar (ou abanar) para atiçar o
fogo.
Explique o efeito de cada uma dessas estratégias.
a) Utilizar gravetos:
b) Abanar o fogo:
23- Alguns extintores de incêndio de espuma contêm
bicarbonato de sódio e ácido sulfúrico em
compartimentos separados. Quando o extintor é
acionado, essas substâncias entram em contato,
produzindo gás carbônico, que sai misturado com uma
solução e forma uma espuma que atua apagando o
fogo.
a) Explique como a espuma atua para apagar o fogo.
b) Escreva a equação da reação do ácido sulfúrico com
o bicarbonato de sódio.
c) Explique porque esse tipo de extintor não deve ser
utilizado para apagar incêndio em rede elétrica.
24- Considere a seguinte informação: ”quando a
temperatura é aumentada de 10ºC, a velocidade da
reação é duplicada.“ Se o período de conservação de
um alimento fora de geladeira, a 35ºC, é de 2 dias,
A partir desses dados, pede-se:
a) Determine a expressão de velocidade da reação.
b)
Determine
o
valor
da
proporcionalidade para a reação.
constante
de
26- A reação redox que ocorre entre os íons brometo
(Br–) e bromato (BrO3–) em meio ácido, formando o
bromo (Br2) é representada pela equação.
BrO3–(aq) + 5 Br–(aq) + 6 H+ (aq) → 3Br2(aq) + 3
H2O(ℓ)
Um estudo cinético dessa reação em função das
concentrações dos reagentes foi efetuado, e os dados
obtidos estão listados na tabela a seguir.
Considerando
as
observações
experimentais,
determine
a) a expressão de velocidade para a reação.
b) o valor da constante de proporcionalidade.
c) o valor da velocidade quando todos os reagentes
forem utilizados a uma concentração de o,2omol.L–1.
27- Considerando a reação hipotética 2A + B → C e
supondo-a uma reação elementar, faça o que se pede:
a) Dê a expressão de velocidade da reação.
b) Qual será a variação da velocidade da reação se a
concentração dos reagentes A e B for duplicada?
28- A reação H2(g) + I2(g) → 2HI(g) é elementar.
a) Escreva a expressão de velocidade para a reação.
b) Explique o que ocorrerá com a velocidade da reação
se a concentração de um dos reagentes for duplicada.
c) Explique o que ocorrerá com a velocidade da reação
se a concentração dos dois reagentes for duplicada ao
mesmo tempo.
REVISÃO – 2º ANO - QUÍMICA
29- Considere a reação: M(g) + N(g) → O(g)
Observa-se, experimentalmente, que, dobrando a
concentração de M, a velocidade de formação de O
quadruplica e, dobrando-se a concentração de N, a
velocidade da reação dobra. Determine equação da (v)
velocidade da reação.
30- Considere a seguinte reação química elementar:
N2(g) + 2O2(g) → 2NO2(g)
Triplicando-se a concentração de N2 e duplicando-se a
concentração de O2 e mantendo-se as demais
condições constantes, determine a expressão de
velocidade da reação. Demonstre seus cálculos.
31- A oxidação do íon iodeto pelo peróxido de
hidrogênio em meio ácido ocorre segundo a equação
química balanceada:
H2O2 + 3I– + 2H+ → 2H2O + (I3)–
Medidas de velocidade de reação indicaram que o
processo é de primeira ordem em relação à
concentração de cada um dos reagentes.
a) Escreva a equação de velocidade da reação.
b) Os coeficientes da equação de velocidade da reação
são diferentes dos coeficientes da equação química
balanceada. Explique o porquê.
32- O rótulo de um produto de limpeza diz que a
concentração de amônia (NH3) é de 9,5g/L. Com o
intuito de verificar se a concentração de amônia
corresponde à indicada no rótulo, 5,00mL desse
produto foram titulados com ácido clorídrico de
concentração 0,100mol/L. Para consumir toda a
amônia dessa amostra, foram gastos 25,00mL do
ácido.
(Dados: H = 1, N = 14 e Cl = 35,5.)
NH3 + HCl → NH4Cl
Com base nas informações fornecidas acima, faça o
que se pede:
a) Determine a concentração da solução em mol/L.
b) A concentração indicada no rótulo é correta?
Justifique através de cálculos.
33- Calcule a massa de NaOH necessária para
neutralizar totalmente 200mL de uma solução
0,01mol/L de H2SO4.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
34- O eletrólito empregado em baterias de automóvel
é uma solução aquosa de ácido sulfúrico. Uma amostra
de 7,50mL da solução de uma bateria requer 40,0mL
de hidróxido de sódio 0,75mol/L para sua neutralização
completa.
Calcule a concentração em mol/L do ácido na solução
da bateria.
35- Uma solução foi preparada pela mistura de 100mL
de H2SO4 1,0mol.L– e 100mL de solução de KOH
3,0mol.L–.
H2SO4(aq) + 2KOH(aq) → K2SO4(aq) + 2H2O(ℓ)
a) Calcule a concentração do reagente em excesso.
b) Calcule a massa de K2SO4 produzida na reação.
36- Considerando o princípio de equivalência química,
determine o volume de solução aquosa de ácido
clorídrico (HCℓ) a 3,65g/L que seria necessário para
reagir com 50,0mL de solução aquosa de hidróxido de
sódio (NaOH) a 0,1mol/L.
Massas atômicas: H = 1u; O = 16u; Na = 23u; Cℓ =
35,5u
37- O ácido oxálico é encontrado, em baixas
concentrações, em alguns vegetais importantes na
alimentação humana, tal como o espinafre. Apesar de
ser uma substância tóxica, é bem tolerado pelo
organismo humano em concentrações abaixo do limite
de toxicidade. Os sucos concentrados de espinafre,
entretanto, podem conter quantidades excessivas do
ácido oxálico, que ultrapassem tais limites. Por este
motivo, a indústria de sucos de espinafre exerce um
controle rigoroso em seus produtos, analisando os
teores de ácido oxálico (H 2C2O4), através de titulação
com o íon permanganato (MnO41–), de acordo com a
seguinte reação:
5H2C2O4(aq) + 2MnO41–(aq) + 6H+(aq) → 10CO2(g) +
2Mn2+(aq) + 8H2O(ℓ)
Sabendo-se que uma amostra de 20mL de suco de
espinafre reagiu completamente com 24mL de uma
solução 0,20mol/L em íons permanganato, calcule a
concentração em mol/L, em ácido oxálico, neste suco.
38- Um controle rápido sobre a condição de utilização
de uma bateria de automóvel, é a medida da densidade
da solução aquosa de H2SO4 que a mesma contém, e
que deve situar-se entre 1,25g/mL e 1,30g/mL. Outro
ensaio consistiria em retirar uma alíquota de 1mL dessa
solução, que é colocada em erlenmeyer, diluída com
água destilada, adicionada de indicador e titulada com
solução aquosa de NaOH 1mol/L. Supondo que nessa
titulação o volume de titulante gasto fosse de 26mL,
determine a concentração em mol/L da solução ácida
da bateria testada.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
39- A remoção de ferrugem (Fe2O3) com ácido oxálico
(H2C2O4) ocorre de acordo com a reação:
Fe2O3 + 6H2C2O4 → 2[Fe(C2O4)3]3– + 3H2O + 6H+
Indique quantos gramas de ferrugem podem ser
removidos com 500mL de solução de ácido oxálico
0,10mol/L.
40- Calcule a massa de NaOH necessária para
neutralizar totalmente 200mL de uma solução
0,01mol/L de H2SO4.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
41- Considere a reação abaixo equacionada:
AgNO3(aq) + NaBr(aq) → AgBr(s) + NaNO3(aq)
Se 100mL de uma solução 0,1mol/L de solução de
nitrato de prata são misturados com 200mL de solução
0,1mol/L de brometo de sódio, determine:
a) a massa de precipitado formado.
b) a concentração do íon NO3–.
42- Foi preparada em laboratório uma solução de
ácido clorídrico, dissolvendo-se 0,73g do ácido em
água; o volume foi completado até 250mL. Um volume
de 15,0mL da solução deste ácido foi completamente
neutralizado por 25,0mL de hidróxido de cálcio.
2HCℓ + Ca(OH)2 → Ca(Cℓ)2 + 2H2O
a) Calcule a concentração de base, em mol/L.
b) Calcule o número de mols da base, que foi
neutralizado.
(massas moleculares, em g/mol: H = 1; Cℓ = 35,5)
REVISÃO – 2º ANO - QUÍMICA
43- Adicionaram-se 100mL de solução de Hg(NO3)‚ de
concentração 0,40mol/L a 100mL de solução de Na 2S
de concentração 0,20mol/L. Sabendo-se que a reação
ocorre com formação de um sal totalmente solúvel
(NaNO3) e um sal praticamente insolúvel (HgS),
determine as concentrações, em mol/L, dos íons Na+ e
Hg2+ presentes na solução final.
47- No gráfico a seguir, as curvas I, II, III e IV
correspondem à variação da pressão de vapor em
função da temperatura de dois líquidos puros e das
respectivas soluções de mesma concentração de um
mesmo sal nesses dois líquidos. O ponto de ebulição de
um dos líquidos é 90°C.
44- Ácido cítrico reage com hidróxido de sódio
segundo a equação:
Considere que a acidez de certo suco de laranja
provenha apenas do ácido cítrico. Uma alíquota de
5,0mL desse suco foi titulada com NaOH 0,1mol/L,
consumindo-se 6,0mL da solução básica para completa
neutralização da amostra analisada. Levando em conta
estas informações e a equação química apresentada,
determine a concentração de ácido cítrico no referido
suco.
45- Suponha que 500mL de solução de iodeto de
potássio, com concentração em quantidade de matéria
de 1,0mol/L, reajam com nitrato de chumbo II,
conforme a reação:
2KI(aq) + Pb(NO3)2(aq) → PbI2(s) + 2KNO3(aq).
Calcule a massa mínima de nitrato de chumbo II
necessária para o consumo total do iodeto de potássio.
46- Em dois frascos idênticos, I e II, foram colocados
volumes iguais de água e de solução concentrada de
cloreto de sódio, respectivamente. Os dois frascos
foram colocados sob uma campânula de vidro
hermeticamente fechada, como mostra a figura a
seguir.
Utilizando os números das curvas respectivas:
a) Indicar quais curvas correspondem aos líquidos
puros. Indicar entre os dois qual é o líquido mais volátil
e justificar.
b) Indicar quais curvas correspondem às soluções.
Justificar.
48- Em uma amostra contendo ácido palmítico
gastaram-se 40,0mL de NaOH 0,250mol/L para
neutralizá-lo.
Determine a massa, em gramas, do ácido presente na
amostra.
Dados: Ácido palmítico = H3C(CH2)14COOH
Massa molecular = 256,00u
Equação balanceada: H3C(CH2)14COOH + NaOH →
H3C(CH2)14COONa + H2O
49- As figuras a seguir representam dois sistemas A e
B em aquecimento. Após iniciar a ebulição, um
termômetro foi introduzido em cada recipiente e,
depois de medidas, as temperaturas foram registradas
como TA e TB. Continuando o aquecimento, as
temperaturas foram medidas novamente como TA' e
TB'.
Em relação aos sistemas, compare as temperaturas:
a) TA e TB.
b) TA e TA'.
c) TB e TB'.
Justifique cada uma das suas respostas.
Após algum tempo, observou-se que o frasco I estava
totalmente vazio, e que no frasco II o volume havia
dobrado, contendo, portanto, uma solução diluída de
cloreto e sódio.
a) Explique porque ocorreu esse fenômeno.
b) Explique o que acontece com o ponto de ebulição
das soluções inicial e final de cloreto de sódio.
Justifique sua resposta.
50- O soro glicosado é uma solução aquosa contendo
5% em massa de glicose (C6H12O6) e isotônica em
relação
ao
sangue,
apresentando
densidade
aproximadamente igual a 1 g.mL-1.
a) Sabendo que um paciente precisa receber 80 g de
glicose por dia, que volume desse soro deve ser
ministrado diariamente a este paciente?
REVISÃO – 2º ANO - QUÍMICA
b) O que aconteceria com as células do sangue do
paciente caso a solução injetada fosse hipotônica?
Justifique sua resposta, utilizando as propriedades
coligativas das soluções.
51- Calcule a pressão osmótica de uma solução 0,1
mol/L de CaCl2 (100 % dissociado), a 27oC.
52- Duas soluções aquosas, uma de glicose e a outra
de sacarose, contêm a mesma massa, em gramas, de
soluto por litro de solução.
Dados: massas molares (g/mol): glicose = 180;
sacarose = 342.
a) Compare os valores dos pontos de congelamento
dessas soluções com o da água pura.
b) Qual das duas soluções apresentará o menor ponto
de congelamento? Explique a resposta
53- Injeções endovenosas de glicose são aplicadas em
pessoas que estão alcoolizadas. A solução de glicose,
que é injetada nas veias desses pacientes, deve ser
isotônica em relação ao sangue, para não lesar os
glóbulos vermelhos. Considerando que o sangue
humano possui uma pressão osmótica () da ordem de
7,8 atmosferas,
a) qual deve ser o valor da pressão osmótica da injeção
endovenosa a ser aplicada no paciente alcoolizado?
b) demonstre através de cálculos que o soro fisiológico,
utilizado nas injeções endovenosas, é solução com
concentração C = 0,16 mol/L em cloreto de sódio
(NaCl).
54- A adição de substâncias à água afeta suas
propriedades coligativas. Compare as temperaturas de
fusão e ebulição de duas soluções aquosas contendo,
respectivamente, 1mol/L de NaCℓ e 1mol/L de glicose,
nas mesmas condições de pressão.
55- O Mar Morto apresenta uma concentração salina
de 280g×L–1, enquanto nos demais mares e oceanos
essa concentração é de 35g×L–1.
Considere as três amostras a seguir, admitindo que as
soluções salinas apresentadas contenham os mesmos
constituintes:
- amostra A: água pura;
- amostra B: solução salina de concentração idêntica à
do Mar Morto;
- amostra C: solução salina de concentração idêntica à
dos demais mares e oceanos.
a) Indique a amostra que apresenta a maior
temperatura de ebulição, justificando sua resposta.
b) Calcule o volume da amostra B a ser adicionado a
7L da amostra A para formar uma nova solução salina
que apresente a mesma concentração da amostra C.
56- Água potável pode ser obtida pelo bombeamento
de água do mar contra uma membrana semipermeável
que permite somente a passagem de parte da água, de
acordo com o diagrama a seguir.
Por esse processo, obtém-se uma corrente de água
pura e outra de rejeito, concentrada em sal.
Disponha as correntes aquosas 1, 2 e 3, em ordem
crescente de temperaturas de congelamento à pressão
atmosférica. Justifique sua resposta.
57- Para matar baratas, precisamos fazer uma solução
aquosa a 30% de ácido bórico (H3BO3) (d=1,30g/cm3),
com concentração molar de (Dados: H=1, B=10,8,
O=16)
a) 5,0 M.
b) 5,5 M.
c) 6,0 M.
d) 6,5mol/L.
58- Que volume de água destilada devemos adicionar
a 150,0mL de uma solução a 7,00% de um shampoo
para automóvel a fim de torná-la a 3,00%?
a) 50,0mL
b) 100,0mL
c) 200,0mL
d) 450,0mL
59- 300 mililitros de solução contendo 0,01mol/L de
sulfato cúprico são cuidadosamente aquecidos até que
o volume da solução fique reduzido a 200 mililitros. A
solução final, tem concentração, em mol/L, igual a
a) 0,005
b) 0,010
c) 0,015
d) 0,016
60- O limite máximo de concentração de íon Hg 2+
admitido para seres humanos é de 6 miligramas por
litro de sangue. O limite máximo, expresso em mols de
Hg2+ por litro de sangue, é igual a
(Massa molar de Hg=200g/mol):
a) 3×10–5.
b) 6×10–3.
c) 3×10–2.
d) 6.
61- O volume, em litros, de uma solução 0,30mol/L de
Aℓ2(SO4)3 )sulfato de alumínio) que contém 3,0mol de
cátion alumínio (Aℓ3+) é:
Dado: Aℓ2(SO4)3 → 2Aℓ3+ + 3SO42–
a) 2,5
b) 3,3
c) 5,0
d) 9,0
62- Considere o gráfico, representativo da curva de
solubilidade do ácido bórico em água
REVISÃO – 2º ANO - QUÍMICA
d) 18,0 e 3,6.
68- Na preparação de 500mL de uma solução aquosa
de H2SO4 de concentração 3 mol/L, a partir de uma
solução de concentração 15mol/L do ácido, deve-se
diluir o seguinte volume da solução concentrada:
a) 10 mL
b) 100 mL
c) 150 mL
d) 300 mL
Adicionando-se 200 g de H3BO3 em 1,00kg de água, a
20°C, quantos gramas do ácido restam na fase sólida?
a) 75,0
b) 100
c) 150
d) 175
63- A curva de solubilidade do KNO3 em função da
temperatura é dada a seguir. Se a 20°C misturarmos
50g de KNO3 com 100g de água, quando for atingido o
equilíbrio teremos
a) um sistema homogêneo.
b) um sistema heterogêneo.
c) apenas uma solução insaturada.
d) uma solução supersaturada.
64- A solubilidade do oxalato de cálcio a 20°C é de
33,0 g por 100 g de água. Qual a massa de sal, em
gramas, depositada no fundo do recipiente, quando
100g dessa substância são adicionados em 200 g de
água a 20°C?
65- Preparou-se uma solução contendo 8g de
hidróxido de sódio (NaOH) em 250mL de água.
a) Calcule a concentração em g/L da solução.
b) Calcule a concentração em quantidade de matéria
(mol/L) da solução.
Dado: NaOH = 40g/L
66- Pode-se dizer que uma solução saturada é uma
solução concentrada? Justifique sua resposta.
67- Deseja-se diluir um litro da solução de H 2SO4 a
80% e de densidade 2,21g/cm3 até o volume de cinco
litros. As concentrações em mol/L do H 2SO4, antes e
depois da diluição, são, respectivamente, em mol/L:
a) 10,1 e 5,2.
b) 12,0 e 4,0.
c) 4,0 e 11,3.
69- Soro fisiológico é uma solução aquosa de cloreto
de sódio a 0,9% em massa. A massa de NaCℓ em
gramas necessária para preparar 2 litros de soro
fisiológico é
Dado: massa específica H‚O = 1g/mL
a) 0,9.
b) 1,8.
c) 9.
d) 18.
70- Uma solução aquosa de hidróxido de sódio tem
densidade igual a 1,25g/mL e 40% em massa de
soluto. A massa, em gramas, de 100 mililitros de
solução é
a) 4,00
b) 40,0
c) 125
d) 250
71- A concentração de íons fluoreto em uma água de
uso doméstico é de 5,0x10–5 mol/litro. Se uma pessoa
tomar 3,0L dessa água por dia, ao fim de um dia, a
massa de fluoreto, em miligramas, que essa pessoa
ingeriu é igual a:
Dado: massa molar de fluoreto: 19,0 g/mol
a) 0,9
b) 1,3
c) 2,8
d) 5,7
72- Para preparar 80L de uma solução aquosa 12%
(massa/massa) de KOH (massa específica da
solução=1,10g/cm3) foram adicionados x litros de uma
solução aquosa 44% (massa/massa) de KOH (massa
específica da solução=1,50g/cm3) e y litros de água
deionizada (massa específica=1,00g/cm 3). Os valores
de x e de y são respectivamente:
a) 12L e 68L.
b) 16L e 64L.
c) 30L e 50L.
d) 36L e 44L.
73- Uma mineradora de ouro, na Romênia, lançou
100.000m¤ de água e lama contaminadas com cianeto,
CN-(aq), nas águas de um afluente do segundo maior
rio da Hungria.
A concentração de cianeto na água atingiu, então, o
valor de 0,0012mol/litro. Essa concentração é muito
mais alta que a concentração máxima de cianeto que
ainda permite o consumo doméstico da água, igual a
0,01miligrama/litro.
Considerando-se essas informações, para que essa
água pudesse servir ao consumo doméstico, ela
deveria ser diluída, aproximadamente,
a) 32.000 vezes.
b) 3.200 vezes.
c) 320 vezes.
d) 32 vezes.
REVISÃO – 2º ANO - QUÍMICA
74- A massa de cloreto de crômio (III) hexaidratado,
necessária para se preparar 1L de uma solução que
contém 20mg de Cr3+ por mililitro, é igual a:
a) 0,02g.
b) 20g.
c) 52g.
d) 102,5g.
Dados: CrCℓ3.6H2O
(Massas molares, em g/mol: Cr = 52; cloreto de crômio
hexaidratado = 266,5).
75- O ácido fosfórico (H3PO4) é um dos componentes
presentes em determinado refrigerante, formando uma
solução de concentração igual a 0,49g/L. Calcule a
concentração mol/L dessa solução.
76- Considere o NaOH sólido e puro. Calcule:
a) a massa de NaOH que deverá ser pesada para se
preparar 500,0mL de solução 0,1mol/L.
b) a percentagem em massa de NaOH na solução
preparada no item A.
Obs: Considere a densidade da solução igual à da água
(d=1,0g/cm3).
Dado: Massa molar do NaOH = 40 g/mol
77- Uma solução aquosa de hidróxido de sódio tem
densidade igual a 1,25g/mL e 40% em massa de
soluto. Calcule a massa, em gramas, de 100 mililitros
de solução.
78- A recristalização consiste em dissolver uma
substância a uma dada temperatura, no menor volume
de solvente possível e a seguir resfriar a solução,
obtendo-se cristais da substância.
Duas amostras de ácido benzóico, de 25,0g cada,
foram recristalizadas em água segundo esse
procedimento, nas condições apresentadas na figura 1:
a) Qual é a concentração da solução em quantidade de
matéria em mol/L?
b) Qual é a concentração da solução em g/L?
80- Uma solução possui densidade 1,5g/mL e
20%(m/m) do soluto X.
a) Qual é a sua concentração em g/L?
b) Sabendo que a o soluto X possui massa 30g/mol,
qual é a concentração em mol/L da solução?
81- Uma solução de hidróxido de alumínio (MM =
78g.mol–1 ), utilizada no combate à acidez estomacal,
apresenta uma concentração igual a 3,90g.L–1. Calcule
a concentração, em mol.L–1, dos íons hidroxila (OH –),
presentes nessa solução.
Dado: Aℓ(OH)3 → Aℓ3+ + 3OH–
82- Qual o volume, em litros, de uma solução
0,30mol/L de sulfato de alumínio que contém 3,0mol
de cátion alumínio?
Dado: Sulfato de alumínio: Aℓ2(SO4)3 → 2Aℓ + 3SO4
83- Dissolveu-se 1,0g de permanganato de potássio
em água suficiente para formar 1,0L de solução.
Sabendo que 1mL contém cerca de 20 gotas, calcule a
massa de permanganato de potássio em uma gota de
solução.
84- A 25°C e 1 atm tem-se:
ΔH de formação do C2H2 = –94,1kcal mol–
ΔH de formação de H2O = –68,3kcal mol–
ΔH de combustão do C2H2 = –310,6kcal mol–
Calcule o valor do ΔH de formação do CO2.
85- Com base na equação de reação abaixo, calcule o
valor do ΔH de formação do CℓO.
2CℓO(g) → Cℓ2(g) + O2(g) ΔH= –18,20 cal
86- Observe o gráfico.
a) Calcule a quantidade de água necessária para a
dissolução de cada amostra.
b) Qual das amostras permitiu obter maior quantidade
de cristais da substância? Explique.
Dados: curva de solubilidade do ácido benzóico em
água (massa em gramas de ácido benzóico que se
dissolve em 100g de água, em cada temperatura), ver
figura 2.
79- Uma solução é preparada dissolvendo-se 0,1mol
de NaOH em 200mL de água.
Qual o valor da entalpia de:
a) Formação de 1mol de SO2(g)?
b) Combustão de 1mol de SO2(g)?
87- Classifique
os
processos
endotérmicos ou exotérmicos.
a) combustão do álcool.
b) H2O(ℓ) → H2O(g).
c) sublimação do CO2(s) (gelo seco).
d) H2(g) + ½O2(g) → H2O(ℓ)
abaixo
como
REVISÃO – 2º ANO - QUÍMICA
88- A dissolução de uma pequena quantidade de CaCℓ2
liberou 930cal. Sabendo que a massa da solução é igual
a 150g e que a temperatura da água antes da
dissolução era de 25°C, determine a temperatura final
da solução obtida.
Dado: calor específico da água: c = 1cal/g°C.
89- A oxidação de 1g de gordura num organismo libera
9.300cal. Se o nosso corpo possui 5.300g de sangue,
quanto de gordura deve ser metabolizado para fornecer
o calor necessário para elevar a temperatura do sangue
da temperatura ambiente (25°C) até a temperatura do
nosso corpo (37°C)?
Dado: calor específico da água = calor específico do
sangue = 1cal/g°C.
90- Na tabela são dadas as energias de ligação
(kJ/mol) a 25°C para algumas ligações simples, para
moléculas diatômicas entre H e os halogênios (X).
O cloreto de hidrogênio [HCℓ(g)] é um gás que, quando
borbulhado em água, resulta numa solução de ácido
clorídrico. Esse composto é um dos ácidos mais
utilizados nas indústrias e laboratórios químicos.
Calcule a energia para formação de 2mol de cloreto de
hidrogênio, em kJ.
Dados: H2(g) + Cℓ2(g) → 2HCℓ(g)
91- A variação de entalpia de uma reação na fase
gasosa, ΔHr, pode ser obtida indiretamente por duas
maneiras distintas:
I) pelas diferenças entre as entalpias de formação, ΔH f,
dos produtos e dos reagentes;
II) pela diferença entre as entalpias de ligação, ΔH ℓ,
das ligações rompidas e das ligações formadas.
Considerando a reação e as tabelas a seguir:
a) Determine o valor de ΔHr.
b) Calcule a entalpia de formação para o H 3CCℓ(g).
Dados:
92- Calcule a variação de entalpia para a reação, dada
pela equação:
4HCℓ(g) + O2(g) → 2H2O(g) + 2Cℓ2(g) é:
Dados: (Energia de ligação em kcal/mol)
H–Cℓ = 103,1
H–O = 110,6
O=O = 119,1
Cℓ–Cℓ = 57,9












