Sanidade
Interação entre sistema
imunológico do suíno e
micotoxicose
Introdução
O sistema imunológico dos animais é fundamental para a defesa contra
agentes estranhos ao organismo como vírus, bactérias, protozoários e outros parasitas. Na realidade, são o equilíbrio entre
a boa funcionalidade deste sistema (imunocompetência) e os desaÞos de campo
que vão determinar a saúde de um animal.
Sempre que ocorrer aumento na pressão
infectiva ou uma diminuição na capacidade imunogênica do indivíduo ocorre o que
caracterizamos como doença.
Animais enfermos são menos
produtivos, e, além disso, aumentam os
custos de produção por necessidade de
medicamentos e intervenções veterinárias. Devido a isso, atualmente vários programas de manejo (incluindo programas
de biossegurança e criações all in all out)
têm colaborado na diminuição da pressão
infectiva nas instalações para animais.
Entretanto, existem vários fatores nesta
forma de produção intensiva de animais
que possibilita uma menor competência do sistema imunológico dos animais
como situações de estresse ou presença de
fatores anti-nutricionais e tóxicos na ração. Entre estes fatores destaca-se o papel
das micotoxinas, que são produtos do metabolismo intermediário de fungos e que
podem estar presentes na ração. O crescimento fúngico em cereais e rações é cada
vez mais comum devido as novas tecnologias de plantio de cereais, péssimas condições de transporte, armazenamento e
estocagem destas matérias primais, o que
aumenta muito a probabilidade da presença de micotoxinas nas rações.
Essas micotoxinas presentes na
ração podem causar diversas alterações
metabólicas no animal, que acarretam
em diversas apresentações de enfermidades que chamamos micotoxicoses. Entre
A presença de micotoxinas na ração, podem desencadear alguns sinais clínicos como o edema de
vulva em leitões recém-nascidos.
Suínos & Cia
22
Elizabeth Santin H. Dalagnol
Departamento de Medicina Veterinária,
Universidade Federal do Paraná
[email protected]
essas micotoxicoses clínicas especíÞcas,
podem-se citar as conhecidas formas clínicas caracterizadas por estrogenismos
e abortos provocados por zearalenona, o
edema pulmonar porcino provocado por
fumonisinas, vômitos provocados pela
toxina DON (vomitoxina), etc. O grande
problema no que se refere as micotoxinas é que doses de micotoxinas que não
causam esses quadros clínicos conhecidos
podem culminar com o aparecimento de
imunossupressão nos animais caracterizadas por infecções subclínicas, falhas de
vacinações e enfermidades infecciosa nos
animais. Vários são os mecanismos pelos
quais as distintas micotoxinas conhecidas podem atuar no sistema imunológico.
Desta maneira, neste texto, busca-se apresentar estudos envolvendo a interferência
destas micotoxinas com o sistema imunológico de suínos.
Conhecendo Sistema Imunológico em
Suínos
De acordo com Abbas et al.,
(2000), o termo imunidade tem sua origem na palavra latina immunitas que na
Roma antiga referia-se a exceções legais
oferecidas aos senadores da época durante seu período de mandato. Infelizmente
hoje ainda esses privilégios políticos acabam trazendo inúmeros problemas para
nossa sociedade moderna. Entretanto, a
parte disso, ao longo dos séculos o termo
imunidade refere-se a prevenir doenças,
mais especiÞcamente a doenças infecciosas. Uma deÞnição mais ampla de imunidade relaciona a reação do organismo
contra substâncias incluindo microorganismos, macromoléculas como proteínas
e polissacarídeos. As células e moléculas
responsáveis por essa imunidade constituem o sistema imunológico e a interação
coletiva dessas estruturas e moléculas na
resposta contra agentes estranhos ao orga-
Ano VI - nº 25/2008
Sanidade
neutralizar a infectividade dos agentes e
sinalizá-los para a eliminação através de
vários mecanismos. Alguns anticorpos induzem a fagocitose por células fagocíticas
e outros desencadeiam a liberação de mediadores da resposta inßamatória a partir
de mastócitos. A imunidade celular é mediada por linfócitos T que normalmente
dirigem-se contra células infectadas. Isso
pode acontecer quando algum vírus, bactéria ou protozoário infecta e se prolifera
dentro de fagócitos.
As micotoxinas são substâncias toxicas que atuam diretamente no sistema imunológico, tornando
os animais mais susceptiveis as efermidades.
nismo é denominado resposta imunológica.
Quando o sistema imunológico
funciona adequadamente e ocorre um
equilíbrio entre ele e a pressão infecciosa, o animal encontra-se em condições de
homeostase ou apresenta-se saudável. Em
condições de homeostase, este sistema é
um consumidor modesto dos recursos orgânicos, porém, uma vez ativado, tornase um grande sorvedouro de energia e
nutrientes - os quais o organismo animal
desvia da produção de carne, leite e ovos
(Koutsos e Klasing, 2001). Algumas vezes pode ocorrer também, que esses mecanismos desenvolvidos para defender o
organismo causem danos teciduais e doenças.
coordenam muitas atividades das células
que fazem parte desta imunidade inata.
Apesar da imunidade inata já existir no
animal, independente de qualquer desaÞo,
sabe-se que esta imunidade aumenta em
magnitude e capacidade defensiva a cada
exposição sucessiva a distintos agentes.
A defesa do organismo contra
agentes estranhos é mediada por reações
primárias da imunidade inata do organismo. Posteriormente, ocorre a resposta
imune denominada adaptativa. A imunidade inata é reconhecida como barreiras
físicas e químicas como epitélio e substâncias produzidas por algumas células
que possam ter alguma atividade antibacteriana como o ácido estomacal, por
exemplo.
Por outro lado, a imunidade adaptativa é considerada a imunidade desenvolvida especiÞcamente para um agente,
por isso também é denominada imunidade
especíÞca, e tem a capacidade de “memorizar”, de forma que a segunda resposta
a esse mesmo agente será ainda mais vigorosa que da primeira vez em que esse
agente for detectado. Os componentes
primordiais desta resposta especíÞca são
os linfócitos e seus produtos como as
linfocinas e os anticorpos. Na realidade,
estes dois tipos de imunidade (inata e
adaptativa) trabalham de forma integrada,
sendo que a imunidade inata é fundamental para que se desenvolva posteriormente
uma imunidade especíÞca contra determinado antígeno. Por outro lado, a resposta
secundária da imunidade especíÞca utiliza
inúmeros componentes da imunidade inata para que essa resposta secundária especíÞca seja realmente mais rápida e eÞcaz.
Além disso, fazem ainda parte da
imunidade inata do organismo as células
fagocíticas (macrófagos e neutróÞlos) e
células natural killer (NK), proteínas do
sangue como as que compõem o sistema
complemento e as citocinas que regulam e
Dentro da imunidade especíÞca
pode haver dois tipos de imunidade que
chamamos imunidade especíÞca humoral
e imunidade celular. A imunidade humoral é mediada por anticorpos produzido
pelos linfócitos B, que têm como função
Ano VI - nº 25/2008
Para otimizar essa interação entre os componentes do sistema imune,
os linfócitos e as células assessórias do
sistema imune encontram-se localizados
e concentrados em órgãos denominados
anatomicamente como órgãos linfóides
primários e secundários. Os primários são
aqueles onde os linfócitos primeiramente
se desenvolvem, expressam os receptores
de antígenos e atingem sua maturidade
funcional. São eles o timo (desenvolvimento de linfócitos T) e a medula óssea
(desenvolvimento de linfócitos B). Os
órgãos imunes secundários são aqueles
para onde migram essas células B e T e
onde ocorre a resposta destas aos antígenos. São eles o baço, linfonodos, sistema
imune cutâneo e sistema imune de mucosas. O sistema imune de mucosas é muito
importante para conferir proteção contra
patógenos que tipicamente invadem o organismo através de suas superfícies.
No caso da utilização de vacina por via oral, sabe-se que ao imunizar
esta mucosa desencadeia-se uma proteção também em outras mucosas(22). Outro
ponto interessante neste sistema imune de
mucosa são as alterações morfológicas
descritas por alguns pesquisadores. De
acordo com Pluske et al. (1997) e Brown
et al. (2006), em suínos, logo após o desmame o intestino tem papel fundamental
na defesa do organismo e por isso aumenta sua taxa de renovação celular na membrana, alterando a relação vilo/crypta e
aumentando a atividade das enzimas digestivas na membrana em escova da mucosa intestinal.
Desta maneira, Þca claro que
o sistema imune tem papel importante
também no desempenho animal podendo
interferir no funcionamento de outros órgãos e sendo interferido por diversos fatores, principalmente nutricionais, como é
o caso da troca alimentar e a presença de
micotoxinas na dieta.
Suínos & Cia
23
Sanidade
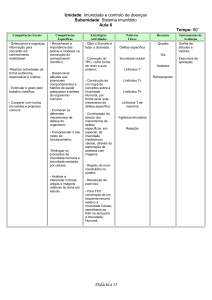
Principais toxinas produzidas pelos fungos
Micotoxina
Aßatoxina, B1, B2, G1, G2
Gênero Fúngico Produtor
Aspergillus e Penicillium
Tricotecenos (+30 substâncias entre elas Fusarium
T2, DON, DAS, etc)
Ocratoxina
Aspergillus e Penicillium
Patulina
Aspergillus e Penicillium
Zearalenona
Fusarium
Citrinina
Aspergillus e Penicillium
Fumonisina
Fusarium
Gliotoxina
Aspergillus
Ácido Penicílico
Penicillium
Moniliformina
Fusarium
Ergotamina
Claviceps
Ácido ciclopiazônico
Aspergillus
Ácido fusárico
Fusarium
Micotoxinas e sua interferência no
sistema imune de suínos
Micotoxinas são substâncias tóxicas produzidas por fungos que podem
ocorrer em cereais utilizados na ração
animal e que causam inúmeras alterações
no organismo tendo principal inßuência
no sistema imune. Acredita-se que 25%
dos cereais produzidos no mundo estão
contaminados por micotoxinas. Estudos
indicam que as micotoxinas podem ser
formadas em várias partes da cadeia de
produção alimentar como nos cereais ainda na lavoura, durante o armazenamento, a fabricação e transporte de rações e
durante o armazenamento deste alimento
nas granjas de produção animal(20).
Até hoje foram descritos mais de
300 diferentes tipos de toxinas produzidos por distintas espécies fúngicas e que
podem afetar de diversas maneiras o sistema de defesa do organismo a agentes
estranhos com imunossupressão ou imunoestimulação. Na tabela 1 estão descritas
algumas das principais toxinas produzidas
pelos fungos.
A maioria das micotoxinas é descrita como inibidoras da síntese de proteínas como DON, aßatoxina, ocratoxina e
muitos descrevem que a maior inßuência
destas toxinas estaria relacionada ao fato
de diminuírem a cascata de síntese protéica tão necessária para os mecanismos de
defesa do organismo que envolvem desde
mitose celular até produção de proteínas
Suínos & Cia
24
como anticorpos e linfocinas, provocando
imunossupressão no animal exposto a estas toxinas.
Entretanto, Pestka et al. (2004)
descreveram que deoxynivalenol (DON) e
outros tricotecenos podem tanto ter efeito
imunoestimulatório como imunossupressivo dependendo da dose, freqüência de
exposição e status imunitário. De acordo
com aqueles autores, baixas doses de tricotecenos interferem com a expressão de
citocinas e genes inßamatórios induzindo
imunoestimulação, enquanto altas doses
promovem apoptose de leucócitos com
concomitante imunossupressão. Aquele estudo demonstra que as micotoxinas
podem também causar desregulação na
sinalização celular com conseqüentes alterações na expressão gênica de distintos
tipos celulares.
Um estudo in vitro realizado com
células imunes humanas demonstrou que
T-2 e fusarenon X causam efeito imunossupresivo em linfócitos. Nivalenol e DON
inibem a mitogenese de células NK e zearalenona, alfa-zearalenol e beta-zearalenol apresentam um efeito de inibição na
mitogenese de linfócitos somente em altas
doses(3). Um estudo realizado por Silvotti
et al (1997) demonstrou que quando porcas foram alimentadas com 800 ppb de
aßatoxina durante gestação e lactação,
foi detectado 500 ppt de aßatoxina M1 no
leite e os leitões nascidos destas porcas
apresentaram-se alteração na imunidade
celular. No caso da aßatoxina, o mecanismo responsável pela imunossupressão
está relacionado com sua inibição na síntese protéica.
Tanto a imunidade inata como a
adquirida pode ser afetada pelas micotoxinas. O efeito das micotoxinas pode ser
ilustrado sobre o epitélio intestinal, por
exemplo, já que essa mucosa é considerada uma barreira física contra patógenos
- possuindo ao mesmo tempo componentes da imunidade inata quanto especíÞca
- como é o caso da presença de linfócitos
e IgA. Na realidade, logo da ingestão de
um alimento contaminado, as células da
mucosa intestinal podem Þcar expostas a
grandes concentrações desta toxinas(19).
Como é descrito por Bouhet e Oswald
(2005), a função de barreira física realizada pelo epitélio intestinal é conseguido
através da resistência elétrica trans-epitelial (TEER) que existe na monocamada
celular. Algumas toxinas são capazes de
diminuir essa TEER em células do intestino de humanos como ocratoxina, patulina e deoxivalenol. Bouhet et al., (2004)
descreveram que fumonisina altera essa
resistência trans-epitelial nas células do
intestino de suínos.
De acordo com aqueles autores,
essa pode ser uma explicação dos processos de injúria, descamação e ulceração
observada em animais expostos à ingestão de micotoxinas. Vários investigadores
procuraram explicar qual o mecanismo
que as micotoxinas poderiam afetar essa
TEER na mucosa intestinal. McLaughlin
et al. (2004) explica que isso pode acontecer devido a diminuição na quantidade de
proteínas nas junções celulares. De acordo com Leung et al. (2003) a diminuição
na biossíntese de esÞngolipidios que é inibida pelas toxinas pode alterar a regulação
elétrica das células epiteliais.
Por outro lado, as células da mucosa intestinal que fazem essa proteção física inata são um tecido que está em constante renovação para manter a integridade
deste epitélio, o que ocorre a partir da proliferação de células indiferenciadas provenientes da cripta e que se diferenciam e se
deslocam ao longo das vilosidades, sendo
eliminados por extrusão no ápice do vilo
intestinal. Micotoxinas como T2 (Li et
al, 1997) e ocratoxina(2) induzem necrose
das células epiteliais da cripta chegando
à atroÞa de vilosidades. Fumonisinas são
descritas como bloqueadora das fases G0/
G1 do ciclo das células epiteliais diminuindo sua proliferação(4). Baixas doses
de DON interferem com a diferenciação
de enterócitos(10).
Ano VI - nº 25/2008
Sanidade
Ainda no que se refere à imunidade inata da mucosa intestinal, sabe-se que
a produção de muco a partir das células
caliciformes (também chamadas células
Globbet) tem importante função como
lubriÞcação e barreira protetora deste
epitélio. Sabe-se que quando a mucosa
intestinal é “desaÞada” ocorre incremento no número destas células no intestino
com aumento na produção de muco. Isto é
demonstrado no caso de fatores antinutricionais dos cereais (Oliveira et al., 2000).
Entretanto, somente um estudo na literatura demonstra que fumonisina induz hiperplasia de células epiteliais da mucosa
intestinal de frangos de corte(6). Mais estudos neste aspecto são necessários para
veriÞcar a inßuência desta e outras micotoxinas sobre a proliferação de células
caliciformes e a produção de muco.
Na imunidade especíÞca de mucosa destaca-se o papel das imunoglobulinas
e células imunes como linfócitos T. Em
suínos, assim como em outros mamíferos,
80-90% das imunoglobulinas presentes
nos ßuídos intestinais, lágrimas e glândulas parótidas são IgA(08). De acordo com
revisão de Bouhet et al. (2005), toxina T-2
suprime as células B nas placas de Peyer
mas o efeito direto sobre a produção de
IgA não foi investigado. Por outro lado,
Petska et al. (2004) aÞrmam que outros
tricotecenos como DON e nivalenol provocam uma dramática elevação na produção de IgA em ratos, a ponto de o acúmulo destes anticorpos causar nefropatia
e hematuria.
Outro aspecto afetado pelas micotoxinas é a produção de citocinas pelas células intestinais que desempenham
papel fundamental no recrutamento de
células inßamatórias para defesa desta
mucosa. Oswald et al. (2003) descreveu
que leitões alimentados com baixos níveis
de fumonisina diminuem a expressão de
IL-8 no íleo, sugerindo que este fato pode
ter grande inßuência na maior susceptibilidade à E. coli observada nestes animais
quando comparado ao grupo controle.
Aqueles autores sugerem que esse menor recrutamento de células inßamatórias
ocasionado pela diminuição na expressão
de IL-8 se associa a ação desta toxina na
redução de proliferação celular e integridade da mucosa do intestino aumentado a
susceptibilidade dos animais a colonização bacteriana.
A interferência de micotoxinas na
defesa das mucosas também foi descrita
sobre a funcionalidade de macrófagos al-
Suínos & Cia
26
As micotoxinas podem ser formadas em várias partes da cadeia de produção alimentar, como nos
cereais ainda na lavoura, no armazenamento e transporte.
veolares em suínos. Liu et al. (2002) demonstrou que tanto fumonisina B1 quanto
aßatoxina apresentam citotoxicidade dose
e tempo dependente para macrófagos alveolares de suínos, porém a partir de alterações distintas uma vez que são metabólitos totalmente diferentes. Fumonisina
B1 inibe a esÞgosina e esÞgosina N-acetiltransferase que são fundamentais para a
rota “de novo” de síntese de esÞngolipídios. Este é descrito como um evento inicial da citotoxicidade da fumonisina em
células. Alguns estudos demonstram que
a toxicidade da fumonisina para macrófagos de aves (Qureshi and Hagler, 1992) é
maior que a observada em suínos(12), sugerindo uma diferença entre as espécies
animais quanto à sensibilidade a esta micotoxina.
Por outro lado, o efeito biológico de toxicidade celular das aßatoxinas
inclui citotoxicidade aguda que requer
a ativação do 2,3 epoxy metabólito pela
monooxigenase, ativando ligações covalentes entre aßatoxina epoxidos com
macromoléculas. De acordo com Liu et
al (2002) macrófagos de suínos possuem
essa monooxigenase para ativar aßatoxina B1, gerando citotoxicidade nestas
células de forma 10 vezes mais potente
que a fumonisina B1. Aqueles autores relataram ainda que somente a fumonisina
induz apoptose nestes macrófagos, mas
ambas as toxinas diminuem a atividade
fagocitica destas células. A fumonisina
atuaria ainda reduzindo a produção de ci-
tocinas por essas células o que diminui a
regulação da resposta inßamatória nestes
tecidos. Pang et al. (1987) observaram
diminuição na capacidade fagocítica de
macrófagos alveolares e na resposta blastogênica de linfócitos pulmonares em suínos que inalaram T-2.
Esta inßuência dos metabólitos tóxicos de fungos na imunidade das mucosas pode afetar muitíssimo o desempenho
animal, já que a indução desta imunidade
é muito importante para conferir proteção
contra diversos patógenos que tipicamente invadem essas superfícies. Em adição,
existe aparentemente uma interrelação
entre as distintas mucosas do organismo,
o que permite que a estimulação de uma
superfície mucosa potencialmente induza
proteção especíÞca em outras mucosas(22).
Como a administração de vacina via oral
também é uma rota bastante prática e econômica de imunização dos animais, quando ocorre a interferência de micotoxinas
nesta resposta imune, o resultado da vacinação pode ser afetado.
Estudos em ratos também apresentaram que o efeito da fumonisina sobre a resposta à imunização com SRBC
(eritrócitos de carneiro) depende do momento da administração da toxina, sendo
seu efeito evidente somente se a imunização ocorrer concomitantemente com a
vacinação(23). Aqueles autores também declararam que somente os machos, e não as
fêmeas, tiveram sua imunidade humoral
afetada pela fumonisina.
Ano VI - nº 25/2008
Sanidade
O efeito de micotoxinas afetando
a produção da imunidade a vacinações
já foi descrita em 1978 por Cysewski et
al. demonstrando que dietas contaminadas com aßatoxina diminuíam a resposta
de suínos a vacinação contra Erisipela.
De acordo com Oswald (2006), alimentação de suínos com 8 ppm fumonisina
não modiÞca a concentração sérica total
de imunoglobulinas mas diminui signiÞcativamente a resposta especíÞca a um
modelo de antígeno como a vacina de
micoplasma. Aquela mesma autora aÞrma
que em estudos in vitro a fumonisina inibe
a proliferação celular e altera a produção
de citocinas, referindo-se especiÞcamente ao aumento na síntese de IFN-y, uma
citocina de linfócitos T helper 1 (Th1)
envolvidas na mediação da resposta imune celular e ao mesmo tempo, diminui a
IL-4, citocina Th2, envolvida na resposta
imune humoral.
Na verdade, todas essas alterações
descritas na literatura comprovam que as
micotoxinas alteram a resposta imune dos
animais, podendo interferir com a resposta
vacinal deixando os animais susceptíveis
a infecções inespecíÞca ou mesmo para
aquelas as quais esses animais tenham
sido vacinados. Cabe ainda ressaltar que
a maioria dos estudos citados relaciona a
adição de micotoxinas puriÞcadas a dietas
de boa qualidade. Na prática, quando há
presença de micotoxinas na dieta, em algum momento ocorreu o desenvolvimento de fungos neste cereal e/ou ração. Normalmente, esse desenvolvimento fúngico
causa perdas nutricionais, além de poder
haver várias toxinas presentes, cujo sinergismo ainda não é conhecido. Nestas condições é bem possível que o efeito do uso
de cereais e/ou alimentos contaminados
com fungos e micotoxinas na dietas dos
animais possa promover interferências no
sistema imune dos animais que ainda não
são conhecidas, mas que provavelmente
esteja relacionada a imunossupressão.
Infelizmente, está bastante distante a solução para o controle total das
micotoxinas em alimento animal, mas o
emprego de um programa adequado de
controle de fungos e micotoxinas pode
ajudar a prevenir ou minimizar esses efeitos deletérios das micotoxinas.
Ano VI - nº 25/2008
Referências
01. Abbas, A.K., Lichtman, A.H., Pober, J.S.
Cellular and Molecular Immunology 4
edition, 2000.
02. Albassam, M., Yong, S., Bartnagar, R.,
Sharma, A., Prior, M. Histopathologic and
electron microscopic studies on the acute
toxicity of ochratoxin A in rats. Vet. Pathol.
24(1987) 427-435.
03. Berek, L., Petri, I.B., Mesterházy, Á, Téren, J.,
Molnár, J. Effects of mycotoxins on human
immune functions in vitro. Toxicology in
vitro 15 (2001) 25-30.
04. Bouhet, S., Oswald, I.P. The effects of
mycotoxins, fungal food contaminats, on
the intestinal epithelial cell-derived innate
immune response. Veterinary Imm. And
Immunopath. 108 (2005), 199-209
05. Bouhet, S. Hourcade, E., Loiseau, N., Fikry, A.,
Martinez, S., Roseli, M., Galtier, P., Mengheri,
E., Oswald, I.P. The mycotoxin fumonisin
B1 alters the proliferation and the barrier
function of porcine intestinal cells. Toxicol.
Sci. 77 (2004), 165-171.
06. Brown, T., Rottinghaus, G., Willians, M.
Fumonisin mycotoxosis in broilers:
performance and pathology. Avian Dis. 36
(1992) 450-454.
07. Brown, D.C., Maxwell, C.V., Erf, G.F., Davis,
M.E., Singh, S., Johnson, Z.B. The inßuence
of different management systems and
age on intestinal morphology, immune
cell numbers and mucin production
from goblet cells in post-weaning
pigs. Veterinary Immunology abd
Immunopathology 111 (2006) 187-198.
08. Butler, J.E., Sun, J., Wertz, N., Sinkora, M.
Antibody repertoire development in swine.
Develop. and Comparat. Immunology 30
(2006) 199-221.
09. Cysewski, S.J., Wood, R.L., Pier, A.C.,
Baetz, A.L. Effeects of aßatoxin on the
development of acquired immunity to
swine erysipelas. Am. J. Vet. Res. 39 (1978)
445-448.
12. Liu, B.H., Yu, F.Y., Chan, M.H., Yang, Y. L. The
effects of mycotoxins, fumonisin B1 and
aßatoxin B1, on primary swine alveolar
macrophages. Toxicology and App.
Pharmacology 180 (2002) 197-204.
13. McLaughlin, J., PadÞeld, P.J., Burt, J.P.,
O’Neill, C.A., Ochratoxin A increases
permeability through tight junctions
by removal of speciÞc claudin isoforms.
Am.J.Physiol.Cell.Physiol. 287(2004)14121417.
14. Oswald , I.P, Desautels, C., LafÞtte, J.,
Fournout, S., Peres, S.Y., odin, M., Le Bars,
P., Le Bars, J., Fairbrother, J.M. Mycotoxin
fumonisin B1 increases intestinal
colonization by pathogenic Escherichia coli
in pigs. Appl. Environ. Microbiol. 69 (2003)
5870-5874.
15. Oswald, I.P. Risk of mycotoxins to pig health:
immunosuppressive effects. In: Proc. Of The
Wourld Mycotoxin Forum (2006) 40-43.
16. Pang, V.F., Swanson, S.P., Beasley, V.R., Buck,
W.B., Haschek, W.M. The toxicity of T-2 toxin
in swine following topical application.
Fundam. Appl. Toxicol. 9 (1987) 41-49.
17. Pestka, J.J., Hui-Ren Zhou, Moon, Y, Chung,
Y.J. Cellular and molecular mechanism for
immune modulation by deoxynivalenol
and other trichothecenes: unraveling a
paradox. Toxicology Letters 153 (2004)
61-73.
18. Pluske, J.R., Hampson, D.J., Willian, I.H.
Factors inßuencing the structure and
function of the small intestine in weaned
pig: a review. Livestock production science
51 (1997) 215-219.
19. Prelusky, D.B. Trenholm, H.L., Rotter, B.A.,
Miller, j.D., Savard, M.E., Yeung, J.M., Scott,
P.M. Biologicalfate on fumonisin B1 in foodproducing animals. Adv. Exp.Med.Biol. 392
(1996) 265-278.
20. Santin E. Mould growth and mycotoxin
production. In: Diaz, D. The Mycotoxin Blue
Book (2005) 225 -234.
21. Silvotti, L., Petterino,C., Bonomi, A., Cabassi,
E. Immunotoxicological effects on piglets
of feeding sows diets containing aßatoxins.
Vet. Rec. 141 (1997) 469-472.
10. Kasuga, F., Hara-Kudo, Y., Saito, N., Kamagai,
S., Sugita-Konishi, Y. In vitro effect of
deoxynivalenol on the differentiation of
human of human colonic cell lines caco-2
and T84. Mycopathologia 142(1998), 161167.
22. StreatÞeld, S. J. Mucosal immunization
using recombinant plant-based oral
vaccine. Methods 38 (2006) 150-157.
11. Leung , L.W., Contreras, r.G., FloresMaldonado, C., Cereijido, M., RodriguezBoulan, E. Inhibitors of glycosphingolipid
biosynthesis reduce transpithelial electrical
resistance in MDCK I and FRT cells. Am.
J. Physiol.Cell.Physiol.284 (2003) C1021C1030.
23. Tryphonas, H., Bondy, G., Miller, J.D., Lacroix,
F., Hodgen, M., Meguire, P., Fernie, S., Miller,
D., Hayward, S. Effects of fumonisin B1 on
the immune system of Sprague-Dawley
rats following a 14-day oral (gavage)
exposure. Fundamental and Applied
Toxicology 39 (1997) 53-59.
Suínos & Cia
27