06/2008
Lipidemia
Metabolismo e
Endocrinologia
Grupo 2
André Zamith, nº58556
Eduardo Bicacro, nº58615
Pedro Teixeira, nº58482
Lipidemia define-se
se como a concentração de lípidos no plasma sanguíneo. Neste documento irá ser
abordada a forma como essa concentração se estabelece, e que mecanismos a regulam.
Os lípidos são biomoléculas insolúveis em água, tendo como exemplos os triacilgliceróis (TAG) ou colesterol.
Existem vários motivos que tornam oss TAG bons combustíveis de reserva: têm longas cadeias alquilo altamente
reduzidas; a sua energia de oxidação
o
total é mais de duas vezes superior à dos glícidos ou proteínas de
igual peso molecular;; a sua insolubilidade em água evita o aumento da osmolaridade do meio; a não
solvatação pela água reduz o volume que
qu esta ocuparia nas reservas; o facto
de serem inertes quimicamente, faz com que não tenham tendência a participar em
reacções indesejadas. Contudo, os TAG apresentam também algumas desvantagens, pois a
sua insolubilidade na água exige emulsionamento antes na sua digestão e ainda transporte
especializado no sangue que consiga ultrapassar essa insolubilidade.
O colesterol é uma
ma molécula lipídica
lipíd cuja importância é elevada: é constituinte das
membranas celulares do organismo humano; é precursor de hormonas esteróides, como
por exemplo cortisol ou progesterona, da Vitamina D e dos sais biliares.
Os ácidos gordos podem ter origem em gorduras absorvidas na dieta, ser sintetizados pelo fígado (que
também sintetiza colesterol, entre outros) ou no tecido adiposo, onde
constituem TAG. Estes precisam de ser transportados entre estas fontes e os
destinos onde cumprem funções metabólicas. A solução para o problema da
sua insolubilidade reside na capacidade de sintetizar uma estrutura
designada de lipoproteína.. No plasma sanguíneo, com a excepção dos ácidos
gordos livres (AGL) que viajam ligados à albumina, os lípidos são
transportados nessas estruturas micelares denominadas lipoproteínas. As
lipoproteínas plasmáticas contêm, no seu núcleo, lípidos hidrofóbicos (TAG e
ésteres decolesterol) envolvidos por uma monocamada de lípidos
anfipáticos (fosfolípidos e colesterol)) associados a proteínas
(apolipoproteínas). As apolipoproteínas
proteínas são as partes funcionais que serão
reconhecidas
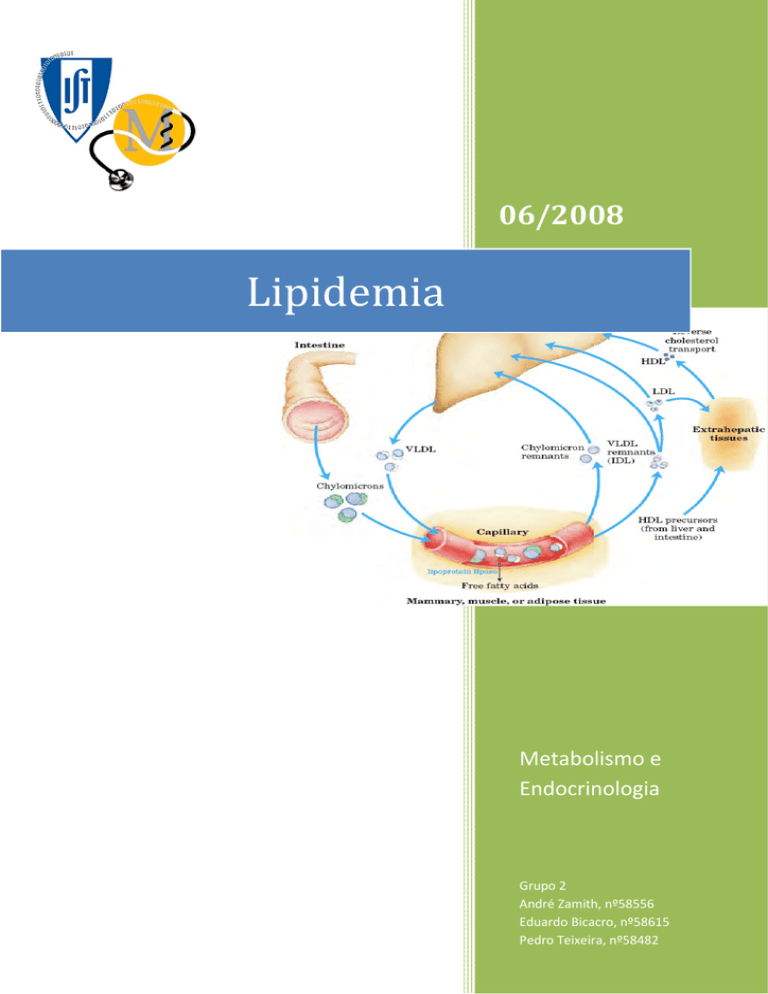
das pelas superfícies celulares, podendo ser integrais (p/ex. ApoA
e ApoB) ou periféricas (p/ex. ApoC e ApoE) – ver figura adjacente. As apolipoproteínas periféricas, ao contrário
con
das
integrais, podem ser transferidas entre diferentes lipoproteínas plasmáticas.
plasmáticas. Consideram-se
Consideram
os seguintes tipos de
lipoproteínas:
Chylomicron– Quilomicra;
Chylomicronremnant – Quilomicra remanescente;
remanescente
VLDL – VeryLowDensityLipoproteins
VeryLowDensityLipoprotei – Lipoproteínas de densidade
muito baixa;
IDL – Intermediate-DensityLipoproteins
DensityLipoproteins– Lipoproteínas de densidade
intermédia;
LDL – Low-DensityLipoproteins – Lipoproteínas de baixa densidade;
HDL - High-DensityLipoproteins – Lipoproteínas de alta densidade.
Os várioss tipos de lipoproteínas podem ser distinguidos pelos diferentes tamanhos, densidades,
apoproteínas
nas constituintes, percentagem proteica, percentagem lipídica, propriedades electroforéticas
electroforé
e
constituintes fundamentais (ver tabela abaixo).
a
Composição (wt %)
Proteína
Fosfolípidos
Colesterol
livre
Ésteres de
colesterol
TAG
2
9
1
3
85
-
-
-
-
-
10
18
7
12
50
-
-
-
-
-
23
20
8
37
10
55
24
2
15
4
Destaque-se que com a diminuição do tamanho das lipoproteínas, a sua densidade aumenta. Podemos ainda
observar que quanto menor for a percentagem lipídica da lipoproteína, maior será a sua percentagem proteica. As
quilomicra e as VLDL são as lipoproteínas em que os TAG são o composto dominante, ao contrário dos LDL e dos
HDL, cujos compostos dominantes são os fosfolípidos e as proteínas. Todas estas tendências são explicadas pelos
processos de formação das várias lipoproteínas que serão explicados adiante.
Cada classe de lipoproteína tem uma função específica que pode ser determinada pelos pontos de síntese,
composição lipídica e conteúdo apolipoproteico.
As apolipoproteínas participam no metabolismo dos lípidos contidos nas lipoproteínas de diferentes
maneiras: (i) podem ser ligandos de receptores das membranas celulares (permitindo a interacção das lipoproteínas
com as células) como a ApoE, a ApoB100 e a ApoAI; (ii) podem ser reguladores de enzimas como a ApoCI-I e ApoC-III
(activação e inibição da proteína lipase, respectivamente) e a ApoA-I (activação da lecitina colesterolaciltransferase).
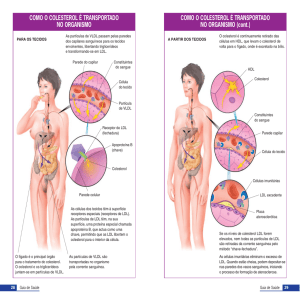
Após a ingestão de gorduras na dieta de um indivíduo, os sais biliares
emulsionam os aglomerados macroscópicos que estas formam no quimo expelido
do estômago para o intestino, formando micelas dispersas (partículas
microscópicas). Lipases hidrossolúveis existentes no intestino hidrolisam as micelas
em monoacilgliceróis e AGL. Posteriormente estes lípidos são absorvidos pela
mucosa intestinal e reesterificados em TAG no retículo endoplasmático dos
enterócitos. Por acção de uma proteína do retículo endoplasmático denominada
proteína microssomática de transferência, os TAG formados são de seguida
combinados com apolipoproteínas (ApoB48 e ApoA) dando origem a quilomicra
imaturos (ou nascentes) que, por processos desenvolvidos no complexo de Golgi,
sofrem exocitose no pólo basal dos enterócitos. Estas são as únicas lipoproteínas
exógenas, pois o seu conteúdo é obtido a partir do interior do tubo digestivo. Os
quilomicra são então transportados nos vasos linfáticos e posteriormente vertidos
na corrente sanguínea onde interagem com as HDL, recebendo destas as apolipoproteínas essenciais ao seu
metabolismo (Apo C e ApoE). Desta forma são sintetizados os quilomicra maduros.
O conteúdo lipídico dos quilomicra maduros pode ser armazenado no tecido adiposo, bem como
aproveitado directamente pelos músculos para produção de energia. Os quilomicra maduros, em concentração
elevada no plasma após uma refeição contendo lípidos, darão
origem aos quilomicra remanescentes nos capilares dos
tecidos adiposo e muscular, por perda do conteúdo em TAG.
Nesta transformação está envolvida uma enzima - a
lipoproteína lipase - que, ligada na face luminal da membrana
das células endoteliais dos capilares de tecidos extrahepáticos, catalisa a hidrólise dos TAG do núcleo dos
quilomicra a ácidos gordos e glicerol. O cofactor essencial à
actividade desta lipase é o ApoC-II. Existe também diminuição
de outros componentes lipídicos (como fosfolípidos e
colesterol) e proteicos (ApoA e ApoC, incluindo ApoC-II) por
transferência para as HDL.
Posteriormente, os quilomicra remanescente chegam ao fígado, onde são endocitados através dos
receptores LDL (ApoB-48, ApoE) e LRP (LDL receptor-related protein), e onde os seus constituintes vão ser
desmembrados, podendo ser aproveitados para a síntese de novas lipoproteínas, ou constituir as reservas do
próprio órgão.
A síntese hepática de TAG ou a sua chegada através dos quilomicra remanescentes fornecem o estímulo
imediato para a formação e secreção das VLDL. As VLDL formam-se no fígado e transportam para o plasma
sanguíneo os TAG e os outros lípidos aí sintetizados. Estas lipoproteínas são constituídas por ApoB100, ApoE e ApoC.
A formação das VLDL tem semelhanças com a dos quilomicra: as ApoC e ApoE também têm origem nas HDL. Os seus
TAG também sofrem a acção da lipoproteína lipase, sendo acolhidos nos tecidos extra-hepáticos, e também a ApoCII e alguns fosfolípidos e colesterol são transferidos para as HDL no decorrer da lipólise. As partículas lipoproteicas
resultantes do processo hidrolítico designam-se, neste caso, por IDL e tal como os quilomicra remanescentes contêm
ApoE. Para além de ApoE, as IDL contém ApoB100.
A apoE, presente nas IDL e nos quilomicra remanescentes, é ligando de receptores membranares hepáticos
de dois tipos: o receptor das LDL (que se liga às ApoE mas também às ApoB100) e o LRP (LDL receptor related
protein) que se liga apenas às apoE. A ligação das IDL e
dos quilomicra remanescentes aos receptores das LDL ou
aos LRPs permite a captação (por endocitose) destas
lipoproteínas pelo fígado. Nos lisossomas dos
hepatócitos os diversos componentes (incluindo as
apolipoproteínas, os ésteres de colesterol, os fosfolípidos
e os TAG restantes) destas lipoproteínas são
hidrolisados; os produtos desta hidrólise são libertados
para o citoplasma onde podem contribuir para um novo
ciclo ao originarem VLDL.
Existem depois duas possibilidades de destino
para as IDL: podem ser endocitadas pelo fígado
directamente pelo receptor LDL (ApoB-100 e ApoE) ou
podem ser convertidas em LDL (observar a figura adjacente). Nos humanos, ocorre em maior proporção a conversão
das IDL em LDL. Esta conversão envolve a perda de TAG, novamente por acção catalítica da lipase ligada ao endotélio
dos capilares dos tecidos e a transferência de apolipoproteínas (com excepção das ApoB-100) para as HDL. As LDL
são as lipoproteínas que contêm a maior parte do colesterol plasmático.
Resumindo, o VLDL é o precursor do IDL (ou VLDL remanescente), que pode ser convertido em LDL. Apenas
uma molécula de ApoB-100 está presente em cada uma destas lipoproteínas e é conservada durante a
transformação, sendo esta a única apolipoproteína conhecida do LDL. Estas lipoproteínas, em conjunto com as HDL,
formam o grupo de lipoproteínas endógenas, por se constituírem por lípidos circulantes ou armazenados no
organismo.
Através da ligação das ApoB100 ao receptor LDL (consegue ligar-se a ApoB-100 e a ApoE) existente na
membrana celular, as LDL plasmáticas são captadas (por endocitose) pelas células do organismo, sendo assim,
devido à sua constituição, que pode ser consultada na tabela, a principal via de transporte de colesterol para as
células. Após a captação (tal como no caso das IDL e dos quilomicra remanescentes) ocorre a hidrólise nos
lisossomas. A actividade dos receptores das LDL é regulada negativamente pelo conteúdo de colesterol da célula,
quanto maior a quantidade de colesterol dentro duma célula menor a actividade dos receptores. Nos macrófagos
dos tecidos e em algumas células endoteliais existe um outro tipo diferente de receptores chamados scavenger.
Estes receptores têm uma especial afinidade para as LDL que sofreram alterações (nomeadamente oxidação) na
estrutura dos seus componentes. Via ligação das LDL a estes receptores os macrófagos, nomeadamente os
macrófagos situados na íntima das artérias, podem acumular colesterol no seu interior. A actividade dos receptores
scavenger nos macrófagos não é regulada pelo conteúdo de colesterol, pelo que estes podem ultrapassar a
quantidade de colesterol.
As HDL estão envolvidas no chamado
transporte reverso do colesterol (dos tecidos para o
fígado). As HDL são lipoproteínas com origem no
fígado e intestino que, na sua forma imatura, são
pequenos discos de tipo membranar contendo um
duplo folheto lipídico rico em fosfolípidos, colesterol
e apolipoproteínas dos tipos A, C e E. As HDL
nascentes captam colesterol dos tecidos extrahepáticos (incluindo macrófagos) e neste transporte
participa um transportador celular (transporte
activo) denominado ATP-binding cassete 1– ABC1. O
colesterol captado pelas HDL é subsequentemente
esterificado e os ésteres de colesterol integrados no
núcleo. Neste momento, as HDL deixam de ser
estruturas discóides e passam a ser esféricas. A formação destes ésteres de colesterol é catalisada pela lecitinacolesterol aciltransferase plasmática (LCAT) que é activada pela ApoA-I das HDL.
As HDL, após captarem e esterificarem o colesterol vão aumentando de diâmetro. Na membrana dos
hepatócitos existe um receptor para as ApoA-I que permite a ligação das HDL. Após a ligação, os ésteres de
colesterol das HDL são absorvidos para o hepatócito. O colesterol dos hepatócitos pode ser excretado (na forma de
sais biliares), enquanto as HDL, que perderam quase todo o seu conteúdo lipídico, são recicladas e usadas como HDL
nascentes.
Um
m outro mecanismo que também poderá contribuir para o transporte reverso do colesterol envolve a
actividade da proteína de transferência de ésteres de colesterol.
colesterol Esta
sta proteínapromove a transferência dos ésteres
de colesterol das HDL para as VLDL e os quilomicra. A transformação destas em IDL e quilomicra remanescentes (por
acção da lipoproteína lipase)) e a subsequente captação destas pelo fígado permite compreender que
q ocolesterol dos
tecidos captado pelas HDL possa ser absorvido pelo fígado.
O tecido adiposo é a principal reserva de TAG no organismo
No organismo, mono, di e TAG são armazenados sobretudo em adipócitos (e também em células produtoras
de esteróis). Os adipócitos são fibroblastos modificados que armazenam TAG (80-90%
(80 90% do volume celular).Nestas
celular).
células,ass gorduras organizam-se
organizam
em gotículas com uma constituição específica: uma
monocamada de fosfolípidos envolvendo uma grande acumulação de TAG, revestida
externamente
xternamente por perilipinas – proteínas que restringem a mobilização do conteúdo da
gotícula, através de um mecanismo que se discutirá posteriormente.
As reservas de TAG no tecido adiposo estão em constante renovação através da
lipólise e reesterificação.
reesterificação Estes dois processos ocorrem em vias diferentes com intervenção
de enzimas diferentes, sendo regulados separadamente por variados factores. O balanço
destes dois processos determina a reserva de AGL no tecido adiposo, o que por sua vez
determina os níveis de AGL circulantes,, o que tem influência em muitos outros tecidos para
além do adiposo.
A enzima glicerol cinase não é expressada no tecido
adiposo, pelo que o glicerol não pode ser
s utilizado para a
provisão de glicerol-3-fosfato
fosfato (tem de ser obtido pela
glicólise).
Não sendo utilizado, o glicerol difunde-se
difunde
para o
sangue e é utilizado em tecidos como o hepático e renal,
que possuem uma glicerol cinase activa.
Controlo hormono-dependente
dependente da lipólise
1.
Sinal de necessidade de energia – a sua proveniência será
s
discutida
posteriormente.
2.
Activação da adenilatociclase,, localizada na membrana plasmática
do adipócito, resultando produção do cAMP.
3.
Proteína cinase dependente de cAMPfosforila
fosforila a lipase.
4.
A mesma proteína cinase fosforila também as
a perilipinas.
5.
Resulta a possibilidade de mobilização - hidrólise dos TAG.
6.
Libertadoss AGL que passam para o sangue onde se ligam
covalentemente à albumina serosa, responsável pelo seu transporte no
sangue.
7.
AGL viajam para o músculo esquelético, coração, córtex renal ou
outro tecido, onde são recebidos por transportadores específicos.
Utilização lipídica por diferentes tecidos/órgãos no organismo
Cérebro – A glicose
cose é essencialmente o único combustível utilizado, exceptuando em jejum prolongado, em que os
corpos cetónicos podem ser fonte energética.
energética. Os AGL, porque estão ligados à albumina no sangue, não atravessem a
barreira hematoencefálica.
Músculo – Utiliza glicose,
cose, ácidos gordos e corpos cetónicos. Quando em actividade explora as suas reservas de ácidos
gordos. Quando em repouso,
epouso, os AGL são o principal combustível (85%). No músculo cardíaco,
cardíaco os AGL são a principal
fonte energética,, mas também os corpos cetónicos podem ser usados.
Rim – Requerem grandes quantidades de energia para realizar a absorção, que obtêm apenas a partir
part de glicose e
AGL.
Fígado – Regulador central da quantidade de lípidos em circulação, através da síntese de VLDL ou corpos cetónicos.
Obtém os seus requisitos energéticos sobretudo a partir de cetoácidos derivados da degradação de aminoácidos.
aminoácidos
Relação daa mobilização lipídica com o metabolismo da glicose nos adipócitos
Quando há glícidos disponíveis nos adipócitos, estes são preferencialmente usados em detrimento das
reservas lipídicas. Esta “poupança” lipídica,
lipídica que inibe a mobilização das reservas, estabelece
belece-se de 3 formas:
1.
Quando há utilização de glicose nos adipócitos diminui o fluxo de AGL para o sangue, contudo a libertação de
glicerol continua, mostrando que a lipólise continua a dar-se.
dar se. O que acontece é que o aumento da concentração de
glicose 6-fosfato traduz-se
se num aumento de glicerol 3-fosfato
3 fosfato através da glicólise. Este aumento provoca um
desequilíbrio que pela lei de acção de massas favorece a reacção de síntese de TAG. Isto faz com que se reduza o
número de acilgordo-CoA,
CoA, o que estimula, também
também pela mesma lei, a reacção de reesterificação, culminando numa
redução do número de AGL, e formação de TAG.
2.
A redução de AGL e o aumento de acetil-CoA
acetil CoA em consequência da disponibilidade de glicose, criam
condições para que a reacção de síntese de ácidos gordos
g
a partir de acetil-CoA
CoA se dê mais rapidamente do que a
degradação de lípidos, constituindo-se
se mais reservas lipídicas.
3.
O aumento da concentração dos intermediários do ciclo de Krebs em resultado da abundância de glícidos
estimula a actividade da enzima acetil-CoA
CoA carboxilase responsável pelo 1º passo (e também o limitante) da síntese
dos ácidos gordos a partir de acetil-CoA..
Hormonas que influenciam o metabolismo lipídico
Insulina – Estimula
stimula a utilização de glicose pelos tecidos, favorecendo a relação
relaç referida anteriormente.
Amplifica a acção das lipases das paredes dos adipócitos, favorecendo a entrada de AGL e armazenamento sob a
forma de TAG. Inibe ainda a acção da lipase, reforçando esse efeito. A sua ausência faz aumentar muito a
mobilização das reservas.
Glicagina, epinefrina e norepinefrina, glicocorticóides, somatotrofina – Estimulam a lipase hormonohormono
dependente, aumentando a mobilização lipídica. O cortisol e a glicagina têm ainda influência negativa na entrada de
glicose na célula, o que contribui
con
também para uma
maior mobilização.
Hormonas tiroideias – provocam um
aumento genérico da mobilização de compostos
energéticos em todas as células do corpo, o que
diminui a concentração de colesterol, fosfolípidos e
TAG, aumentando os níveis de AGL.
Variação de ácidos gordos no sangue em regime pré e pós-prandial
pós
Na figura à direita pode observar-se
se que após a ingestão de alimentos, os
níveis de insulina sobem, devido à disponibilidade de glicose. Este aumento
provoca uma inibição da mobilização das
as reservas lipídicas dos adipócitos, pelo
que os níveis de AGL no plasma sanguíneo descem muito. Porém, à medida
que as reservas de glicose vão sendo debeladas, este mecanismo reverte-se,
reverte
e
a diminuição da concentração de insulina provoca a mobilização lipídica.
li
Variação de AGL no sangue em regime pré e pós-prandial
pós
Os corpos cetónicos são formados a partir do Acetil-CoA,
Acetil
que foi obtido no fígado
a partir da β-oxidação
oxidação dos ácidos gordos. Quando há falta de glicose, os
intermediários do ciclo de Krebs encontram-se
encontram
em baixas concentrações
(utilizados na gliconeogénese). O acetil-CoA,
CoA, não reagindo com o oxaloacetato no
ciclo do citrato, entra na via dos corpos cetónicos que podem ser utilizados nos
tecidos extra-hepáticos
hepáticos para obtenção de energia.
energi É importante que estes
compostos abandonem o fígado, de forma a continuar a β-oxidação, pois a sua
acumulação provocaria desequilíbrios fatais no pH do meio.