Lipoproteínas plasmáticas; Rui Fontes
Lipoproteínas plasmáticas
1-
No plasma sanguíneo, exceptuando os ácidos gordos “livres” que viajam ligados à albumina, os
lipídeos são transportados em estruturas micelares esféricas denominadas lipoproteínas. As
lipoproteínas plasmáticas contêm, no seu miolo, lipídeos hidrofóbicos (triacilgliceróis e ésteres de
colesterol) e, no exterior, em monocamada, lipídeos anfipáticos (fosfolipídeos e colesterol)
associados a proteínas (apolipoproteínas). O grupo hidroxilo do colesterol não esterificado e os
grupos fosfo-base dos fosfolipídeos estão voltados para o exterior das lipoproteínas enquanto as partes
hidrofóbicas destas moléculas mergulham no miolo. As apolipoproteínas podem ser integrais (como as
de tipo B) ou periféricas (como as dos tipos A, C e E). As apolipoproteínas periféricas, ao contrário
das integrais, são trocadas entre diferentes lipoproteínas plasmáticas e podem existir livres no plasma.
As apolipoproteínas participam no metabolismo dos lipídeos contidos nas lipoproteínas de diferentes
maneiras: (i) podem ser ligandos de receptores das membranas celulares permitindo a interacção das
lipoproteínas com as células como no caso das apo E, da apo B100 e da apo AI ou (ii) podem ser
reguladores de enzimas como no caso da apo CII e da apo CIII (activação e inibição da lípase de
lipoproteínas, respectivamente) assim como da apo AI (activação da lecitina-colesterol-aciltransférase).
2-
As lipoproteínas plasmáticas costumam ser classificadas de acordo com a sua densidade: por ordem
decrescente temos as HDL (lipoproteínas de alta densidade; 30-60% proteínas; 1,06-1,13 de
densidade), as LDL (lipoproteínas de baixa densidade), as IDL (lipoproteínas de densidade
intermédia; também são designadas de VLDL remanescentes), as VLDL (lipoproteínas de muito baixa
densidade) e os quilomicra (1-2% proteínas; 85% de triacilgliceróis; <0,95 de densidade;). Esta
ordem também reflecte o seu tamanho relativo: as lipoproteínas mais pequenas são as HDL e as
maiores os quilomicra. Quanto maior é a percentagem de proteínas e menor a de triacilgliceróis maior
é a sua densidade e menor o seu tamanho. As lipoproteínas mais ricas em triacilgliceróis são os
quilomicra e, logo a seguir, as VLDL. As LDL e as HDL são muito pobres em triacilgliceróis e ricas
em colesterol e ésteres de colesterol. A técnica da ultracentrifugação permite separar as lipoproteínas
de acordo com a sua densidade e pode ser usada em investigação. Na prática clínica do dia a dia
doseiam-se os triacilgliceróis (em jejum, são uma medida das VLDL e IDL), o colesterol total e o
colesterol ligado às HDL. O colesterol ligado às LDL é habitualmente estimado usando uma equação
(colesterol das LDL = colesterol total - colesterol das HDL - estimativa do colesterol das VLDL e
IDL). Na verdade, o contributo das IDL para o colesterol total do plasma é muitíssimo menor que o
das LDL, HDL e VLDL; as IDL são uma classe intermédia (de limites mal definidos) entre as VLDL e
as LDL. Quer as IDL, quer os quilomicra remanescentes são, no metabolismo, lipoproteínas “de
transição” e, na ausência de patologia, as suas concentrações são muito baixas.
3-
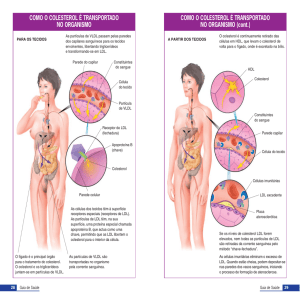
No processo digestivo dos lipídeos, após hidrólise no lume intestinal e a absorção dos produtos dessa
hidrólise, ocorre reesterificação parcial no retículo endoplasmático dos enterócitos. No caso dos
triacilgliceróis a esterificação envolve a transferência de grupos acilo do acil-CoA para o 2monoacilglicerol; no caso do colesterol a acil-colesterol-acil-transférase (ACAT) catalisa a
transferência de um grupo acilo do acil-CoA para o colesterol (ver equação 1). Por acção de uma
proteína do retículo endoplasmático denominada proteína microssomática de transferência, os
lipídeos formados são de seguida combinados com apolipoproteínas (apo B48 e apo A) dando origem
a quilomicra imaturos (ou nascentes) que, via aparelho de Golgi, sofrem exocitose no pólo basal dos
enterócitos. Depois são transportados nos vasos linfáticas que se reúnem no canal torácico que drena
para uma veia central (tronco braquicefálico esquerdo). Assim, após uma refeição que contenha
lipídeos, os quilomicra imaturos acabam vertidos na corrente sanguínea. Já no plasma sanguíneo, os
quilomicra imaturos interagem com as HDL recebendo destas lipoproteínas componentes proteicos
essenciais ao seu posterior metabolismo (apo C e apo E). Desta maneira, formam-se no plasma os
quilomicra maduros. Com excepção dos ácidos gordos de cadeia curta (que são raros), a maior parte
dos lipídeos da dieta têm um processo de absorção mais complexo e mais lento que o dos glicídeos e o
dos aminoácidos (que entram para o meio interno via veia porta).
colesterol + acil-CoA acil-colesterol + CoA
Página 1 de 5
(1)
Lipoproteínas plasmáticas; Rui Fontes
4-
Os quilomicra só começam a aparecer no plasma cerca de 1 hora após uma refeição e só atingem o
pico máximo de concentração cerca de 3-4 horas depois. O seu metabolismo ocorre sobretudo nos
capilares do tecido adiposo (e, em menor grau, também nos capilares do tecido muscular) onde vão ser
transformados em quilomicra remanescentes. Nesta transformação esta envolvida uma ectohidrólase
(a lípase de lipoproteínas) que, “ancorada” na face luminal da membrana das células endoteliais dos
capilares, catalisa a hidrólise dos triacilgliceróis presentes no miolo dos quilomicra. Um cofactor
essencial na actividade desta lípase é a apo CII. O esvaziamento em triacilgliceróis do miolo (por
acção hidrolítica da lípase de lipoproteínas) acompanha-se de esvaziamento noutros componentes
situados na superfície como os fosfolipídeos, o colesterol, a apo A e a apo C (incluindo apo CII) por
transferência para as HDL. (Se a hidrólise dos triacilgliceróis do miolo dos quilomicra não fosse
acompanhado deste processo de transferência os quilomicra deixariam de ter forma esférica.) Os
quilomicra remanescentes contêm apo B48 e apo E e é através das apo E que vão poder ligar-se
com receptores hepáticos; esta ligação leva à sua endocitose para dentro dos hepatócitos. As apo B48
(existe uma molécula por micela) “nascem” com os quilomicra imaturos e são captadas no fígado
aquando da captação dos quilomicra remanescentes.
5-
As VLDL são, embora menos que os quilomicra, muito ricas em triacilgliceróis (55% da sua massa).
A maior parte dos triacilgliceróis plasmáticos é, mesmo após refeições ricas em lipídeos, transportado
nas VLDL porque as suas micelas são sempre mais abundantes no plasma que as dos quilomicra [1].
As VLDL formam-se no fígado num processo semelhante ao da síntese dos quilomicra no intestino
incluindo a acção da proteína microssomática de transferência na formação das micelas no retículo
endoplasmático. No entanto, neste caso, os componentes lipídicos não têm origem directa na dieta; as
VLDL transportam para o plasma sanguíneo triacilgliceróis (e outros lipídeos) formados no fígado e
contêm apo B100, apo E e apo C. Tal como a síntese, também o metabolismo das VLDL é
semelhante ao dos quilomicra: (i) parte das apo C e das apo E das VLDL também têm, já no plasma,
origem nas HDL, (ii) os triacilgliceróis das VLDL também sofrem a acção da lípase de lipoproteínas
dos capilares e (iii) também as apo C e componentes lipídicos da superfície das VLDL (colesterol e
fosfolipídeos) se transferem para as HDL no decurso desta lipólise. As micelas lipoproteicas
resultantes do processo hidrolítico designam-se, neste caso, por IDL (ou VLDL remanescentes) e tal
como os quilomicra remanescentes contém apo E. Para além de apo E, as IDL contém apo B100
(existe uma molécula de apo B100 por micela) e é através destas proteínas que se vão ligar a
receptores hepáticos e ser aí captadas.
6-
A maioria dos ácidos gordos formados por acção da lípase de lipoproteínas do endotélio dos
capilares é captada pelas células dos tecidos onde ocorre a hidrólise. Dentro das células, após
activação (formação de acis-CoA), os ácidos gordos podem ser usados como combustíveis (oxidação
em ) ou servir de substratos para a síntese de triacilgliceróis (esterificação), fosfolipídeos,
glicolipídeos ou colesterídeos. No tecido adiposo, a síntese da lípase de lipoproteínas é induzida pela
insulina e, por isso, neste tecido, a sua actividade está muito aumentada após as refeições tendo um
papel relevante na hidrólise dos triacilgliceróis dos quilomicra. O facto de a insulina também estimular
a esterificação dentro dos adipócitos explica que os ácidos gordos libertados no plasma aquando da
acção da lípase de lipoproteínas sejam captados pelos adipócitos e usados na síntese de
triacilgliceróis. Nos capilares dos músculos, pelo contrário, a actividade da lípase de lipoproteínas é
maior em jejum e após exercício físico; no músculo, o destino dos ácidos gordos aí libertados pode ser
a sua oxidação ou serem substratos para a síntese de triacilgliceróis das próprias fibras musculares. A
actividade muscular contráctil e o treino atlético estimulam a síntese da lípase lipoproteínas no tecido
muscular o que explica que o exercício físico, sobretudo se feito de forma regular, provoque
diminuição de concentração dos triacilgliceróis plasmáticos.
7-
As apo E, presentes nas IDL e nos quilomicra remanescentes, são ligandos de receptores
membranares hepáticos de dois tipos: o receptor das LDL e o LRP (LDL receptor related protein).
(Ao contrário das LRP que apenas se liga às apo E, o receptor das LDL também se liga às apo B100 e,
por isso, também tem um papel na captação das IDL e irá participar na captação das LDL.) À medida
que as IDL e os quilomicra remanescentes vão, por acção da lípase de lipoproteínas, diminuindo de
tamanho aumenta a sua afinidade para os receptores hepáticos. A ligação das IDL e dos quilomicra
remanescentes aos receptores das LDL ou às LRP permite a sua captação (endocitose) pelo fígado.
Nos lisossomas dos hepatócitos, os diversos componentes destas lipoproteínas (as apolipoproteínas, os
Página 2 de 5
Lipoproteínas plasmáticas; Rui Fontes
ésteres de colesterol, os fosfolipídeos e os triacilgliceróis sobrantes) são hidrolisados. Os produtos
destes processos de hidrólise são libertados para o citoplasma e, entre outros destinos possíveis, podem
contribuir para um novo ciclo originando novas micelas de VLDL.
8-
Parte das IDL (formadas no plasma por acção da lípase de lipoproteínas nas VLDL) não sofrem
endocitose mas são, no plasma, convertidas em LDL. As LDL têm como única apolipoproteína a
apo B100 (uma molécula por micela) e contêm a maior parte do colesterol plasmático. Os mecanismos
de conversão das IDL em LDL são mal conhecidos mas envolverão a transferência de
apolipoproteínas (com excepção das apo B100) para as HDL e a hidrólise de fosfolipídeos e
triacilgliceróis ainda presentes nas IDL pela lípase de lipoproteínas hepática. A lípase de
lipoproteínas hepática é também uma ectohidrólase dos capilares (neste caso, dos capilares do fígado),
mas é diferente da dos outros tecidos: para além de, em acréscimo aos triacilgliceróis, poderem
catalisar a hidrólise de fosfolipídeos, só actuam em micelas lipoproteicas que já diminuíram de
tamanho por acção da lípase de lipoproteínas dos tecidos adiposo ou muscular.
9-
Através da ligação das apo B100 aos receptores das LDL (liga apo E e apo B100) existente na
membrana celular, as LDL plasmáticas são captadas (endocitose) pelas células do organismo com
especial relevância para os hepatócitos. Após a captação das LDL ocorre a hidrólise dos seus
componentes nos lisossomas. A actividade dos receptores das LDL é regulada negativamente pelo
conteúdo de colesterol da célula: quanto maior a quantidade de colesterol dentro duma célula menor a
actividade dos receptores. As LDL também podem ser captadas por mecanismos que não envolvem os
receptores das LDL: nos macrófagos dos tecidos e em algumas células endoteliais existe um outro tipo
diferente de receptores chamados “receptores de limpeza”. Estes receptores têm uma especial
afinidade para as LDL que sofreram alterações (nomeadamente oxidação) nos seus componentes. Via
ligação das LDL a estes receptores, os macrófagos, nomeadamente os macrófagos situados na íntima
das artérias (camada sub-endotelial), podem acumular colesterol no seu interior. Porque a actividade
dos receptores de limpeza não é regulado pelo conteúdo de colesterol na célula os macrófagos podem
“encher-se” de colesterol. Na íntima das artérias os macrófagos cheios de colesterol designam-se de
“células espumosas”.
10-
As HDL estão envolvidas no chamado transporte reverso (dos tecidos para o fígado) do colesterol.
As HDL são lipoproteínas que têm origem no fígado e intestino e que, na sua forma imatura, são
pequenos discos de tipo membranar (duplo folheto lipídico) contendo fosfolipídeos, colesterol e
apolipoproteínas dos tipos A, C e E. As HDL nascentes captam colesterol dos tecidos extrahepáticos (incluindo macrófagos) e, nesta captação, participa um transportador membranar
denominado ATP-binding cassete-A1 (ABC-A1) e o receptor de limpeza B1. (Um outro processo
pelo qual as HDL captam colesterol já foi referido: aquando da hidrólise dos triacilgliceróis dos
quilomicra e das VLDL parte do colesterol passa para as HDL.) O colesterol captado pelas HDL é
subsequentemente esterificado e os ésteres de colesterol vão formando o seu miolo; as HDL deixam de
ser estruturas discoides para passarem a ser esféricas. A formação destes ésteres de colesterol é
catalisada pela lecitina-colesterol acil transférase (LCAT), uma enzima plasmática que é activada
pela apo AI das HDL. A lecitina (fosfatidil-colina) é um glicerofosfolipídeo presente nas HDL e a
LCAT catalisa a transferência do resíduo de ácido gordo da posição 2 da lecitina para o colesterol (ver
equação 2). À medida que uma dada micela de HDL vai captando colesterol dos tecidos extrahepáticos e de outras lipoproteínas, este colesterol vai sendo esterificado. Este processo catalítico, para
além de, permitindo a continuação do processo de captação, manter baixo o colesterol não esterificado
da periferia das micelas de HDL, também faz com que estas micelas vão aumentando de diâmetro.
lecitina + colesterol ésteres de colesterol + lisolecitina
11-
(2)
Quando as HDL atingem maiores diâmetros acabam por verter o seu conteúdo de ésteres de colesterol
no fígado. Na membrana dos hepatócitos existe um receptor para as apo AI (denominado receptor de
limpeza B1) que permite a ligação das HDL; após a ligação das HDL ao receptor de limpeza B1 os
ésteres de colesterol das HDL são vertidos no hepatócito. Ao contrário do que acontece no caso das
LDL, a captação dos ésteres de colesterol das HDL pelos hepatócitos não é um processo endocítico:
como resultado da interacção entre as HDL e os receptores de limpeza B1 hepáticos regeram-se
micelas de HDL discóides desprovida de ésteres de colesterol que se mantêm no plasma sanguíneo. Os
Página 3 de 5
Lipoproteínas plasmáticas; Rui Fontes
ésteres de colesterol captados pelos hepatócitos podem sofrer hidrólise e o colesterol libertado pode
voltar ao plasma incorporado nas VLDL ou pode ser excretado (não transformado ou transformado
em sais biliares) pelas vias biliares e, parcialmente, perder-se nas fezes. As HDL discóides que
perderam o seu colesterol são recicladas: captam colesterol, “armazenam” no seu miolo o colesterol
esterificado que se vai formando (acção da LCAT) e, via receptor de limpeza B1, vertem o colesterol
no fígado. Para além dos hepatócitos, também as células do córtex supra-renal e dos ovários captam
colesterol das HDL e, nestas células, o colesterol é usado na síntese de hormonas esteróides.
12-
Um outro mecanismo que também poderá contribuir para o transporte reverso do colesterol envolve a
actividade da proteína de transferência de ésteres de colesterol (CETP). Esta proteína plasmática
catalisa a transferência dos ésteres de colesterol das HDL para as VLDL, para os quilomicra e para as
LDL (ao mesmo tempo que transfere triacilgliceróis no sentido oposto). A subsequente transformação
das VLDL em IDL e dos quilomicra em quilomicra remanescentes (por acção da lípase de
lipoproteínas) e a subsequente captação pelo fígado das IDL e dos quilomicra remanescentes permite
compreender que o colesterol dos tecidos que foi captado pelas HDL possa ser vertido no fígado.
Porque as LDL são predominantemente captadas no fígado também o colesterol transferido para as
LDL pode acabar no fígado. As HDL enriquecidas em triacilgliceróis (após acção da CETP) interagem
com a lípase de lipoproteínas hepática onde estes triacilgliceróis e os fosfolipídeos das HDL sofrem
hidrólise; neste processo as HDL diminuem de tamanho.
13-
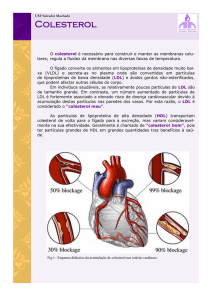
A aterosclerose é uma doença caracterizada pela deposição de colesterol e ésteres de colesterol nos
macrófagos da íntima das artérias (camada sub-endotelial) levando, em fases mais avançadas, ao
estreitamento do lúmen (isquemia). Nesta fase, se as artérias em questão forem as coronárias, o
indivíduo pode sentir dor no peito (angina) aquando do esforço muscular. Numa fase incipiente do
processo (que de facto começa logo na infância) há apenas aglomerados de “células espumosas”, ou
seja, macrófagos com colesterol no citoplasma. A subsequente proliferação das fibras musculares
lisas, a inflamação e a deposição de colagénio contribuem para o processo patológico levando à
formação das chamadas placas de ateroma. A eventual rotura duma dessas placas pode levar à
formação de um coágulo sanguíneo com obstrução aguda da artéria. Se a artéria onde ocorreu essa
obstrução for uma artéria coronária estamos numa situação designada de enfarto do miocárdio. Sabese que indivíduos com concentrações elevadas de colesterol ligado às LDL ( 130 mg/dl) têm maior
probabilidade de desenvolver aterosclerose e sofrer enfarto de miocárdio precoce e outros processos
isquémicos. Um aumento do colesterol ligado às HDL ( 60 mg/dl) tem, pelo contrário, um efeito
protector. São ainda mal conhecidos os mecanismos metabólicos que possam explicar estas
associações epidemiologicamente bem definidas. Na etiologia da aterosclerose podem estar
envolvidos múltiplos factores. Uma das possíveis causas de aumento da concentração de colesterol
associado às LDL é a deficiência de receptores de LDL por mutações no gene que os codifica.
Quando há aumento das LDL ou quando há alterações oxidativas nas LDL aumenta a actividade dos
receptores de limpeza dos macrófagos e, consequentemente, aumento da formação das “células
espumosas”. O risco de aterosclerose também está aumentado quando há deficit na captação hepática
de IDL e quilomicra remanescentes. Tal como as LDL, também as IDL e os quilomicra
remanescentes podem ser captados pelos macrófagos da íntima das artérias e o seu aumento no
plasma estimula este processo.
14-
O aumento da concentração plasmática do colesterol ligado às HDL está associado a um risco
diminuído no desenvolvimento da aterosclerose mas as razões desta associação são mal conhecidas.
É provável que observar aumento do colesterol ligado às HDL seja um indicador de aumento do
transporte reverso do colesterol e, portanto, da capacidade do organismo para retirar colesterol das
células incluindo os macrófagos. Para além de participarem no transporte reverso do colesterol, as
HDL também podem ter outros papéis biológicos que ajudam a explicar o seu papel anti-aterogénico.
As HDL teriam um papel anti-inflamatório e protector da função do endotélio inibindo a adesão e a
migração de monócitos (precursores dos macrófagos) para as lesões ateroscleróticas. Além disto
teriam uma acção anti-oxidante impedindo a oxidação das LDL [2]. A proteína de transferência de
ésteres de colesterol (CETP) participa, como referido, no transporte reverso do colesterol mas também
pode ter um papel na génese da aterosclerose. Na verdade, a actividade da proteína de transferência de
ésteres de colesterol está anormalmente aumentada em dislipidemias (aterogénicas) em que há alta
concentração de VLDL e diminuição da actividade da lípase de lipoproteínas. São exemplos comuns
Página 4 de 5
Lipoproteínas plasmáticas; Rui Fontes
deste tipo de situações a resistência (insensibilidade) à insulina e a diabetes. Como já referido, a
insulina estimula a lípase de lipoproteínas do tecido adiposo; assim, quando há resistência à insulina
ou diabetes, há diminuição da actividade da lípase de lipoproteínas o que resulta em aumento da
concentração plasmática dos triacilgliceróis (maioritariamente ligados às VLDL). Nestas condições, há
aumento da actividade de transferência de triacilgliceróis das VLDL para as HDL e de colesterol no
sentido inverso. Uma das consequências é a diminuição do colesterol das HDL mas, uma outra
consequência, que ajudaria a explicar a associação entre aterosclerose e diminuição do colesterol
associado às HDL, seria o aumento da concentração plasmática de IDL. Uma lentificação do processo
de hidrólise dos triacilgliceróis das IDL (consequência de diminuição da síntese da lípase de
lipoproteínas no tecido adiposo mas também da competição das VLDL em excesso) provocaria
aumenta na concentração plasmática destas lipoproteínas de pequeno tamanho e, consequentemente,
da sua capacidade para promover a aterosclerose [3]. Uma condição frequentemente associada é
também a diminuição de tamanho das “partículas” de LDL. Esta diminuição resultaria da diminuição
da actividade de transferência de ésteres de colesterol das HDL para as LDL. Esta é uma das
actividades da proteína de transferência de ésteres de colesterol que seria inibida (inibição
competitiva) na presença de altas concentrações de VLDL ricas em triacilgliceróis; nestas condições, a
transferência de ésteres de colesterol para as LDL seria preterida em favor das VLDL. As LDL de
pequeno tamanho têm maior capacidade de penetrar na íntima das artérias e provocar aterosclerose
que as LDL de maior tamanho [4].
1. Griffiths, A. J., Humphreys, S. M., Clark, M. L., Fielding, B. A. & Frayn, K. N. (1994) Immediate metabolic
availability of dietary fat in combination with carbohydrate, Am J Clin Nutr. 59, 53-9.
2. Chapman, M. J. (2006) Therapeutic elevation of HDL-cholesterol to prevent atherosclerosis and coronary heart
disease, Pharmacol Ther. 111, 893-908.
3. Frayn, K. N. (2010) Metabolic regulation. A human perspective., 3rd edn, John Willey And Sons, Oxford.
4. Chapman, M. J., Guerin, M. & Bruckert, E. (1998) Atherogenic, dense low-density lipoproteins. Pathophysiology
and new therapeutic approaches, Eur Heart J. 19 Suppl A, A24-30.
Página 5 de 5