MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
MINISTÉRIO DA SAÚDE
SECRETARIA DE ASSISTÊNCIA À SAÚDE
PORTARIA N° 872, DE 6 DE NOVEMBRO DE 2002
DO 217, de 8/11/02
O Secretário de Assistência à Saúde, no uso de suas atribuições legais,
Considerando a necessidade de estabelecer Protocolo Clínico e Diretrizes
Terapêuticas para o tratamento da Doença Falciforme, que contenha critérios de
diagnóstico e tratamento, observando ética e tecnicamente a prescrição médica,
racionalize a dispensação do medicamento preconizado para o tratamento da doença,
regulamente suas indicações e seus esquemas terapêuticos e estabeleça mecanismos de
acompanhamento de uso e de avaliação de resultados, garantindo assim a prescrição
segura e eficaz;
Considerando a Consulta Pública a que foi submetido o Protocolo
Clínico e Diretrizes Terapêuticas - Doença Falciforme, por meio da Consulta Pública
SAS/MS nº 06, de 06 de junho de 2002, que promoveu sua ampla discussão e
possibilitou a participação efetiva da comunidade técnico científica, sociedades
médicas, profissionais de saúde e gestores do Sistema Único de Saúde na sua
formulação, e
Considerando as sugestões apresentadas ao Departamento de Sistemas e
Redes Assistenciais no processo de Consulta Pública acima referido, resolve:
Art. 1º - Aprovar o PROTOCOLO CLÍNICO E DIRETRIZES
TERAPÊUTICAS - DOENÇA FALCIFORME - Hidroxiuréia , na forma do Anexo
desta Portaria.
§ 1º - Este Protocolo, que contém o conceito geral da doença, os critérios
de inclusão/exclusão de pacientes no tratamento, critérios de diagnóstico, esquema
terapêutico preconizado e mecanismos de acompanhamento e avaliação deste
tratamento, é de caráter nacional, devendo ser utilizado pelas Secretarias de Saúde dos
estados, do Distrito Federal e dos municípios, na regulação da dispensação do
medicamento nele previsto.
§ 2º - As Secretarias de Saúde que já tenham definido Protocolo próprio
com a mesma finalidade, deverão adequá-lo de forma a observar a totalidade dos
critérios técnicos estabelecidos no Protocolo aprovado pela presente Portaria;
§ 3º - É obrigatória a observância deste Protocolo para fins de
dispensação do medicamento nele previsto;
§ 4º - É obrigatória a cientificação do paciente, ou de seu responsável
legal, dos potenciais riscos e efeitos colaterais relacionados ao uso do medicamento
preconizado para o tratamento da Doença Falciforme, o que deverá ser formalizado
através da assinatura do respectivo Termo de Consentimento Informado, conforme o
modelo integrante do Protocolo.
1
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Art. 2º - Esta Portaria entra em vigor na data de sua publicação,
revogadas as disposições em contrário.
RENILSON REHEM DE SOUZA
ANEXO
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS
DOENÇA FALCIFORME
Medicamento: Hidroxiuréia
1. INTRODUÇÃO
A Doença Falciforme é uma das mais freqüentes doenças genéticas no
Brasil (1). Caracteriza-se pela presença predominante de hemoglobina S que tem a
propriedade de formar polímeros quando desoxigenada. O indivíduo pode ser
homozigoto (SS) ou heterozigoto (AS) para a presença de hemoglobina S. O termo
anemia falciforme é reservado para a forma de doença que ocorre nos homozigotos
(SS). Os indivíduos heterozigotos (AS) são assintomáticos. Além disso, o gene da
hemoglobina S pode combinar-se com outras anormalidades hereditárias das
hemoglobinas, como hemoglobina C e beta-talassemia, entre outros, gerando
combinações que também são patológicas, e em conjunto são denominadas doenças
falciformes (2).
As doenças falciformes (SS, SC, Sb) têm alta morbidade e mortalidade
precoce (3). Em um estudo multicêntrico realizado nos Estados Unidos, os pacientes
com anemia falciforme homozigotos para hemoglobina S tinham média de idade, ao
falecerem, de 42 e 48 anos para homens e mulheres respectivamente (4). A maioria dos
eventos fatais ocorre durante exacerbações ou complicações agudas, como síndrome
torácica aguda ou acidente vascular encefálico, e não por complicações crônicas. Há
correlação entre o número de episódios agudos (como síndrome torácica aguda, acidente
vascular encefálico, priapismo, episódios álgicos recorrentes) com menor sobrevida.
As síndromes eritrofalcêmicas levam à injúria tecidual sistêmica por
isquemia e necrose tissular, ocorrendo lesão progressiva de múltiplos órgãos, como o
cérebro, coração, fígado, rins, pele, olhos, esqueleto e pulmões. Além disso, a
imunossupressão tem importante impacto na morbimortalidade(5).
Concentrações elevadas de hemoglobina fetal (HbF) podem diminuir a
gravidade da doença por inibir a polimerização da Hemoglobina S. A hidroxiuréia é
capaz de aumentar as concentrações de HbF e produzir melhora do curso clínico (6). O
mecanismo de ação da hidroxiuréia não é plenamente conhecido. Sabe-se que eleva os
níveis de hemoglobina F nos eritrócitos, diminui o número de neutrófilos, aumenta a
capacidade de deformação das células falciformes e altera a adesividade das hemácias
ao endotélio (6-9).
2. Classificação CID 10
D 56.1 Talassemia beta
D 56.8 Outras talassemias
D 57.0 Anemia falcifome com crise
D 57.1 Anemia Falciforme sem crise
2
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
D 57.2 Transtornos falciformes heterozigóticos duplos
3. CRITÉRIOS DE INCLUSÃO NO PROTOCOLO DE
TRATAMENTO
Serão incluídos nesse Protocolo de Tratamento pacientes com todos os
critérios abaixo:
a) diagnóstico laboratorial de doença falciforme (HbSS), Sß-Talassemia
(HbSß), HbSC ou HbSD, por eletroforese de hemoglobina;
b) idade superior a 18 anos. Se idade entre 4 e 18 anos, considerar a
relação risco-benefício. (ver situações especiais, item 5);
c) capacidade de comparecer às revisões periódicas bem como submeterse a exames laboratoriais a cada duas semanas;
d) teste de gravidez (ß-HCG sérico) negativo para mulheres sexualmente
ativas;
e) pelo menos uma das seguintes complicações nos últimos 12 meses:
- 3 ou mais episódios de crises vaso-oclusivas com necessidade de
atendimento médico;
- 1 crise torácica aguda recidivante (definida como dor torácica aguda
com infiltrado pulmonar novo, febre de 38,5 °C ou superior, taquipnéia, sibilos
pulmonares ou tosse) (10);
- 1 ou mais acidentes vasculares encefálicos ou ataques isquêmicos
transitórios mesmo que em programas de transfusão de substituição.;
- 1 episódio de priapismo grave pós-puberal ou priapismo recorrente;
- anemia grave e persistente (Hb < 6,0 g/dL em três dosagens no período
de 3 meses).
4. CRITÉRIOS DE EXCLUSÃO DO PROTOCOLO DE
TRATAMENTO
Não deverão ser incluídos no Protocolo de Tratamento os pacientes que
apresentarem:
a) Hipersensibilidade à hidroxiuréia;
b) Qualquer das evidências abaixo de disfunção medular:
- contagem de leucócitos inferior a 2.500/mL
- neutrófilos < 2.000/mL
- plaquetas < 100.000/mL
- nível de hemoglobina < 4,5 g/dL
- contagem de reticulócitos < 80.000/mm3 (quando hemoglobina < 9
g/dl)
c) Gestação (não há estudos adequados em humanos e há evidência de
teratogênese em animais);
d) infecção pelo HIV.
5. SITUAÇÕES ESPECIAIS
Devido aos possíveis efeitos adversos da droga, a relação entre o risco e
o benefício deve ser cuidadosamente avaliada nos seguintes casos:
a) Idade inferior a 18 anos: a eficácia e a segurança da hidroxiuréia em
criança ainda não estão bem estabelecidas (11-13). Uso do medicamento deve ser feito
após a informação e autorização dos pais;
b) Amamentação: Sabe-se que o fármaco é excretado pelo leite. Não há
estudos suficientes para determinar seus efeitos sobre o lactente. Seu uso deve ser
evitado durante a amamentação ou esta ser descontinuada;
3
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
c) Uricosúria: o uso de hidroxiuréia pode aumentar os níveis séricos de
ácido úrico. Em pacientes com níveis basais acima do limite normal estes valores devem
ser monitorados mensalmente;
d) Insuficiência renal: poucos estudos avaliaram seu uso em pacientes
com insuficiência renal (6);
e) Insuficiência hepática: não há dados para orientação do ajuste de dose
nessa situação;
f) Interações medicamentosas: Não há estudos adequados sobre
interações. Portanto, o uso concomitante de outros fármacos, principalmente os que
também possam produzir depressão da medula óssea, deve ser atenciosamente
monitorizado.
6. TRATAMENTO
6.1. Fármaco:
Hidroxiuréia. O medicamento encontra-se disponível em cápsulas gel
dura com 500 mg
6.2. Esquema de Administração
Dose inicial: A dose inicial é de 10 mg/kg/dia, em tomada única diária.
Deve-se considerar o peso real ou ideal, o que for menor.
Ajuste de dose: A dose diária deve ser aumentada em 5 mg/kg /dia a cada
4 semanas até serem atingidos os efeitos desejáveis, sem a ocorrência de toxicidade
hematológica (definida em tabela abaixo) ou outros efeitos adversos graves como
hepatotoxicidade (definida por aumento de duas vezes o valor referencial máximo das
transaminases). A dose máxima não deve ultrapassar 35 mg/kg/dia.
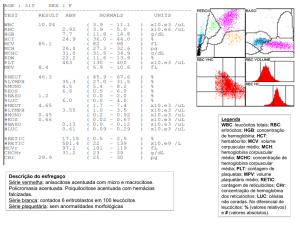
Valores Hematimétricos:
Valores Hematimétricos Aceitáveis
Valores Hematiméricos Tóxicos
neutrófilos > 2.500/mL
neutrófilos < 2.000/mL
plaquetas > 95.000/mL
plaquetas < 80.000/mL
hemoglobina > 5,3 g/dL
hemoglobina < 4,5 g/dL
reticulócitos > 95.000//mL quando
hemoglobina < 9 g/dL
reticulócitos < 80.000/mL quando
hemoglobina < 9 g/dL
Valores intermediários entre os aceitáveis e tóxicos, a dose fica
inalterada.
Se qualquer valor preencher critério de toxicidade (14), o uso de
hidroxiuréia deve ser interrompido até que retornem a níveis superiores aos aceitáveis.
Então, o tratamento é reiniciado com dose 2,5 mg/kg/dia inferior à última empregada,
seguindo a mesma escala de aumento progressivo a cada 4 semanas. Caso haja
ocorrência de toxicidade duas vezes para a mesma dosagem, esta passa a ser
considerada a dose máxima tolerada e não deverá mais ser utilizada.
Ajuste de dose em insuficiência renal: Poucos estudos avaliaram seu uso
em pacientes com insuficiência renal. Recomenda-se o ajuste de dose conforme a
depuração de creatinina:
10-50 mL/min administrar 50% da dose
<10 mL/min administrar 20% da dose
4
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Ajuste de dose em insuficiência hepática: Não há dados para orientação
do ajuste de dose nessa situação.
6.3. Duração do Tratamento:
O tratamento deve ser de pelo menos 2 anos, mantido por tempo
indeterminado de acordo com a evolução do paciente.
6.4. Benefícios esperados:
▪ Diminuição da freqüência dos episódios de dor, que podem até mesmo
desaparecer;
▪ Aumento da produção de hemoglobina F e aumento discreto da
concentração total de hemoglobina;
▪ Diminuição dos episódios de síndrome torácica aguda;
▪ Diminuição do número de hospitalizações;
▪ Diminuição do número de transfusões sangüíneas.
7. Monitorização
A resposta terapêutica esperada é o aumento da hemoglobina F,
diminuição da freqüência dos episódios dolorosos, da necessidade de hospitalizações e
de transfusões.
- Realizar antes de iniciar o tratamento:
Hemograma e contagem de plaquetas
Sorologias: hepatite B e C e HIV
Contagem de reticulócitos
Dosagem de hemoglobina F - eletroforese de hemoglobina
Determinação do tempo de protrombina (TP) e dosagem de
transaminases (AST, ALT)
Determinação do clearance de creatinina,
Dosagem de uréia, sódio, potássio e ácido úrico
Teste de gravidez em mulheres (ß-HCG sérico). Devem ser reiterados os
riscos em caso de gravidez e as orientações para o uso de métodos contraceptivos
durante o tratamento.
- Realizar a cada 2 semanas até ser atingida a dose de manutenção e,
após, a cada 4 semanas:
Hemograma e contagem de plaquetas
Contagem de reticulócitos
- Dosar a cada 4 semanas até ser atingida a dose de manutenção e, após,
a cada 12 semanas:
Creatinina
Transaminases (AST, ALT)
- Dosar a cada 8 semanas até ser atingida a dose de manutenção e, após,
a cada 24 semanas:
Hemoglobina F
8. Cuidados e Precauções
a) Ácido fólico: o uso de hidroxiuréia produz macrocitose, dificultando o
reconhecimento da deficiência de ácido fólico. Desta forma, é recomendado o emprego
profilático concomitante de ácido fólico.
b) Interações farmacológicas: não há estudos adequados sobre interações.
Portanto, o uso concomitante de outros fármacos com hidroxiuréia deve ser
atenciosamente monitorizado.
5
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
c) Vigiar o aparecimento de efeitos adversos nos seguintes órgãos e
sistemas:
- Neurológico: letargia, cefaléia, tonturas, desorientação e alucinações
(raras);
- Gastrintestinais: estomatite, anorexia, náuseas, vômitos, diarréia e
constipação;
- Dermatológicos: erupções maculopapulares, eritema facial e periférico,
ulceração da pele ou agravamento de úlcera já existente e alterações como
dermatomiosite;
- Renais: elevação dos níveis séricos de uréia e creatinina;
- Outros: febre, calafrios, mal-estar, astenia.
9. CENTROS DE REFERÊNCIA
Conforme já definido na Portaria GM/MS nº 822, de 06 de junho de
2001, Serviços de Referência em Triagem Neonatal / Acompanhamento e Tratamento
de Doenças Congênitas Tipo I, II ou III - onde se inclui a Doença Falciforme - são os
responsáveis pela realização da triagem dos pacientes. O tratamento e o
acompanhamento deverão ser realizados pelos Serviços de Referência ou Hemocentros
que devem estar cadastrados na rede de atendimento.
10. CONSENTIMENTO INFORMADO
É obrigatória a cientificação do paciente, ou de seu responsável legal,
dos potenciais riscos e efeitos colaterais relacionados ao uso do medicamento
preconizado neste Protocolo, o que deverá ser formalizada por meio da assinatura de
Termo de Consentimento Informado, de acordo com o modelo em anexo.
11. REFERÊNCIAS BIBLIOGRÁFICAS
1 - Alves AL. Estudo da Mortalidade por Anemia Falciforme. IESUS
1996;(4):45-7.
2 - Chamone DAF, Gualandro SFM, Zago MA, Ferreira MFO, Nogueira,
RBG. Grupo de Trabalho para a Elaboração do Programa Nacional de Anemia
Falciforme - Ministério da Saúde - SAS -Coordenação de Sangue e Hemoderivados.
Programa de anemia Falciforme. 1996
3 - Miller ST, Sleeper LA, Pegelow CH, et al. Prediction of adverse
outcomes in children with sickle cell disease. N Engl J Med 2000;342(2):83-9
4 - Platt OR, Brambilla DJ, Rosse WF, et al. Mortality in Sickle Cell
Disease-Life Expectancy and Risk Factors for Early Death. N Engl J Med
1994;330(23):1639-44.
5 - Fester A, Tahriri P, Vermylen C, et al. Five years of experience with
hydroxyurea in children and young adults with sickle cell disease. Blood
2001;97(11):3628-34.
6 - Steinberg MH, Wood AJJ. Management of Sickle Cell Disease. N
Eng J Med 1999;340(13):1021-30
7 - Charache A, Terrin M, Moore RD, et al. Effect of hydroxyurea on the
frequency of painful crises in sickle cell anemia. N Engl J Med 1995;332(20):1317-22
8 - Montalembert M, Belloy M, Bernaudin F, et al. Three-year FollowUp of Hydroxyurea Treatment in Severely Ill Children with Sickle Cell Disease. J
Pediatr Hematol Oncol 1997;19(4):313-8
9 - Steinberg MH, Lu ZH, Barton FB, et al. Fetal hemoglobin in sickle
cell anemia: determinants of response to hydroxyurea: Multicenter study of
hydroxyurea. Blood 1997;89:1078-88
6
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
10 - Vichinsky EP, Neumayr LD, Earles AN, et al. Causes and outcomes
of the acute chest syndrome in sickle cell disease. N Eng J Med 2000;342:1855-65
11 - Kinney TR, Helms RW, O`Branski EE, et al. Safety of Hydroxyurea
in Children With Sickle Cell Anemia: Results of the HUG-KIDS Study, a Phase I/II
Trial. Blood 1999;94(5):1550-4
12 - Hoppe C, Vichinsky E, Quirolo K, et al. Use of hydroxyurea in
children ages 2 to 5 years with sickle cell disease. J Pediatr Hematol Oncol
2000;22(4):330-4
13 - Montalembert M, Begue P, Bernaudin F, et al. Preliminary report of
a toxicity study of hydroxyurea in sickle cell disease. French Study Group on Sickle
Cell Disease. Arch Dis Child 1999;81(5):437-9
14 - Drug Information for the Healthcare Professional - USP DI - Vol.I
21st ed. Englewood, CO: Thomson Health care - MICROMEDEX, 2001.
TERMO DE CONSENTIMENTO INFORMADO
Hidroxiuréia
Eu, ........................................................ (nome do(a) paciente), abaixo
identificado(a) e firmado(a), declaro ter sido informado(a) claramente sobre todas as
indicações, contra-indicações, principais efeitos colaterais e riscos relacionados ao uso
do medicamento hidoxiuréia para o tratamento da Doença Falciforme.
Estou ciente de que este medicamento somente pode ser utilizado por
mim, comprometendo-me a devolvê-lo caso o tratamento seja interrompido.
Os termos médicos foram explicados e todas as minhas dúvidas foram
esclarecidas pelo médico ................................................................... (nome do médico
que prescreve).
Expresso também minha concordância e espontânea vontade em
submeter-me ao referido tratamento, assumindo a responsabilidade e os riscos por
eventuais efeitos indesejáveis.
Assim, declaro que:
Fui claramente informado(a) de que o medicamento pode trazer os
seguintes benefícios:
▪ Diminuição do número de crises dolorosas;
▪ Diminuição da necessidade de transfusões sangüíneas e de
hospitalizações;
▪ Diminuição da anemia com aumento discreto da concentração total da
hemoglobina
Fui também claramente informado a respeito dos potenciais efeitos
adversos, contra-indicações, riscos e advertências a respeito do medicamento:
Sangue: redução do número de glóbulos brancos (leucopenia e
neutropenia), podendo diminuir muito a resistência a infecções. Redução do número de
glóbulos vermelhos (anemia). Redução do número de plaquetas, o que pode acarretar
sangramentos. Alguns pacientes que utilizam essa medicação necessitam, em algum
momento, interromper o tratamento para que as contagens de células sangüíneas voltem
aos valores adequados;
Gravidez: risco de causar alterações graves sobre o feto, até mesmo
fatais, em caso de gravidez durante o uso de hidroxiuréia. É fundamental que a gravidez
seja evitada durante o tratamento;
7
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Amamentação: este medicamento é eliminado pelo leite materno, porém,
não se conhece o efeito sobre o bebê. Desta forma, é fundamental discutir com o médico
antes de amamentar;
Reprodução: pode causar redução da capacidade reprodutiva de homens
e mulheres;
Câncer: existem indícios de que pacientes em uso dessa medicação
podem desenvolver câncer, principalmente leucemia e câncer de pele;
Crianças: embora várias pesquisas demonstrem benefícios do tratamento
em crianças a partir dos 3 anos de idade, os efeitos adversos nessa faixa etária não são
bem estudados;
Neurológicos: cansaço, cefaléia, tonturas, desorientação e alucinações;
Gastrintestinais: estomatite, perda de apetite, náuseas, vômitos, diarréia,
prisão de ventre e dor de estômago;
Hepáticos: elevação de enzimas hepáticas, hepatite medicamentosa;
Pulmonares: infiltrado pulmonar e fibrose pulmonar;
Dermatológicos: erupções maculopapulares, eritema facial e periférico,
hiperpigmentação das unhas, ulceração da pele e alterações como dermatomiosite,
queda de cabelos, câncer de pele;
Renais: perda de função renal, elevação dos níveis sangüíneos de uréia,
creatinina e ácido úrico;
Outros: febre, calafrios, mal-estar.
Fui orientado (a) a:
▪ Comparecer às consultas periódicas conforme agendadas e a realizar os
exames e avaliações solicitados pelo médico;
▪ Não usar outros remédios sem orientação médica;
▪ Não doar sangue durante o tratamento.
▪ Em caso de aparecimento de algum sintoma que indique uma reação
adversa devo comunicar ao médico ou farmacêutico.
Estou ciente que posso suspender este tratamento a qualquer momento,
sem que este fato implique em qualquer forma de constrangimento entre mim e meu
médico, que se dispõe a continuar me tratando em quaisquer circunstâncias.
Autorizo o Ministério da Saúde e as Secretarias de Saúde a fazer uso de
informações relativas ao meu tratamento desde que assegurado o anonimato.
Declaro, finalmente, ter compreendido e concordado com todos os
termos deste Consentimento Informado.
Assim, o faço por livre e espontânea vontade e por decisão conjunta,
minha e de meu médico.
8
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Paciente___________________________________________________________________
Documento de identidade:
Sexo: Masculino ( )
Feminino ( )
Idade:_____________
Endereço: ________________________________________________________________
Cidade:___________________________ CEP:___________ Telefone: ( )______________
Responsável legal (quando for o caso): _________________________________________
Documento de identidade do responsável legal: ___________________________________
________________________________________________________________________
Assinatura do paciente ou do responsável legal
Médico Responsável: __________________________CRM: _________UF:__________
Endereço: ________________________________________________________________
Cidade:___________________________________ CEP:_________ Telefone: ( )________
_________________________
Assinatura e carimbo do médico
Data
Observações:
1. O preenchimento completo deste Termo e sua respectiva assinatura
são imprescindíveis para o fornecimento do medicamento.
2. Este Termo será preenchido em duas vias: uma será arquivada na
farmácia responsável pela dispensação dos medicamentos e a outra será entregue ao
paciente.
9