TÍTULO: HIDROXIURÉIA E ANEMIA FALCIFORME: UM CASO DE OFF-LABEL DE SUCESSO
CATEGORIA: EM ANDAMENTO
ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE
SUBÁREA: FARMÁCIA
INSTITUIÇÃO: CENTRO UNIVERSITÁRIO DAS FACULDADES METROPOLITANAS UNIDAS
AUTOR(ES): VANESSA MACENA LIMA, GLEDSON DOS SANTOS SILVA
ORIENTADOR(ES): SANDRA SATIKO MATSUDA
1.
RESUMO
O que chama a atenção em relação à hidroxiureia, um fármaco primeiramente
aprovado para o tratamento de doenças neoplásicas, foi a sua utilização em
portadores da anemia falciforme, antes da sua aprovação para utilização em adultos
pelo Food and Drug Administration em 1998. A anemia falciforme é uma doença
hereditária caracterizada pela mutação pontual do gene da globina beta da
hemoglobina. Esta mutação causa a produção de uma hemoglobina anômala,
chamada de hemoglobina S, e ocasiona um quadro clínico variado entre os seus
portadores, podendo inclusive, levar à morte. Atualmente a utilização em pacientes
pediátricos é off-label, ou seja, são medicamentos prescritos de forma diferente
daquela orientada na bula.
2.
INTRODUÇÃO
A anemia falciforme (AF) caracteriza-se por ser uma doença monogênica
causada por mutação no gene da globina beta que resulta em uma hemoglobina
anômala, a hemoglobina S (HbS), resultado da mutação GAGGTG no sexto
códon, que resulta na substituição do ácido glutâmico pela valina na sexta posição
da cadeia da globina β1.
O principal determinante da gravidade da doença é a extensão da polimerização
da HbS, pois é diretamente proporcional à duração da desoxigenação da
hemoglobina e da própria concentração da HbS intracelular, e leva á falcização do
eritrócito. Um dos importantes fatores que pode modular essa polimerização da HbS,
é a concentração da hemoglobina fetal (HbF), mesmo em paciente adultos.
As curas para a AF são os transplantes de medula óssea e terapia celular ou gênica,
que ainda estão em fase experimental2. Os principais tratamentos envolvem os
cuidados sintomáticos e transfusão de hemácias quando necessário sendo que, este
último, pode levar à sobrecarga de ferro mesmo quando acompanhado por
meticuloso regime de quelação de ferro1.
Desta forma, a hidroxiuréia (HU) tem sido utilizada como agente terapêutico para
pacientes com AF desde 1998. É administrada oralmente, com efeitos na elevação
da HbF, o que reduz os eventos de falcização dos eritrócitos, redução da hemólise e
prevenção de eventos vaso-oclusivos,3,4. Além disso, induz outros benefícios clínicos
através de mecanismos não relacionados à indução de HbF4.
3.
OBJETIVOS
O objetivo deste trabalho foi fazer uma revisão bibliográfica sobre a hidroxiureia,
um fármaco utilizado para o tratamento de câncer, e que desde 1998 também tem
sido utilizado no tratamento da anemia falciforme.
4.
METODOLOGIA
Revisão de periódicos nacionais e internacionais. Este trabalho teve início em
dezembro de 2014 e segue até os dias atuais. Os critérios de inclusão definidos para
a seleção foram: artigos originais, publicados em português ou inglês e sem limite de
datas. Nas buscas utilizou-se as bases de dados Scielo (Scientific Electronic Library
Online) e Pubmed, e os descritores foram: anemia falciforme, tratamento de anemia
falciforme, crianças, hidroxiurea, sickle cell, hydroxyurea, children.
5.
DESENVOLVIMENTO
A HU é um medicamento citotóxico, quimioterápico, antineoplásico, e sua
síntese ocorreu pela primeira vez na Alemanha em 1869 por Dressler e Stein. A
utilização em doenças neoplásicas foi aprovada apenas em 1967 pelo Food and
Drug Administration (FDA)1, 4. Em 1984 Platt e cols5., trataram dois pacientes por
cinco dias e constataram uma melhora nos níveis de HbF e sugeriram que a HU era
um potencial agente para o tratamento da AF. Em 1995, Charache e cols6., num
estudo duplo-cego randomizado, demonstraram a eficácia da HU na redução na
frequência de crises de dor em adultos portadores da AF e em 1998, a utilização da
HU passou a fazer parte do conjunto de estratégias adotadas no tratamento de
pacientes com AF
2,7,8
. Sabe-se que a HU é capaz de inibir a ação da enzima
ribonuclotídeo redutase, o que acarreta na parada do ciclo celular. Porém ainda
pouco se conhece sobre o mecanismo de ação em relação à indução da HbF 9.
Diversos estudos, tanto brasileiros como internacionais, apontaram a eficácia
da HU na melhora de algumas características clínicas e laboratoriais. Estes
trabalhos envolveram indivíduos em diferentes faixas etárias e ambos os sexos. Os
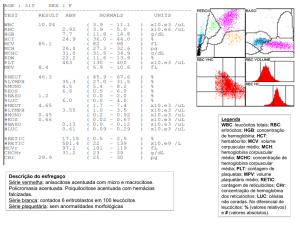
dados laboratoriais e hematológicos mostram que além do aumento dos níveis de
HbF, houve elevação nas taxas de hemoglobina,
volume corpuscular médio,
hidratação eritrocitária, biodisponibilidade de oxido nítrico, além da diminuição da
expressão de moléculas de adesão. Notou-se também a supressão da eritropoiese
endógena, redução da hemólise, aderência dos eritrócitos, leucócitos e plaquetas ao
endotélio vascular, melhora a reologia, com diminuição da viscosidade e
vasodilatação, contribuindo para a diminuição dos fenômenos inflamatórios. Com
isso, houve a redução da ocorrência de síndrome torácica aguda, evento vaso
oclusivo, hospitalizações, transfusões e crises dolorosas
1, 2, 3, 4, 8, 7 e 10
. Apesar de
muitos estudos também demonstrar eficiência clínica em crianças, a HU continua
sob intensa investigação e o seu uso permanece off-label3, 10.
6. RESULTADOS PRELIMINARES
A análise da literatura revelou que a experiência clínica com a HU e portadores
de AF vêm se acumulando nos últimos 31 anos e sugere que este medicamento
tem sido bem tolerado e é eficiente para a maioria desses pacientes.
7. FONTES CONSULTADAS
1. STEINBERG, MH e RODGERS, GP. Pharmacologic modulation of fetal
hemoglobina. Reviews in molecular medicine, v. 80, n. 5, p. 328-344, 2011.
2. MA, Q etal. Fetal hemoglobin in sickle cell anemia: genetic determinants of
response to hydroxyurea. The pharmacogenomics journal, v. 2007, n. 7, p. 386394, 2007.
3. WARE, R. E.; AYGUN, B. Advances in the use of hydroxyurea. Hematology Am
Soc Hematol Educ Program, v.2009, n.1, p.9-62, 2009.
4. STEINBERG, M. H. Hydroxyurea treatment for sickle cell disease. The cientific
world, n. 2, p. 1706-1728, 2002.
5. PLATT, OS etal. Hydroxyurea enhances fetal hemoglobin production in sickle cell
anemia. J Clin Invest. 74(2), 652-656, 1984.
6. CHARACHE, S etal. Effect of hydroxyurea on the frequency of painful crises in
sickle cell anemia. Investigators of the Multicenter Study of Hydroxyurea in Sickle
Cell Anemia. N Engl J Med. 18; 332(20):1317-22, 1995.
7. VOSKARIDOU, E. et al. The effect of prolonged administration of hydroxyurea on
morbidity and mortality in adult patients with sickle cell syndromes: results of a 17year, single-center trial (LaSHS). Blood, v.115, n.12, p. 63-2354, 2010.
8. CANÇADO, R. D. et al. Protocolo clínico e diretrizes terapêuticas para o uso de
hidroxiureia na doença falciforme. Rev. Bras. Hemato. Hemoter., v.31, n.5, p2009.
9. IRISHA, E. W. et al. Update on the use of hydroxyurea therapy in sickle cell
disease. Blood, v. 124, n. 26, p. 3850-3857, 2014.
10. Green, N e Barral, S. Emerging Science of hydroxyurea therapy for pediatric
sickle cell disease. Pediatric Research, 75, 196-204, 2014.