Avaliação Mensal 1o ano Vivian março/ 2011
Química
Turma:
Nome:
GABARITO RESOLVIDO
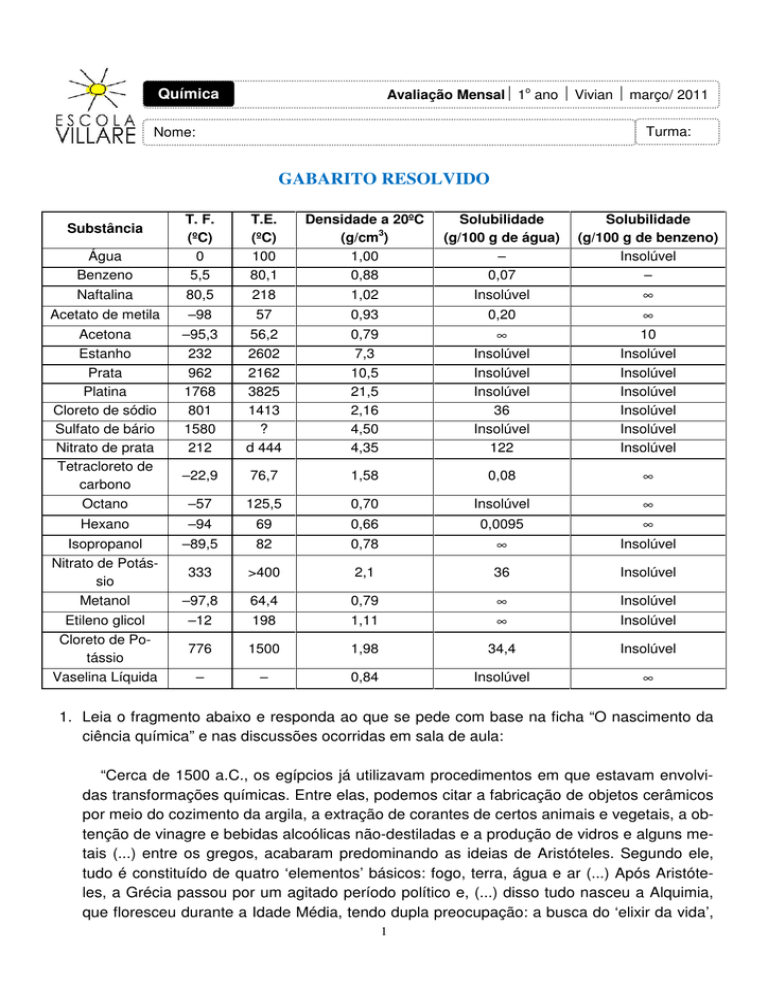
Água
Benzeno
Naftalina
T. F.
(ºC)
0
5,5
80,5
T.E.
(ºC)
100
80,1
218
Densidade a 20ºC
(g/cm3)
1,00
0,88
1,02
Solubilidade
(g/100 g de água)
–
0,07
Insolúvel
Solubilidade
(g/100 g de benzeno)
Insolúvel
–
Acetato de metila
–98
57
0,93
0,20
Acetona
Estanho
Prata
Platina
Cloreto de sódio
Sulfato de bário
Nitrato de prata
Tetracloreto de
carbono
Octano
–95,3
232
962
1768
801
1580
212
56,2
2602
2162
3825
1413
?
d 444
0,79
7,3
10,5
21,5
2,16
4,50
4,35
∞
Insolúvel
Insolúvel
Insolúvel
36
Insolúvel
122
∞
10
Insolúvel
Insolúvel
Insolúvel
Insolúvel
Insolúvel
Insolúvel
–22,9
76,7
1,58
0,08
∞
–57
125,5
0,70
Insolúvel
∞
Hexano
–94
69
0,66
0,0095
Isopropanol
Nitrato de Potássio
Metanol
–89,5
82
0,78
∞
∞
Insolúvel
333
>400
2,1
36
Insolúvel
–97,8
64,4
0,79
∞
Insolúvel
Etileno glicol
Cloreto de Potássio
Vaselina Líquida
–12
198
1,11
∞
Insolúvel
776
1500
1,98
34,4
Insolúvel
–
–
0,84
Insolúvel
∞
Substância
∞
1. Leia o fragmento abaixo e responda ao que se pede com base na ficha “O nascimento da
ciência química” e nas discussões ocorridas em sala de aula:
“Cerca de 1500 a.C., os egípcios já utilizavam procedimentos em que estavam envolvidas transformações químicas. Entre elas, podemos citar a fabricação de objetos cerâmicos
por meio do cozimento da argila, a extração de corantes de certos animais e vegetais, a obtenção de vinagre e bebidas alcoólicas não-destiladas e a produção de vidros e alguns metais (...) entre os gregos, acabaram predominando as ideias de Aristóteles. Segundo ele,
tudo é constituído de quatro ‘elementos’ básicos: fogo, terra, água e ar (...) Após Aristóteles, a Grécia passou por um agitado período político e, (...) disso tudo nasceu a Alquimia,
que floresceu durante a Idade Média, tendo dupla preocupação: a busca do ‘elixir da vida’,
1
que garantiria a imortalidade e a cura das doenças do corpo, e a descoberta de um método
para a transformação de metais comuns em ouro, que ocorreria na presença de um agente
conhecido como pedra filosofal.”
a) Qual a relação entre a química e a sociedade? Comente os efeitos positivos e os efeitos negativos.
O desenvolvimento da investigação na Química tem dado um grande contributo para a melhoria da qualidade de vida das pessoas em áreas como a saúde, a agricultura, a síntese de novos materiais ou mesmo a investigação na área da criminalidade.
Contudo, é também responsável pela produção de resíduos e produtos resultantes de processos químicos que causam desequilíbrios no meio ambiente tais como
poluição, chuvas ácidas, aumento do efeito de estufa, diminuição da espessura da
camada de ozônio, entre outros. Assim, nesta teia de inter-relações entre benefícios
e prejuízos, entre Ciência e Sociedade, cabe à Química a procura de novas soluções
para os problemas causados.
b) Analise a adequação da seguinte sentença. Justifique. “O conhecimento produzido pelos alquimistas é inútil, pois suas teorias eram baseadas em afirmações dogmáticas,
muitas vezes de caráter místico.”
A citação está incorreta. A alquimia, uma mistura de ciência, arte e magia, tinha
como objetivos a busca pelo elixir da vida e a pedra filosofal. Embora tais objetivos não tenham sido atingidos, foi através das pesquisas feitas pelos alquimistas
que foi possível o domínio de diversas técnicas / processos e o estudo de diversas
substâncias químicas. A alquimia também contribuiu para progressos no conhecimento das substâncias provenientes de minerais e vegetais. Assim, o conhecimento
dos alquimistas não é inútil.
2. Um copo, a temperatura ambiente, contém uma mistura de água, acetona, pequena quantidade de cloreto de sódio, octano e sulfato de bário.
a) Faça um fluxograma do processo de separação dos componentes dessa mistura. Indique o seu procedimento passo a passo, citando os nomes dos processos utilizados. O
seu método deve ser prático e eficiente. Consulte a tabela.
Professora: Vivian
Disciplina: Química
2
1ª mensal de 2011
1º Ano
b) Justifique os processos utilizados para a separação no item anterior. Para isso utilize as
propriedades específicas das substâncias envolvidas e a classificação dos sistemas em
homogêneos ou heterogêneos.
Mistura
Filtração
Decantação
Destilação Fracionada
Destilação Simples
Propriedade Específica
Heterogênea (sólido/líquido)
Solubilidade
Heterogênea (líquido/líquido) Solubilidade e Densidade
Homogênea (líquido/líquido)
Solubilidade e TE
Homogênea (sólido/líquido)
Solubilidade e TE
TE: temperatura de ebulição
3. A tabela a seguir mostra alguns dados experimentais de massa e volume de amostra de
três substâncias puras líquidas diferentes: substância 1, substância 2, substância 3.
Professora: Vivian
Disciplina: Química
3
1ª mensal de 2011
1º Ano
Substância 1
Massa (g)
Volume (cm3)
10
10
15
15
20
20
25
25
30
30
Substância 2
Massa (g) Volume (cm3)
10
2
15
3
20
4
25
5
30
6
Substância 3
Massa (g) Volume (cm3)
10
16
15
23
20
32
25
40
30
48
A partir destes dados, responda:
a) Construa o gráfico que indique como seriam as curvas que relacionam massa (eixo y) e
volume (eixo x) destas três substâncias. Não se esqueça de identificar cada uma das
curvas com a substância que ela representa.
b) Por que a substância 2 apresenta menor volume para a mesma massa das três substâncias? Justifique com base no gráfico do item a.
O menor volume da substância 2, para a mesma massa das três substâncias, é explicado pelo fato de a substância 2 ter a maior densidade, o que podemos observar
no gráfico pela alta inclinação de sua curva. Como densidade e volume são grandezas inversamente proporcionais, quanto maior a densidade, menor é o volume.
c) Uma bolinha maciça de um metal puro X foi colocada em três recipientes diferentes, cada um deles contendo, respectivamente, uma das três substâncias da tabela anterior.
Os desenhos abaixo mostram o que foi observado durante esta nova experiência.
Professora: Vivian
Disciplina: Química
4
1ª mensal de 2011
1º Ano
Substância 1
Substância 2
Substância 3
A partir dos desenhos acima, indique qual o intervalo de valores, onde se encontra a
densidade do metal X? Justifique.
Calculo das densidades através do coeficiente de variação do gráfico (∆y/∆x):
d1= 1 g/cm3
d2= 5 g/cm3
d3= 0,6 g/cm3
Através das densidades das substâncias podemos concluir que a densidade do
metal X se encontra no intervalo: 1 g/cm3 < x < 5 g/cm3
Analisando os recipientes verifica-se que o metal X afunda em duas substâncias
(as duas menos densas). Portanto sua densidade é maior que essas duas substâncias
(d1 e d3). Além disso, ele flutua na substância mais densa (d2), sendo, portanto menos denso que ela.
4. Três tubos de ensaio, I, II e III, contêm, separadamente, amostras de 4 mL dos líquidos clorofórmio, etanol e gasolina, não necessariamente nesta ordem, a uma dada temperatura. A
cada um destes tubos foi adicionado 1 mL de água. Sabe-se que apenas o etanol é solúvel em água. O comportamento das misturas em cada tubo está mostrado a seguir:
Tubo 1
Tubo 2
Tubo 3
Responda:
a) Complete a tabela com a densidade dos quatros líquidos, sabendo que suas massas
estão abaixo relacionadas:
Volume dos líquidos = 4 ml
Volume de água = 1 ml
Através do cálculo d = m/v determina-se a densidade das substâncias.
Professora: Vivian
Disciplina: Química
5
1ª mensal de 2011
1º Ano
Líquidos
Gasolina
Massa (g)
2,8
Clorofórmio
6,0
Etanol
3,2
Água
1,0
Densidade (g/mL)
0,7
1,5
0,8
1,0
b) Coloque verdadeiro (V) ou falso (F), justificando as alternativas falsas:
I.
O tubo I contém álcool, enquanto o tubo II e III contém, respecti(F)
vamente, clorofórmio e gasolina.
Os tubos II e III contêm, respectivamente, gasolina e clorofórmio. Como a densidade da gasolina é menor que a da água,
este líquido ficará acima da água (maior volume acima do menor volume). Já o clorofórmio, por ser mais denso, afundará
(menor volume acima do maior volume).
II.
(F)
Ao aumentar a temperatura das três substâncias, etanol, gasolina
e clorofórmio, suas partículas receberiam energia e, com isto,
seus respectivos volumes diminuíram, aumentando suas densidades.
Com o aumento da temperatura, aumenta o grau de agitação
das moléculas e, conseqüentemente, suas velocidades. O número de colisões entre as moléculas aumentariam e, portanto,
seu volume aumentaria, diminuindo sua densidade.
III.
(V)
Triplicando o volume de gasolina, sua massa será de 8,4 g.
Volume inicial = 4 ml
Volume final = 3 x Volume inicial = 3 x 4 = 12 ml
d = m / V → 0,7 = m / 12 → m = 8,4g
IV.
(F)
Construindo um gráfico de massa em função do volume, a curva
referente ao etanol estará localizada acima da curva referente à
água.
A curva do etanol estará embaixo da curva da água, já que é
menos denso que esta.
Professora: Vivian
Disciplina: Química
6
1ª mensal de 2011
1º Ano
5. Com base nas curvas de solubilidade de alguns sais em função da temperatura abaixo,
responda:
a) Qual a massa de nitrato de sódio (NaNO3) necessária para saturar 25 g de água a
10oC?
Analisando o gráfico, a 10ºC tem-se:
80g NaNO3 ------- 100g água
x g NaNO3 ----- 25g água
:4
x = 20g NaNO3
b) Preparam-se 450 g de uma solução saturada de KCl (cloreto de potássio) a 75oC. Qual
a massa de sal precipitado ao resfriarmos essa solução à 10oC?
Analisando o gráfico, a 75ºC tem-se:
Soluto + solvente = solução
50g
100g
150g
x3
m
v
450g
m = 150g KCl
v = 300g água
Analisando o gráfico, a 10ºC tem-se:
30g KCl – 100g água
x3
x g KCl – 300g água
x = 90g KCl (quantidade máxima de soluto dissolvido em água a 10ºC)
Portanto: massa de soluto na solução inicial – massa de soluto dissolvido = massa de
sal precipitado
150g – 90g = mp
mp = 60g
Professora: Vivian
Disciplina: Química
7
1ª mensal de 2011
1º Ano










