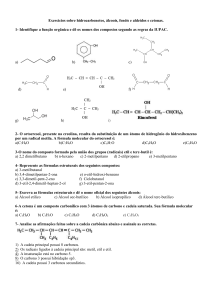
Rio, 27 de Maio de 2008.
Trabalho de A2
Prof.: Celeste
Alunas: Miriel Tânia Silva Ribeiro
E Eline Azevedo Brazão
Matrícula: 2007020004
Matricula:2007020225
Curso: Ciências Biológicas (3º período)
Funções da Química Orgânica
Introdução
Química Orgânica é um ramo da química que estuda os compostos extraídos dos
organismos vivos. Essa divisão foi proposta em 1777 pelo químico alemão Torbern
Olof Bergman. Em 1807, foi formulada a Teoria da Força Vital por Jöns Jacob
Berzelius. Ela baseava-se na idéia de que os compostos orgânicos precisavam de uma
força maior (a vida) para serem sintetizados.
Friedrich Wöhler, em 1828, derrubou a teoria de seu professor Berzelius
sintetizando em laboratório a uréia.
Percebe-se que a definição de Bergman para a química orgânica não era
adequada, então, o químico alemão Friedrich August Kekulé propôs a nova definição
aceita atualmente: “Química Orgânica é o ramo da Química que estuda os compostos do
carbono”.
A química orgânica é o estudo das substâncias que constituem a matéria viva e
dos compostos resultantes das suas transformações. Hoje em dia, prefere-se a
designação de compostos de carbono, visto que este elemento é comum a todos eles e é,
em parte, responsável pelas suas propriedades. Contudo, nem todos os compostos que
possuem o elemento carbono são incluídos no grupo dos compostos de carbono. A
facilidade com que os átomos de carbono formam ligações covalentes (simples, duplas
ou triplas) com outros átomos de carbono ou com átomos de outros elementos explica o
número e a variedade de compostos orgânicos. Os compostos orgânicos podem ser
agrupados e classificados de acordo com a presença de determinados grupos de átomos
nas suas moléculas, que são responsáveis pelo comportamento químico dessas famílias
de compostos orgânicos. Qualquer composto orgânico é constituído por uma cadeia
carbonada não reactiva, e por uma parte reactiva, o grupo funcional.
Os Hidrocarbonetos
Só carbonos e hidrogênios, nomenclatura com terminação (o). Suas
classificações:
Alcanos (hidrocarboneto de cadeia aberta, ligação simples entre os carbonos);
Alcenos (hidrocarboneto de cadeia aberta, com ligação dupla entre os carbonos);
Alcinos (hidrocarboneto de cadeia aberta, com ligação triplas entre os carbonos);
Ciclanos (hidrocarboneto de cadeia fechada, ligação simples entre os carbonos);
Ciclenos (hidrocarboneto de cadeia fechada, com ligação dupla entre os carbonos);
Arómaticos (hidrocarboneto com o anel benzênico).
Benzeno (aromático)
Naftaleno (aromático).
É capaz de efetuar até 4 ligações sigma (Tetravalente).
Ligações múltiplas.
O caráter da ligação é anfótero (não importa se é metal ou não-metal).
Formar cadeias carbônicas (aminoácidos, proteínas, ácidos nucléicos, diesel, etc).
Na química orgânica, compostos orgânicos são nomeados de acordo com:
Hidrocarbonetos (apresentam somente carbono e hidrogênio em sua fórmula molecular).
Prefixo
Nomenclatura dos Alcanos Lineares: nº de Carbonos , Nome:
1 : Metano
2 : Etano
3 : Propano
4 : Butano
5 : Pentano
6 : Hexano
7 : Heptano
8 : Octano
9 : Nonano
10 : Decano
Intermediário
É indicado pela classificação da cadeia quanto à saturação:
Saturada (an): Aquelas que possuem apenas ligações simples entre os carbonos.
Insaturada: aquelas que possuem 2 ou 3 ligações entre os carbonos.
1 dupla ligação ---> EN
2 duplas ligações ---> DIEN
3 duplas ligações ---> TRIEN
1 tripla ligação ---> IN
2 triplas ligações ---> DIIN
3 triplas ligações ---> TRIIN
1 dupla ligação e uma tripla ligação -> ENIN
Sufixo
Hidrocarbonetos ---> O
Ác. Carboxílicos --> Ácido Oico
Cetona ------------> Ona
Aldeido -----------> Al
Álcool ------------> Ol
Éster -------------> Hidrocarboneto+Ato De Ila
Haleto
Possuem um elemento halogênio (coluna 17/7A).
Ex.: CH3-CH2-Br bromo-etano;
Cl - CH - Cl
|
Cl
Tricloro-metano (clorofórmio).
Éter
Possui o oxigênio entre carbonos.
Nomenclatura:
(Número de carbonos da menor cadeia) OXI-(nome da cadeia maior)
Ex.:
CH2-O-CH2-CH3 - metóxi-etano
CH3-CH2-CH2-O-CH2-CH3 - etóxi-propano
CH3-CH2-O-CH2-CH3 - etóxi-etano (éter etílico)
Os Álcoois
Os álcoois caracterizam-se por possuírem um ou mais grupos hidroxilo ou
oxidrilo, OH, ligados à cadeia carbonada. O grupo hidroxilo constitui, pois, o grupo
funcional álcool. A nomenclatura dos álcoois segue as regras já referidas para os
hidrocarbonetos. Caso se trate de um monoálcool, é portanto só com um grupo hidroxilo
na cadeia carbonada, o nome é dado pelo número de átomos de carbono da cadeia
principal (a maior que contém o grupo hidroxilo) acrescido da terminação (ol). Caso se
trate de um poliálcool, o nome termina em (diol, triol, etc), consoante o número de
grupos hidroxilo ligados à cadeia carbonada. A numeração da cadeia carbonada é feita
de modo a que os átomos de carbono onde estão implatados os grupos hidroxilo tenham
a menor numeração possível.
Se o grupo hidroxilo se encontrar ligado diretamente a um anel aromático, os
compostos têm a designação de fenóis.
Função álcool: – OH
Fórmula geral dos álcoois: R – OH
Exs.:
Hidratação de alcenos
Substituição
nucleófila.
No
entanto, esta reacção só é útil com
substratos incapazes de reagir
rapidamente por E2.
Na presença de bases fortes, os álcoois atuam como doadores de prótons. Os
álcoois são geralmente ácidos ligeiramente mais fracos do que a água, com valores de
pKa entre 16 e 18. Os álcoois são compostos versáteis, e podem ser usados como
material de partida para a preparação de uma grande variedade de compostos.
Oxidação de álcoois a compostos carbonilo.
A oxidação de álcoois pode dar origem a um aldeído, uma cetona, ou um ácido
carboxílico, dependendo do álcool, do agente oxidante e das condições da reação.
Normalmente usam-se compostos de Cr(VI) como oxidantes. A reação de um álcool
primário com ácido crômico (preparado por acidificação de soluções de cromato, CrO42, ou dicromato, Cr2O72-) dá origem principalmente ao ácido carboxílico correspondente:
Álcoois primários
Os álcoois primários têm o grupo hidroxila ligado a um carbono primário; um
exemplo é o etanol. A fórmula geral dos álcoois primários é:
Para se oxidar um álcool primário apenas até ao estado de aldeído não se pode
usar ácido crômico, pois este é um oxidante muito forte. Em vez deste, usam-se outras
espécies de Cr(VI), por exemplo clorocromato de piridínio - PCC - ou dicromato de
piridínio – PDC, em solução anidra.
Álcoois secundários
Os álcoois secundários têm o grupo hidroxila ligado a um carbono secundário;
por exemplo: 2-propanol. A fórmula geral é:
Os álcoois secundários são oxidados a cetonas pelos mesmos reagentes que
oxidam os álcoos primários:
Álcoois terciários
Os álcoois terciários têm o grupo hidroxila ligado a um carbono terciário; por
exemplo: 2-metil-2-propanol (trimetilcarbinol). A fórmula geral é:
Os álcoois terciários, por não possuírem hidrogênio ligado ao carbono
hidroxilado, não são facilmente oxidados.
O etanol ou álcool etílico é o tipo de álcool mais comum. Está contido nas
bebidas alcoólicas, é usado para limpeza doméstica e também é combustível para
automóveis. A fórmula do etanol é CH3CH2OH.
O metanol ou álcool metílico é um álcool que não deve ser ingerido, pois é
extremamente tóxico para o Fígado. A fórmula do metanol é CH3OH.
Álcool anidro é um álcool com até 1% de água (já que é difícil a obtenção de
álcool totalmente puro), e pode ser adicionado à gasolina para aumento da octanagem,
atuando como "antidetonante", para que a gasolina possa ser comprimida no pistão do
motor carburante ao máximo e não entre em combustão antes de acionada a vela do
motor.
O álcool bornílico é obtido ligado com o hidroterpendio que corresponde a
cânfora.
O álcool desnaturado é uma composição com o metileno.
O álcool natural é obtido pela fermentação e destilação de produtos agricolas e
naturais.
Os Aldeídos e as Cetonas
Os aldeídos e as cetonas pertencem a duas famílias de compostos orgânicos
caracterizados por possuírem na sua cadeia carbonada o grupo carbonilo, C = O. A diferença
entre eles reside somente na posição do grupo carbonilo: nos aldeídos está posicionado num
átomo de carbono primário (C1) e, portanto, numa das extremidades da cadeia carbonada; nas
cetonas está posicionado num átomo de carbono secundário (C2), onde nunca se encontra numa
posição terminal.
O nome dos aldeídos é dado pelo nome do alcano com cadeia carbonada idêntica à do
aldeído, mas com a terminação (al). A numeração da cadeia carbonada é sempre iniciada pelo
átomo de carbono do grupo carbonilo, seguindo-se as restantes regras de nomenclatura dos
compostos orgânicos já estudados.
Quanto às cetonas os seus nomes seguem também as regras de nomenclaturaconhecidas,
com a diferença de apresentarem a terminação (ona). Os átomos de carbono devem ser
numerados de modo a que o átomo de carbono do grupo carbonilo tenha a menor numeração
possível.
As cetonas são compostos orgânicos caracterizados pela presença do
grupamento -C=O, carbonila, ligado a dois radicais orgânicos. Apresentam uma
fórmula geral R-C(=O)-R', onde R e R' podem ser iguais (cetonas simples ou simétricas)
ou diferentes (cetonas mistas ou assimétricas); alifáticos ou aromáticos; saturados ou
insaturados. R e R' podem também estar unidos. Nesse caso, compõem um ciclo
(cetonas cíclicas).
Quando R ou R' é um átomo de hidrogénio, estamos na presença de um aldeído.
Cetonas são formadas pela oxidação de álcoois secundários. Um átomo de
hidrogênio (ligado ao oxigênio) é retirado e o átomo de oxigênio passa a fazer uma
ligação dupla com o carbono da cadeia.
Os Ácidos Carboxílicos
Estes compostos têm na sua estrutura um ou mais grupos funcionais carboxilo,
COOH, responsáveis pelo comportamento ácido destes compostos. Trata-se de uma
função química composta de outros dois grupos funcionais: o grupo carbonilo, C = O, e
o grupo hidroxilo, OH.
O nome dos ácidos carboxílicos é obtido a partir do nome da cadeia carbonada
principal que contém o(s) grupo(s) carboxilo. Caso apenas contenha um grupo
carboxilo é um monoácido, com nome terminado em (óico); caso tenha dois grupos
carboxilo é um diácido, um (dióico).
Os ácidos carboxílicos de menor cadeia carbonada são líquidos, incolores e
bastante solúveis em água graças às ligações de hidrogênio que podem estabelecer com
as moléculas de água, dado que o grupo carboxilo é bastante polar. As interações com
as moléculas de água permitem que, em parte, as moléculas de ácido se ionizem o que
explica o comportamento ácido, ainda que fraco, destes compostos.
Ácidos carboxílicos são geralmente ácidos fracos, com apenas 1% de moléculas
RCOOH dissociadas em íons a temperatura ambiente em solução aquosa.
Ácidos carboxílicos reagem com bases para formar carboxilatos sais, nos quais o
hidrogênio do grupo -OH é substituído por um ion metálico. Deste modo, ácidos
etanóicos/acéticos reagem com bicarbonato de sódio para formar etanoato sódico
(acetato de sódio), dióxido de carbono, e água.
OBS.: Os ácidos carboxílicos apresentam odor característico. Os monocarboxílicos que
apresentam até 12 átomos de carbono apresentam cheiro bastante desagradável. Os
indívíduos através do seu metabolismo produzem e excretam ácidos carboxílicos, que é
de composição diferente para cada indivíduo; portanto, cada pessoa tem o seu cheiro
característico. Por isso, o cão, que apresenta olfato bastante aguçado, reconhece as
pessoas pelo cheiro.
As Aminas
As aminas são compostos orgânicos constituídos por carbono, hidrogênio e
azoto. São compostos azotados derivados do amoníaco, por substituição de um ou mais
hidrogênios por radicais alquilo.
O nome das aminas é formado indicando antes do termo amina os nomes dos
radicais alquilo ligados ao átomo de azoto, por ordem alfabética.
Certas aminas apresentam mais do que um grupo amina, designam-se
poliaminas. Para dar nome a estes compostos começa-se por referir os números que
indicam a localização dos grupos amino, NH2, seguindo-se o nome do hidrocarboneto e,
finalmente , o prefixo que indica o número de grupos amina seguido do termo amina.
Exemplos:
H2NCH2CH2NH2, 1,2 – etanodiamina;
NH2CH2CH2CH(NH2)CH2CH2NH2, 1,3,5 – pentanotriamina.
As aminas são uma classe de compostos químicos orgânicos nitrogenados
derivados do amoníaco (NH3) e que resultam da substituição parcial ou total dos
hidrogênios da molécula por grupos hidrocarbónicos (radicais alquilo ou arilo –
frequentemente abreviados pela letra R). Se substituirmos um, dois ou três hidrogénios,
teremos, respectivamente, aminas primárias (R-NH2), secundárias(R1R2NH) ou
terciárias (R1R2R3N).
As aminas podem ser classificadas como simples quando os grupos alquil são
iguais ou mistos, se estes forem diferentes.
Quando se usa os prefixos di e tri, indica-se que a amina é secundária ou
terciária, respectivamente, e com grupos radicais iguais. Quando os grupos são
diferentes, estes são nomeados sucessivamente, do menor para o maior, terminando o
nome do composto com o sufixo “amina”. Algumas vezes indica-se o prefixo amino,
indicando, de seguida a posição e o nome do grupo hidrocarbónico.
Tais como a molécula NH3, da qual são derivadas formalmente, têm uma
estrutura piramidal com 3 ligações sp3 e um par de electrões desemparelhados. Por isso,
os orbitais apresentam hibridação sp3 e estão dirigidos em direção aos vértices de um
tetraedro. O átomo de azoto localiza-se no centro do tetraedro; as ligações covalentes
(com hidrogénio ou com o radical) formarão os vértices da base, a que se oporão os dois
electrões desemparelhados no vértice do topo do tetraedro.
A presença de um par de electrões livres é responsável por propriedades físicas e
químicas particulares nas aminas.
Como o azoto (nitrogénio) é menos electronegativo que o oxigénio, as ligação
N-H apresentam-se menos polares que as ligações O-H (presentes nos álcoois). Por essa
razão, as aminas formam pontes de hidrogénio mais débeis que os álcoois com pesos
moleculares semelhantes. Como as ligações são mais fracas, compreende-se que os
pontos de ebulição das diversas aminas também sejam mais baixos (necessitarão de
menos energia para evaporar, porque também estão menos ligadas umas às outras).
Assim, as aminas primárias e secundárias têm pontos de ebulição menores que
os dos álcoois, mas maiores que os dos éteres de peso molecular semelhante. As aminas
terciárias, sem pontes de hidrogénio, têm pontos de ebulição mais baixos que os das
aminas primárias e secundárias de pesos moleculares semelhantes.
Como a amônia, as aminas agem como bases razoavelmente fortes (veja a tabela
com exemplos de valores de força de ácidos conjugados Ka). O átomo de nitrogênio
possui um par de electrões livres que pode receber um ião H+ para formar um ião
amônio substituído.
Os pares de pontos sobre os átomos N nas reações químicas mostradas neste
artigo representam o par de electrões livres do nitrogênio das aminas. Estes pares
também contribuem para a solubilidade de aminas simples mediante a formação de
pontes de hidrogênio com moléculas de água.
Um haloalcano pode reagir com uma amina para formar uma amina alquilsubstituída correspondente, com liberação de um ácido de halogênio:
Se a amina reagente é uma amina terciária neste tipo de reação, formam-se um
catião de amônio quaternário e um anião haleto:
Os compostos com iões emparelhados desta forma são chamados de sais
quaternários de amônio. O "X" mostrado nas reações anteriores pode também ser outro
tipo de grupo abandonador.
Os aminoácidos contêm um grupo amino e um grupo carboxilo ligados ao
mesmo átomo de carbono. Os aminoácidos unem-se uns aos outros através da ligação
destes dois grupos – que formam um grupo amida – dando origem às ligações
peptídicas que estruturam as proteínas.
A degradação de proteínas (por exemplo, quando um pedaço de carne apodrece),
leva, pelo contrário, à sua decomposição em aminas distintas. Os odores mais
desagradáveis de que geralmente nos lembramos são, provavelmente, devidos à
presença de aminas. Por exemplo, a 1,5-pentanodiamina (mais conhecida pelo sugestivo
nome de cadaverina, libertada pelos corpos em putrefacção, o escatol, um composto
heterocíclico presente nos excrementos, a 1,4-butanodiamina (putrescina – outro cheiro
“a podre”), etc…
Os alcalóides são compostos complexos presentes na constituição das plantas
que contêm grupos amina. Podemos citar alguns exemplos mais conhecidos, como a
morfina, a nicotina, etc.
A importância das aminas, em termos biológicos, é inegável. A classe de
compostos designados por β-feniletilaminas inclui a adrenalina, a noradrenalina, a
mescalina, etc. As sulfamidas, que afetam as bactérias ao inibir nelas a produção de
ácido fólico, mas que são inócuas para o ser humano, contêm um grupo amino. O
neurotransmissor GABA (ácido 4-aminobutanóico) também contém um grupo amino.
Alguns derivados do ácido p-aminobenzóico são também usados como anestésicos.
Encontram-se aminas secundárias em alguns alimentos (carne e peixe) ou no
fumo do tabaco. Estas podem reagir com os nitritos (presentes nos conservantes
utilizados nos produtos alimentares e usados como fertilizante, no caso das plantas,
como o tabaco), levando à formação de N-nitrosoaminas secundárias, que são
cancerígenas.
Origem: Wikipédia, a enciclopédia livre.
Portal de Química.