MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DE GOIÁS
INSTITUTO DE PATOLOGIA TROPICAL E SAÚDE PÚBLICA
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA TROPICAL
E SAÚDE PÚBLICA
MAURÍCIO BARCELOS COSTA
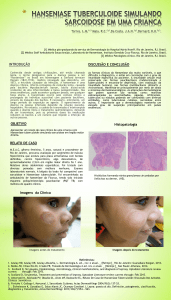
Estudo in situ da heterogeneidade de mastócitos e
células T reguladoras em pacientes com hanseníase,
com e sem episódios reacionais
Goiânia-GO
2014
Termo de Ciência e de Autorização para Disponibilizar as Teses e Dissertações
Eletrônicas (TEDE) na Biblioteca Digital da UFG
Na qualidade de titular dos direitos de autor, autorizo a Universidade Federal de Goiás–
UFG a disponibilizar gratuitamente através da Biblioteca Digital de Teses e Dissertações –
BDTD/UFG, sem ressarcimento dos direitos autorais, de acordo com a Lei nº9610/98, o
documento conforme permissões assinaladas abaixo, para fins de leitura, impressão e/ou
download, a título de divulgação da produção científica brasileira, a partir desta data.
1. Identificação do material bibliográfico: [] Dissertação
[X] Tese
2. Identificação da Tese ou Dissertação
Autor(a): Maurício Barcelos Costa
CPF:
158.666.371-20
E-mail:
[email protected]
Seu e-mail pode ser disponibilizado na página? [X]Sim
[ ] Não
Vínculo EmpreProfessor – 40 horas - Regime Jurídico Único – Faculdade de Medicina - UFG
gatício do autor
Agência de fomento:
Conselho Nacional de Pesquisa
Sigla:
CNPq
País:
Brasil
UF:
Goiás
CNPJ:
Título:
Estudo in situ da heterogeneidade de mastócitos e células T reguladoras em
pacientes com hanseníase, com e sem episódios reacionais
Palavras-chave: Treg, mastócitos, triptase, quimase, hanseníase, dermatoses
Título em outra língua:
In situ study of the heterogeneity of mast cells and regulatory T cells
in patients with leprosy, with and without reactional episodes
Palavras-chave em outra língua: treg, mast cell, tryptase, chymase, leprosy, skin diseases
Área de concentração:
Doenças Infecciosas e Parasitárias
Data defesa: (dd/mm/aaaa)
26/02/2014
Programa de Pós-Graduação:
EM MEDICINA TROPICAL E SAÚDE PÚBLICA
Orientador(a): Profa. Dra. Mariane Martins de Araújo Stefani
CPF:
260.258.841-53
E-mail:
[email protected]
Co-orientador(a):
CPF:
E-mail:
3. Informações de acesso ao documento:
Liberação para disponibilização?1 [ X ] total
[ ] parcial
Em caso de disponibilização parcial, assinale as permissões:
[ ] Capítulos. Especifique: __________________________________________________
[ ] Outras restrições: _____________________________________________________
Havendo concordância com a disponibilização eletrônica, torna-se imprescindível o envio
do(s) arquivo(s) em formato digital PDF ou DOC da tese ou dissertação.
O Sistema da Biblioteca Digital de Teses e Dissertações garante aos autores, que os arquivos
contendo eletronicamente as teses e ou dissertações, antes de sua disponibilização, receberão
procedimentos de segurança, criptografia (para não permitir cópia e extração de conteúdo,
permitindo apenas impressão fraca) usando o padrão do Acrobat.
________________________________________
Assinatura do autor
Data: 10 /04 /2014
1
Em caso de restrição, esta poderá ser mantida por até um ano a partir da data de defesa. A extensão deste prazo suscita
justificativa junto à coordenação do curso. Todo resumo e metadados ficarão sempre disponibilizados.
ii
MAURÍCIO BARCELOS COSTA
Estudo in situ da heterogeneidade de mastócitos e
células T reguladoras em pacientes com hanseníase,
com e sem episódios reacionais
Tese de Doutorado apresentada ao Programa de PósGraduação em Medicina Tropical e Saúde Pública
da Universidade Federal de Goiás para obtenção do
Título de Doutor em Doenças Infecciosas e
Paraitárias.
Orientadora: Profa. Dra. Mariane Martins de
Araújo Stefani
Este trabalho foi realizado com auxílio financeiro do Conselho Nacional de Pesquisa
(CNPq – projeto n. 401276/) e da American Leprosy Missions.
Goiânia-GO
26-02-2014
iii
Dados Internacionais de Catalogação na Publicação na (CIP)
GPT/BC/UFG
Costa, Maurício Barcelos.
xxxx
Estudo in situ da heterogeneidade de mastócitos e células T
reguladoras em pacientes com hanseníase, com e sem
episódios reacionais e em outras dermatoses [manuscrito] /
Maurício Barcelos Costa. - 2014.
xxx f.
Orientadora: Profa. Dra. Mariane Martins de Araújo
Stefani.
Dissertação (Doutorado) – Universidade Federal de Goiás,
Instituto de Patologia Tropical e Saúde Pública, 2014.
Bibliografia.
Inclui lista de figuras, abreviaturas, siglas, tabelas e
anexos.
1. Hanseníase 2. Matócitos 3. Células T reguladoras.
Título.
CDU: xxx-xxx.xx
iv
Programa de Pós-Graduação em Medicina Tropical e Saúde Pública da
Universidade Federal de Goiás
BANCA EXAMINADORA DA TESE DE DOUTORADO
Aluno: MAURÍCIO B ARCELOS COSTA
____________________________________________________________
Orientadora: PROFA. DRA. MARIANE MARTINS DE ARAÚJO STEFANI
__________________________________________________________
Membros:
1. Profa. Dra. Isabela Wastowski – UEG
2. Prof. Dr. Luiz Carlos de Lima Ferreira – UFAM
3. Profa. Dra. Mirian Lane C. de O. Rodrigues – UCG
4. Profa. Dra. Sônia Maria Oliani – IBILCE – UNESP
5. Profa. Dra. Mariane Martins de Araújo Stefani – IPTSP - UFG
Data: 26/02/2014
v
Dedico minha Tese de Doutorado
Aos Meus Pais, José (Seu Juquita – 80 anos) e Zany;
A Minha Esposa, Eula Maria; e aos Meus Filhos, Fabrício, Mariane e Flávia.
“Feliz é aquele que transfere o que sabe e aprende o que ensina”.
Cora Coralina
vi
AGRADECIMENTOS
Primeiramente à DEUS, por tudo, por permitir a realização dos meus sonhos.
A Eula, minha esposa, cúmplice e companheira de todas ashoras, por entenderme sempre que foi preciso, mantendo a harmonia do lar. A Sogra, que não posso
esquecer, Dona Ica, pela amizade e que soube cuidar bem da Eula, para que eu pudesse
desfrutar deste convívio.
Aos meus pais, José (Seu Juquita) e Zany, grandes responsáveis por todas
asminhas vitórias e de meus irmãos, por tudo que fizeram por mim e por nós, durante
toda a minha vida.
Aos meus irmãos, Marcos, Márcio, Maria Márcia, Maristela, Marlúcia, Marcelo
e Mônica (“in memoriam”), pela confiança que em mim sempre depositaram epelo
apoio em todas as ocasiões.
Aos meus filhos, Fabrício, Mariane e Flávia, motivo de orgulho e de grandes
alegrias, apesar das preocupações.
A Dra. Ana Lúcia Osório Maroccolo de Sousa, minha estimada ex-aluna, colega,
mãe e esposa dedicada, por toda abnegação e contribuição na parte clínica do projeto.
Sem você este trabalho não seria possível.
A enfermeira Maria Divina Silva (Divina Morena), pelo carinho, dedicação e
auxílio no recrutamento dos pacientes comhanseníase, peça importante neste quebracabeça.
Aos colegas do Laboratório de Imunologia, Mônica Nogueira da Guarda Reis,
Yanna Lima, Keila Alcântara, eespecialmente para turma da hansenologia Regiane
Morillas de Oliveira, Ludimila Cardoso, Emerith Mayra Hungria, Danielle de Freitas
Mizoguti, Aline Freitas e Rodrigo Scalianti Moura, pelas trocas de conhecimentos,
experiências, companheirismo, cumplicidade e dedicação. Uma equipe.
Aos professores do Instituto de Patologia Tropical e Saúde Pública (IPTSP), por
todos os ensinamentos transmitidos. A todos os professores que tive ao longo de minha
jornada de doutorando e todos os demais.
A Direção do Instituto de Patologia Tropical e Saúde Pública e a Coordenaçãodo
Programa de Pós-Graduação em Medicina Tropical da Universidade Federal deGoiás.
Aos colegas e funcionários do IPTSP. Na pessoa da Profa. Dra. Marília Dalva Turchi,
agradeço a todos!
A Direção Geral do Centro de Referência em Diagnóstico e Terapêutica e a
Secretaria Municipal de Saúde de Goiânia, na pessoa da Enfermeira Ana Cecília
Coelho, meus agradecimentos e reconhecimento pelo trabalho dedicado à saúde de
nosso povo.
Aos pacientes e voluntários que fizeram parte deste estudo, pela permissão
quenos deram de estudá-los para a evolução da medicina e ciência.
vii
Ao Dr. Sebastião Alves Pinto, amigo e colaborador de todas as horas, pelo apoio
na imuno-histoquímica e outros.
Ao Alexandre Alves Vieira, meu amigo e Histotécnico, que com dedicação e
carinho, preparou todas as lâminas para nossos estudos.
A Flávia Aparecida Rodrigues, Secretária de todos os momentos, que
pacientemente tolerou-me por todos estes anos e fez a revisão nos bancos de dados.
Mais recentemente a nova Secretária, Eliete Macedo da Silva, cúmplice das pequenas
inverdades juntos aos Médicos e pacientes, quando meu tempo era escasso e necessário
à realização desta tese.
Andréia Luiza Pereira e Magno Belém Cirqueira, biomédicos, técnicos em
Imuno-histoquímica da Patologia do HC-UFG, que gentilmente ajudaram-me nas
preparações de lâminas da imuno-histoquímica convencional.
Aos Colegas Professores e Médicos Residentes do Departamento de Patologia,
Radiologia, Imaginologia e Diagnóstico por Imagem, pelo companheirismo e
compreensão pela nossa ausência temporária e parcial.
A Profa. Dra. Sônia Maria Oliani do IBILCE da UNESP de São José do Rio
Preto, que viabilizou a realização do estudo de heterogeneidade dos mastócitos em seu
laboratório de Imunomorfologia.
A Kallyne Kioko Oliveira Mimura e Rubens de Paula Júnior, colegas do IBILCE
da UNESP de São José do Rio Preto, com quem realizamos a contagem dos mastócitos
e imuno-histoquímica e densitometria (quimase e tripatse).
Ao Prof. Dr. Fernando Augusto Soares, Professor Titular da USP, Chefe do
Departamento de Patologia do Hospital A. C. Camargo – SP, que viabilizou a realização
da dupla marcação no laboratório do Centro Internacional de Pesquisa (CIPE).
Ao Juliano Jampietro, colega do Hospital A. C. Camargo – SP, orientando de
Mestrado do Prof. Dr. Fernando Augusto Soares, que realizou a dupla marcação imunohistoqímica, CD25/Foxp3.
A todas as pessoas que direta ou indiretamente me fizeram seguir em frente e
que porventura ou desventura esqueci-me de nominar, meus sinceros agradecimentos.
Agradecimento especial
A Professora Dra. Mariane Martins de Araújo Stefani, minha orientadora, pela
dedicação, pelas oportunidades que tem dado a muitos pós-graduandos, durante vários
anos, pela garra e determinação, paciência e incentivo. Pelo muito que tem produzido
com o pouco que nos é dado e pela manutenção de um grupo de pesquisa dedicado à
Hanseníase. Meus sinceros agradecimentos. Sua orientação foi imprescindível e sem
está minha tese não seria possível!
viii
SUMÁRIO
Agradecimentos ............................................................................................................
vii
Sumário ........................................................................................................................
ix
Tabelas, figuras e anexos ..............................................................................................
xii
Símbolos, siglas e abreviaturas ......................................................................................
xiv
Apresentação ................................................................................................................
xvii
Resumo .........................................................................................................................
xxiii
Abstract ........................................................................................................................
xxv
Organização da tese ................................................................................................xxvii
1. INTRODUÇÃO ................................................................................................
1
1.1 Conceito ..................................................................................................................
1
1.2 Agente etiológico, infecção e doença ................................................................
1
1.3 Aspectos históricos................................................................................................3
1.4 Dados epidemiológicos – retrospectiva e atualidade ................................................
6
1.5 Manifestações clínicas da Hanseníase – definição de caso ................................ 14
1.5.1 Manifestações cutâneasna Hanseníase ..............................................................
15
1.5.2 Manifestações neuraisna Hanseníase ................................................................
17
1.5.3 Manifestações otorrinolaringológicas na Hanseníase ................................
19
1.5.4 Manifestações oftalmológicas na Hanseníase ...................................................
20
1.5.5 Manifestações viscerais e/ou sistêmicas na Hanseníase ................................21
1.6 Imunologia da Hanseníase .......................................................................................
22
1.6.1 A resposta imune inata contra o M. leprae .......................................................
22
1.6.2 A resposta imune adaptativa contra o M. leprae ...............................................
26
1.6.3 Hanseníase e Células T reguladoras ................................................................
33
1.6.4 Hanseníase e Mastócitos ..................................................................................
37
1.7 Hanseníase: classificação de Ridley-Jopling e a classificação operacional–
OMS/MS-Brasil ............................................................................................................
42
1.8 Hanseníase e Genética .............................................................................................
46
1.8.1 Predisposição genética e resposta imune inata para a hanseníase ......................
46
1.8.2 Predisposição genética e resposta imune adquirida para a hanseníase ..............
48
1.9 Diagnóstico .............................................................................................................
51
1.9.1 Baciloscopia ................................................................................................52
ix
1.9.2 Biópsia e exame histopatológico ................................................................ 52
1.9.3 Biologia Molecular ..........................................................................................
53
1.9.4 Estudos sorológicos ........................................................................................
54
1.9.4.1 Sorologia anti-PGL-I e outras proteínas ou peptídeos do M. leprae ...............
54
1.9.4.2 Avaliação da imunidade celular a peptídeos e proteínas
recombinantes do M. leprae......................................................................................
58
1.9.4.3 Testes cutâneos para avaliação da imunidade celular ao M. leprae ................
61
1.9.4.4 Outros meios auxiliares de diagnóstico .........................................................
62
1.10 Diagnósticos Diferenciais ......................................................................................
62
1.11 Reações Hansênicas ..............................................................................................
64
1.11.1 Reação Tipo 1(RT1 ou Reação Reversa) ........................................................
65
1.11.2 Reação Tipo 2 (RT2 ou Eritema Nodoso Hansênico ................................ 67
1.11.3 O impacto das reações no manejo clínico da hanseníase ................................
71
1.12 Tratamento: Multidrogaterapia (Poliquimioterapia) ...............................................
71
1.12.1 Tratamento: Multidrogaterapia nos adultos .....................................................
72
1.12.2 Tratamento: Multidrogaterapia nas crianças e adultos com até 30 Kg ..............
74
1.12.3 Tratamento: Multidrogaterapia nas reações .....................................................
75
1.12.3 Tratamento: Métodos profiláticos e vacina .......................................................
75
2. JUSTIFICATIVA ................................................................................................79
3. OBJETIVOS ...............................................................................................................
81
4. APRESENTAÇÃO DOS MANUSCRITOS ..............................................................
82
5. RESULTADOS ................................................................................................ 83
5.1. ARTIGO 1: In situ expression of CD25+ Foxp3+ Regulatory T Cells in
human skin diseases: leprosy and leprosy reactions .................................................
83
Abstrat .................................................................................................................
83
Introduction .........................................................................................................
84
Methods ...............................................................................................................
86
Results .................................................................................................................
89
Discussion ...........................................................................................................
91
References ...........................................................................................................
96
Table 1 .................................................................................................................
99
Figure 1 ...............................................................................................................
99
Figure 2 ...............................................................................................................
100
x
Figure 3 .................................................................................................................
101
Figure 4 ...............................................................................................................
102
Figure 5 ...............................................................................................................
103
Figure 6 ...............................................................................................................
104
Figure supplementary 1 ........................................................................................
105
5.2. ARTIGO 2: Mast cell heterogenity in human dermatoses: in situ
tryptase and chymase positive cells with emphasis on leprosy and leprosy
reactions ..................................................................................................................
106
Abstrat .................................................................................................................
106
Introduction .........................................................................................................
107
Methods ...............................................................................................................
108
Results .................................................................................................................
111
Discussion ...........................................................................................................
113
References ...........................................................................................................
119
Table 1 .................................................................................................................
123
Figure 1 ...............................................................................................................
124
Figure 2 ...............................................................................................................
125
Figure 3 .................................................................................................................
126
Figure 4 ...............................................................................................................
127
Figure 5 ...............................................................................................................
128
6. CONCLUSÕES ................................................................................................ 129
7. REFERÊNCIAS BIBLIOGRÁFICAS ................................................................ 130
8. ANEXOS ..................................................................................................................
150
xi
TABELAS, FIGURAS E ANEXOS
Tabela 1. Casos registrados e estimados de hanseníase no mundo em 1966 ..................
6
Tabela 2. Casos de Hanseníase no período de 1966 a 1987 ...........................................
7
Tabela 3. Casos registrados de hanseníase, casos novos e cobertura pela MDT.............
8
Tabela 4. Casos registrados, prevalência e casos novos de hanseníase em 2012 ............
9
Tabela 5. Casos de hanseníase no Brasil antes da implementação da MDT ...................
10
Tabela 6. Hanseníase – coeficientes de prevalência e detecção por região em
10
menores e maiores de 15 anos no Brasil 2011 ................................................................
Figura 1. Hanseníase no Brasil - coeficiente de prevalência no período de 1990
11
a 2010 .............................................................................................................................
Figura 2. Hanseníase coeficiente de prevalência e detecção no período de 1990
11
a 2010 .............................................................................................................................
Figura 3. Hanseníase – coeficiente de detecção nas diferentes regiões do
12
Brasil, no período de 1990 a 2010 .................................................................................
Tabela 7. Hanseníase – indicadores epidemiológicos e operacionais – Brasil
12
2001 a 2012 ..................................................................................................................
Tabela 8. Hanseníase – tendência de detecção em países com mais de 1000
13
casos em 2012 .................................................................................................................
Figura 4. Hanseníase – coeficiente de detecção geral de casos novos no Brasil
13
e estados em 2010 .........................................................................................................
Figura 5. Hanseníase – coeficientes de prevalência segundo UF - Brasil, em
14
2011 ..............................................................................................................................
Figura 6. Espectro clínico e imunopatológico da hanseníase e reações .........................
15
Tabela 9. Hanseníase – formas clínicas, caracterização e classificação
17
operacional ...................................................................................................................
Figura 7. Interação entre a imunidade inata e a imunidade adaptativa na
33
resposta à infecção pelo M. leprae.................................................................................
xii
Figura 8. Eventos de transdução de sinal na ativação dos mastócitos ............................
39
Figura 9. Espectro imunopatológico da hanseníase segundo Ridley-Jopling .................
45
Tabela 10. Apresentação das cartelas para o esquema padrão da OMS .........................
72
Figura 10. Cartelas com medicamentos dos esquemas padrões da PQT
72
(Poliquimioterapia/OMS) para adultos e crianças, PB e MB .........................................
Tabela 11. Esquema terapêutico utilizado para Paucibacilar: 6 cartelas ........................
73
Tabela 12. Cartelas com medicamentos dos esquemas padrões da PQT .......................
74
Tabela 13. Dosagens dos medicamentos no esquema terapêutico utilizado para
75
crianças e adultos com peso inferior a 30 Kg ................................................................
Tabela 14. Avaliação para aplicação do BCG ..............................................................
76
Anexo 1. Parecer do Comitê de Ética em Pesquisa Médica Humana e animal ...............
151
Anexo 2. Parecer da Comissão de Ética em Pesquisa - CONEP ................................
152
Anexo 3. Ficha de dados clínicos ..................................................................................
153
Anexo 4. Termo de consentimento livre e esclarecido ...................................................
154
Anexo 5. Comprovantes de submissão dos artigos/ aceite para publicação para
155
artigos ainda não publicados/ DOI dos artigos publicados .............................................
xiii
SÍMBOLOS, SIGLAS E ABREVIATURAS
AraLAM
Lipoarabinomanana com arabinose
AT
Azul de Toluidina
BAAR
Bacilo Ácido Álcool Resistente
BB
Hanseníase Borderline-Borderline
BCG
Bacilo Calmette-Guerin
BL
Hanseníase Borderline-Lepromatosa
BT
Hanseníase Borderline-Tuberculoide
CEP/CONEP Comitês de Ética em Pesquisa/Conselho Nacional de Ética em Pesquisa
CGRP
CRDT
“Calcitonin gene-related peptide” (peptídeo relacionados com o gene de
calcitonina)
Centro de Referência em Diagnóstico e Terapêutica, Goiânia, Goiás
CXCL
Quimiocina com motivo C-X-C
DC
“Dendritic Cells” (células dendríticas)
DE
Dermatoses
DNA
Ácido desoxirribonucléico
ELISA
“Enzyme-Linked Immunosorbent Assay” (Ensaio Imunoenzimático)
ENH
Eritema Nodoso Hansênico
Foxp3
Fator de transcrição de células T reguladoras
HLA
“Human Leucocyte Antigens” (Antígenos leucocitários humanos)
IB
Índice baciloscópico
IgG
Imunoglobulina G
IGRAs
IL
“Interferon-Gamma Release Assays” (ensaios de liberação de interferongama)
Interleucina
IFN-
Interferon Gama
IPTSP
Instituto de Patologia Tropical e Saúde Pública
LL
Hanseníase Lepromatosa
LPS
Lipopolissacarídeo
ManLAM
Lipoarabinomanana com manose
MB
Multibacilar
xiv
MCT
Mastócitos de mucosa
MCTC
Mastócitos de mucosa
MDT
Multidrogaterapia
MHB
Hanseníase Borderline (Moléstia de Hansen Borderline)
MHI
Hanseníase Indeterminada (Moléstia de Hansen Indeterminada)
MHL
Hanseníase Lepromatosa (Moléstia de Hansen Lepromatosa)
MHT
Hanseníase Tuberculoide (Moléstia de Hansen Tuberculoide)
M. leprae
Mycobacterium leprae
MT
Mycobacterium tuberculosis
NF-κB
Fator Nuclear kappa B
NRAMP1
Proteína 1 dos macrófagos associada à resistência natural
NLRs
“NOD-Like-receptors”
NOD
“Nucleotide-binding Oligomerization Domain”
OMS
Organização Mundial da Saúde
PADL
“protein advances diagnostic of Leprosy” (proteína para diagnóstico
rápido da hanseníase)
“Pathogen-Associated Molecular Patterns” (Padrões Moleculares
Associados aos Patógenos)
Paucibacilar
PAMPs
PB
PBMC
PCR
“Peripheral Blood Mononucleated Cell” (Células Mononucleares de
sangue periférico)
“Polymerase Chain Reaction” (Reação em Cadeia da Polimerase)
PGL-I
Glicolipídeo Fenólico-I ou fenoglicolipídeo I
POC
“Point of care” (ponto de atendimento)
PRRs
RIA
“Pattern Recognition Receptors” (receptores de reconhecimento de
padrões)
Resposta imune adaptativa
RII
Resposta imune inata
RIC
Resposta imune celular
RNI
Reativos Intermediários do Nitrogênio
ROI
Reativos Intermediários do Oxigênio
RT1
Reação Tipo 1
RT2
Reação Tipo 2
xv
SNP
SP
“Single-nucleotide Polymorphism” (Polimorfismo de Nucleotídeos
Simples)
Substância P
TCR
“T cell receptor” (receptor para antígeno do linfócito T)
TGF-β
“Transforming Growth Factor- β” (fator de crescimento transformador-β)
TLR
“Toll-Like Receptor”
TT
Hanseníase Tuberculoide
TNF-
Fator de necrose tumoral
Treg
Células T reguladoras
WBA
“whole-blood assays” (ensaio de sangue total)
WHO
“World Health Organization”
xvi
APRESENTAÇÃO
Nasci em Quintinos, Minas Gerais, segundo filho de uma prole de oito, um dos
oitenta netos de meus avós. Destes, os sete vivos de meus pais, e apenas mais uns quatro
ou cinco primos, tem curso superior. Graças aos meus pais sou médico, e desde os
quatro ou cinco anos falo apenas nesta profissão, como a minha, a que eu sempre
desejei.
Meus estudos superiores foram na UFG, graduação e especialização. Fui um
bom aluno, operava muito bem, ótimo relacionamento médico-paciente, pois gostava e
gosto da Medicina. Passei na seleção para residência de cirurgia, e ginecologia e
obstetrícia, como segunda opção, a primeira sempre foi a Patologia. Nesta, minha
natural predileção inexplicável por pele e pela Hanseníase.
A hanseníase tem sido foco de meu interesse nos trinta e poucos anos de
atividade docente e profissional. Na minha Residência Médica, especialização em
Patologia, quando na área de Dermatopatologia fui orientado pelo Prof. Warteloo João
Alves, que faleceu prematuramente em 1983, tive os primeiros contatos com a doença.
Após sua morte fui convidado por dois colegas Patologistas, Dr. Antônio Martins de
Macedo e Prof. William Machado Sobral, para ocupar o lugar deixando pelo mesmo,
em seu laboratório particular. Assumi então a área de Dermatopatologia, ainda muito
imaturo e pouco preparado para tanta responsabilidade. Na época estudava no livro de
Dermatopatologia da Izamar Malidiu, no “A guide of Dermatopatology” do Pinkus e
“Histopathology of the Skin” do Lever, que ainda conservo-os até hoje. Em 1984 fui
então para São Paulo, fazer um estágio de Dermatopatologia, na Clínica de
Dermatologia da Universidade de São Paulo, na época chefiada pelo Prof. Dr. Sebastião
de Almeida Prado Sampaio, que atendeu a uma solicitação do Chefe de Departamento
de Medicina Tropical e Dermatologia do Instituto de Patologia Tropical e Saúde Pública
(IPTSP), o Prof. Paulo Cesar Borges. Permaneci lá por três meses e tive a oportunidade
de
conhecer
grandes
nomes
da
Dermatologia
Brasileira,
bem
como
a
Dermatopatologista do Serviço, Profa. Dra. Mirian Nacagami Sotto, que tornou minha
amiga. Em 1984, aos vinte e oito anos, fui aprovado no concurso de Professor de
Patologia da Faculdade de Medicina da Universidade Federal de Goiás, tendo tomado
posse em 02 de janeiro de 1985. Em parte, o responsável pela minha nomeação, foi o
xvii
Prof. Maurício Sérgio Brasil Leite. Ficou sob minha responsabilidade a assistência e
ensino na área de Dermatopatologia.
Ingressei na carreira de magistério, FM-UFG, onde atuo na graduação, sempre
responsável pelas aulas de patologia das doenças infecciosas, entre elas a hanseníase, a
leishmaniose, a tuberculose, a paracoccidioidomicose, entre outras. Hoje tenho por volta
de 3.000 ex-alunos, aos quais incubi a responsabilidade de diagnosticar a hanseníase,
onde quer que fossem atuar como médicos. Desde então, institui também o ensino
sistemático da Dermatopatologia para os Médicos Residentes de Dermatologia e
Patologia da Faculdade de Medicina – Hospital das Clínicas da UFG, onde convivi com
praticamente todos os Dermatologistas Goianos, entre eles destacam o Prof. Paulo Cesar
Borges, o Prof. Anuar Auad, o Prof. Aiçar Chaul, o Prof. Hugo Junqueira, a Profa. Lia
Miranda, entre outros. Neste convívio dermatopatológico, tive a oportunidade de
participar da formação de quase uma centena de Médicos Residentes. Na Patologia são
mais 50 Médicos Residentes que tentei ajudá-los no aprendizado da Dermatopatologia.
Em 1987 foi realizado em Goiânia, no prédio do Fórum recém inaugurado, o
Congresso Brasileiro de Dermatologia, oportunidade na qual conheci o grande nome da
Dermatopatologia Mundial, Dr. Albert Bernard Ackerman (November 22, 1936 –
December 5, 2008). Aprendi com ele, no seu livro ou bíblia da Dermatopatologia,
“Histologic diagnosis of inflammatory skin diseases”, grande parte da arte do
diagnóstico dermatopatológico por silhueta, por padrões.
Em 1989, juntamente com o Prof. Roberto Rhuman Daher – IPTSP, fomos
convidados pela Profa. Dra. Maria Leide Wand-Del-Rey de Oliveira para participar da
edição do manual de Controle da Hanseníase – Uma proposta de integração ensinoserviço – 1989, publicado pelo Ministério da Saúde – Secretaria Nacional de Programas
Especiais de Saúde – Divisão Nacional de Dermatologia Sanitária. Pude então
aprofundar minhas atividades na área, oportunidade na qual fomos (FM-HC) agraciados
com um microscópio Nikon, para emissão de laudos histopatológicos no Hospital das
Clínicas da Universidade Federal de Goiás, onde tínhamos muitos doentes hansênicos.
Depois, pelos idos de 1991/1992, fiz a análise dos mais de 100 biópsias de pele
dos casos de hanseníase da tese de mestrado da Dra. Mirian Lane Castilho de Oliveira
Rodrigues, sobre proteção da vacina BCG intradérmica contra a hanseníase, artigo
referência sobre o assunto e citado em metanálise do tema.
Em 1992/1993 fui convidado pela Profa. Celina Maria Turchi Martelli a integrar
um grupo de pesquisa na área, sendo que na época a mesma estava interessada em
xviii
estudar hepatites e hanseníase, assuntos de sua tese de doutorado, publicada em 1995.
Para acertamos os ponteiros, fizemos um estudo de campo, duplo cego, onde os exames
de pele dos pacientes hansênicos foram vistos por mim e pelo Prof. Dr. Raul Negrão
Fleury, grande conhecedor de hanseníase, na época trabalhando no Instituto Lauro de
Souza Lima de Baurú – SP (faleceu recentemente, 07-02-2014). O Kappa na época foi
em torno de 85%, sendo que considero esta grande concordância pelo fato de ter
aprendido com Raul boa parte da histopatologia da doença. Para a tese da Profa. Celina,
na oportunidade, examinei em torno de 700 biópsias de casos da doença.
Em 1998 a Profa. Dra. Celina Maria Turchi Martelli criou um Grupo
Multicêntrico para o estudo da Hanseníase, incluindo participantes de Rondônia, a Dra.
Kasuê Narahashi Emília Ueda, do Rio de Janeiro/Fiocruz, a Dra. Maria Kátia Gomes,
do Amazonas/IDTVAN, a Dra. Paula Frassinetti Bessa Rebello, de Goiânia, Profa. Dra.
Mariane Martins de Araújo Stefani e eu. Do trabalho deste grupo foi possível
desenvolver teses e alguns artigos publicados em periódicos internacionais. As teses,
sempre sobre hanseníase, foram da Dra. Maria Kátia Gomes, Dra. Paula Rebello e a
minha. Deste grupo fiquei responsável pela análise histopatológica das biópsias de peles
de todos os casos, em torno de 350.
A partir de então, passei a participar como Médico Patologista, emitindo os
laudos histopatológicos das biópsias de peles, deste grupo de estudo de hanseníase, que
se estabeleceu no IPTSP, colaborando indiretamente em várias dissertações e teses:
Em 1999, a dissertação de mestrado da Dra. Maria Kátia Gomes, da Fiocruz Rio, orientanda da Profa. Dra. Celina Maria Turchi Martelli: características
epidemiológicas, clínicas e imunológicas de pacientes de hanseníase paucibacilar (PB)
lesão única, tratados com Rifampicina, Ofloxacina e Minociclina em dose única (ROM),
em três regiões do Brasil: estudo multicêntrico. UFRJ - RJ.
Em 2001, a dissertação de mestrado da Dra. Paula Frassinetti Bessa Rebello, do
Instituto de Dermatologia Tropical e Venereologia “Alfredo da Matta” – Fundação
FUAM, orientanda da Profa. Dra. Celina Maria Turchi Martelli: hanseníase paucibacilar
lesão única. IPTSP-UFG, Goiânia – Go.
A dissertação de mestrado da Profa. Dra. Jacqueline Gomes Guerra, orientanda
da Profa. Dra. Lia Cândida Miranda de Castro: “reações hansênicas: aspectos clínicos,
epidemiológicos e imunológicos”. IPTSP-UFG, Goiânia – Go.
Conclusão de minha dissertação de mestrado com o tema: “Caracterização
histopatológica de biópsias de pele de pacientes com hanseníase paucibacilar lesão
xix
única”, orientado pela Profa. Celina Maria Turchi Martelli e co-orientado pelo Prof. Dr.
Florêncio Figueiredo Cavalcanti Neto, oportunidade na qual estudei mais de 350 casos
da doença. Este mestrado propiciou-me uma ida aos Estados Unidos da América, em
Baton Rouge – Louisiana, onde um grupo de pesquisa, em colaboração com o grupo do
IPTSP, estudava a doença. Lá conheci grandes nomes da área, como o Dr. David
Scollard, Dr. Tomas Gillis, Dr. Krahenbuhl, a técnica do setor Nayoko, e
acompanhando a Profa. Mariane, tive minha primeira experiência com a reação da
polimerase em cadeia (PCR- polymerase chain reaction).
Em 2002, a dissertação de mestrado da Dra. Ana Lúcia Osório Maroccolo Sousa,
orientada da Dra. Celina Maria Turchi Martelli: Detecção de DNA de Mycobacterium
leprae por reação em cadeia da polimerase em coorte de pacientes paucibacilares com
lesão única tratados com esquema terapêutico de dose única. IPTSP-UFG, Goiânia –
Go.
Em 2007, a tese de doutorado da Profa. Dra. Jacqueline Gomes Guerra:
“Reações hansênicas: aspectos clínicos, epidemiológicos e imunológicos”. UFRJ, Rio
de Janeiro – Rio de Janeiro.
Em 2008, a dissertação de mestrado de Adriano Badotti Grassi, orientando da
Profa. Dra. Mariane Martins de Araújo Stefani: Hanseníase, comparação entre testes
rápidos com antígeno PGL-I em amostras de sangue total e soro. IPTSP-UFG, Goiânia
– Go.
A dissertação de mestrado de Lucas Henrique Ferreira Sampaio, orientando da
Profa. Dra. Mariane Martins de Araújo Stefani: Diagnóstico da Hanseníase
Paucibacilar: Resposta Imune Celular a Proteínas Recombinantes do Mycobacterium
leprae. IPTSP-UFG, Goiânia – Go.
Em 2009 a tese de doutorado da Profa. Ana Lúcia Osório Maroccolo Sousa,
orientando da Profa. Dra. Mariane Martins de Araújo Stefani: “marcadores moleculares,
imunológicos e genéticos das reações hansênicas”. IPTSP-UFG, Goiânia – Go.
Em 2010 a dissertação de mestrado da Regiane Morillas Oliveira: “pesquisa da
reatividade sorológica a proteínas recombinantes do Mycobacterium leprae”. IPTSPUFG, Goiânia – Go.
Em 2011 atese de doutorado de Lucas Henrique Ferreira Sampaio, orientando
Mariane Martins de Araújo Stefani: “avaliação da resposta imune celular a antígenos
recombinantes do Mycobacterium leprae e potencial aplicação para o diagnóstico da
hanseníase paucibacilar”. IPTSP-UFG, Goiânia – Go.
xx
Em 2013 a dissertação de mestrado da Emerith Mayra Hungria Pinto, orientanda
da Profa. Dra. Mariane Martins de Araújo Stefani: “reatividade sorológica a proteínas
recombinantes do Mycobacterium leprae em diferentes grupos populacionais de
distintas regiões endêmicas do Brasil”. IPTSP-UFG, Goiânia – Go.
Junto com este grupo, produtos das teses e dissertações, como coordenadora e
pesquisadora principal, a Profa. Dra. Mariane Martins de Araújo Stefani, tivemos a
oportunidade de participar como autor ou co-autor da publicação de diversos artigos
sobre o tema Hanseníase, a saber:
Stefani MM, Martelli CM, Morais-Neto OL, Martelli P, Costa MB, de Andrade AL
1998. Assessment of anti-PGL-I as a prognostic marker of leprosy reaction. Int J
Lepr Other Mycobact Dis 66: 356-64.
Martelli CM, Stefani MM, Gomes MK, Rebello PF, Peninni S, Narahashi K, Maroccolo
AL, Costa MB, Silva SA, Sacchetim SC, Nery JA, Salles AM, Gillis TP,
Krahenbuhl JL, Andrade AL 2000. Single lesion paucibacillary leprosy: baseline
profile of the Brazilian Multicenter Cohort Study. Int J Lepr Other Mycobact
Dis 68: 247-57.
Guerra JG, Castro LCM, Stefani MM, Martelli CM, Penna GO 2002. Erythema
Nodosum Leprosum: clinical and therapeutic up-date. An. bras Dermatol 77:
389-407.
Guerra JG, Penna GO, Castro LC, Martelli CM, Stefani MM, Costa MB 2004.
Erythema nodosum leprosum case series report: clinical profile, immunological
basis and treatment implemented in health services. Rev Soc Bras Med Trop 37:
384-90.
Sousa AL, Stefani MM, Pereira GA, Costa MB, Rebello PF, Gomes MK, Narahashi K,
Gillis TP, Krahenbuhl JL, Martelli CM 2007. Mycobacterium leprae DNA
associated with type 1 reactions in single lesion paucibacillary leprosy treated
with single dose rifampin, ofloxacin, and minocycline. Am J Trop Med Hyg 77:
829-33.
Stefani MM, Guerra JG, Sousa AL, Costa MB, Oliveira ML, Martelli CT, Scollard DM
2009. Potential plasma markers of Type 1 and Type 2 leprosy reactions: a
preliminary report. BMC Infect Dis 9: 75.
Sgambatti S, Andrade JG, Sousa ALS, Stefani MMA, Costa MB, Andrade ALSS.
12010. An unusual presentation of leprosy at diagnosis: erythema multiformelike type 2 reaction. Revista de Patologia Tropical Vol. 39 (3): 221-227. Jul.-set.
Sampaio LH, Sousa AL, Barcelos MC, Reed SG, Stefani MM, Duthie MS 2011.
Evaluation of various cytokines elicited during antigen-specific recall as
xxi
potential risk indicators for the differential development of leprosy. Eur J Clin
Microbiol Infect Dis 31: 1443-51.
Sousa AL, Fava VM, Sampaio LH, Martelli CM, Costa MB, Mira MT, Stefani MM
2012. Genetic and immunological evidence implicates interleukin 6 as a
susceptibility gene for leprosy type 2 reaction. J Infect Dis 205: 1417-24.
Hungria EM, de Oliveira RM, de Souza AL, Costa MB, de Souza VN, Silva EA,
Moreno FR, Nogueira ME, Costa MR, Silva SM, Bührer-Sékula S, Reed SG,
Duthie MS, Stefani MM 2012. Seroreactivity to new Mycobacterium leprae
protein antigens in different leprosy-endemic regions in Brazil. Memo Inst
Oswaldo Cruz 107 Suppl 1: 104-11.
Stefani MM, Grassi AB, Sampaio LH, Sousa ALOM, Costa MB, Scheelbeek P,
Neupane K D, Hagge DA, Macdonald M, Cho S, Oskam L, Bührer-Sékula S
2012. Comparison of two rapid tests for anti-phenolic glycolipid-I serology in
Brazil and Nepal. Mem Inst Oswaldo Cruz 107 Suppl 1: 124-131.
Oliveira R, Hungria E, Freitas A, Sousa A, Costa M, Reed S, Duthie M, Stefani MM.
Antigen associations for the diagnosis of paucibacillary leprosy. Abstract
Submission for the International Leprosy Congress/ILC Brussels/2013 –
Immunology - ILC2013-2122.
Hungria E, Freitas A, Oliveira R, Cardoso L, Mizoguti D, Costa M, Sousa A, Reed S,
Duthie M, Stefani MM. Serologic profile to lid-1 and PGL-I during leprosy
reactions. Abstract Submission for the International Leprosy Congress/ILC
Brussels/2013 ILC 2013 – Immunology - ILC2013-2137.
Freitas A, Oliveira R, Hungria E, Cardoso L, Costa M, Sousa A, Reed S, Duthie M,
Stefani MM. Differential diagnosis of multibacillary leprosy and other
dermatoses: potential application of serology. Abstract Submission for the
International Leprosy Congress/ILC Brussels/2013 ILC 2013 – Immunology ILC2013-2140.
Freitas A, Oliveira R, Hungria E, Cardoso L, Costa M, Sousa A, Reed S, Duthie M,
Stefani MM. The impact of multidrug therapy on cell mediated and humoral
immune responses to mycobacterium leprae protein antigens. Abstract
Submission for the International Leprosy Congress/ILC Brussels/2013 ILC
2013 – Immunology - ILC2013-2142.
Com este retrospecto de minha vida acadêmica, pesquisando sobre Hanseníase,
nada mais justo que minha tese de doutorado fosse sobre o tema.
xxii
RESUMO
Titulo: Estudo in situ da heterogeneidade de mastócitos e células T reguladoras em
pacientes com hanseníase, com e sem episódios reacionais.
Resumo
A hanseníase é uma complexa doença dermato-neurológica, crônica, de causa infecciosa
que afeta a pele e os nervos periféricos, especialmente durante os episódios imunoinflamatórios agudos conhecidos com reações tipo 1/RT1 e tipo 2/RT2. Não existe
modelo experimental para hanseníase e as lesões de pele têm sido extensivamente
usadas para desvendar os multifacetados mecanismos imunopatológicos associados com
a doença. Este estudo investigou a expressão in situ de duas distintas populações
celulares que apresentam importante papel imunorregulatório: células Treg (Treg) e
mastócitos (MC) em pele normal e diversas doenças cutâneas com ênfase nas reações
hansênicas RT1 e RT2. Para o estudo de Tregs foram utilizadas 154 biópsias cutâneas de
114 participantes de três grupos: 1. Hanseníase (n=74), 56 RT1 (28-biópsias pareadas
do mesmo paciente sem reação/durante reação, 28 biópsias únicas de RT1), 18 RT2 (12
biópsias pareadas sem reação/durante reação, 6 biópsias únicas de RT2); 2. Dermatoses:
(n=29) doenças cutâneas não infecciosas e infecciosas. Controles Normais: fragmentos
de peles obtidos de mamoplastias eletivas em mulheres saudáveis. Imunomarcação
dupla CD25+Foxp3 +de células Treg foi realizada em plataforma automatizada.
Quantificação das células Treg duplo positivas foram feitas sem conhecimento da
condição clínica do paciente (valores expressos em mm2). Para o estudo dos MC 80
biópsias de 3 grupos foram investigadas: 40 pacientes com hanseníase recém
diagnosticados não tratados (18 sem reação, 11 RT1, 11 RT2), 29 pacientes com outras
dermatoses e 11 biópsias de pele normal. Quantificação de MC intactos e desgranulados
corados por azul de toluidina/mm2; imunomarcação streptavidina-biotina-peroxidase foi
empregada para detectar MC triptase/try+ e chimase/chy+ e a densidade ótica (mediana
da densidade ótica) foi avaliada. Resultados: Estudo das Tregs: Nenhuma célula Treg
CD25 +Foxp3 + foi identificada em nenhuma das 11 amostras de pele normal, enquanto
um número variável de Tregs foi identificado nas diversas doenças cutâneas (p<0.0001);
o número de células Treg duplo positivas foi maior nas doenças infecciosas comparado
com as não-infecciosas (p=0.008). Medianas de Treg entre hanseníase e outras doenças
infecciosas foram semelhantes (p=0.157). Quantificação de Tregs em lesões reacionais
foram maiores do que as sem reação (p<0.02). Nas biópsias pareadas de lesões de
xxiii
RT1/sem reação ou RT2/sem reação, números maiores de Treg foram vistos durante a
RT1 quando comparados com a não reacional do mesmo paciente (p< 0.001). Mediana
de Treg em RT1 desenvolvidas durante MDT foi ligeiramente superior comparada a RT1
desenvolvida em pacientes sem de tratamento (p=0.047). Observou-se uma tendência de
aumento no número das T regs do polo tuberculoide em direção ao lepromatoso, mais
especificamente até a forma borderline-lepromatosa que apresentou a maior mediana da
quantificação de Treg, entretanto esta diferença não foi estatisticamente significativa
(p>0.8). Estudo dos Mastócitos: lesões cutâneas de origem infecciosa e não infecciosa
mostraram números aumentados de mastócitos desgranulados do que intactos tanto na
hanseníase como nas outras dermatoses quando comparados com pele normal. Os
números de mastócitos (MC) desgranulados foram maiores do que intactos,
independente da forma de hanseníase (do polo tuberculoide/TT ao lepromatoso/LL),
independente da ocorrência de reações hansênicas (lesão reacional/sem reação) e
independente do tipo de reação (RT1/RT2). Número e densidade de mastócito triptase
positivo (MC try+) estão aumentados em relação aos quimase positivo (MC chy+) na
hanseníase, em pacientes com e sem reação, particularmente na RT2, mas não nas
outras dermatoses. Conclusões: aumento nas Treg detectados durante RT1 sugerem
papel supressor dessas células em eventos associados à resposta imune celular
exacerbada, responsáveis pela RT1. Expressão diferencial das subpopulações de MC
try+ e chy+ foi observada na hanseníase em relação a outras doenças cutâneas e pele
normal. Entretanto, nem a forma da hanseníase, nem a ocorrência de reação hansênica,
estava associada a mudanças nas subpopulações de MC nas lesões sugerindo que o
processo infeccioso pelo Mycobacterium leprae per se direciona a expressão de MC nas
lesões cutâneas da hanseníase.
Palavras chaves: células Treg, mastócitos, triptase, quimase, hanseníase, dermatose.
xxiv
ABSTRACT
Title: In situ study of the heterogeneity of mast cells and regulatory T cells in
patients with leprosy, with and without reactional episodes.
Abstract
Leprosy is a complex, chronic, infectious dermato-neurological disease that affects the
skin and peripheral nerves especially during acute immune-inflammatory episodes
known as type 1/T1R and type 2/T2R reactions. There is no experimental model for
leprosy and leprosy skin lesions have been extensively used to unravel its multifaceted
immunopathological mechanisms.This study investigated in situ expression of two
distinct cell populations with important immunoregulatory roles: T regulatory (Treg)
cells and mast cells (MC) in diverse skin diseases with emphasis on leprosy T1R and
T2R. For the Treg cell study, 154 skin biopsies from 114 participants belonging to 3
groups were investigated: 1. Leprosy (n=74), 56 T1R (28-paired biopsies reactionfree/reactional from the same patient, 28 single reactional biopsy), 18 T2R (12 pairedreaction-free/reactional lesions, 6 single reactional biopsy); 2. Dermatoses: (n=29) noninfectious and cutaneous infectious diseases; 3. Normal controls: skin fragment of
mammoplasty
from
healthy
females
that
had
cosmetic
surgery.
Double
immunohistochemical detection of Treg cells was performed with automated platform
for CD25 and Foxp3 staining. Quantifications of double immunostained Treg cells was
performed (values expressed by mm2) blinded to the participants’ clinical status. For
the mast cell study 80 skin biopsies from 3 groups were investigated: 40 newly
diagnosed untreated leprosy patients (18 reaction-free, 11 T1R, 11 T2R), 29 patients
with other dermatoses (the same as for T reg study) and 11 normal skins. Toluidine blue
stained intact and degranulated MC counts/mm2; streptavidin-biotin-peroxidase
immunostaining was used to detect tryptase/try+ and chymase/chy+ MCs and their
density (median optical density) was evaluated. Results: Treg study: Not one
CD25 +Foxp3 +Treg cell was seen in any of the 11 normal skin sections while variable
numbers were detected in skin diseases (p<0.0001); the number of double stained cells
was higher in infectious compared to non-infectious diseases (p=0.008). Treg cell
numbers were comparable between leprosy and other infectious dermatoses (p=0.157)
Treg cell counts in reactional lesions were higher than in reaction-free leprosy lesions
(p<0.002). Paired biopsies of T1R or T2R reactional/reaction-free lesions showed
xxv
increased numbers of Treg during T1R compared to reaction-free lesions from the same
patient (p< 0.001). Treg cell median in T1R developed during MDT was slightly higher
compared to T1R developed at diagnosis in naïve patients (p=0.047). There was a trend
in increasing Treg cell numbers from the tuberculoid to borderline-lepromatous form,
which showed the highest median value of T regs, however this difference was not
significant (p>0.8). Mast cell study: Infectious and non-infectious skin lesions showed
higher numbers of degranulated than intact MC both for leprosy and other dermatoses,
compared to normal skin. The numbers of degranulated MC were higher than intact MC
regardless of the leprosy form (from tuberculoid/TT to lepromatous/LL), regardless of
the occurrence of leprosy reactions (reactional and reaction-free) and regardless of the
type of reaction (T1R/T2R). Try+ MC numbers and density were higher than chy+ MC
in leprosy, in reaction-free and reactional lesions, particularly in T2R, but not in other
dermatoses.
Conclusions: Higher Treg numbers seen in T1R suggest Treg role in suppressing the
exacerbated cell-mediated phenomenon that causes T1R. Differential expression/ of
try+ and chy+ MC subsets was seen in leprosy compared to other skin diseases and to
normal skin. However, neither leprosy form nor leprosy reaction was associated with
MC changes in lesions suggesting that the Mycobacterium leprae infectious process per
se dictates MC expression in leprosy skin lesions.
Key words: treg, mast cell, tryptase, chymase, leprosy, skin diseases.
xxvi
ORGANIZAÇÃO DA TESE
Esta tese de doutorado está apresentada de conformidade com a NORMA –
CPGMTSP No. 04/2009, sendo composta por uma introdução, contendo uma
abordagem geral acerca da hanseníase, desde a epidemiologia, aspectos clínicos, meios
de diagnóstico, moleculares, imunológicos, genéticos, diagnósticos diferenciais, reações
e tratamento. Conforme a norma supracitada, a colocação dos métodos é opcional, e não
foram colocados por ser redundante, e já estarem no contexto dos artigos.
Além da introdução, esta tese inclui dois artigos científicos, ambos em fase de
submissão para publicação.
O artigo 1 se refere às células T regulatórias (Treg): “In situ expression of
CD25+ Foxp3+ Regulatory T Cells in human skin diseases: leprosy and leprosy
reactions”, realizado em colaboração com o Hospital A. C. Carmargo, Departamento de
Patologia, chefiado pelo Prof. Dr. Fernando Augusto Soares.
O artigo 2 se refere aos Mastócitos: “Mast cell heterogenity in human
dermatoses: in situ tryptase and chymase positive cells with emphasis on leprosy and
leprosy reactions”, realizado em colaboração com o IBILCE, Departamento de
Biologia, Laboratório de Imunomorfologia, coordenado pela Profa. Sônia Maria Oliani,
UNESP – São José do Rio Preto – São Paulo.
xxvii
1. INTRODUÇÃO
1.1- Conceito
A hanseníase é uma doença infecciosa, granulomatosa, de evolução crônica,
causada pelo Mycobacterium leprae (M. leprae), descrito por Gerhard Amauer Hansen
em 1873, dermato-neurológica, complexa, comprometendo principalmente pele e
nervos periféricos, podendo levar a incapacidades físicas. Entretanto pode acometer
qualquer órgão do corpo humano, como: testículos, fígado, ossos, etc. Apesar da
evolução crônica pode apresentar surtos de agudizações, denominados episódios
reacionais ou reações tipo 1 (RT1) e tipo 2 (RT2) (Modlin 1987, Talhari et al. 1997,
revisado por Jacobson & Krahenbuhl 1999, Britton & Lockwood 2004, revisado por
Scollard et al. 2006, Walker& Lockwood 2006). É uma das primeiras constatações de
uma doença microbiana do homem (WHO 1988a). A Organização Mundial da Saúde
(OMS/WHO) inclui a hanseníase entre as 17 doenças tropicais negligenciadas (WHO
2012a).
1.2- Agente etiológico, infecção e doença.
O M. leprae é uma bactéria intracelular obrigatória, não cultivável em meios de
culturas axênicos, que tem tropismo para macrófagos da pele e células de Schwann dos
nervos periféricos (Ridley 1955, Jopling 1978, WHO 1988a, Scollard et al. 2006). A
taxa de replicação do M. leprae é extremamente lenta, quando comparada a de outras
bactérias, apresentando ciclo replicativo de, em média, 12,5 dias (Ridley 1955, Jopling
1978, Jacobson & Krahenbuhl 1999). O M. leprae é um bastonete reto, corado em
vermelho pela fucsina e que não é descorado na passagem em álcool e ácidos orgânicos,
ou seja, é um bacilo ácido álcool resistente (BAAR). Nos esfregaços de raspado
intradérmico (linfa) e nos cortes histopatológicos os bacilos podem ser vistos
isoladamente ou em agrupamentos de tamanhos variados (Ridley 1955, Jopling 1983),
referidos como globias.
Em 2008, foi descrita uma nova bactéria imputada na etiologia da hanseníase, o
Mycobacterium lepromatosis sp nov. Os autores descreveram esta nova espécie
baseados em diferenças genéticas significativas com oM leprae, incluindo uma
divergência de 2,1% do gene 16S RNA ribossomal (rRNA), um marcador altamente
conservado da evolução. Análise filogenética dos genes 16S rRNA, rpoB e hsp65
indicou que os organismos são relacionados e evoluíram de um ancestral comum que
1
tinha ramificado de outras micobactérias. Estes resultados e as características únicas
clinicopatológicas da Hanseníase Lepromatosa Difusa (Hanseníase bonita, Lepra de
Lúcio e Latapi) levaram-os a propor esta nova espécie, que pode contabilizar algumas
das variabilidades clínicas e geográficas da hanseníase. Esta descoberta pode ter
implicações para a pesquisa e o diagnóstico da hanseníase (Han et al. 2008).
O M. leprae e o Mycobacterium tuberculosis (MT) surgiram de um ancestral
comum há 36 milhões de anos atrás (Cole et al. 2001, Djelouadji et al. 2011). O
Mycobacterium tuberculosis foi descrito em 1883 por Robert Koch e foi a primeira
micobactéria a ter seu genoma seqüenciado (Cole et al. 1998), enquanto o M. leprae foi
sequenciado a seguir (Cole et al. 2001). Comparando o M. leprae com o MT, o
sequenciamento completo do genoma do M. leprae revelou uma extensa redução
evolutiva em comparação ao genoma do M. tuberculosis, o que significa redução do
número de genes, grande número de pseudogenes e redução do número de proteínas
produzidas pelo primeiro. Esse processo evolutivo redutivo pode ter tornado o M.
leprae um microrganismo extremamente fastidioso, com longo período de duplicação e
impossibilitando seu cultivo in vitro (Cole et al. 2001, revisado por Vissa & Brennan
2001).
Apesar do M. leprae ter sido o primeiro patógeno humano a ser descrito no final
do século XIX, os mecanismos de transmissão ainda não estão totalmente estabelecidos.
Acredita-se que o trato respiratório seja a principal porta de entrada e fonte de
transmissão do M. leprae, já que um grande número de bacilos é eliminado pelas vias
aerodigestivas de pacientes com formas bacilíferas não tratadas (Ridley 1955, Jopling
1978; Jacobson & Krahenbuhl 1999, revisado por Walker & Lockwood 2007). Outras
possíveis fontes de transmissão do bacilo são hansenomas ulcerados, urina, fezes, suor,
leite materno, secreções vaginais e esperma (Jopling 1978, Job et al. 1989, Fine et al.
1997), e, mais recentemente, a possibilidade de ser uma doença zoonótica, tendo o tatú
como uma possível fonte de infecção para o homem (Truman et al. 2011).
Acredita-se que o período de incubação da doença pode variar de 2 até 10 anos e
que a maioria das pessoas expostas não é susceptível à infecção, ou seja, há uma
resistência natural na ordem de 95% dos indivíduos (Jopling 1978). Populações de
diferentes etnias, morando na mesma área endêmica, exibem taxas de prevalência
diferentes (WHO 1988a, Fine et al. 1997). Entretanto, a hiperpopulação doméstica e
fatores genéticos do hospedeiro parecem predispor a infecção e ao desenvolvimento da
2
doença (Jopling 1978, WHO 1988a, Schurr et al. 1991, Jacobson & Krahenbuhl 1999,
Fine et al. 1997, Mira et al. 2004, Goulart et al. 2008, Pereira et al. 2009, Bazin-Furini
et al. 2011). A maioria das pessoas que vivem em áreas endêmicas para a hanseníase já
esteve exposta ao M. leprae, mas, apenas cerca de 0,1-1,0% desenvolve a doença
(Ridley 1955, Fine et al. 1997, Moraes et al. 2006, revisado por Pereira et al 2009).
Contatos domiciliares de pacientes com formas bacilíferas de hanseníase apresentam
risco aumentado para o adoecimento. Estima-se que contatos intradomiciliares de
pacientes com baciloscopia positiva apresentem 4 a 10 vezes mais risco de adoecer que
outros indivíduos de uma população endêmica (Ridley 1955, WHO 1988a, Fine et al.
1997, Jacobson & Krahenbuhl 1999, Goulart et al. 2008). Evidências apontam para a
ocorrência de transmissão da doença entre domiciliares, inclusive na fase présintomática (Fine et al. 1997).
Após um período de incubação variável, os indivíduos susceptíveis que foram
infectados podem desenvolver a doença. Esta é bastante pleomórfica, com diferentes
formas clínicas, que serão categorizadas a seguir, sendo as lesões predominantemente
de pele e de nervos periféricos, mas a doença pode acometer também órgãos internos,
tais como: fígado, testículos, olhos, etc (Jopling 1978, Neves & Talhari 1997, Scollard
et al. 2006). A evolução é habitualmente crônica, mas pode manifestar-se com episódios
agudos denominados de reações ou formas reacionais.
1.3- Aspectos históricos
A Hanseníase é tida como uma das doenças mais antigas da humanidade, com
muitas citações, mas sem registros precisos e commuitos pontos obscuros, sendo difícil
uma abordagem precisa do tema. Segundo relatos, era também confundida com várias
outras doenças de pele, muitas das quais descritas sob a mesma denominação de “lepra
ou morféia” (revisado por Andrade 1996, revisado por Eidt 2004). A relação do
cristianismo com os hansenianos está ligada à vida de Jesus. No Novo Testamento
(Mateus 8,1-14; Marcos 1,40-45; Lucas 5,12-16; Lucas 17,11-19) encontram-se relatos
sobre a dedicação de Jesus aos hansenianos por meio dos milagres da cura destes
doentes. Com as palavras: “Os cegos veem e os coxos andam, os leprosos ficam limpos
e os surdos ouvem, os mortos ressuscitam e os pobres são evangelizados” (Mateus 11,56), Cristo quer expressar, além do objetivo da sua missão, a sua piedade e compaixão
principalmente para com os doentes e marginalizados, e ambas são características dos
hansenianos (Cunha 1997).
3
Na Europa, a Hanseníase alcançou seu ponto máximo de disseminação e
contaminação entre os séculos XI e XV, com o pico no século XIII e XIV. Nas
Américas e Brasil a doença foi trazida pelos europeus e africanos, já que a doença não
existia entre os indígenas. Em 1897, foi realizada a “Conferência sobre a Lepra”, que
aconteceu em Berlim. Nesta foram apresentadas as novas descobertas dos cientistas e
médicos, como Danielsen, que, em 1847, identificou as formas tuberculosa e anestésica
da Hanseníase; Virchow, em 1860 identificou a forma “L” da doença e sua
contagiosidade e, ainda Hansen, que em 1873 isolou o bacilo e descobriu a forma de
transmissão da doença (revisado por Cunha 1997, revisado por Eidt 2004, Lyon & Lyon
2013).
Estudo sobre a diversidade genética e a filogeografia do M. leprae sugere que
este bacilo começou a infectar os seres humanos há cerca de 5.000 anos na atual Etiópia
(Monot et al. 2009). Apenas quatro padrões de polimorfismo de nucleotídeos simples
(“Single-nucleotide Polymorphism”, SNP) foram encontrados em todo o globo. O tipo 1
está presente na maior parte da Ásia Central e leste da África. O tipo 2 foi encontrado na
Etiópia, Malawi, Nepal e norte da Índia. O tipo 3 foi encontrado na Europa, norte da
África e Américas e o tipo 4 apenas no oeste da África. O trabalho de Monot lançou a
hipótese de que os soldados de Alexandre, o Grande (século IV a.C.) foram os
prováveis responsáveis pela disseminação do M. leprae pela Ásia e Europa, e que a
colonização e tráfico de escravos foram os responsáveis pela vinda do M. leprae para as
Américas. O fato da bactéria ser extremamente lenta em sua duplicação, talvez explique
a baixíssima quantidade de cepas diferentes em todo o mundo (Monot et al. 2005).
Ácido desoxirribonucléico (DNA) do M. leprae foi detectado e amplificado pela reação
em cadeia da polymerase (PCR - polymerase chain reaction) utilizando-se primers
específicos, em restos de ossos do crânio de um esqueleto encontrado em um cemitério
da Escócia, em caso de hanseníase virchowiana, do século 13–14, Orkney - Escócia
(Taylor et al. 2000).
A Hanseníase era endêmica na Europa até a idade média e sequências de DNA
do M. leprae foram amplificadas de esqueletos de cinco casos de hanseníase medieval
do Reino Unido, Suécia e Dinamarca. Em um caso, o DNA foi tão bem preservado que
a montagem do genoma bacteriano antigo poderia ser alcançada por meio de
sequenciamento. Estas sequências antigas do M. leprae, comparadas com as de 11
variedades modernas, representam diversos genótipos e origens geográficas. As
comparações revelaram notável conservação genômica durante os últimos 1.000 anos,
4
uma origem européia para hanseníase nas Américas, e a presença do genótipo M.
leprae, na Europa medieval, agora comumente associado com o Médio Oriente. A
preservação excepcional de biomarcadores de M. leprae, ácidos micólicos tanto de
DNA, em esqueletos antigos tem implicações importantes para a palaeomicrobiologia e
evolução do patógeno humano (Schuenemann et al. 2013).
Alguns dados da história da doença no Brasil merecem ser lembrados. Nos três
primeiros séculos da nossa história, poucos médicos aqui se estabeleceram, muitos
vinham de Portugal ficavam temporadas depois retornavam. Em 1740, ano em que
aconteceu no Rio de Janeiro a 1ª Conferência Médica sobre a Hanseníase no Brasil, cujo
objetivo era indicar e uniformizar otratamento a ser dispensado aos hansenianos, o
número de doentes nesta capital era estimado em 400 e a doença existia oficialmente
desde o ano de 1600. Em 1741, é fundado o primeiro lazareto, hospital especializado em
tratar os hansenianos, que proliferaram com o crescente número de casosexistentes. Em
Goiás foi construído o primeiro “preventório”, local destinado a abrigar os filhos de
hansenianos (revisado por Cunha 1997, Lyon & Lyon 2013).
O Brasil teve e tem pesquisadores atuando nesta área há muitos anos, muitos
destes com destaque no cenário mundial. A classificação internacional vigente de
“formas” ou “grupos” da hanseníase é a redação final da antiga “classificação
sulamericana”, nascida no Brasil (Michalany & Michalany 1988). A doença passou a
ser de notificação obrigatória em 1904, quando foi também instituída a criação dos
leprosários. Em 1920, foi instituído o isolamento compulsório para os doentes, sendo
este abolido em 1962 (Eidt 2004, revisado em Lyon & Lyon 2013). O nome Hanseníase
em substituição a “lepra” foi sugerido, em 1967, por Abrahão Rotberg, dermatologista
brasileiro (Michalany & Michalany 1988). Em 1976, um decreto substitui o termo
“lepra” por hanseníase, sendo que em 1995, outro decreto de lei federal proibiu a
utilização do termo “lepra”. Em 1941, começa a terapia da doença com a sulfona, sendo
que a multidrogaterapia (MDT ou poliquimioterapia/PQT, conforme portaria do
Brasil/Ministério Saúde 2010a) foi iniciada na década de 1980, por recomendação da
OMS (Eidt 2004, revisado em Lyon &Lyon 2013).
No cenário mundial a OMS, a partir de 1982, patrocinou os principais eventos,
fases ou períodos, assim distribuídos:
1- de 1982 a 1985 – introdução de MDT em uma base global.
2- de 1986 a 1990 – expansão de MDT em áreas "menos difícil".
5
3- de 1991 a 1999 – estratégia de eliminação da hanseníase como problema de
saúde pública, definida como uma prevalência de menos de um caso para cada 10.000
habitantes, meta que deveria ser atingida no ano 2000 (WHO 1991).
4- a partir de 2000 – um quarto período, planejado para os últimos 6 anos,
designados para a "estratégia de eliminação intensiva" ou o "empurrão final" (WHO
2004).
Hoje, na era pós-MDT e genômica a doença ainda permanece intrigante e com
muitas perguntas ainda para serem respondidas, e apesar de todas as mediadas
terapêuticas, educacionais e preventivas a incidência, não tem diminuído (Rodrigues &
Lockwod 2011).
1.4- Dados epidemiológicos – retrospectiva e atualidade
É difícil fazer uma estimativa do número totalde casos de hanseníase no mundo,
pois os diagnósticos e suas definições de casos nem sempre são claros ou consistentes.
Em 1966 o relatório da OMS aponta para os números da tabela 1 mostrada abaixo
(Bechelli & Martinez Dominguez 1966).
Tabela 1. Casos registrados e estimados de hanseníase no mundo em 1966. Fonte:
Bechelli & Martinez Dominguez 1966. Bull World Health Organ (WHO).
A WHO estimou para 1966, 1976 e 1985, 10,8, 10,6 e 12,0 milhões de casos de
hanseníase, respectivamente. Nas décadas de 60, 70 e 80, o número de casos registrados
sofreu aumento constante, conforme mostra a tabela 2. A introdução da
6
multidrogaterapia reduziu em mais de 80% a prevalência global de hanseníase. (WHO
1988a, WHO 1988b).
Ano
Casos registrados
Aumento no período
Prevalência/10.000
habitantes
1966
2.831.775
1976
3.599.949
1985
5.368.202
1987
5.609.283
8,40
89,6%
49,1%
8,80
12,0
Tabela 2. Casos de Hanseníase no período de 1966 a 1987. Fonte: WHO 1988a. “A
guide to leprosy control”.
Em 1985, o número estimado de casos de hanseníase no mundo era de 12
milhões de pessoas, correspondendo a uma prevalência estimada de 19 casos para
10.000 habitantes. A implementação da MDT começou gradualmente, de forma piloto,
durante o período 1982–1985, com cobertura estimada inferior a 1%. Posteriormente foi
implementada em muitos países endêmicos e a cobertura geográfica começou a
aumentar significativamente, atingindo quase 50% no final de 1992 e 100% dos casos
registrados em 1997, tabela 3 (WHO 2004).
7
Tabela 3. Casos registrados de hanseníase, casos novos e cobertura pela MDT. Fonte:
WHO 2004. Multidrug therapy against leprosy. Development and implementation over
the past 25 years.
O boletim de Registro Epidemiológico Semanal da WHO (OMS) informou, que
a prevalência global de hanseníase registrada no ano de 2012, em 115 países, foi de
189.018 casos, com 232.857 novos casos detectados. Esses dados mostram que a meta
de prevalência global de menos de 1 caso de hanseníase para cada 10.000 habitantes foi
atingida, ou seja, a prevalência global foi de 0,33 casos por 10.000 habitantes.Apesar da
drástica redução no número de casos registrados nas últimas duas décadas, a incidência
da doença tem caído lentamente. O número de casos novos detectados mostra uma
incidência de 4,00 casos por 100.000 habitantes, ou seja, permanece alta (WHO 2013),
tabela 4. O declínio apresentado na prevalência de hanseníase, com a implementação da
MDT, não foi acompanhado de um declínio da incidência, detecção ou casos novos,
indicando que a prevalência é um parâmetro inadequado para se avaliar o controle da
infecção (Brasil/Ministério da Saúde/SVS 2009, SINAN/SVS/MS 2012).
8
Tabela 4. Casos registrados, prevalência e casos novos de hanseníase em 2012. Fonte:
WHO 2013. Global leprosy: update on the 2012 situation. Wkly Epidemiol Rec 35.
No Brasil, a doença esteve presente desde a época colonial, trazida pelos
europeus e africanos, e foi aumentando paulatinamente até tornar-se endêmica. Além
disso, o levantamento de casos feito no Hospital dos Lázaros do Rio de Janeiro, no
período de 12 de setembro de 1798 a 27 de janeiro de 1872, demonstrou que um grande
número de pacientes hansenianos era de origemafricana: num total de 2.170 assentados,
sendo que 751 eram escravos negros africanos procedentes de Moçambique, Congo,
Cabinda, Manguella, Angola e outros. Entre 1923 e 1936, foi realizado o primeiro senso
de doentes de hanseníase no Brasil, por Sousa-Araújo, totalizando 48.840 doentes
distribuídos por todos os estados da federação (revisado por Cunha 1997). Em 1966, o
relatório da OMS aponta para o Brasil 104.398 casos registrados (Bechelli & Martinez
Dominguez 1966).
No período de 1980-1983, na era pré-MDT, o Brasil mostrava uma tendência de
crescimento da endemia, com 70% dos casos registrados nos 12 países da América
Central e do Sul de maior prevalência da hanseníase, bem como, tinha 80% dos casos
novos registrados nestes países (Lombardi 1989). Tabela 5.
9
Tabela 5. Casos de hanseníase no Brasil antes da implementação da MDT. Fonte:
Lombardi 1989. Evaluation of leprosy epidemiology in 12 countries of the Americas.
Bull Pan Am Health Organ.
Após a assinatura do Compromisso para a Eliminação da Hanseníase em 1991,
no Brasil houve uma redução de 60% na prevalência, em decorrência das altas por cura,
no entanto, houve um aumento na detecção de casos novos (Brasil/Ministério da
Saúde/SVS 2009). O Brasil é o segundo país em todo o mundo em número absoluto de
casos, ficando atrás apenas da Índia, e há estados com baixa, média, alta, muita alta
endemicidade e hiperendêmico. É considerado hiperendêmico quando a detecção é ≥ 40
casos/100.000 habitantes, de muito alta endemicidade entre 20 e 39,99 casos/100.000
habitantes, alta endemicidade entre 10 e 19,99 casos/100.000 habitantes, média de 2 a
9,99 casos/100.000 habitantes e baixa quando há menos de 2 casos/100.000 habitantes
(SINAN/SVS/MS 2012). Tabela 6.
Tabela 6. Hanseníase – coeficientes de prevalência e detecção por região em menores e
maiores de 15 anos no Brasil 2011. Fonte: SINAN/SVS/MS 2012.
10
O Brasil está entre os 16 países, que entre 2001 e 2009 tiveram um número de
casos novos maior do que 1.000, ocupando hoje o segundo lugar no mundo em número
de casos novos, sendo sobrepujado apenas pela Índia (WHO 2012b). Em 2012, o Brasil
registrou um total de 33.303 casos novos, apresentando uma taxa de detecção de 17,17
casos/100.000 habitantes, portanto, um país com alta endemicidade, e a prevalência de
1,51 casos/10.000 habitantes (SINAN/SVS/MS 2012, WHO 2013). As figuras 1 a 3 e
tabelas 7 e 8 mostram uma série histórica, culminando com a atual (Tabela 8).
Figura 1. Hanseníase no Brasil - coeficiente de prevalência no período de 1990 a 2010.
Fonte: SINAN/SVS/MS 2012.
Figura 2. Hanseníase coeficiente de prevalência e detecção no período de 1990 a 2010.
Fonte: SINAN/SVS/MS 2012.
11
Figura 3. Hanseníase – coeficiente de detecção nas diferentes regiões do Brasil, no
período de 1990 a 2010. Fonte: SINAN/SVS/MS 2012.
Tabela 7. Hanseníase – indicadores epidemiológicos e operacionais – Brasil 2001 a
2012. Fonte: SINAN/SVS/MS 2012.
12
Tabela 8. Hanseníase – tendência de detecção em países com mais de 1000 casos em
2012. Fonte: WHO 2013.
No Estado de Goiás em 2012 foram registrados 2.205 casos novos, com
coeficiente de detecção muito alto, de 35,82 casos/100.000 habitantes, enquanto
aprevalência foi de 3,00 casos/10.000 habitantes, considerada média. O estado foia
sétima unidade federativa com maior incidência e prevalência em 2010/2011
(SINAN/SVS/MS 2012). Figuras 4 e 5.
Figura 4. Hanseníase – coeficiente de detecção geral de casos novosno Brasil e estados
em 2010. Fonte: SINAN/SVS/MS 2012.
13
Figura 5. Hanseníase – coeficientes de prevalência segundo UF - Brasil, em 2011.
Fonte: SINAN/SVS/MS 2012.
Em Goiânia, no ano de 2013, foram registrados 659 casos de hanseníase
(SINAN/SVS/MS 2013).
1.5- Manifestações clínicas da hanseníase – definição de caso
Hanseníase deve ser suspeitada em pessoas com qualquer um dos seguintes
sintomas ou sinais: manchas hipocrômicas ou avermelhadas na pele; perda ou
diminuição da sensibilidade nas manchas da pele; dormência ou formigamento das
mãos ou pés; fraqueza das mãos, pés ou pálpebras; nervos dolorosos ou sensíveis;
inchaço ou nódulos na face ou orelhas; feridas indolores ou queimaduras nas mãos ou
pés (WHO 2012c). Definição de caso de hanseníase: é uma pessoa com sinais cardinais
(clínicos) da doença e que ainda não tenha sido submetida ao tratamento específico ou
que requer tratamento quimioterápico. Os sinais cardinais são: diminuição da
sensibilidade em área ou lesão cutânea; espessamento neural periférico e/ou presença de
BAAR em pele, baciloscopia positiva (WHO 1988a, Brasil/Ministério da Saúde 2002,
Britton & Lockwood 2004, Brasil/Ministério da Saúde 2010). Nesta tese foi
considerado caso de hanseníase o paciente com sinais clínicos da doença, baciloscopia
positiva e/ou encontro no exame histopatológico de características da doença, conforme
os critérios de Ridley e Jopling (1966).
A hanseníase é uma doença espectral, cujas formas clínicas são determinadas
pela interação entre o agente e a resposta imunológica do paciente (Ridley & Jopling
14
1966, Modlin & Rea 1987, Jacobson & Krahenbuhl 1999, revisado por Walker &
Lockwood 2007). Figura 6.
Figura 6: espectro clínico e imunopatológico da hanseníase e reações. Fonte:
Leprosy. Walker SL, Lockwood DN 2007.
1.5.1- Manifestações cutâneas na hanseníase
A avaliação diagnóstica da hanseníase se baseia no exame dermato-neurológico,
mediante identificação de lesões de pele com alteração da sensibilidade térmica,
dolorosa e/ou tátil, geralmente ocorrendo nesta ordem. A sensibilidade nas lesões pode
estar diminuída (hipoestesia), ausente (anestesia) ou, em menor frequência, aumentada
(hiperestesia) (Ridley 1955, Neves &Talhari 1997, Britton & Lockwood 2004, revisado
por Scollard 2006, Sampaio & Rivitti 2011, Rodrigues Júnior & Gresta 2013).
As lesões cutâneas da hanseníase podem se manifestar como manchas, placas,
infiltração difusa, nódulos, tubérculos, alopecia, madarose, triquíase e lesões de mucosa
(Ridley & Jopling 1966, Brasil/Ministério da Saúde 2002, Lyon 2013). Os distúrbios
sensitivos nas lesões são devido às neurites, que podem ser causadas tanto pela ação do
bacilo nos nervos como pela reação do sistema imune ao bacilo (Ridley 1955, Neves
&Talhari 1997, Walker & Lockwood 2006, Sarubi & Shibuya 2013).
A manifestação inicial da hanseníase é geralmente a forma indeterminada, com
resposta imune do hospedeiro e manifestações clínicas indiferenciadas, não permitindo
15
a classificação clínica nem o prognóstico da doença. A hanseníase indeterminada (MHI)
geralmente se manifesta como uma lesão hipocrômica, com alteração de sensibilidade
(hipoestesia ou hiperestesia), podendo evoluir para cura espontânea ou para outras
formas clínicas da doença (Ridley & Jopling 1966, Guinto et al. 1986, Neves &Talhari
1997, revisado por Jacobson & Krahenbuhl 1999, Brasil/Ministério da Saúde 2002,
Sampaio & Rivitti 2011, Lyon 2013), não sendo incluída no espectro de Ridley e
Jopling por seu caráter incipiente e imunologicamente indeterminado (Ridley & Jopling
1966).
A Hanseníase Tuberculoide (MHT ou TT) apresenta lesões cutâneas eritematohipocrômicas, eritematosas, eritemato-escamosas, com bordos discretamente elevados
ou com microtubérculos, com alteração de sensibilidade, hipoestesia ou mesmo
anestesia. O centro da lesão pode estar aparentemente poupado, indene. As lesões
podem apresentar alopecia e/ou anidrose. As placas variam de forma, tamanho e
número, sendo que a forma clássica habitualmente não tem tendência à disseminação e
pode curar espontaneamente (Ridley & Jopling 1966, Guinto et al. 1986, Neves &
Talhari 1997, revisado por Jacobson & Krahenbuhl 1999, Brasil/Ministério da Saúde
2002, Sampaio & Rivitti 2011, Lyon 2013).
A Hanseníase Borderline (MHB ou BB, BT ou BL) exibe lesões eritematosas,
eritemato-violáceas, ferruginosas, infiltradas, edematosas, brilhantes, escamosas,
contornos internos bem definidos e externos mal definidos (lesões pré-foveolares ou
foveolares), centro deprimido, aparentemente poupado, hipocrômico ou com cor de pele
normal. Seu caráter instável faz-se assemelhar com as lesões bem delimitadas da TT ou
com as lesões disseminadas da Hanseníase Lepromatosa (LL) (Ridley & Jopling 1966,
Guinto et al. 1986, Neves & Talhari 1997, revisado por Jacobson & Krahenbuhl 1999,
Brasil/Ministério da Saúde 2002, Sampaio & Rivitti 2011, Lyon 2013).
A Hanseníase Lepromatosa (MHL ou LL) mostra pele com infiltração difusa,
numerosas lesões eritematosas, infiltradas, brilhantes, coalescentes, mal definidas e de
distribuição simétrica. Há infiltração difusa da face, regiões malares, supraciliares e
pavilhões auriculares, com formação de tubérculos e nódulos, perda de supercílios
(madarose), o que confere ao paciente aspecto peculiar, denominado facies leonina. Por
vezes mostra nódulos e tubérculos, poucos ou múltiplos, são semelhantes ao quelóide,
caracterizando a forma históide (Neves & Talhari 1997, revisado por Jacobson &
Krahenbuhl 1999, Brasil/Ministério da Saúde 2002, Brasil/Ministério da Saúde/SVS
16
2009, Sampaio & Rivitti 2011, Lyon 2013). São descritas duas variantes da forma LL, a
saber: a forma histoide, já referida acima, e a forma de Lúcio e Alvarado (hanseníase
difusa ou “lepra bonita”), que pode cursar com o fenômeno de Lúcio, uma forma
reacional, com vasculite trombótica, necrose tecidual e ulcerações (Ridley & Jopling
1966, Ridley & Jopling 1966, Guinto et al. 1986, Neves & Talhari 1997, Sampaio &
Rivitti 2011, Lyon-Moura & Pedrosa 2013).
A tabela 9 mostra um resumo das características das lesões cutâneas das formas
clínicas da hanseníase e a classificação operacional adotada na rede pública de saúde
(Brasil/Ministério da Saúde/SVS 2009, Brasil/Ministério da Saúde 2010a), sendo o
paciente diagnosticado e classificado pelo número de lesões, em paucibacilar (PB) e
multibacilar (MB), com até cinco lesões ou mais de cinco lesões, respectivamente.
Tabela 9. Hanseníase – formas clínicas, caracterização e classificação operacional.
Fonte: Brasil/Ministério da Saúde/SVS 2009.
1.5.2- Manifestações neurais na hanseníase
Os nervos são frequentemente acometidos na hanseníase, com neurites
(neuropatias periféricas), levando a perdas de sensibilidades (térmica, dolorosa e tátil) e
distúrbios motores, como paralisias, atrofias musculares, reabsorções ósseas e outras,
provocando sequelas e incapacidades físicas de graus variados (Facer et al. 2000, van
Brakel et al. 2008, Jadhav et al. 2011). Estas ocorrem em todas as formas da hanseníase
17
do espectro de Ridley e Jopling e ao diagnóstico da doença já acometem 25% dos
hansênicos. Algumas vezes o hansênico apresenta clinicamente apenas sinais de
comprometimento neural, sendo estas formas denominadas de neuríticas puras, variando
na literatura entre 1 a 16% dos pacientes, e que por vezes são assintomáticas, as neurites
silenciosas, sendo o diagnóstico estabelecido pela biópsia neural (Scollard 2008, Sarubi
& Shibuya 2013). Os nervos mais frequentemente acometidos são: o cubital (ulnar), o
mediano, o radial, o ciático poplíteo, o tibial posterior, o ramo zigomático do facial, o
trigêmeo e o auricular. Entre as incapacidades físicas mais frequentes estão a garra
cubital (por lesão do nervo cubital), a paralisia cúbito-mediana (por lesão do cubital e
mediano, com amiotrofia de músculos interósseos), a mão caída (por lesão do nervo
radial), úlceras em mãos e pés (mal perfurante plantar), a mão e o pé reacional,
diminuição da sensibilidade corneana (por lesão do ramo do trigêmeo) etc (Neves &
Talhari 1997, Sarubi & Shibuya 2013).
A neurite pode levar a perda de força muscular, com posterior paralisia, o que
pode originar incapacidades e deformidades, como articulações anquilosadas (sem
movimento) e em garras, ectrópio e lagoftalmo (eversão e desabamento da pálpebra
inferior) (Ridley & Jopling 1966, Neves & Talhari 1997, Sarubi & Shibuya 2013).
Outras deformidades também podem se originar de infecção secundária grave devido a
traumas em regiões sem sensibilidade, podendo causar necrose, que muitas vezes pode
levar a amputação da região ou a osteomielite com um processo de reabsorção das
extremidades ósseas, particularmente os dedos dos pés e mãos (Moonot et al. 2005,
Warren 1971).
O comprometimento dos nervos está ligado à resposta imune do hospedeiro, que
ao tentar defender o organismo do M. leprae agride também os componentes neurais. O
envolvimento neural é maior nas formas de maior resposta imune celular (RIC), ou seja,
no polo tuberculoide, onde os filetes nervosos podem ser completamente destruídos. No
polo lepromatoso este comprometimento é menor, geralmente com o infiltrado
inflamatório circundando a fibra neural, sem destruí-la (Talhari & Neves 1997, Sarubi
& Shibuya 2013).
As bases moleculares da neuropatia hansênica ainda não estão bem definidas.
Um estudo sobre esta, avaliando anticorpos anti-PGL-I, imunoglobulinas G e M antiLAM (IgG e IgM), anti-ceramida, anti- S100 e anti-fator de necrose tumoral alfa (TNFα), os autores mostraram que a lesão neural é uma dinâmica entre estes e os antígenos
do M. leprae, do nervo e de citocinas (Jadhav et al. 2011). Outro estudo demonstrou que
18
a base molecular do tropismo neural do M. leprae é imputada ao domínio G da cadeia
de laminina-α2 das células de Schwann (Rambukkana et al. 1997). Em outro estudo
Rambukkana demonstra as bases moleculares do dano neural, com o M. leprae
invadindo a célula de Schwann e levando a perda motora e sensorial e consequente
deformidades e incapacidades. A base molecular deste evento é que a célula de
Schwann possui lâmina basal, com moléculas de laminina-α2 com os domínios G e
complexos de distroglicans, onde o M. leprae se liga através do PGL-1 (Rambukkana
2001).
Em outro estudo, mais recente, focando na lecitina tipo C, CD209, expressa em
macrófagos e nas células de Schwann, foi observado que as células positivas se ligam
mais ao M. leprae que expressam CD209. Observou-se também que a IL-4 aumentou a
expressão de CD209 nas células de Schwann, com posterior ligação ao M. leprae. As
citocinas Th1 não induz a expressão de CD209 nas células de Schwann (Teles et al.
2010).
Mediadores dos mastócitos também podem estar envolvidos nestas neurites, por
exemplo, a triptase mastocitária, uma protease, liga a receptores de proteinase, agindo
diretamente sobre os neurônios sensitivos. Além disso, ATP liberado dos mastócitos
pode ativar os nervos sensoriais vizinhos e neuropeptídeos lançados de neurites, tais
como, o peptídeo relacionado com o gene de calcitonina (CGRP) e a substância P (SP),
ligam aos seus receptores nos mastócitos e podem estimular a degranulação (revisado
por Silver & Curley 2013).
Todos os estudos com base molecular poderão servir de base para futuras
terapias moleculares, minimizando assim o dano neural. As sequelas ou incapacidades
físicas relacionadas ao comprometimento neural podem ser evitadas ou minoradas com
o diagnóstico precoce e tratamento da hanseníase e da neurite, esta comum nas formas
reacionais (Neves & Talhari 1997, Walker & Lockwood 2007, Teles et al 2010).
1.5.3- Manifestações otorrinolaringológicas na hanseníase
As manifestações otorrinolaringológicas são mais frequentes nas formas MHB e
LL com ressecamento da mucosa e obstrução nasal, aumento das secreções, coriza
persistente, que inicialmente é mucosa, evoluindo para sanguinolenta ou epistaxe,
levando a infecção secundária, formação de crostas, com odor fétido, que tardiamente
leva a ulceração, destruição e perfuração do septo nasal. Como sequela ocorre o
19
desabamento do nariz, com aponta caindo e colapso do dorso nasal, conferindo ao
hansênico o nariz com aspecto de “tromba de elefante” ou “nariz de anta” e “nariz em
sela”, respectivamente. Ao final do processo instala-se a rinite atrófica, lenta e
irreversível. As secreções e tecidos nasais são ricos em BAAR e uma das principais vias
de contaminação de comunicantes ou contatos. Pode haver também comprometimento
da orofaringe, geralmente secundário ao comprometimento da mucosa nasal, palato
mole, úvula, laringe, sendo que antigamente o comprometimento desta, por vezes era
grave, provocando obstrução e morte do hansênico por asfixia. O comprometimento do
pavilhão auricular, com espessamento da borda livre ocorre em 80% dos casos BL e LL
(Neves & Talhari 1997, Walker & Lockwood 2007, Sampaio & Rivitti 2011, Lyon &
Oliveira 2013).
A boca também é comprometida em muitos casos de hanseníase e, na forma LL,
o comprometimento ocorre em 60% dos casos. Lesões aparecem em maior frequência
no palato mole, úvula e pilares de fauces, que vão desde eritema até ulcerações, levando
a cicatrizes com atrofias e deformidades. Nas formas reacionais, RT2, pode ocorrer
necrose de palato. A língua, dentes e tecidos periodontais também podem ser
acometidos. As alterações são pouco comuns nas formas paucibacilares, TT e BT
(Walker & Lockwood 2007, Sampaio & Rivitti 2011, revisado por Lyon 2013).
1.5.4- Manifestações oftalmológicas na hanseníase
As manifestações oftalmológicas na hanseníase são frequentes, variando de 47 a
90% o envolvimento ocular dos pacientes. Nos olhos, as partes mais comprometidas são
o aparelho lacrimal, pálpebra, córnea e úvea. Pacientes hansênicos BL e LL apresentam
diminuição da produção de lágrima, principalmente os que usam clofazimina. Esta
diminuição poderá levar a ressecamento da córnea com sensação de queimor. Paciente
com comprometimento da mucosa nasal poderá ter bloqueio do canal nasolacrimal,
provocando lacrimejamento e retenção da lácrima no saco lacrimal, o que poderá
ocasionar infecção bacteriana secundária, a dacriocistite. As pálpebras podem
apresentar problemas nos músculos que as movimentam, devido a uma fraqueza dos
mesmos, secundária à lesão neural, o que poderá levar ao fechamento inadequado das
pálpebras (lagoftalmo), eversão da pálpebra inferior (ectrópio) com consequente
ressecamento da córnea, o que poderá levar até a cegueira. A hanseníase é uma das
principais causas de cegueira no mundo, variando de 0,7 a 30% dos pacientes. As
20
alterações palpebrais podem estar associadas com alterações da sensibilidade da córnea,
com abolição do reflexo córneopalpebral, expondo o paciente a risco de trauma nos
olhos, devidoa abolição de reflexo de defesa, que nos protege de corpos estranhos. O
uso de corticoides, tão comum no tratamento das reações, poderá levar à catarata e
aumento da pressão intraocular (glaucoma) (Woods 1997, Wlaker & Lockwood 2007,
Sampaio & Rivitti 2011, Lyon & Lyon-Freire 2013).
Na córnea, o comprometimento dos ramos oftálmicos dos nervos trigêmeos leva
a uma hipoestesia, que com traumas leva a uma ceratite, inflamação da córnea,
denominada ceratite neurolítica, com proliferação de vasos e formação do “panos”,
tecido que provoca redução da visão e diminuição da sensibilidade da córnea (Woods
1997, Lyon & Lyon-Freire 2013).
A úvea, camada média e vascular do olho, é composta por 3 estruturas: íris,
corpo ciliar e coroide. Na hanseníase o comprometimento mais importante é o da íris,
que é a camada visível e que da cor ao olho, levando a inflamação da mesma, a irite
aguda ou crônica, isolada ou em conjunto com a inflamação do corpo ciliar, ou seja, a
iridociclite. Estas mostram sintomas variados, como lacrimejamento, ardor e
vermelhidão nos olhos, diminuição da visão, fotofobia (dificuldade para ver em
ambientes claros, aversão à luz), entre outros. A forma crônica pode ser silenciosa ou
assintomática, provocando atrofia progressiva da íris, o que leva a um fechamento da
pupila, com redução da entrada da luz, prejudicando a visão do paciente. (Woods 1997,
Lyon & Lyon-Freire 2013).
1.5.5- Manifestações Viscerais e/ou Sistêmicas da hanseníase
A hanseníase é doença sistêmica, envolvendo mais frequentemente pele e nervos
periféricos, mas pode comprometer qualquer órgão interno, como: aparelho respiratório,
digestivo, fígado, linfonodos (gânglios linfáticos), medula óssea, testículos, entre outros.
Este comprometimento é principalmente nas formas multibacilares (MB) do polo
lepromatoso (formas BL e LL) e mais intenso, com reação inflamatória sistêmica,
durante as reações tipo II. As alterações viscerais são mais lentas, por aparente
dificuldade de proliferação do BAAR e, consequentemente, pouco sintomáticas,
regredindo com o tratamento específico, exceto o comprometimento testicular e da
laringe. São mais evidentes o comprometimento da laringe com sintomas de rouquidão,
mas pode ser grave, com fibrose laríngea e levar a dificuldade de fonação e respiração.
Já o comprometimento testicular pode ser intenso, levando a atrofia total dos mesmos,
21
com consequente infertilidade, alterações hormonais secundárias com perda dolibido e
impotência sexual, e das características sexuais, como redução e distribuição dos pelos e
ginecomastia (Fleury 1997, Magnago 2013).
Outra manifestação sistêmica importante é a amiloidose secundária, com
produção de amiloide pelos macrófagos ativados durante a inflamação, depositando nos
rins e podendo levar a lesões, tipo glomerulonefrites, atrofia dos mesmos e morte por
insuficiência renal crônica. O comprometimento renal é mais comum nos surtos de RT2
(Woods 1997, Magnago 2013).
Comprometimentos menos importantes, muitas vezes assintomáticos, podem
ocorrer no fígado, baço, medula óssea, linfonodos e outros, com a presença de
granulomas, mas sem repercussões clínicas. A suprarrenal pode ser acometida em até
um terço dos pacientes, com depósitos de amiloide, podendo levar a disfunções no eixo
hipotálamo-hipófise-adrenal e consequente distúrbios endócrinos (Magnago 2013).
1.6- Imunologia da hanseníase
A hanseníase tem sido explorada como um modelo de doença humana que exibe
padrões dinâmicos de resposta imunológica frente à infecção por um patógeno
intracelular. Como não existe um modelo experimental ideal, as lesões humanas da
hanseníase têm sido extensamente utilizadas para desvendar os mecanismos
imunológicos protetores e a sua complexa patogênese (Modlin 2010, Montoya &
Modlin 2010). É um exemplo de doença espectral na qual, diferentes tipos de resposta
imune ao M. leprae definem as manifestações clínicas, ilustrado por duas respostas
polares, a da hanseníase tuberculóide e lepromatosa (Modlin 1987, Yamamura et al
1991, Modlin 1994, revisado por Scollard et al. 2006, revisado por Duthie et al. 2008).
O organismo humano frente a um patógeno agressor responde de imediato com a
resposta imune inata (RII) e, mais tardiamente, com a resposta imune adaptativa
(RIA).É intrigante que na hanseníase, tanto as diferentes manifestações clínicas da
doença crônica como as manifestações agudas das reações hansênicas estejam
diretamente associadas ao tipo de resposta imune do hospedeiro aos antígenos do M.
leprae (Britton & Lockwood 2004, Montoya & Modlin 2010).
1.6.1- A resposta imune inata contra o M. leprae
22
A resposta imune inata é inicial e rápida à penetração de agentes agressores,
feita mediante mecanismos imunológicos inatos, que sãoinespecíficos e gerais contra
patógenos, independente de sua natureza. Esta é constituída por barreiras, ou seja, pele e
mucosas íntegras, fatores plasmáticos solúveis, como a lisozima, o complemento,
proteínas, citocinas, pela fagocitose (células dendríticas, macrófagos, neutrófilos e
outros), células “natural killer”, etc. (Akira 2003, Costa et al. 2013). A RII desempenha
papel crucial na definição do tipo de estratégia a ser usada pela resposta imune
adaptativa (Modlin 2010, Montoya & Modlin 2010).
As células do sistema imune inato expressam em suas membranas receptores de
reconhecimento de padrões (pattern recognition receptors/PRRs), que interagem e
reconhecem moléculas das membranas dos patógenos, os padrões moleculares
associados aos patógenos (“pathogen-associated molecular patterns/PAMPs”) (Akira
2003, Scollard et al. 2006, Modlin 2010, Montoya & Modlin 2010).Os PRRs são
proteínas, que forma a família dos Toll-like receptores (TLRs, TLR1 a 13), que são
expressos nas membranas dos monócitos, macrófagos e células dendríticas(“dendritic
cells” – DC), as células apresentadoras de antígeno (APCs) clássicas. Por outro lado, os
PAMPs são moléculas das paredes dos patógenos, como por exemplo, o
lipopolissacarídeo (LPS) das paredes das bactérias gram negativas, as lipoproteínas di e
tri-aciladas das micobactérias, a lipoarabinomanana com manose ou arabinose
(ManLAM e AraLAM), etc (Akira 2003, Modlin 2010, Hart & Tapping 2012).
A ligação entre um TLR e seu agonista gera uma cascata sinalizadora que
culmina com a ativação de genes regulados pelo fator nuclear kappa B (NF-κB), que
codificam citocinas pró-inflamatórias, quimiocinas e moléculas co-estimulatórias, que
irão ativar as células T etc (Akira 2003). Na hanseníase, o TLR2, dimerizado com
outros TLRs (TLR2/6 e TLR2/1), reconhece os PAMPs do M. leprae, representados por
lipoproteínas di e tri-aciladas, pelo fenoglicolipídeo ou glicolipídeo fenólico I (PGL-I),
pela ManLAM, AraLAM, etc. A ligação entre um TLR e seu agonista ativa a resposta
inflamatória via produção de citocinas, a produção de TNF- e da interleucina 12 (IL12), direcionando a RIA para o tipo Th1(Krutzik et al. 2005, Scollard 2006, Bochud et
al 2008, Misch et al. 2008, Modlin 2010, Montoya & Modlin 2010).
O genoma do M. leprae prevê 31 genes para diferentes lipoproteínas, sugerindo
que muitas delas tri-aciladas poderiam sinalizar via TLR2/1, desencadeando atividade
imunoestimuladora ou imunossupressora.
23
A defesa e/ou resistência à hanseníase estão relacionadas também à produção de
reativos intermediários do oxigênio (ROI) e nitrogênio (RNI), elementos fundamentais
para a destruição bacilar dentro do macrófago. A produção de ROI, RNI e IL-12, pelo
macrófago, ocorre após o reconhecimento de antígenos do M. leprae via TLR2/1
(Scollard et al. 2006, Modlin 2010, Montoya & Modlin 2010).
Polimorfismos de uma única base de nucleotídeo nas regiões codificadoras das
moléculas de TLR2 ou TLR1 parecem estar associados a uma maior suscetibilidade a
hanseníase (revisado por Scollard et al. 2006, Bochud et al. 2008, Modlin 2010,
Montoya & Modlin 2010). Misch e colaboradores concluíram que a deficiência de
TLR1 influencia a resposta imune adaptativa durante a infeção pelo M. leprae,
provocando manifestações clínicas, tais como, o dano neural e incapacidades (Misch et
al. 2008). Outros receptores TLR parecem correlacionar-se com a resistência ou
susceptibilidade à doença. O TLR9 reconhece o DNA CpG do M. leprae, por isso SNPs
associados ao gene codificador do TLR9 predispõe as formas lepromatosas de
hanseníase (Krutzik et al. 2005). Por outro lado, polimorfismos no TLR4, que se liga a
HSP-20 (proteína do choque térmico) do M. leprae, estão relacionados às formas
tuberculoides (citado por Scollard et al. 2006, Teles et al. 2010).
Além dos TLR, existem outros PRRs localizados no citoplasma, os NLRs
(receptores semelhantes ao NOD [Nucleotide-binding oligomerization domain]-likereceptors). No M. leprae, NOD1 e NOD 2 reconhecem componentes das paredes das
células (ácido d-glutamil-meso-diaminopimélico e o muramil dipeptídeo/MDP,
respectivamente). Estimulação dos NLRs ativa um complexo protéico denominado
“inflamosoma”, que atua na caspase, levando a clivagem proteolítica e ativação da
produção da IL-1β e outras citocinas (Modlin 2010). Em adição aos TLRs e NLRs,
existem outros PRRs, os receptores semelhantes ao RIG-I (“RIG-I-Like receptors),
receptores de manose e receptores de proteínas do complemento. Os receptores
citoplasmáticos do tipo NOD2 parecem ser altamente relevantes na resposta contra
hanseníase, já que polimorfismos de uma única base de nucleotídeo (SNPs) de NOD2
estão relacionados com manifestação de formas lepromatosas de hanseníase (Zhang et
al. 2009, Kang et al. 2010, Modlin 2010, Montoya & Modlin 2010).
Receptores de lectina tipo C (CD209), expressos em macrófagos, reconhecem
especificamente estruturas de carboidratos encontradas na parede celular do M. leprae,
como a galactana, iniciando a produção de TNF-α e óxido nítrico (revisado por Scollard
et al. 2006). Outro receptor de lectinas, o DC-SIGN [DC-Specific Intercelular adhesion
24
molecule (ICAM)-3-Grabbing Nointegrein ou CD209] de células dendríticas e
macrófagos, promove imunossupressão, ou seja, é receptor considerado inibitório,
expresso mais em células de pacientes multibacilares (Krutzik et al. 2005, citado por
Scollard et al. 2006, Montoya et al. 2009, Teles et al. 2010).
Os receptores do complemento CR3 podem facilitar a fagocitose do M. leprae
por meio de opsoninas do complemento ou fagocitose mediada por lectinas. Pacientes
LL/BL expressam menos receptores CR3 (Modlin 2010). Outra proteína receptora que
parece ter relação com as diferentes formas de manifestação da hanseníase é o receptor
de vitamina D (VDR). Essa proteína, que está relacionada à ativação de macrófagos e
produção de catalecidinas e defensinas, parece estar aumentada em pacientes TT/BT em
comparação a pacientes LL/BL (Prevedello & Mira 2007, Montoya et al. 2009, Modlin
2010). O polimorfismo de VDR não está associado a fenótipos da hanseníase (Sapkota
et al. 2010).
A fagocitose é um dos principais mecanismos efetores da imunidade inata e
desencadeia uma série de mecanismos microbicidas e digestivos que possibilitam o
processamento e apresentação dos antígenos e o início da resposta imune adaptativa. A
fagocitose é realizada principalmente pelos macrófagos, que também têm a função de
varredores (“scavenger”) para remover material extracelular, em especial lipoproteínas
oxidadas de baixa densidade, que contribuem para a formação de células vacuolizadas
(células de Virchow). Na hanseníase, os macrófagos desenvolvem diferentes programas
funcionais para fagocitose e resposta antimicrobiana que são desencadeados por
citocinas da resposta imune inata. Assim, a IL-15 presente nas lesões tuberculóides
induz a via antimicrobiana dependente de vitamina D. Já a IL-10, presente nas lesões
lepromatosas, induz a via fagocítica com expressão de receptores scavenger e fagocitose
de micobactéria e lípides oxidados (Montoya et al. 2009).
Para evadir-se da resposta imune do hospedeiro o patógeno usa de vários meios.
Na hanseníase, nas lesões lepromatosas, a diferenciação das células dendríticas, APCs,
em células maduras, a partir de precursores mieloides, é interrompida resultando em
menor diferenciação e função das DCs e da sua capacidade de apresentar antígenos.
Agonistas do TLR2/1 (ManLAM e AraLAM) são fatores que contribuem tanto para
ativação de macrófagos e destruição bacilar como para imunomodulação das respostas
do hospedeiro “desativando” os macrófagos, com o bloqueio da fusão fagosomalisosoma, e estimulando da resposta Th2. Estas moléculas funcionam em grande parte
como consumidoras de espécies reativas de oxigênio produzidas durante a explosão
25
oxidativa do fagosoma, o que proporciona condições para que o bacilo fique protegido
no citoplasma da célula, multiplicando-se, formando globias e disseminando-se (Modlin
2010, Teles et al. 2010).
Nas formas lepromatosas, são encontrados bacilos vivos residentes em vacúolos
lipídicos no citoplasma e nas membranas dos macrófagos. O bacilo ainda possui
mecanismos para inibir a atividade de reativos do oxigênio no interior dos macrófagos,
como a inibição da síntese de superóxido pelo PGL-I e a expressão de superóxidodismutases SodA e SodC que inibem o óxido nítrico (revisado por Scollard et al. 2006).
Trabalho recente demonstrou que a apoptose está diminuída em macrófagos infectados
com BAAR, mesmo que a carga bacilar seja alta, em comparação com macrófagos
infectados com BAAR irradiados ou mortos (Lahiri et al. 2010).
O M. leprae possui, ainda, mecanismos para impedir a fusão do fagossoma com
o lisossomo. A TACO (tryptophan aspartate-containing coat protein ou CORO1A) é
uma proteína, presente na membrana lisossomal de macrófagos infectados pelo M.
leprae, que inibe fusão dos fagossoma ao lisossomo do macrófago e é expresso em altas
concentrações em lesões de pacientes MB (Suzuki et al. 2006, Tanigawa et al. 2009).
1.6.2- A resposta imune adaptativa contra o M. leprae
Após a resposta imune inata inicial, fagocitose e processamento dos patógenos,
com as APCs apresentando os antígenos aos linfócitos, dá-se o início da resposta imune
adaptativa, representada pela ativação dos linfócitos T e B, que é complementar e agora
simultânea com a inata e representa uma segunda linha na defesa do organismo, já que a
RII por si só, pode não ser suficiente para eliminar o patógeno (Modlin 1994, Akira
2003, revisado por Scollard et al. 2006, revisado por Moraes et al. 2006, Abbas et al.
2012c).
As células T auxiliares CD4 + (T helper/Th) são fundamentais para o
funcionamento do sistema imune e atuam coordenando a expansão e regulação das
células T CD8+, facilitando a resposta de células B, recrutando e modulando múltiplos
componentes da RIA. O encontro inicial de células T “naïve” (virgens) com o antígeno
varia, dependendo do sitio anatômico, do tipo de patógeno e da presença de citocinas e
moléculas co-estimulatórias que influenciam a diferenciação de células Th em células
efetoras específicas para o antígeno com características funcionais distintas. As células
apresentadoras de antígenos, células dendríticas, podem processar e apresentar
26
antígenos protéicos via MHC de classe I e MHC de classe II além de antígenos
glicolipídicos via CD1 para linfócitos (Hunger et al. 2004, Abbas et al. 2012a). As
células T virgens requerem dois sinais diferentes das APCs para se tornarem ativadas.
O sinal 1 se refere à interação entre o receptor para antígeno do linfócito T (T cell
receptor/TCR) e o Ag processado/peptídeo associado à molécula de MHC apresentado
na superfície da APC. O sinal 2 se refere à expressão na superfície das APCs de
moléculas co-estimulatórias e a produção de citocinas (Abbaset al. 2012a). A existência
do sinal 1 na ausência do sinal 2 induz anergia de células T, e na ausência de ativação
completa de APC, pode ser iniciada uma resposta do tipo Th2.
As DCs de pacientes tuberculoides, assim como os macrófagos ativados desses
pacientes, podem produzir citocinas pró-inflamatórias, como a IL-12 e TNF-α, que
estimularão uma resposta Th1 (revisado por Scollard et al, 2006). Porém as DCs de
pacientes lepromatosos, infectadas com M. leprae, passam a expressar PGL-I em sua
membrana celular e produzem IL-4 e IL-10. A utilização de anticorpos anti-PGL-I
opsoniza essas DCs, que passam a produzir IL-12, que estimularão uma resposta Th2.
(Modlin 1994, Krutzik et al. 2005).
A resistência à infecção pelo M. leprae está fortemente condicionada às células
T do tipo Th1 (fator de transcrição T-bet), que desempenham papel essencial na síntese
local das citocinas IL-12, TNF-α, Interferon Gama (IFN-γ), IL-2 e a produção de
mediadores de oxidação, como reativos intermediários do oxigênio e do nitrogênio
parecem ser essenciais no combate ao bacilo (Yamamura et al. 1991, Modlin 1994,
Misra et al. 1995, Stefani et al. 2003, Sampaio & Rivitti 2011).
Os pacientes TT desenvolvem resposta imune celular específica do tipo Th1 com
produção de citocinas IL-2, IFNγ e TNF-α (Ochs et al. 2009). Nestes os bacilos são
escassos ou ausentes, caracterizando a doença paucibacilar, com teste cutâneo
(Lepromina ou Reação de Mitsuda), os testes de linfoproliferação e ensaio de sangue
total (“whole blood assay/WBA”) positivos. As lesões TT expressam também citocinas
da imunidade inata do tipo 1 como linfotoxina α/β, IL12p70, IL-18
e
GM-CSF
(Yamamura et al. 1991, Modlin 1994, revisado por Scollard et al. 2006, Montoya &
Modlin 2010). A IL-2 é produzida pelas células T CD4+ e CD8+ em pacientes TT, mas
não por pacientes LL. Esta ativa receptores dos linfócitos Th1, responsáveis pela
manutenção da produção de citocinas, e estimula a formação de clones celulares
específicos (Modlin 1994, Kim et al. 2001).
27
No outro lado do espectro, os pacientes LL desenvolvem resposta imune do tipo
Th2 (fator de transcrição GATA3), com expressão das citocinas IL-4, IL-10 e IL-5,
produção de anticorpos, que não protegem contra o bacilo intracelular, clinicamente,
mas frequentemente com múltiplas lesões disseminadas, os testes cutâneos, de
linfoproliferaçãoe ensaio de sangue total negativos. A anergia apresentada pelos
pacientes LL é restrita aos antígenos do M. leprae (Yamamura et al. 1991, Ochs et al.
2009, Scollard et al. 2006, Montoya & Modlin 2010). Em um estudo, os autores
encontraram que a IL-9 é capaz de reverter o efeito inibitório da IL-10 e IL-13 na
atividade citotóxica induzida pelo M. leprae (Finiasz et al. 2007).
A IL-12 é secretada por células dendrítcas e macrófagos em resposta
principalmente a antígenos protéicos do M. leprae em pacientes TT, mas não em
pacientes LL. Estimula a produção de IFN-γ pelos linfócitos Th1 e linfócitos TCD8+ na
lesão. A IL-12 parece, ainda, inibir a secreção de IL-4 por outros macrófagos, células
dendríticas e linfócitos (Libraty et al. 1997). Um estudo que avaliou pacientes com
hanseníase e IL-12 mostrou que as células T de pacientes tuberculoide, a forma
resistente da hanseníase, são sensíveis a IL-12; no entanto, as células T de pacientes
virchowiana, forma suscetível de lepra, não respondem a IL-12. Neste a IL-12Rβ2 foi
mais altamente expressa nas lesões tuberculoides em comparação com lesões
virchowianas. Em contraste, a expressão de IL-12Rβ1 foi semelhante em ambos
tuberculoide e lesões virchowianas(Kim et al. 2001).
O TNF-α, citocina pró-inflamatória, é secretado por macrófagos e linfócitos T
CD4+, em resposta aos antígenos lipídicos e glicídicos, como o PGL-I. O TNF-α é
crucial na manutenção da ativação macrófagos e células Th1, sendo a principal citocina
responsável pela manutenção da granuloma em pacientes tuberculoides, mas não é
encontrado nas lesões de pacientes lepromatosos (Foss 1997, Moraes et al. 2001,
Modlin 1994, Sapkota et al. 2010). É encontrado em grandes quantidades em pacientes
de hanseníase com osteomielite e reabsorção óssea e, podendo provocar dano neural
(Barnes et al. 1992, Sarno et al. 2000). Outro estudo mostra que existe uma relação
entre polimorfismo de região promotora de TNF-α e IL-10 com o desenvolvimento de
hanseníase PB (Santos et al. 2002).
O IFN-γ é produzido por células T CD4+ e CD8+ nas lesões de pacientes
TT/BT, sendo importante na manutenção do granuloma e inibe a formação de IL-4 e IL5 por macrófagos e a produção de anticorpos por linfócitos B (Yamamura et al 1991,
Modlin 1994). Este estimula a fagocitose pelos macrófagos e os mecanismos de
28
ativação celular, expressão de MHC de classe II, processamento, destruição, digestão e
apresentação de antígenos do M. leprae e potencialização da produção de óxido nítrico e
intermediários reativos de oxigênio. O IFN-γ promove a inibição da diferenciação de
células T “naive” em células Th2 (Modlin 1994). A expressão de IFN-γ apresentou
maiores níveis em lesões TT quando comparadas às lesões LL (Yamamura et al. 1991,
Modlin 1994, Misra et al. 1995, Libraty et al 1997, Moubasher et al. 1998, Stefani et al.
2003). Esta citocina participa também nos episódios reacionais, quando está elevada
(Moraes et al. 2001). Recentemente outro trabalho mostrou a inibição do intereferon
tipo II (IFN-γ) pelo tipo I (IFN-α e β), sendo que este, juntamente com a IL-10,
expressaram-se mais em pacientes MB (Teles et al. 2013).
Quando ocorre a polarização do tipo Th2, há exacerbação da resposta humoral,
com vigorosa produção de anticorpos, que é ineficaz para a eliminação dos bacilos
intracelulares e causa maior suscetibilidade à hanseníase (Yamamura 1991, Modlin
1994). A subpopulação Th2 produz as citocinas IL-4, IL-5 e IL-10 que são supressoras
da atividade macrofágica, produzindo bloqueio da estimulação de células Th1, com
consequente desvio da resposta imunológica (Modlin 1994, Foss 1997). Os antígenos
PGL-I e lipoarabinomanana (LAM) apresentam função supressora na ativação dos
macrófagos, favorecendo a polarização para resposta do tipo Th2 com a produção de
citocinas supressoras como fator de crescimento transformador- β (TGF-β), IL-10 e IL4 (Foss 1997).
A IL-4 é uma citocina encontrada principalmente nas lesões de pacientes LL/BL
e é produzida tanto por macrófagos quanto por linfócitos T CD8+ e CD4+ (Modlin
1994). Esta estimula a ativação de linfócitos B, que aumenta a secreção de
imunoglobulinas, e a ativação de mastócitos locais, que passam a produzir mais IL-4,
potencializando a resposta supressora macrofágica (Yamamura et al. 1991, Misra et al.
1995, Teles et al. 2010).
A IL-5 é produzida pela subpopulação de células Th2 e mastócitos nas lesões de
pacientes células LL/BL e inibe fortemente a produção de TNF-α e IL-12 pelos
macrófagos (Ochoa et al. 2010). Apesar da IL-5 estimular o crescimento e a
diferenciação dos eosinófilos em outros tipos de infecções, dificilmente são encontrados
eosinófilos nas lesões da hanseníase (Modlin 1994). Uma análise de lesões de
hanseníase por imuno-histoquímica mostrou que houve cerca de 8% mais células IgM
positivas nas lesões LL do que em lesões TT. Além disso, a IL-5 sinergizada in-vitro
pelo M. Leprae, aumenta a secreção de IgM total das células mononucleares do sangue
29
periférico. Este estudo in vitro demonstrou o papel da IL-5 na promoção do aumentado
do IgM no local da lesão de hanseníase (Ochoa et al. 2010).
A IL-10 é uma citocina produzida por macrófagos e células dendríticas em
lesões de pacientes LL/BL. Inibe fortemente a produção de substâncias microbicidas
como reativos de oxigênio, óxido nítrico e catalecidinas em macrófagos infectados pelo
M. leprae (Yamamura et al. 1991, Modlin 1994, Misra et al. 1995, Pereira et al. 2009).
A IL-10 inibe ainda a expressão de MHC de classe II, assim como a produção de IL-12
por células dendríticas e macrófagos (Misra et al. 1995). Já referido anteriormente foi
demonstrado que polimorfimos da IL-10 favorece o desenvolvimento de hanseníase PB
(Santos et al. 2002) e que a IL-10 favorece o desenvolvimento das formas MB (Teles et
al. 2013).
Em lesões de pacientes com hanseníase há clara diferença na proporção de
linfócitos TCD8 + e TCD4 +. Nas lesões de pacientes TT, os linfócitos T encontram-se
bem unidos a macrófagos ativados, dentro e nas proximidades de granulomas e são
geralmente observados em uma proporção de 1,9:1,0 células TCD4 +/CD8+. As células
TCD4+ encontram-se distribuídas por todo granuloma, enquanto as TCD8+ são
geralmente encontradas na periferia deste (Modlin et al 1983, Modlin & Rea 1987). Nas
lesões TT, tanto as células TCD8+ quanto TCD4 + produzem grandes quantidades de
IFN-γ (Modlin et al. 1983, Modlin & Rea 1987, revisado por Foss 1997, revisado por
Scollard et al. 2006). Em pacientes tuberculoides, as células TCD8+ produzem grandes
quantidades de perforina, granzima e granulisina (Modlin et al. 1988). Em contraste, nas
lesões de pacientes LL as células T são encontradas na proporção de 0,6:1,0
TCD4+/TCD8 +, e ambos os fenótipos de linfócitos T estão distribuídos de forma
desorganizada dentro do processo inflamatório (Modlin et al. 1983, Modlin et al. 1988).
Outra diferença notável nas lesões LL é a grande quantidade de citocinas IL-4
produzidas pelo linfócito TCD4+ e principalmente por TCD8+ (Yamamuraet al. 1991,
revisado por Foss 1997).
O paradigma Th1 e Th2 foi substituído por um painel de novas subpopulações
de células T, que foram adicionadas ao “portfolio” de células Th (Joosten et al. 2007,
Ochs et al. 2009, Shevach 2009). Estas novas subpopulações incluem as células Th17,
Th22, Th9, Th3, células T auxiliares foliculares (Thf), células T invariantes associadas à
mucosa (MAIT), células T restritas por MHC Ib e subpopulações de células T
reguladoras (Treg).
Existem evidências de que algumas destas subpopulações de
30
células T participam da resposta imune contra o M. leprae (Massone et al. 2010,
Palermo et al. 2012).
As células Th17 são pró-inflamatórias, associadas a doenças autoimunes e
participam da imunidade antimicrobiana contra bactérias extracelulares e fungos,
principalmente nas superfícies mucosas (Nouri-Aria 2009, Ochs et al. 2009). Estas são
induzidas a partir de células T “naive”, na presença de IL-6 e TGF-β (“transforming
growth factor β”), requerem IL-23 para sua expansão e estabilização, expressando o
fator de transcrição RORγT (orphan nuclear receptor). As células Th17 produzem IL17, IL-24, IL-21, IL-22 e CCL-20 (Nouri-Aria 2009). Na hanseníase, as células Th17
parecem participar da patogênese da reação tipo 2 (Martiniuk et al.2012). Na vacinação
experimental com Bacilo Calmette-Guerin (BCG) ocorreu ativação de Th17, no entanto,
exposições repetidas a M. tuberculosis e a BCG levaram a doença pulmonar e não a
proteção.
As células Th22, funcionalmente, sobrepõem-se às células Th17, mas não
existem evidências que participem da proteção contra a tuberculose em murinos. Estudo
recente dos subconjuntos de células T, demonstra Th17e Th22, agem localmente para
induzir plasticidade de células T nas lesões LL, manifestando com hiperplasia pseudoepiteliomatosa da epiderme (HPE) e que miR-21 e STAT3 encontram-se aumentadas
em lesões LL com HPE, dada sua associação com a hiperproliferação epitelial (Fischer
et al. 2012).
As células T helper foliculares (Tfh) e Th9 associadas à defesa do hospedeiro
contra patógenos extracelulares, ainda não foram estudadas na hanseníase nem na
tuberculose.
Os estudos não esclarecem exatamente o que constitui uma resposta imune
protetora e não dispomos, até o momento, de um marcador ideal de proteção para
hanseníase. Além disso, diante da complexidade da resposta imune contra
micobactérias, não parece razoável supor que uma única população celular seja
responsável pela proteção do hospedeiro.
Uma característica intrigante da resposta imune adaptativa é a sua plasticidade,
segundo a qual as populações de células T e macrófagos não estão em estágios de
diferenciação terminais, mas podem se converter e reverter em fenótipos opostos (Sun
et al. 2007, Shevach & Davidson 2010, Wohlfert & Belkaid 2010). Por exemplo, as
células Th17 podem se converter em células Th1 ou mesmo as células Th1 podem ser
redirecionadas em células Treg. Existem também evidencias de que as células pró-
31
inflamatórias Th17 juntamente com as células Treg devem atuar de forma a manter o
equilíbrio do sistema imune do hospedeiro. Tanto células imunomoduladoras Treg
como células pró-inflamatórias Th17 são ativadas por M. leprae, sendo que a ação das
células Treg se contrapõe à ativação das células Th17, inibindo o recrutamento precoce
de células efetoras para o sítio da infecção. Mais recentemente, foi demonstrado que as
células Th17 estão em balanço positivo/negativo com células Treg, e existem células T
híbridas, que possuem tanto o fator de transcrição de células Th17, RORγ T, como o
fator de transcrição de Treg (Foxp3), podendo atuar com função pró-inflamatória ou
supressora. Assim, neste novo conceito de plasticidade, populações celulares únicas
podem adquirir diferentes funções numa infecção crônica como a hanseníase,
dependendo do contexto e da situação em que atuam. A figura 7, esquematicamente,
ilustra a intrincada resposta imunológica, inata e adaptativa, frente a uma infecção pelo
M. leprae.
32
Reconhecimento
- Vias Aéreas Superiores
DC
Receptor de Manose
PAMPs
- LIPOPROTEÍNAS
- GLICOLIPÌDEOS
-
TLR2/1
NOD2
Receptor Scanvenger
TLR2/6
M. leprae
Apresentação do an geno
Órgãos Linfóides
Secundários
Fase Efetora
Tecidos periféricos
Polo Lepromatoso
Polo Tuberculóide
I FN
Ac
IB
I FN
Ac
IB
TH17
LB
LB
LB
IL-10
IL-17
IL-4; IL-5IL-13
TNF-; INF-IL-1
A vação de
Formação de granuloma
espumosos
Ausência de granuloma
Figura 7. Interação entre a imunidade inata e a imunidade adaptativa na resposta à
infecção pelo M. leprae. Fonte: esta figura é parte do capítulo de Imunologia de
autoria de Stefani et al., livro de Hanseníase, Talhari et al. Comunicação pessoal.
1.6.3- Hanseníase e Células T Reguladoras
O balanço entre imunidade e tolerância é importante para manter a homeostase
imune. Muitos mecanismos são utilizados para manter a resposta imune sob controle,
como a anergia de linfócitos T, a apoptose e a ignorância imunológica. Um quarto
mecanismo de tolerância periférica é a supressão ativa por células reguladoras.
As Treg foram descritas primeiramente no início dos anos 70 (Gershon& Kondo
1970), mas como fatores supressores solúveis hipotéticos, que não puderam ser
33
identificados em nível molecular e marcadores celulares apropriados não eram
conhecidos, o conceito de célula T supressora permaneceu esquecido por um longo
tempo. A descoberta de Sakaguchi e seus colaboradores de que a transferência adotiva
de uma população de células T depletadas da molécula CD25+ induzia uma série de
doenças autoimunes órgão-específicas em recipientes imunodeficientes, colocou o
modelo de células T supressoras de novo no foco de imunologistas (Sakaguchi et al.
1995). As células T CD4+CD25+ reguladoras foram inicialmente descritas como
derivadas do timo, entretanto, descobertas recentes indicam que essas células também
podem ser geradas na periferia (revisado por Shevach & Davidson 2010).
As células Treg são uma subpopulação minoritária das células T, têm papel
essencial na regulação da tolerância imunológica, atuam prevenindo o dano tecidual por
inflamação e autoimunidade, pois são capazes de suprimir os efeitos deletérios das
respostas imunes contra auto ou não auto-antígenos (Hori & Sakaguchi 2004, Beissert et
al. 2006, Shevach & Davidson 2010, Kitagawa et al. 2013). Entretanto, para o
hospedeiro, a função supressora das células Treg pode ser tanto benéfica, quando atua
suprimindo a imunopatologia, ou pode ser maléfica quando suprime a resposta imune
protetora (Joosten & Ottenhoff 2008).
Muitos tipos de células T têm função imune reguladora, mas os dois
subconjuntos de células Treg mais importantes expressam o fator de transcrição Foxp3
e desenvolvem no timo ou podem ser induzidos em locais periféricos, incluindo o tecido
linfoide associado à mucosa (MALT). Embora a expressão de Foxp3 seja considerada
um marcador útil para essas subpopulações de células em camundongos, a expressão de
Foxp3 também pode ser induzida em células T humanas que não possuem a função de
células Treg (Shevach e Davidson, 2010).
As células Treg humanas naturais são CD4+ e expressam constitutivamente a
cadeia α do receptor para IL-2 (IL-2Ra-chain/CD25) e o fator de transcrição Foxp3
(forkhead box P3), apresentando o fenótipo CD4 +CD25+Foxp3 +. Há vários fenótipos de
células Treg, mas nem todos expressam atividade supressora. As Treg expressam
constitutivamente as moléculas CTLA-4, GITR e Foxp3, as células Th3 produtoras de
TGF-β, células Tr1 produtoras de citocinas anti-inflamatórias como IL-10 e TGF-βde
IL-10 e células T CD8+CD28-. O CTLA-4, uma molécula co-estimulatória capaz de
suprimir várias funções de células TCD4 + (Fontenot et al. 2003, Fontenot et al.
2005,Sakaguchi 2005, Sakaguchi et al. 2008, Sakaguchi et al. 2010, Shevach &
Davidson 2010, Pandiyan & Zheng 2011).
34
Células Treg Foxp3+ humanas funcionais ativadas, expressam um padrão único
de marcadores de superfície celular que podem facilitar o seu isolamento. Um tipo
importante de célula Treg segrega citocina imunossupressora, a interleucina-10 (IL-10),
e pode-se desenvolver a partir de células T CD4+ convencionais ativadas na presença de
IL-10 ou a partir de T helper 1 (Th1) ou subconjuntos de células Th2. Outras
subpopulações de células T, incluindo células T “natural killer” (NK), as células Tγδ e
células T CD8+ também podem exercer funções de potentes supressores em
determinadas configurações (Shevach e Davidson 2010).
O Foxp3 foi identificado como um marcador molecular específico para células
Treg e sua expressão é essencial para o desenvolvimento e a função dessa célula.
Camundongos deficientes de Foxp3 morrem com 3-4 semanas de vida, devido a uma
síndrome linfoproliferativa auto-imune fatal (“Scurfy”) e rápida. Além disso, esses
mesmos camundongos são incapazes de gerar Treg (Fontenot et al. 2003). Mutações no
gene Foxp3 interferem com o desenvolvimento de células Treg e causam desregulação
imune, a rara síndrome ligada ao X de poliendocrinopatia e enteropatia (IPEX). Outros
defeitos de gene simples resultando em função de células Treg reduzida incluem CD25,
transdutor de sinal e ativador da transcrição 5b, regulador auto-imune e síndrome da
proteína de Wiskott-Aldrich (O’Garra & Vieira 2003, Ochs et al. 2009).
As células Treg mantêm a tolerância periférica suprimindo a função das células
T autorreativas e têm sido alvo de investigações em diferentes doenças cutâneas como
lúpus eritematoso, doenças reumáticas, dermatite atópica, dermatite de contato,
psoríase, doença de enxerto versus hospedeiro, sarcoidose, leishmaniose, tuberculose e
câncer cutâneo (Chen et al. 2007, de Boer et al. 2007, Cruvinel et al. 2008, Chiacchio et
al 2009).
Em um estudo imuno-histoquímico, em peles normais e dermatoses (Psoríase
vulgar, micose fungoide e dermatites eczematosas), foram observados os seguintes
resultados: 1) na pele normal, as células epidérmicas e dérmicas Foxp3+ eram raras; 2)
na Psoríase vulgar, micose fungoide e nas dermatites eczematosas continham números
substanciais de CD3+ e Treg Foxp3+ na epidérmica e dérmica; 3) a epiderme continha
um percentual maior de células CD3+ e Treg Foxp3+ do que na derme; 4) a
percentagem de células Foxp3+ entre as CD3+ ou CD4+ foi significativamente menor
nas dermatites eczematosas do que na Psoríase vulgar e na Micose fungoide; 5) e o
número de células Foxp3+ dérmicas foi significativamente menor na Psoríase vulgar do
que nas dermatites eczematosas e na Micose fungoide (Fujimora et al. 2008).
35
Na hanseníase, estudos sobre a expressão de Treg são muito poucos e usando
desenhos e metodologias distintas (estudos “in situ” com imuno-histoquímica versus
estudos de citometria de fluxo em sangue periférico) mostraram resultados conflitantes.
A frequência de células Treg circulantes expressando Foxp3 foi avaliada por
citometria de fluxo em pacientes com hanseníase TT, BT, BB, BL e LL, em pacientes
com reação tipo 2 e em controles saudáveis. Níveis elevados de Treg foram encontrados
nos pacientes TT comparados com controles normais sugerindo papel benéfico no
controle bacilar na hanseníase. Não houve diferença de Treg entre as diferentes formas
de hanseníase e estas estavam aumentadas em pacientes com RT2 comparados com
controles normais (Attia et al. 2010).
Estudo recente com imuno-histoquímica mostrou a presença de células Foxp3 +
no infiltrado granulomatoso sem diferença entre as formas TT, BT, BL e LL, com
aumento estatisticamente significativo na RT1, quandocomparada com a RT2 e em
pacientes sem reação (Massone et al. 2010).
Outro estudo recente avaliou a expressão de células T regulatórias na circulação
por citometria de fluxo e em lesões de pacientes com hanseníase, com imunohistoquímica e dupla marcação (CD25 e Foxp3+), bem como contatos domiciliares e
controles saudáveis. Uma maior proporção de Treg e IL-10 foi encontrada na circulação
de pacientes lepromatosos. Já a produção de IFN-γ e resposta linfoproliferativa foram
maiores entre os pacientes com hanseníase tuberculóide. Resultados similares foram
obtidos nas lesões de pele, com duas vezes mais células T regulatórias, IL-10 e CTLA-4
nas lesões de pacientes lepromatosos (Palermo et al. 2012).
Ainda recente, outro estudo de pacientes hansênicos menores de 15 anos e em
contatos foram avaliadas as frequências de células CD4+/CD8+ CD25high Foxp3+ e
CD4+/CD8+ CD25high Foxp3high. Células Mononucleares de sangue periférico
(“peripheral blood mononucleated cell”/PBMC) dos pacientes e contatos foram
cultivadas com anti-CD3 e anti-CD28 (ativadores) ou com ativadores associados com
sonicado total de fração do M. leprae. Após a cultura, a frequência de CD4+/CD8+ Treg
foi identificada por citometria de fluxo. Células dos pacientes multibacilares
estimuladas pelos ativadores e antígenos mostraram frequências de Treg quase duas
vezes mais que dos contatos e a intensidade de fluorescência média de Foxp3 nas Treg
foi maior em pacientes multibacilares, do que nos contatos (Fernandes et al, 2013).
Desta forma, os estudos realizados até o momento trazem resultados conflitantes
e não esclareceram em definitivo qual o papel das células Treg na hanseníase. As
36
células Treg podem ter papel benéfico controlando a resposta imune inflamatória que
destrói os nervos periféricos ou maléfico, suprimindo a resposta imune celular protetora
contra o M. leprae. Nos episódios reacionais, RT1 e RT2, a participação das Treg ainda
não foi motivo de estudo com o número significativo de pacientes, nem comparando as
Treg no momento do episódio e fora dele, em um mesmo paciente, motivo principal do
nosso estudo.
1.6.4- Hanseníase e Mastócitos.
Os mastócitos foram relatados primeiramente por Friedrich von Recklinghausen
(1833–1910) quando ele descreveu em 1863, a presença de células granuladas em
tecidos conjuntivos de várias espécies. Muitos anos depois, os mastócitos foram assim
denominados por Paul Ehrlich (1854–1915), em sua tese sobre a teoria e a práxis de
coloração histológica, publicada em 1878, onde descreveu as células com granulações
em tecidos conectivos que coravam com tinturas de anilina básicas (revisado por Blank
et al. 2013).
Os mastócitos são componentes fisiológicos da pele e mucosas, e estão presentes
no tecido conjuntivo em torno dos vasos sanguíneos, subepiteliais, estruturas linfáticas,
anexos da pele e nervos. São caracterizadas pela presença de inúmeros grânulos
citoplasmáticos contendo potentes mediadores farmacológicos. Estes originam-sw a
partir de células pluripotentes da medula óssea, que expressam CD34 +/CD117+e um
receptor tirosina quinase (c-kit) específico para o ligante c-kit, e se diferenciam
emcélulas maduras pela influência do fator de células fonte (SCF) e outras citocinas
localmente produzidas comointerleucina-3 (IL-3), IL-4, IL-9 e IL-10,expressam o
fenótipo final, ou seja, mastócitos detecido conjuntivo (MCTC) ou de mucosa (MCT)
(Metcalfe et al. 1997, Metcalfe 2008, Blank et al. 2013, revisado por Silver & Curley
2013).Ao ocorrer essa interação, promove-se o crescimento e a diferenciação dos
mastócitos, que migram e maturam na pele e nas mucosas; estes são células
heterogêneas quanto à morfologia, bioquímica e função (revisado por Malufet al. 2009,
Abbas et al. 2012b, revisado por Silver & Curley 2013).
Em humanos, a heterogeneidade dos mastócitos é baseada em dois subtipos,
classificados pelas serina proteinases estocadas em seus grânulos citoplasmáticos:
mastócitos
que
contêm
triptase/quimase
(MCTC),
que
estão
presentes
predominantemente na derme, vasos sanguíneos e submucosa intestinal, ou aqueles que
contêm somente triptase (MCT) e encontram-se predominantemente em paredes
37
alveolares e na mucosa do intestino delgado (MCCT) (Payne & Kam 2006, Metcalfe et
al. 1997, Metcalfe 2008, Abbas et al. 2012b, revisado por Silver & Curley 2013).
Osmastócitos contêm potentes mediadores bioativos pré-estocados em seus
grânuloscitoplasmáticos, tais como histamina, heparina, triptase e quimase, capazes de
potencializara migração e a proliferação celular, induzir a expressão de moléculas de
adesão nas célulasendoteliais e, consequentemente, ativar o processo de angiogênese e
proliferação celular (Amon et al. 1994, Abbas et al. 2012b, Metcalfe et al. 1997).
Os grânulos dos mastócitos coram metacromaticamente em róseo-avermelhado
com o Azul de Toluidina (AT), corante básico ou catiônico, devido aos seus
componentes pré-formados proteoglicans, heparina e sulfato de condroitina B, que são
ácidos e se ligam ao Azul de Toluidina (revisado por Sridharan & Shankar 2012,
revisado por Chatura & Sangeetha 2012). A metacromasia depende da polimerização do
AT, proporcionado pela presença da heparina, que o atrai por meio das forças de van
der Waals. O Azul de Toluidina na sua forma monomérica é ortocromático, azul,
enquanto na sua forma polimérica é metacromático, ou seja, vermelho/púrpura (Kumar
& Kiernan 2010, Silva et al. 2011, revisado por Sridharan & Shankar 2012). As
proteases, triptase e quimase, componentes dos grânulos, são específicas dos
mastócitos, são demonstradas por métodos imuno-histoquímicos, por meio de
anticorpos específicos (revisado por Magalhães et al. 2008).
Os mastócitos participam das complexas respostas imunes cutâneas, inatas e
adaptativas, principalmente nas reações de hipersensibilidade imediata, resposta Th2,
juntamente com a imunoglobulina E (IgE) e contribuem também nas reações de
hipersensibilidade tardia, resposta Th1 (Abbas et al. 2012b, Metcalfe 2008). A ativação
dos mastócitos através dos receptores de alta afinidade da IgE, FcεRI, leva a
desgranulação parcial, com liberação de produtos pré-formados, como a histamina,
proteoglicans (heparina e sulfato de condroitina B), serotoninas e proteases (triptase e
quimase), entre outras, e produção de mediadores lipídicos (prostaglandina D2 e
leucotrienos), tromboxanas, citocinas e quimiocinas, e outros, com atividade próinflamatórias, que potencializam os efeitos dos já liberados, prolongando sua ação no
tecido (Figura 8) (Metcalfe 2008, Abbas et al. 2012b). Os mastócitos são também
produtores de substâncias mediadoras anti-inflamatórias, como a anexina, e outras
destrutivas e nocivas aos nossos tecidos, com as enzimas proteases, quimase e triptase
(Oliani et al. 2000, Oliani & Gil 2006).
38
Figura 8. Eventos de transdução de sinal na ativação dos mastócitos,iniciados pelo Kit
e FcεRI levando a respostas específicas do mastócito e a integração destas vias ao
reforço sinérgica de liberação dos mediadores do mastócito. Fonte: Metcalfe 2008.
Mast cells and mastocytosis. Blood 112.
Estudos prévios sobre o papel dos mastócitos na hanseníase e nas reações
hansênicas apresentam resultados diversos e contraditórios. A variação em diferentes
estudos pode ser devido a diferentes critérios usados para seleção dos casos e diferentes
números de casos de cada forma clínica. Vários fatores também influenciam o
diagnóstico histopatológico, tais como, as diferenças em tamanho dos espécimes,
escolha do sítio da biópsia, idade da lesão, status imunológico e tratamento do paciente
no tempo da biópsia (revisado por Chatura & Sangeetha 2012). Estas discrepâncias
devem ser explicadas em partepelos métodos de colorações adotados, anticorpo antitriptase ou anti-quimase usados, e pela de quantificação dos mastócitos (manual,
automatizada, análise assistida por computador, etc). Magalhães afirma: “em nossa
experiência, a imunomarcação histoquímica de mastócitos é a ferramenta mais eficaz
para a identificação do que qualquer outro método clássico” (Magalhães et al. 2008).
Em estudo de hanseníase tuberculóide reacional, os autores encontraram um
número significativamente menor de mastócitos do que nos casos não reacionais, com
39
0,9 mastócitos por campo, ou seja, pelo menos 40% menos que nos não reacionais
(média 1,4 mastócitos por campo), sendo a grande maioria eram desgranulados
(Chowdhury e Gjosh 1968).
Uma estreita associação de BAAR com os mastócitos, os quais acumulam ao
redor do BAAR ou onde estão as estruturas da pele, afetadas na hanseníase, isto é,
nervos, vasos sanguíneos, músculos, folículos pilosos e elementos glandulares indicam
similar distribuição de ambos (Kumar & Vaidya 1982).
Outro estudo, os autores não encontram nenhuma diferença na quantidade de
mastócitos em pele da borda e na pele não afetada do centro da lesão, sendo que os
mastócitos estão mais presentes dentro dos granulomas do que na derme interveniente,
sendo comparáveis aos encontrados em torno de anexos. Mastócitos de qualquer área do
corpo mostravam o mesmo número de mastócitos, mostrando ser independente do sítio
da lesão, ou seja, é sistemicamente determinado (Cree et al. 1990).
O predomínio de mastócito no polo LL pode estar ligado ao aumento da
vascularização e alterações observadas nas células endoteliais, as quais são mais
evidentes na LL. Mas no polo TT, mastócitos não parecem permanecer tanto tempo
como na LL (Aroni et al. 1993).
Outro estudo, quantidade de mastócitos em número mais elevado foi observado
na MHI (p<0,01) e significativamente em menor quantidade no polo TT do que no LL
(p<0,01). A LL também mostrou aumento de mastócitos desgranulados e morfologia
alterada. Relata ainda que, os mastócitos estão presentes em pequeno número nas
biópsias de pele de controles saudáveis (Mysorekar et al. 2001).
Estudo avaliando subtipos de mastócitos e neuropeptídeos, nas reações
hansênicas, mostrou que o número total de mastócitos e o número relativo de mastócitos
triptase-positivos foi signifivativamente maior no interior do infiltrado inflamatório do
que na derme normal, não ocupada pelo infiltrado, pois segundo os autores este
aumento pode estar relacionado com a deflagração do processo reacional (Antunes et al.
2003)
Quantificação de mastócitos usando AT foi normal na MHI e TT e mostrou um
aumento da densidade ao longo do espectro imunológico a BT para LL, com valores em
LL 32,86/mm2, e em pele normal a densidade média foi de 11,43/mm2 (Bagwan et al.
2004).
40
Em 70 casos de TT corados pelo AT, a densidade média foi de 26,6 mm2 fora do
granuloma e 15,1 mm2 dentro do granuloma. A diferença foi estatisticamente
significante, com p<0,0001 (Pilli et al. 2005).
Outro estudo de mastócitos e colagenização epineural os autores demonstraram
que mastócitos, por meio da triptase, induz a fibrogênese, por ser um fator mitogênico
para fibroblastos, levando a fibrose epineural e sequelas (Montagna et al. 2005)
Em 51 biópsias de peles, de casos de pacientes com hanseníase, na imunohistoquímica, com imunomarcação por Ac anti-triptase, os casos de LL mostraram
menores densidades de mastócitos nas dermes. As densidades maiores foram nos casos
BT e BB, sendo considerada uma evidência indireta do papel dos mastócitos na ativação
da resposta imune para o M. leprae (Magalhães et al. 2008).
Estudo onde os autores observaram mastócitos na coloração de Fite-Faraco, no
espectro hansênico, encontraram uma densidade baixa de mastócitos no polo TT
comparado com o LL, sendo as quantificações mais altas nas formas borderlines.
Afirmam que provavelmente uma redução dos mastócitos ocorre quando as lesões
evoluem para o polo TT, com mudanças no perfil das citocinas. Extensiva
desgranulação por causa do aumento da atividade funcional pode ser a causa de baixos
valores em LL. Provavelmente por causa destas duas razões a quantificação de
mastócitos diminui, quando move-se de BB para ambos os polos. Os autores referem
ainda números de mastócitos em todos os subtipos de hanseníasemenores dos que os
citados na literatura, provavelmente em função do método de coloração. A tendência
dos mastócitos diminuírem da forma LL para a TT foi observada neste estudo. As
formas reacionais RT1, em BT e BL não tinham mastócitos, mas nos casos de BL com
RT2 tinha contagem de mastócitos de 6,58/mm2 (Chatura & Sangeetha 2012).
Outro estudo de 60 casos de lesões não neoplásicas de biópsias de peles,
incluindo casos de hanseníase, coradas pelo AT, foi observado aumento do número de
mastócitos quando os casos Indeterminados evoluem para um dos polos, T ou L (Naik
etal. 2003).
Mastócitos foram encontradas e eram mais numerosos na pele aparentemente
normal de pacientes que tinham também lesões da hanseníase, bem como entre o grupo
indeterminado. A ausência de mastócitos foi conspícua em LL (16,7%), em BB
(41,7%), BT (40,9%) e TT (68,0%), nos casos estudados. Isto sugere que os mastócitos
devem ter um papel nos estágios iniciais da doença e proliferação do tecido conjuntivo
pós-reacional (Rav et al. 1990).
41
A resposta imune contra infecções deve representar um equilíbrio complexo
entre as respostas pró-inflamatórias contra o patógeno e as respostas anti-inflamatórias
necessárias para limitar o dano tissular do hospedeiro. A hanseníase é caracterizada por
um amplo espectro de lesões distintas, que refletem a resposta imune do paciente contra
o M. leprae, e estas lesões podem sofrer alterações durante os episódios reacionais.
Vários
aspectos
da
imunopatogênese
das
reações
hansênicas
permanecem
desconhecidos. Na hanseníase as lesões de pele contem muitos, senão todos os tipos
celulares que ocorrem na pele não acometida pela doença, além dos componentes
celulares do sangue periférico que migram para lesão granulomatosa. Neste contexto, é
necessário investigar mais na hanseníase e nos episódios reacionais duas populações
celulares, mastócitos, com características pró-inflamatórias importantes, e as células T
regulatórias (Treg), conhecidas pela sua ação imunossupressora. Alguns trabalhos têm
mostrado que mastócitos e células Treg podem se juntar para efetuarem uma boa
resposta imunológica (Lu et al. 2006). Análise de células Treg in vitro mostrou que
estas células produzem grandes quantidades de IL-9, fator de crescimento de mastócitos
(Leavy 2006).
1.7- Classificaçãode Ridley-Jopling e a classificação operacional (OMS/MS-Brasil)
A classificação clínica, imunológica e histopatológica proposta por Ridley &
Jopling (1966) é considerada o método mais completo e criterioso de categorização das
diferentes formas de hanseníase. Segundo Ridley e Jopling, a hanseníase pode ser
classificada de acordo com suas características clínicas, imunológicas e histopatológicas
em um espectro, variando de um polo imunologicamenre mais resistente, a hanseníase
tuberculoide (TT), ao polo mais susceptível, a hanseníase lepromatosa (LL), com
formas intermediárias: BT (borderline-tuberculoide), BB (borderline-borderline) e BL
(borderline-lepromatosa) (Ridley & Jopling 1966, revisado por Scollard et al. 2006).
Apesar disto, é utilizada uma classificação operacional simplificada para fins de
tratamento dos pacientes nos serviços de rotina, recomendada pela OMS e pelo
Ministério da Saúde do Brasil, ficando a classificação de Ridley e Jopling mais aplicada
nas pesquisas (WHO 1988b, Brasil/Ministério da Saúde 2010a). Esta classificação
operacional, visando definir o esquema detratamento com a MDT, é baseada no número
de lesões cutâneas, de acordo com osseguintes critérios: paucibacilar são casos com até
cinco lesões de pele e multibacilar casos com mais de cinco lesões de pele. A
42
baciloscopia de pele (raspado intradérmico), sempre que disponível, deve ser
utilizadacomo exame complementar para a classificação dos casos como PB ou MB. A
baciloscopia positiva classifica o caso como MB, independentemente do número
delesões (WHO 1998b, Walker & Lockwood 2006, Brasil/Ministério da Saúde/SVS
2009, Brasil/Ministério da Saúde 2010a).
Na classificação de Ridley e Jopling (1966), a caracterização das formas é feita
conforme descrito abaixo:
Hanseníase Tuberculoide: é a forma mais localizada que se manifesta em
pessoas com resposta imune celular exacerbada ao bacilo. Os pacientes com hanseníase
TT apresentam uma única lesão ou poucas lesões, habitualmente menores que 10
centímetros, geralmente eritematosas, de limite bem definido. Podem ocorrer alterações
nos nervos próximos à lesão causando dor, fraqueza e atrofia muscular. Também
podem ser observados distúrbios de sensibilidade. As lesões TT apresentam bordas
elevadas, ásperas, sem pelos e demonstram centro com sinais de regressão ou cura. A
superfície da lesão é seca devido à deficiência da sudorese. A perda de sensibilidade e
bordas bem definidas das lesões são sinais característicos da forma tuberculoide da
hanseníase. A baciloscopia é negativa, forma provavelmente não contagiosa. Sob o
ponto de vista histopatológico ocorre a formação de granuloma tuberculoide,
constituído por um agregado de múltiplas células fagocitárias mononucleares com
diferenciação epitelioide bem evidente e participação de células gigantes multinucleadas
tipo Langhans no centro da lesão e presença de linfócitos contornando este granuloma.
Os granulomas são bem desenvolvidos e compactos e estendem-se desde a derme
profunda até a camada papilar, podendo inclusive atingir a camada basal da epiderme
(Ridley & Jopling 1966, Ridley 1974, Ridley 1977, Guinto et al. 1986, Job & Chandi
2001, revisado por Fleury 2006, revisado por Scollard et al. 2006, Lyon-Moura &
Pedrosa 2013).
Hanseníase borderline-tuberculoide: manifesta-se por poucas lesões cutâneas,
geralmente até cinco, eritematosas bem definidas e delimitadas. Esta forma geralmente
apresenta um número maior de troncos nervosos acometidos e de lesões que a forma
TT. A baciloscopia do esfregaço de raspado intradérmico/linga é negativa.
Histopatologicamente, a forma BT apresenta lesões com granulomas mais frouxos que
podem mostrar raros bacilos e granulomas formados por linfócitos e células
epitelioides, geralmente localizadas na derme com presença de células gigantes tipo
Langhans (Ridley & Jopling 1966, Ridley 1974, Ridley 1977, Guinto et al. 1986, Job &
43
Chandi 2001, revisado por Fleury 2006, revisado por Scollard et al. 2006, Lyon-Moura
& Pedrosa 2013).
Hanseníase borderline-borderline: manifestação intermediária entre as formas
tuberculoide e lepromatosa. Clinicamente a hanseníase BB pode se manifestar por
poucas lesões amplas, sem limites precisos, elevadas e porosas. Em casos mais raros, a
forma BB pode se manifestar por múltiplas lesões (mais de 5) bem delimitadas de borda
eritematosa elevada e centro hipocrômico. A baciloscopia é positiva. Ao exame
histopatológico são observados bacilos, com células epitelioides difusamente
espalhadas, assim como granulomas tuberculoides, porém as células gigantes e
linfócitos em geral são escassos e pode se observar edema intra e intercelular. Pode ser
observada a faixa de Unna, que é uma faixa de fibras colágenas correspondente à derme
papilar retificada, livre de células inflamatórias. (Ridley & Jopling 1966, Ridley 1974,
Ridley 1977, Guinto et al. 1986, Job & Chandi 2001, revisado por Fleury 2006, revisado
por Scollard et al. 2006, Lyon-Moura & Pedrosa 2013).
Hanseníase borderline-lepromatosa: o paciente apresenta entre 5 a 10 lesões de
pele mal delimitadas.
As lesões podem se manifestar como pápulas, tubérculos,
nódulos, placas, ulcerações e infiltração.
Pacientes com a forma BL apresentam
baciloscopia do esfregaço de raspado intradérmico/linfa positiva. Ao exame
histopatológico a forma BL apresenta agrupamentos de macrófagos não ativados, que
contêm grande número de bacilos em seu interior. Há raros linfócitos nas proximidades
dos agrupamentos de macrófagos. Sempre ocorre a observação da faixa de Unna
(Ridley & Jopling 1966, Ridley 1974, Ridley 1977, Guinto et al. 1986, Job & Chandi
2001, revisado por Fleury 2006, revisado por Scollard et al. 2006, Lyon-Moura &
Pedrosa 2013).
Hanseníase lepromatosa (LL): é considerada o polo anérgico da doença, na qual
a RIC específica ao M. leprae encontra-se ausente e o bacilo se multiplica levando a um
quadro disseminado. Pode haver um polimorfismo de lesões com pápulas, tubérculos,
nódulos, placas, ulcerações e infiltração difusa da pele e as lesões têm limites
imprecisos. Esta forma pode estar associada à atrofia muscular, inchaço das pernas e
lesões na pele. Órgãos internos também podem ser acometidos pela doença. Nesta
forma os pacientes apresentam mais de 10 (dez) lesões de pele. Máculas com bordas
pouco definidas aparecem numa fase inicial da forma lepromatosa e são geralmente
pequenas e numerosas. Lesões infiltradas surgem numa fase mais tardia e o infiltrado
44
inflamatório pode originar nódulos. Os nódulos aparecem geralmente nas orelhas, face,
extremidades, articulações e, raramente, nas genitálias. Alguns pacientes não passam
pela fase de máculas e os primeiros sinais notórios de hanseníase podem ser os nódulos,
mais comuns nas orelhas. Na histopatologia mostra um infiltrado inflamatório celular
composto de histiócitos multivacuolados, com o citoplasma carregado de bacilos e
grandes quantidades de lipídios, conferindo o aspecto de células espumosas. Há raros ou
nenhum linfócito nas proximidades dos grupamentos de macrófagos infectados. O
infiltrado inflamatório não atinge a camada basal da epiderme, ficando separado dela
pela faixa de Unna (Ridley & Jopling 1966, Ridley 1974, Ridley 1977, Guinto et al.
1986, Job & Chandi 2001, revisado por Fleury 2006, revisado por Scollard et al. 2006,
Lyon-Moura & Pedrosa 2013). Um artigo recente descreve achado inusitado com
aumento significativo de basófilos nas lesões da forma LL (Otsuka et al. 2012)
A figura 9 (Scollard et al. 2006) ilustra as formas as 5 (cinco) formas clínicas,
conforme a classificação esepctral de Ridley e Jopling.
Figura 9. Espectro imunopatológico da hanseníase segundo Ridley-Jopling.
45
Histopatologia das diferentes formas histopatológicas da hanseníase na classificação
de Ridley-Jopling, em secções coradas pela HE (painel superior) e Fite-Faraco (painel
inferior). As infiltrações granulomatosas epitelioides bemformadas vistas em lesões
polarestuberculoide (TT) tornam-se cada vez mais desorganizadas em direção ao polo
lepromatoso (LL), onde são agregados de histiócitos espumosos completamente
desorganizados, com apenas ocasionais linfócitos. Fonte: Scollard et al. 2006. The
continuing challenges of leprosy. Clin Microbiol Rev.
1.8- Hanseníase e Genética
Antes da descoberta do bacilo por Hansen em 1874, a hanseníase foi
amplamente considerada como uma doença hereditária (revisado por Scollard et al.
2006).Ao longo das últimas décadas, a hanseníase vem sendo estudada por perspectiva
talvez inesperada para uma doença infecciosa: modernos métodos de análise
experimental têm sido empregados para evidenciar a importância do componente
genético no controle da susceptibilidade do hospedeiro à hanseníase e seus fenótipos. A
variabilidade genômica do M. leprae é mínima, e para as diferentes manifestações
clínicas e a transmissibilidade tão baixa da doença, só fatores genéticos podem explicar
tal diversidade.
Esses estudos indicam que constituição genética favorável do hospedeiro,
somada a fatores propícios, ambientais e relativos ao agente patogênico, tem alto
impacto na definição da susceptibilidade tanto à infecção propriamente dita quanto na
evolução clínica da doença. Hoje, diversos genes e regiões genômicas já foram
relacionados ao controle da susceptibilidade à hanseníase. Outros estudos estão em
andamento, visando ao avanço no entendimento das bases moleculares de controle da
susceptibilidade do hospedeiro à doença. O conjunto de resultados desses estudos pode
levar a formas mais eficazes de diagnóstico, tratamento e prevenção da hanseníase e
outras doenças infecciosas. Todas as doenças comuns, pelo menos em parte, são
genéticas. Rotberg, dermatologista brasileiro e estudioso da hanseníase, em 1937
sugeriu a possibilidade de ter um fator genético na susceptibilidade à doença,
denominado Fator N, desconhecido (Prevedello & Mira 2007).
1.8.1- Predisposição genética e resposta imune inata para a hanseníase
A maioria das pessoas que viveem áreas endêmicas da hanseníase já esteve
exposta ao M. leprae, mas, apenas algumas delas desenvolvem a doença (0,1 a
46
1%)(revisado por Moraes et al. 2006). Por isso, a influência de fatores genéticos na
resistência ou susceptibilidade à doença vem sendo investigada. Alguns autores
sugeriram que pelo menos 2 diferentes genes deveriam controlar a resposta imune à
hanseníase, atuando na susceptibilidade e na forma clínica da doença (de Vries et al.
1976, revisado por Scollard et al. 2006).
A susceptibilidade à hanseníase é também influenciada por características
ambientais, como o estado nutricional do hospedeiro, pelas taxas de exposição ao M.
leprae e de vacinação com BCG. As taxas de proteção com a BCG são altamente
variáveis entre as diferentes populações (Rodrigues 1992, Lockwood 2001, revisado por
Moraes et al. 2006, Setia et al. 2006). Estudos em gemelares na Índia demonstraram que
a doença é mais freqüente entre os monozigóticos do que nos dizigóticos tanto para a
doença propriamente dita como para suas formas clínicas (revisado Prevedello & Mira
2007).
A escolha dos genes candidatos para estudo genético não é tarefa fácil, uma vez
que o genoma humano possui cerca de 30 a 40 mil genes. A seleção pode ser ao acaso,
partindo de hipóteses (teste de hipótese) por estudos de associação ou caso-controle.
Esta escolha geralmente é baseada em três critérios: possível papel do gene/produto na
patogênese da doença; localização do gene em região genômica previamente
identificada estar envolvida no controle da doença, ou a combinação das duas (revisado
por Moraes et al. 2006, revisado por Prevedello & Mira, 2007).
Um dos mais extraordinários avanços no entendimento da hanseníase foi a
identificação por Mira e colegas de um locus dentro do gene PARK2 / PACRG que está
associado a susceptibilidade geral das populações humanas aoM. Leprae (Scollard et al.
2006). A análise de desequilíbrio de ligação da região candidata mostrou que 15 dos 17
SNPs associados estavam localizados em um único bloco, cobrindo a região reguladora
compartilhada por dois genes: o gene do parkinsonismo juvenil autossômico recessivo
(AR-JP), denominado Parquina (PARK2) e o gene PACRG (gene co-regulado com
parquina). Uma análise de regressão logística multivariada detectou dois SNPs que
capturavam completamente a informação de associação observada na região. Haplótipos
definidos por estes dois tag SNPs estavam associados com aumento de até 5,28 vezes do
risco de contrair hanseníase (Mira et al. 2003; Mira et al. 2004).
A proteína SLC11A1 (solute Carrier family 11, member 1), também conhecida
como NRAMP1 (natural resistance-associated macrophage protein-1), está localizada
na região 2q35 e tem papel no transporte de íons. O NRAMP foi descrito como o gene
47
envolvido na resistência/susceptibilidade a patógenos intracelulares em camundongos.
Estudo realizado em famílias relatou ligação entre NRAMP1 e múltiplos casos de
hanseníase (revisado por Mira 2006, revisado por Moraes et al. 2006, revisado por
Scollard et al. 2006, revisado por Prevedello & Mira, 2007, revisado por Fava et al.
2012).
1.8.2- Predisposição genética e resposta imuneadquirida para a hanseníase
Os principais genes relacionados à resposta imune investigados quanto à
susceptibilidade à hanseníase foram os genes do sistema de antígenos leucocitários
humanos (“Human Leucocyte Antigens”/HLA) e também genes que codificam
importantes citocinas e que estão localizados fora do complexo HLA como TNFα, LTα,
IL-10, IL-12/23. O complexo HLA é um conjunto de genes localizado no braço curto do
cromossomo 6 região 6p21. Em geral, várias dessesestudos de sorotipagem sugeriram
uma
associação
de
HLA-DR2
e
HLA-DR3
com
hanseníase
tuberculóide
(paucibacilares) ou como sendo fatores de risco importantes na susceptibilidade a
formas da hanseníase. Embora alguns estudos indicaram que uma associação de HLADR2 com hanseníase tuberculoide e virchowiana, nenhuma evidência convincente
demonstrou uma associação da resposta virchowiana com qualquer outros loci HLAD(revisado por Mira 2006, revisado por Moraes et al. 2006, revisado por Scollard et al.
2006, revisado por Prevedello & Mira, 2007, Visentainer et al. 1997).
Em estudo genômico entre indianos com predomínio da forma paucibacilar da
hanseníase,
encontrou-se
associação
da
região
cromossômica
10p13
com
susceptibilidade à forma paucibacilar da doença (Siddiqui et al. 2001). Esse achado foi
replicado através de estudo genômico realizado com população vietnamita. Este
mostrou associação da região 6q25-q27 com susceptibilidade à hanseníase (Mira et al.
2003).
O transportador associado de processamento do antígeno (TAP) é uma proteína
composta de dois polipeptídeos, TAP1 e TAP2. Seus respectivos genes, localizados no
cromossomo 6p21, dentro da região MHC classe II, entre HLA-DP e HLA-DQ.
Funcionalmente,
as
proteínas
TAP
transportam
peptídeos
para
o
retículo
endoplasmático em células apresentadoras de antígeno, onde eles são unidos ao MHC
classe I para apresentação de antígenos. O gene TAP2 tem sido associado com a
hanseníase tuberculoide, mas este gene situa-se tão perto de outros genes HLA, que
interpretação dos resultados tem sido difícil e a importância deste achado é incerta e
48
espera por estudos mais detalhados (revisado por Mira et al. 2006, revisado por Moraes
et al. 2006, revisado por Scollard et al. 2006).
Os genes do TNF estão localizados na região cromossômica da classe III do
complexo MHC, região 6p21.3. O TNF-α é o gene que codifica o fator de necrose
tumoral alfa, uma citocina pró-inflamatória que participa de vários processos biológicos,
como a modulação da resposta imune, tanto inata quanto adaptativa. O TNF-α está
envolvido na formação do granuloma, com controle da infecção por micobactéria e atua
impedindo sua disseminação. Polimorfismo no gene TNF-α está associado tanto com
susceptibilidade, quanto à resistência à hanseníase em populações de etnias distintas
(revisado por Mira 2006, revisado por Moraes et al. 2006, revisado por Scollard et al.
2006).
O gene LTA codifica a linfotoxina alfa, que é uma citocina importante na
modulação da resposta inflamatória, está localizado na região III do complexo MHC.
Estudos encontraram forte evidência de associação entre alelos do gene LTA e
susceptibilidade à hanseníase per se em populações do Vietnã do Sul (revisado por Mira
2006, revisado por Moraes et al. 2006, revisado por Prevedello & Mira 2007).
Estudos recentes mostram a influência de fatores genéticos no desencadeamento
de reações hansênicas, quanto a presença de marcadores tipo SNPs no gene TLR1 em
pacientes no Nepal, revelou que a presença do alelo 1805G estava associada à proteção
contra a reação tipo 1 (revisado por Scollard et al. 2006, revisado por Fava et al. 2012).
Um estudo de polimorfismo tipo microssatélite no gene TLR2 com utilização de
metodologia de caso-controle em pacientes na Etiópia, encontrou associação entre a
presença de homozigose para a extensão alélica de 280pb e um risco aumentado de
reação tipo 1 e o alelo -597T como protetor. Estes dados sugerem um papel significativo
para TLR2 na ocorrência da reação de reversão (Bochud et al. 2008).
O gene VDR (receptor de vitamina D) está localizado no 12q12-q14 e é
responsável pelos efeitos biológicos da vitamina D. A forma ativa da vitamina D induz
a diferenciação de monócitos, enquanto a ativação macrofágica através do VDR, em
combinação com TNFα e IFNγ, é responsável pela destruição do M. tuberculosis
(Montoya et al. 2009). Em estudo feito na população indiana encontrou-se associação
entre o gene VDR e a hanseníase e detectou-se a susceptibilidade à forma LL e TT na
presença dos genótipos TT e tt respectivamente (revisado por Moraes et al. 2006,
revisado por Prevedello & Mira, 2007, revisado por Fava et al. 2012). Um estudo casocontrole de gene candidato a susceptibilidade da lepra, com trinta e oito sítios
49
polimórficos de 13 genes foram investigados pelo seu papel na susceptibilidade a
hanseníase comparando 270 casos com 452 controles no distrito de Karonga, norte do
Malawi. Homozigotos para a variável T→C silenciosa no códon 352 do gene do
receptor da vitamina D pareciam ser de alto risco, enquanto os homozigotos para o
grupo de sangue b McCoy definindo a variante K1590E no gene exon 29 do receptor do
complemento 1 (anteriormente CD35) parecia ser protetor (Fitness et al. 2004). O
polimorfismo de VDR não está associado a fenótipos da hanseníase (Sapkota et al.
2010).
Estudo por genotipagem de associação de dois estágios de doenças, testou três
conjuntos de replicação independente para uma associação entre a presença da
hanseníase e 93 polimorfismos de nucleotídeos simples, que foram mais fortemente
associados com a doença no estudo de associação e testes de heterogeneidade das
associações (ou falta dela), estratificadas de acordo com o subtipo clínico (multibacilar
vs paucibacilares). Observou-se uma associação significativa entre SNPs nos genes
CCDC122, C13orf31, NOD2, TNFSF15, HLA-DR e RIPK2 e uma tendência para uma
associação com um SNP no LRRK2. As associações entre os SNPs em C13orf31,
LRRK2, NOD2 e RIPK2 e hanseníase multibacilar foram mais fortes do que as
associações entre esses SNPs e hanseníase paucibacilar. Variantes de genes da via de
sinalização mediada por NOD2 (que regula a resposta imune inata) estão associadas
com susceptibilidade à infecção por M. leprae (Zhang et al. 2009, revisado por Fava et
al. 2012)
Devido à importância da resposta imune na hanseníase e, sobretudo, no
desencadeamento das reações hansênicas, os genes candidatos mais estudados têm sido
os genes das citocinas e de outras moléculas marcadoras importantes no contexto
imunológico (Moraes et al, 2006). Presença de polimorfismos tipo SNPs em diferentes
genes que codificam para citocinas têm sido descritos e associados com doenças. Os
episódios reacionais são a principal causa de incapacidade física permanente associada
com hanseníase e representam um grande desafio no manejo clínico dos pacientes.
Dado o impacto que a etnia tem sobre o risco de desenvolver episódios reacionais,
fatores genéticos do hospedeiro que podem contribuir para os episódios reacionaistêm
sido descritos. Polimorfismos em sete genes [receptores do tipo Toll (TLR)1, TLR2,
domínio de oligomerização de ligação de nucleotídeos contendo 2 (nucleotide-binding
oligomerisation domain containing 2), receptor de vitamina D, proteína 1de macrófagos
50
associada à resistência natural, C4B e interleucina-6] foram associados com episódios
reacionais (revisado por Fava et al. 2012).
Estudos de uma coorte de 409 pacientes com hanseníase do Brasil central,
monitorados para RT1 e RT2, mostraramevidências de associação entre RT2 e IL-6
rs2069832 de polimorfismos de nucleotídeo único tag, rs2069840, e rs2069845, com
informações sobre o locus inteiro de IL-6, bem como funcional rs1800795 variante do
IL-6. Além disso, os níveis plasmáticos de IL-6, em pacientes com RT2,
correlacionaram com genótipos de IL-6. Nenhuma associação foi encontrada entre as
variantes de IL-6 e T1R (Sousa et al. 2012, revisado por Fava et al. 2012).
1.9- O diagnóstico da hanseníase
O diagnóstico da hanseníase ainda é baseado na identificação de sinais clínicos
dermato-neurológicos da doença, mas testes laboratoriais como o exame histopatológico
da lesão e a baciloscopia podem auxiliar no diagnóstico da hanseníase (Ridley &
Jopling 1966, Brasil/Ministério da Saúde 2010a). A definição de caso de hanseníase é
uma pessoa com sinais cardinais (clínicos) da doença e que não foi submetida ao
tratamento específico ou que requer tratamento quimioterápico. Os sinais cardinais são:
diminuição da sensibilidade em área ou lesão cutânea; espessamento neural periférico
e/ou presença de BAAR em pele, baciloscopia positiva (WHO 1988a, Brasil/Ministério
da Saúde 2002, Brasil/Ministério da Saúde 2010a).
A classificação espectral de Ridley e Jopling é importante para o melhor
entendimento da doença e para seu tratamento adequado, mas não é utilizada em centros
de saúde, que adotam os critérios simplificados da OMS e MS/Brasil, classificando os
pacientes em paucibacilares e multibacilares, simplesmente pelo número de lesões. Tal
simplificação é inaceitável para os Centros de Referência em assistência, ensino e
pesquisa em hanseníase, de modo que é recomendada a padronização pela classificação
de Ridley-Jopling. Devido ao potencial dano neural, com risco de incapacidades, e o
estigma da hanseníase, a correta classificação histopatológica é mandatória para
permitir ao médico uma compreensão do espectro da doença e seu prognóstico,
favorecendo assim uma conduta terapêutica adequada e o acompanhamento do paciente
(Ridley & Jopling 1966, Costa et al, 2001, Scollard 2004, Pardillo et al. 2007, Teixeira
et al. 2008, Brasil/Ministério da Saúde 2010a).
Onde estiver disponível é recomendável a complementação diagnóstica com
outros métodos, como: a baciloscopia, a biópsia da lesão cutânea com estudo
51
histopatológico, sorologia, entre outros (Teixeira et al. 2008, Brasil/Ministério da Saúde
2010a).
1.9.1- Baciloscopia
A baciloscopia é o exame complementar mais importante e específico na
hanseníase para identificar o agente causal, porém, é negativo nas formas paucibacilares
e em alguns pacientes multibacilares, necessitando, ainda, para sua execução de
infraestrutura laboratorial e de profissionais capacitados, inexistentes na maioria dos
serviços de atenção básica (Lyon et al. 2008).
É o exame microscópico onde se pesquisa BAAR nos esfregaços de raspados
intradérmicos das lesões suspeitas de hanseníase, lóbulos auriculares e/ou cotovelos,
corados pela técnica de Ziehl-Neelsen (Ridley 1955, Ridley & Jopling 1966, Leiker &
McDougall 1987, Jacobson & Krahenbuhl 1999, Brasil/Ministério da Saúde 2002,
Brasil/Ministério da Saúde 2010a, Brasil/Ministério da Saúde 2010b). A pesquisa de
BAAR em muco nasal foi proscrita pela OMS, pois pode gerar falsos positivos e
negativos. A carga bacilar é expressa como um índice baciloscópico (IB) que relata o
número de bacilos por campo microscópico em escala logarítmica (revisado por Leiker
& McDougall 1987, Ponnighaus et al. 1987, Brasil/Ministério da Saúde, 2010b). A
baciloscopia é geralmente negativa nas formas tuberculoides, positiva nas formas
borderline e fortemente positiva nas formas lepromatosas, por isso a baciloscopia
negativa não afasta o diagnóstico da hanseníase (Ridley & Jopling, 1966, Lyon et al.
2008). Geralmente o material de quatro sítios (lóbulos auriculares, cotovelos e/ou lesão)
é analisado e a carga bacilar é expressa pelo IB médio dos quatro sítios analisados
(Leiker & McDougall 1987, Brasil/Ministério da Saúde, 2002, Brasil/Ministério da
Saúde, 2010b). Independente do número de lesões do paciente, quando a baciloscopia
for positiva, o mesmo é classificado com multibacilar (Brasil/Ministério da Saúde,
2010b).
1.9.2- Biópsia e exame Histopatológico
O exame histopatológico baseia-se na análise microscópica de preparados
histopatológicos das biópsias de lesões cutâneas e nervos, com o estudo dos espécimes
para verificar infiltrado inflamatório, presença de granulomas, agressão neural, presença
de bacilos álcool-ácido resistentes, vasculite na derme e/ou hipoderme, paniculite,
estratificação e espessamento de tecidos. A descrição dos achados histopatlógicos
52
característicos de cada forma clínica do espectro, foi descrita anteriormente, nesta
introdução. Entre as formas clínicas do espectro há infinitos pontos entre um polo e
outro, o que dificulta a classificação dos pacientes. (Ridley & Jopling 1966, Ridley
1974, Fleury 2006, Job & Chandi 2001).
Tanto a baciloscopia, quanto o exame histopatológico não são exames
preconizados pela OMS para o diagnóstico da hanseníase, por isso não são realizados de
forma rotineira pelos serviços de saúde pública (WHO 2005, Costa et al, 2001, Fleury
2006), ou seja, na rotina operacional os pacientes são classificados baseados apenas no
número de lesões. Estudo realizado na Índia e outros mostram altos índices de
diagnósticos falsos positivos (Single-lesion Multicentric Trial Group 1997, Pardillo et
al. 2007).
Estudo que avaliou a concordância entre o diagnóstico clínico e o da hanseníase,
utilizando os resultados de biópsias, a concordância diagnóstica clínico-histopatológica
foi de 67,6%. A maior concordância foi obtida para a forma V, e a menor para a forma
I. A maior discrepância diagnóstica ocorreu para a forma BB (Teixeira et al. 2008).
1.9.3- Biologia Molecular
A identificação do DNA do M. leprae pela reação em cadeia de polimerase
(PCR) específica (ML-PCR) pode ser realizada com vários tecidos e fluidos biológicos
como: sangue, secreção nasal e linfa, porém, fragmentos de biópsia de pele e de nervos
parecem ser os materiais biológicos de maior sensibilidade para a amplificação do DNA
do M. leprae (Gillis & Williams 1991, Santos et al. 1993).
A técnica de PCR tem mostrado especificidade de 100% e sensibilidade
variando de 34-80% em pacientes com forma paucibacilar e taxa de sensibilidade acima
de 90% em pacientes com forma multibacilar (revisado por Scollard et al. 2006). Os
testes com ML-PCR geralmente apresentam uma positividade em torno de 95% em
pacientes multibacilares, mas dificilmente alcança 50% em pacientes paucibacilares
(Gillis and Williams 1991, Santos et al. 1993, Stefani et al 2003, Truman et al. 2008).
Diferentes genes específicos do M. leprae são utilizados como alvo da
amplificação por PCR (Santos et al. 1993), gene LSR/A15 que codifica o antígeno de
15 kDa (Misra et al. 1995), o fragmento de 360 pb do gene que codifica a proteína de
18 kDa (Williams et al. 1990; Scollard et al. 1998; Stefani et al. 2003, revisado por
Scollard et al. 2006), entre outros.
53
A ML-PCR não é recomendada como teste diagnóstico da hanseníase (WHO,
2005) e requer para sua realização, equipamentos e infraestrutura de alto custo, por isso
continua sendo mais um instrumento de pesquisa (Sousa et al. 2007).
1.9.4- Estudos Sorológicos
O desenvolvimento de métodos laboratoriais para auxiliar o diagnóstico ou
classificação das diversas formas clínicas da hanseníase é uma das prioridades em
pesquisa na área. No campo do sorodiagnóstico, a detecção de anticorpos IgM antiPGL-I, permanece como o melhor padronizado e mais avaliado teste em hanseníase.
(revisado por Stefani 2008). O ideal no diagnóstico nos serviços de saúde seriam testes
que possam ser realizados com recursos laboratoriais mínimos e sem necessitar de mão
de obra especializada, de leitura simples, objetiva e rápida, para serem utilizados no
ponto do atendimento (“point of care”, POC), facilitando o diagnóstico e a classificação
da hanseníase em PB e MB.
1.9.4.1- Sorologia anti-PGL-I e outras proteínas ou peptídeos do M. leprae
A sorologia anti-PGL-Ié um teste altamente específico para hanseníase, e a
presença de anticorpos no soro correlaciona-se com o índice bacteriano. Esta baseia-se
na detecção de anticorpos IgM anti-PGL-I, e não apresenta reação cruzada com M.
tuberculosis (Cho et al. 1983). O PGL-I é um componente de parede celular, exclusivo
do M. leprae, que constitui cerca de 2% da massa total bacteriana, cuja estrutura é
composta de um mono, di ou trissacarídeo, fenol, fitiocerol e de ácido micoceosídico
(Hunter and Brennan 1981, Stefani et al. 1998, revisado por Scollard et al. 2006,
Bührer-Sékula et al. 2008).
Outros estudos propuseram a produção de análogos sintéticos do PGL-I, da
porção mono, di ou trissacarídea associados a carreadores hidrossolúveis (BSA/HSA),
ecomo monossacarídeo–octyl–BSA (M-O-BSA), dissacarídeo natural-octyl–BSA (ND–
O–BSA), dissacarídeo natural-octyl–HSA (ND-O-HSA), trissacarídeo natural-phenil–
BSA (NT-P-BSA) e o trissacarídeo natural-phenil– HSA (NT-P-HSA). Estes antígenos
são utilizados atualmente por diversos grupos de pesquisa em hanseníase (BührerSékula et al. 2000).
A sorologia anti-PGL-I possui baixa sensibilidade para pacientes paucibacilares,
pois forma-se um baixo título desses anticorpos, além de que em áreas endêmicas uma
proporção de indivíduos saudáveis pode ser anti-PGL-I positiva (Stefani et al. 1998,
54
revisado por Stefani 2008). A sensibilidade do teste anti-PGL-I é de até 98% em
pacientes MB e de cerca de 30% em pacientes PB (Bührer-Sékula et al.2003, BührerSékula et al.2008). Com a morte do M. leprae pelo uso da MDT, a síntese de PGL-I é
cessada e o antígeno é eliminado do organismo, consequentemente os níveis de
anticorpos declinam (Silva et al. 2008). Por isto, os títulos de IgM correlacionam-se
com a forma clínica, carga bacilar e a atividade da doença, e apresentam significante
declínio em decorrência do uso da MDT, sendo útil no seguimento do paciente, para
controle de cura ou monitorar recidiva, onde há aumentos dos títulos (Bührer-Sékula et
al. 2008).
Alguns estudiosos defendem ouso do anti-PGL-I em associação com parâmetros
clínicos para classificação e monitoramento dos pacientes multibacilares e não como
ferramenta diagnóstica única das formas multibacilares de hanseníase. Os resultados da
sorologia anti PGL-I podem ser úteis para a classificação/diferenciação de pacientes
MB/PB e podem contribuir para decisões terapêuticas adequadas (Bührer-Sékula et al.
2007).A detecção rápida de anticorpos anti-PGL-I pode ser feita por método do fluxo
lateral (“MLflow”), que possue especificidade e sensibilidade semelhante ao método de
ensaio imunoenzimático(“Enzyme-Linked Immunosorbent Assay” ELISA) anti-PGL-I
e apresenta maior facilidade de execução (Bührer-Sékula et al, 2003, Bührer-Sékula et
al, 2008, Stefani et al. 2012).O teste dipstick, POC, para detecção de anticorpos antiPGL-I que fornece resultados em 3 horas e apresenta 97.2% de concondância com os
resultados do ELISA, e não requer equipamentos sofisticados nem reagentes
refrigerados. Já no fluxo lateral o resultado é imediato e feito com sangue total, em
qualquer local onde estiver o paciente (Bührer-Sékula et al. 1998).
A presença de anticorpos anti PGL-I em contatos domiciliares de pacientes MB
é considerada fator de risco para desenvolvimento de hanseníase. Contatos que
apresentam anticorpos anti PGL-I tem oito vezes mais risco de desenvolver hanseníase
do que contatos soronegativos. Entre os contatos soropositivos para o PGL-I o risco de
desenvolver hanseníase do tipo MB é de 34 vezes (revisado por Scollard et al. 2006). O
seguimento dos contatos de pacientes MB pode permitir o diagnóstico precoce e a
quimioprofilaxia deste grupo de risco poderia prevenir a transmissão da hanseníase.
(Oskam & Bührer-Sékula 2003). Num seguimento de 5 (cinco) anos, observou-se que
2% dos contatos de MB desevolveram a hanseníase e apresentaram um risco de 3,8 de
desenvolver a doença (Goulart et al. 2008).
55
O genoma do M. leprae (Leproma), cujo sequenciamento foi finalizado em
2001, possui 1605 genes codificadores de proteínas em um total de 3.268.203 pb.
Aproximadamente 165 destes genes codificadores de proteínas nãopossuem ortólogo
em Mycobacterium tuberculosise mais da metade dos genes do M. tuberculosis está
ausente no genoma do M. leprae (Cole et al. 2001). O sequenciamento genômico
completo do M. leprae representou um avanço na elucidação da biologia deste bacilo e
abriunovas possibilidades de identificação de antígenos que possam ser utilizados como
reagentes para diagnóstico ou vacina para a hanseníase (Aseffa et al. 2005). Desde o
sequenciamento do genoma do M. leprae, vários laboratórios de pesquisa examinaram
cerca de 200 proteínas recombinantes (Geluk et al. 2011),
quanto a
reatividade
humoral e celular e quanto ao potencial uso no desenvolvimento de testes “point of
care”. Estes testes poderiam contribuir para a classificação de pacientes com hanseníase
(PB/MB), triagem de indivíduos saudáveis e de contactantes de MB com alto risco de
adoecimento e permitir o diagnóstico precoce e monitorização do tratamento.
Recentemente vários estudos, baseados em sequências genômicas, têm
identificado novas proteínas ou peptídeos específicos do M. leprae, que são apropriados
para o sorodiagnóstico da hanseníase. Diferentes estudos têm avaliado
a
imunorreatividade de várias proteínas recombinantes do M. leprae em pacientes com
hanseníase e controles. Estas podem ser associadas ao teste com o PGL-1, na tentativa
de melhorar a sensibilidade do mesmo para os pacientes PB (revisado por Stefani 2008).
Mais recentemente, testes sorológicos (ELISA) para detecção de anticorpos da
classe IgG contra proteínas recombinantes do M. leprae tem revelado novos antígenos
candidatos ao uso no diagnóstico sorológico da hanseníase, especialmente para
pacientes com hanseníase MB (Duthie et al. 2007, Geluk et al. 2009, Corstjens et al.
2011,Duthie et al. 2010). Dentre as proteínas avaliadas, ML0405, ML2331 e ML2055
demonstraram altas taxas de reconhecimento por pacientes LL/BL. Pacientes com
tuberculose e controles saudáveis não endêmicos mostraram baixa reatividade
sorológica. No polo paucibacilar da doença baixas taxas de reconhecimento foram
encontradas, assim como nos contatos de pacientes MB (Geluk et al. 2010, Geluk et al.
2011, Geluk 2013).
O diagnóstico precoce da hansneíase reduz a transmissão e sequelas dos
pacientes, Apesar da redução da prevalência da hanseníase em todo o mundo, como
resultado do uso generalizado de poliquimioterapia, a incidência permanece
relativamente estável, mostrando que há transmissão e o diagnóstico é feito tardiamente
56
(Duthie et al. 2010, Geluk et al. 2010, Geluk 2013,Richardus et al. 2013). Com a
finalidade de desenvolver uma alternativa diagnóstica eficaz, simples, rápida e barata,
foi analisada a resposta sorológica de anticorpos para identificar proteínas de M. leprae,
que são reconhecidas pelos pacientes de hanseníase. Uma nova proteína de fusão,
baseado em estudos anteriores, foi construída unindo as proteínas ML0405 e ML2331,
denominada LID-1 (Leprosy IDRI Diagnostic). Esta foi testada em diferentes
populações (Brasil, Filipinas e Japão) para ver a influência da localização geográfica no
reconhecimento dos antígenos. A LID-1 manteve a atividade diagnóstica e era capaz de
diagnosticar casos de hanseníase com 6 a 8 meses antes do início dos sintomas
clínicos.A taxa de reconhecimento de LID-1 foi de 87% entre os MB e 20% entre os
PB, indicando grande potencial para o uso de LID-1 para o diagnóstico da hanseníase
MB. Entre os controles endêmicos apenas 4% foram sororeativos para esta proteína de
fusão. O aumento dos anticorpos anti LID-1 foi maior do que os anticorpos anti PGL-I,
indicando que LID-1 poderia fornecer um diagnóstico mais precoce da hanseníase
(Duthie et al. 2007).
Outro estudo, mais de 100 antígenos recombinantes foram analisados em um
formato de matriz de proteína para selecionar aqueles com propriedades
discriminatórias para diagnóstico de hanseníase. O estudo foi com a metodologia
ELISA e os dados deste indicam que os pacientes multibacilares podem ser distinguidos
de pacientes paucibacilares, e ambos estes grupos podem ser separados de grupos de
controle endêmico. Foi demonstrado o desempenho destes antígenos em formatos de
teste rápido com o objetivo de desenvolver um teste de diagnóstico“point-of-care”
(Duthie et al. 2008).
Estudo posterior, foi projetada e produzida uma proteína de fusão quimérica com
multiepítopos, a proteína para o diagnóstico rápido da hanseníase (“protein advances
diagnostic of Leprosy” [PADL]), a partir da fusão dos epítopos reativos de proteínas
recombinantes do M. leprae (ML0405, ML2311, ML2055, ML0049, ML0050 ML0091
e ML0411). A proteína foi avaliada em soro de pacientes com hanseníase MB e PB de
São Paulo/Brasil e de Cebu/Filipinaspacientes com hanseníase MB e PB e controles
endêmicos.
Foi demostrado que todas as porções da proteína mantinham sua
capacidade de ligação a anticorpos e a proteína oferecia grande acurácia no diagnóstico
de pacientes MB. Entre os controles saudáveis endêmicos não foi observada resposta
para PADL. Entretanto, outros estudos devem ser realizados para avaliar se PADL pode
fornecer o diagnóstico precoce da hanseníase (Duthie et al. 2010).
57
1.9.4.2- Avaliação da imunidade celular a peptídeos e proteínas recombinantes do
M. leprae
Os testes que avaliam a imunidade humoral têm pouca relevância para o
diagnóstico dahanseníase PB, já que esta apresenta resposta de anticorpos fraca ou
ausente. Estudos que utilizam a detecção de IFN-γ, como marcador de imunidade
celular, após estímulo de células sanguíneas com proteínas recombinantes ou peptídeos
sintéticos do M. leprae, têm o objetivo de desenvolver um método diagnóstico para
hanseníase PB. A secreção de IFN-γ em resposta a proteínas e peptídeos do M. leprae é
observada tipicamente em pacientes TT/BT, contatos domiciliares e controles
endêmicos (Duthie et al. 2008a; Geluk et al. 2005; Geluk et al. 2009; Geluk et al. 2010;
Sampaio et al. 2011; Geluk et al. 2012; Sampaio et al. 2012, Geluk 2013).
Ensaios baseados na liberação de IFN-γ (“Interferon-Gamma Release Assays”
IGRAs) foram desenvolvidospara o diagnóstico de TB latente. Estes se baseiam na
detecção de IFN-γ após estimulação com os antígenos ESAT-6, CFP-10 e TB7.7, que
são expressos especificamente no M. tuberculosis. Existem dois IGRAs no mercado
para diagnóstico de tuberculose latente: “QuantiFERON-TB Gold In-Tube assay” e “TSPOT.TB assay”(Cattamanchi et al. 2011).De modo semelhante tem se buscado o
desenvolvimento deIGRAs para o diagnóstico da hanseníase PB. Neste sentido os
homólogos de ESAT-6 e CFP-10 na tuberculose, a ML0049 e a ML0050 na hanseníase,
respectivamente, presentes no M. leprae foram testados e houve reconhecimento destes
antígenos por células T de pacientes com tuberculose, limitando o potencial uso destes
antígenos em áreas endêmicas para TB (Geluk et al. 2009, Geluk 2013).
Pesquisadores
avaliaram
a
imunorreatividade
celular
a
4
proteínas
recombinantes do M. leprae e a 58 peptídeos sintéticos em pacientes com hanseníase e
grupos controles do Brasil, a partir da detecção de IFN-γ em sobrenadantes de cultura
de células sanguíneas polimorfonucleares de sangue periférico (PBMC). Dos 58
peptídeos testados, 35 induziram respostas com produção de IFN-γ somente nos grupos
paucibacilares e contactantes (Spencer et al. 2005).
Estudo que avaliou estratégias para aumentar a sensibilidade do ensaio de
sangue total com dois peptídeos (p1-15 e 11-25) da proteína ML2531 pela adição de
citocinas, adição de anticorpos anti CD49, CD28, CD40, IL-10 ou CD40L e pela
manosilação de peptídeos, demonstrou que somente a citocina IL-12 aumentou a
58
produção de IFN-γ em cultura de sangue total em amostras de pacientes com hanseníase
BT da Holanda. Diferente do esperado, nenhum dos anticorpos teve impacto no
aumento da secreção de IFN- γ pelas células T. A manosilação não aumentou a
sensibilidade do ensaio, entretanto permitiu utilizar uma quantidade 100 vezes menor
dos peptídeos, diminuindo o custo do teste (Geluk et al. 2010).
Estudo do nosso grupo avaliou um painel de proteínas recombinantes de M.
leprae para avaliar as respostas de células T, medida pela produção de IFN-γ, entre os
pacientes de hanseníase. O estudo foi com ensaios simples de sangue total, que são mais
aplicáveis no campo ou situações clínicas. As respostas de células Tno WBA de
indivíduos de Goiânia-Brasil demonstraram que vários antígenos de M. leprae
(ML0276, ML0840, ML1623, ML2044 e 46f) suscitaram produção de IFN-γ maior que
0,5 UI/ml e estas proteínas foram classificados como imunogênicas e hanseníase
específica. Vários destes antígenos individuais foram reconhecidos por células emmais
de 60% dos pacientes PB e ML0276, ML0840, ML1623 e 46f complementavam uma a
outra, tal que 82% dos pacientes PB tinham respostas fortes (IFN-γ > 1,25 UI/ml) para
pelo menos uma destas proteínas. Mas, estas proteínas também foram reconhecidas por
parte significativa dos contatos familiares dos pacientes MB, em contraste, com poucas
respostas observadas em pacientes com tuberculose ativa ou grupos de controle
saudável de áreas de endemicidade. Os resultados indicam vários antígenos são
potenciais candidatos que podem ser úteis para o diagnóstico de hanseníase ou
vacinação e demonstra a utilidade da hanseníase WBA que pode ser aplicado
amplamente em contextos clínicos ou de campo (Duthie et al. 2008).
Outro estudo do nosso grupo de pesquisa comparou paralelamente a resposta de
anticorpos e de células T, produção de IFN-α, de pacientes com hanseníase MB e PB,
contatos domiciliares de pacientes MB, controles saudáveis de área endêmicas e
pacientes com TB pulmonar provenientes de Goiânia/Goiás. Um painel de 33 proteínas
recombinantes foi avaliado quanto à imunogenicidade e especificidade da resposta por
meio de ELISA e ensaio de sangue total. Destas 33 proteínas avaliadas, 16 delas foram
imunogênicas e estimularam a produção de IFN-α em pacientes PB e contatos
domiciliares ou foram reconhecidas por anticorpos IgG de pacientes com hanseníase
MB. As proteínas ML0405, ML2331 e ML2055 foram reconhecidas por anticorpos e
por resposta imune celular específica para o M. leprae. As proteínas ML1632, ML1685,
ML1556, ML2044, ML0276 e ML0840 foram imunogênicas, entretando somente a
resposta de IFN-α foi específica. As proteínas ML2358, ML2346, ML2541, ML2603,
59
ML0022, ML2380 e ML2203 foram imunogênicas, mas houve reconhecimento por
anticorpos e produção de IFN-α em todos os grupos testados, ou seja, eram proteínas
imunogênicas, mas seu reconhecimento foi inespecífico. As outras 17 proteínas
avaliadas foram não imunogênicas, não reagiram no ensaio de sangue total nem no
ELISA para detecção de IgG. O número de proteínas capazes de estimular a resposta de
IFN-α foi superior ao número de proteínas que foram reconhecidas por anticorpos IgG.
A análise paralela da resposta imune celular e humoral a estas proteínas permitiu
concluir que somente proteínas que foram capazes de induzir imunidade celular/IFN-α
foram também reconhecidas por anticorpos. Além disso, os resultados deste estudo
mostraram que as análises in silico não devem ser o único critério para exclusão de
antígenos, visto que proteínas com alta homologia com proteínas de outras
micobactérias não apresentaram reatividade cruzada. Por exemplo, a proteína ML2331
apresentou mais de 80% de homologia com várias proteínas de outras micobactérias,
entretanto quando avaliada não apresentou reatividade cruzada na resposta imune
humoral e celular. Por outro lado a proteína ML2346 que não apresentou homólogo em
M. tuberculosis nem em outras micobactérias ambientais apresentou reatividade
cruzada, estimulando resposta de IFN-α em todos os grupos avaliados (Sampaio et al.
2011).
Como a resposta de IFN-α para as proteínas e peptídeos do M. leprae é
praticamente idêntica entre os casos TT/BT e contatos domiciliares, outros
biomarcadores que sejam capazes de distinguir estes dois grupos tem sido investigados.
Em recente estudo nosso grupo de pesquisa analisou 14 biomarcadores (eotaxina, IFNγ, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12p70, IL-15, IL-17A, IL-23, IL-31, CXCL10
(IP10)e TNF-α) em pacientes com hanseníase PB e MB e em contatos de pacientes MB.
Neste estudo, nenhum destes biomarcadores foi capaz de distinguir a resposta de
pacientes com hanseníase TT/BT da resposta de contatos domiciliares de pacientes MB,
confirmando resposta com perfil Th1 em ambos os grupos. Houve produção de IL-4 em
ensaio de sangue total de pacientes BL/LL. Entretanto, um contactante de paciente MB
apresentou resposta imune do tipo Th2 e ausência de IFN-γ, o que poderia indicar
doença MB inicial ou subclínica. A confirmação deste achado é essencial para
determinar o valor prognóstico deste imunomarcador (Sampaio et al. 2012).
Outro estudo recente de biomarcadores, avaliou a resposta a 17 proteínas
recombinantes e 19 biomarcadores (IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL12p70, IL-13, IL-17A, IFN-γ, CXCL10, FSC-G, FSC-GM, MCP-1, CXCL9, MIP-1β e
60
TNF-α), com o objetivo de encontrar biomarcadores que distinguissem controles
endêmicos de pacientes TT/BT. Foram avaliadospacientes com hanseníase PB, contatos
domiciliares, pacientes com TB pulmonar e controles endêmicos provenientes do Brasil
(Fortaleza), Bangladesh, Coréia do Sul e Etiópia. Apenas, a proteína ML2478 foi capaz
de estimular resposta de células T específica em grupos geneticamente diversos
(Africano, Asiático e da América do Sul). A citocina IL-1β e as quimiocinas MIP-1β e
MCP-1 foram capazes de diferenciar pacientes TT/BT e controles endêmicos.
Entretanto, foi observada resposta entre contatos domiciliares e em pacientes com
tuberculose (Geluk et al. 2012).
Os resultados de vários estudos que pesquisaram a resposta imune celular de
pacientes com hanseníase e grupos controles a peptídeos sintéticos e proteínas
recombinantes do M. leprae são de extrema importância, pois abrem caminho para a
realização de novas pesquisas que buscam testes sensíveis e específicos para serem
utilizados no diagnóstico de rotina da hanseníase, além de antígenos candidatos ao
desenvolvimento de uma vacina contra a hanseníase(Geluk et al. 2009, Duthie et al.
2008, Duthie et al. 2010, Sampaio et al. 2011, Geluk et al. 2012, Sampaio et al. 2012).
1.9.4.3- Testes cutâneos para avaliação da imunidade celular ao M. leprae
O teste cutâneo para avaliação da imunidade celular ao M. lepraemais utilizado
em hanseníase foi o da lepromina ou Reação de Mitsuda, que é uma reação de
hipersensibilidae tardia aos antígenos M. leprae, e é associado com a capacidade de
desenvolver uma resposta imune granulomatosa, envolvendo células apresentadoras de
antígeno e participação de linfócitos CD4. A lepromina de Mitsuda consiste de bacilos
autoclavados e cada ml da solução de contém 4,0x10 7(40 milhões) de BAAR (WHO
1989a). O teste é feito com injeção intradérmica de 0,1 ml da solução aplicado na face
ventral do antebraço, e a leitura da reação é feita 24 a 28 dias após a aplicação. O teste
positivo é aquele que mostra induração igual ou maior que 4,0 mm, e o ideal é que
também fosse avaliada a resposta por biópsia e exame histopatológico do local do teste
(WHO 1989a, revisado por Talhari & Neves 1997, revisado por Scollard et al. 2006).
O teste de Mitsuda não serve para ser utilizado no diagnóstico da doença, pois
não é específico para a hanseníase devido a forte reatividade cruzada com micobactérias
ambientais não patogênicas e a vacinação BCG e pode apresentar respostas positivas em
indivíduos que nunca foram expostos ao M. leprae (WHO 1989a, revisado por Talhari
& Neves 1997, Geluk et al 2012). Na hanseníase PB, o teste cutâneo é, na maioria das
61
vezes positivo, enquanto que pacientes LL tipicamente não apresentam resposta, ou
seja, são negativos ao teste. Embora a resposta à lepromina de Mitsuda não seja
específica para a hanseníase, uma resposta negativa é associada a forma MB, sem
capacidade para responder ao M. leprae e de eliminar os bacilos (revisado por Scollard
et al. 2006, Goulart et al. 2008, revisado por Geluk et al. 2012).
Atualmente, o teste de Mitsuda (intradermorreação de Mitsuda) não está mais
previsto nas rotinas dos serviços públicos de diagnóstico e tratamento da hanseníase. O
Guia de Controle da Hanseníase, de 1993, ainda ensinava a sua execução
(Brasil/Ministério da Saúde 1993).
1.9.4.4- Outros meios auxiliares de diagnóstico
O comprometimento de nervos periféricos é uma constante nos casos de
hanseníase, devendo ser investigado para corroborar os achados clínicos e afastar ou
confirmar a doença como causa da mesma. A eletroneuromiografia é um exame
complementar e não estabelece o diagnóstico etiológico, mas neuropatia múltipla em
área endêmica, até que se prove o contrário pode ser hanseníase. Esta pode ser
importante na orientação dos atos cirúrgicos de descompressão neural, localizado o
processo e também no estabelecimento de ramos nervosos a serem biopsiados para
diagnóstico das formas neurais puras (Coelho 2013).
1.10 – Diagnósticos Diferenciais
Os diagnósticos diferenciais em hanseníase são numerosos, tanto no aspecto
clínico quanto histopatológico, sendo assunto para livros específicos. Daí também a
necessidade de uma classificação acurada, não apenas baseada em critérios clínicos, que
levam a inúmeros erros de diagnóstico e terapias intempestivas e incorretas (Ridley &
Jopling 1966, Single-lesion Multicentric Trial Group 1997, Scollard 2004, Pardillo et al.
2007, Teixeira et al. 2008, Job & Chandi 2001, Manifold & Marshman 2009). A
banalização do diagnóstico é feita com a classificação da OMS e MS/Brasil, baseada no
número de lesões.
A hanseníase pode ser confundida clinicamente com outras doenças de pele e
com outras doençasneurológicas que apresentam sinais e sintomas semelhantes aos
seus. Portanto, deve serfeito diagnóstico diferencial em relação a essas doenças.
Existem doenças que provocam lesões de pele semelhantes às lesões característicasda
hanseníase, e que podem ser confundidas com as mesmas. Afirmação leviana encontra-
62
se no Guia 2002/MS/Brasil: “A principal diferença entre a hanseníase e outras doenças
dermatológicas é que as lesõesde pele da hanseníase sempre apresentam alteração de
sensibilidade. As demais doençasnão apresentam essa alteração”(Brasil/Ministério da
Saúde 2002). Há um alforisma em medicina que diz: “em Medicina e no amor, nem
sempre nem nunca”. Alteração de sensibilidade nem sempre está presente na
hanseníase, como nas lesões da face, ou mesmo são muitos subjetivas e por vezes de
difícil caracterização clínica.
As principais doenças de pele que fazem diagnóstico diferencial com hanseníase
são: pitiríase versicolor (pano branco), eczemátide, tinha do corpo, vitiligo, esclerose
tuberosa, nevo acrômico, eczemas, psoríase, lúpus vulgar, pitiríase rósea, lintomas
cutâneos,
xantomatose,
esclerodermia,
granuloma
anular,
sarcoidose,
sífilis,
leishmaniose cutânea, neurofibromatose, etc (Guinto et al. 1986, Opromolla& Ura 2002,
Brasil/Ministério da Saúde 2002, Walker & Lockwood 2007, Samapio & Rivitti 2011).
O diagnóstico diferencial também deve ser feito em relação a outras doenças
neurológicas, como: a síndrome do túnel do carpo, neuralgia parestésica, neuropatia
alcoólica, neuropatia diabética e lesões por esforços repetitivos (Brasil/Ministério da
Saúde 2002).
Do ponto de vista histopatológico, a hanseníase pode ser confundida com várias
outras doenças granulomatosas ou não. Job e Chandi tem um livro específico para este
fim, onde faz uma interessante abordagem clínico-patológica. Segundo eles doenças que
relembram a hanseníase indeterminada: pitiríase versicolor, sífilis secundária,
oncocercose, dermatite seborréica, vasculite linfocítica, pitiríase alba, cicatriz pósinflamatória, hipopigmentação nutricional, esclerodermia (morféia), vitiligo e o nevo
hipocrômico. As doenças que relembram da hanseníase tuberculóide e borderleine são:
lúpus vulgar, tuberculose cutânea verrucosa, tubercúlide, sífilis terciária, pinta,
cromomicose, esporotricose, blastomicose, granuloma anular, necrobiose lipoídica,
granuloma multiforme, urticária, eritema anular centrífugo, psoríase vulgar, líquen
nítico, líquen plano, pitiríase rósea, lúpus eritematoso discoide, erupção polimorfa à luz,
e o frinoderma. Já as doenças que relembram a hanseníase lepromatosa são:
neurofibromatose, lipomatose múltipla, dermatofibroma, leucemia “cutis”, micose
fungoide, sarcoma de Kaposi, queloide, verruga vulgar, molusco contagioso,
leishmaniose dérmica pós-calazar, eritema nodoso, síndrome de Weber-Christian, acne
vulgar, rosácea, eritema multiforme, actinomicose, hipotireoidismo e a “normal shiny
waxy skin” (Job & Chandi 2001).
63
Como fazer o diagnóstico diferencial morfológico entre a plêiade de doenças não
será tema abordado nesta tese.
1.11- Reações Hansênicas
A evolução clínica crônica da hanseníase pode ser interrompida por fenômenos
inflamatórios agudos denominados episódios reacionais, que podem ocorrer nos
pacientes virgens de tratamento, antes da MDT, durante ou após a terapia específica.
São classificados como reação tipo 1 e tipo 2, sendo condições distintas que ocorrem
separadamente mas podem surgir em momentos diferentes no mesmo paciente e ambas
podem resultar em perda definitiva da função neural (Ridley & Jopling 1966, Scollard
1994, revisado por Scollard et al. 2006). Alguns autores consideram a neurite como uma
forma especial de reação, classificando os episódios reacionais em três tipos (Nery et al.
2006). A neuropatia pode ser silenciosa, termo proposto para descrever a ocorrência do
dano neural na ausência de sintomas (Jopling 1965, Britton e Lockwood 2004, Walker e
Lockwood 2007, van Brakel &Lockwood 2008).
Os episódios reacionais podem incidir em qualquer das formas clínicas, sendo
rara sua detecção na hanseníase indeterminada (Scollard 1994, revisado por Foss et al.
2003, Ney et al. 2006).
Os episódios reacionais decorrem do processo inflamatório e resposta
imunológica mediada por antígenos do M. leprae, e estabelecem relação com a carga
bacilar e a resposta imune do hospedeiro. Cerca de 30 a 50% dos pacientes apresentam
os episódios reacionais, que se não diagnosticadas e tratadas precocemente, podem
deixar sequelas e incapacidades (Lockwood et al. 1993, Scollard et al. 1994, revisado
por Foss et al. 2003, Walker & Lockwood 2008, revisado por Nery et al 2006, revisado
por Scollard et al. 2006, revisado por Grossi 2013).
Em um estudo epidemiológico prospectivo sobre reações, 45% da coorte
desenvolveu reação; 32% dos pacientes considerados em risco desenvolveram reações
do tipo 1 e 37% dos pacientes considerados em risco desenvolveram reações de tipo 2.
Apesar da predominância de homens entre os pacientes de hanseníase, reações do tipo 1
ocorreram com frequência significativamente maior em mulheres e não parece ser
influenciada pela idade de início da lepra. Indivíduos experimentando uma reação do
tipo 1 não eram propensos a experimentar uma recorrência, sugerindo que os
mecanismos imunológicos desta reação podem ser limitados ou regulados por fatores
genéticos ou imunológicas. Reações do tipo 2, por outro lado, ocorreram com igual
64
frequência em homens e mulheres, mas foram altamente associadas com o aparecimento
da hanseníase na segunda década de vida. Indivíduos que experimentaram reações tipo
2 muitas vezes tinham uma ou mais recorrência da reação (Scollar et al. 1994).
Em uma população de pacientes brasileiros do Rio de Janeiro com baciloscopia
positiva, 25% apresentaram reação tipo 1 durante o período de 2 anos de tratamento
com MDT (Nery et al. 1998). Em um estudo retrospectivo feito em um centro de
referência no Nepal em pacientes com forma borderline 30% desenvolveram reação tipo
1 (van Brakel et al. 1994). Neste estudo, a metade dos indivíduos que teve reação tipo 1
apresentou dano neural. Em uma coorte de pacientes multibacilares recrutados em dois
centros de referência na Índia observou-se taxa de 19,8% de reação tipo 1 na primeira
avaliação e de 2,0% de reação tipo 2 (van Brakel et al. 2005). Estudo prospectivo do
Vietnã detectou taxa de 29,1% de reação tipo 1 (Ranque et al. 2007).
1.11.1- Reação Tipo 1 (RT1 ou Reação Reversa)
A RT1 acomete principalmente pacientes tuberculoides e borderlines (BT, BB e
BL) e estima-se que cerca de um terçodestes pacientes podem apresentar a reação,
principalmente nos primeiros 6 meses de PQT. A RT1 raramente ocorre vários anos
após o término do tratamento com PQT e nesta situação pode ser difícil a distinção entre
RT1 tardia e recidiva da doença (Scollard et al. 1994, Manandhar et al. 2002, Brito et al
2005, Misch et al 2008).A incidência da RT1 na forma LL é significamente menor do
que na forma BL e sua ocorrência pode ser observada na forma TT (revisado por Foss et
al. 2003, revisado por Nery et al. 2006). Pacientes com formas polares também podem
apresentar reação tipo 1, associada a uma exacerbação da resposta imune celular tipo
Th1, com predominância de expressão de citocinas IL-2, IFN-γ e IL-12 (Stefani et al.
2003).
A RT1 resulta do aumento na imunidade celular, resposta Th1, aos antígenos do
M. leprae, mas a causa desta alteração imunológica e o seu mecanismo são
desconhecidos (Scollard 2008). Há aumento das citocinas IFN-γ e IL-12 (Sreenivasan et
al. 1998), TNF-α e IL-1 (Sarno et al.1991), IL-2, IL-6 e IL-8 (Moraes et al.1999).
Os antígenos do bacilo são encontrados no interior dos macrófagos na pele e
dentro das células de Schwann nos nervos periféricos dos pacientes com RT1. Estudos
mostraram que o número e a porcentagem de linfócitos T CD4+, que secretam IFN-γ,
IL-12 e TNF-α, estão aumentados nas lesões de RT1. Foi demonstrado, em estudo
recente, que a expressão do RNA mensageiro (RNA-m) das quimiocinas IL-8, proteína-
65
1 quimiotática de monócitos (MCP-1) e fator regulado por ativação, expresso e
secretado por células T normais (RANTES) é maior nas lesões cutâneas durante a RT1.
NaRT1 tem sido documentado aumento na expressão dos genes de várias citocinas próinflamatórias (IL-1, IL-2, IL-12, IFN-γ, TNF-α) localmente, nas lesões de pele, e
sistemicamente, no soro e nas células mononucleares periféricas (Moraes et al 1999).
Estudos de imuno-histoquímica mostraram coloração mais intensa para TNF-α na pele e
nervos durante a RT1 quando comparado com controles de hanseníase não reacionais.
Produção de citocinas pelos linfócitos do sangue periféricoe concentrações de citocinas
séricas TNF-α e IL-1β também estão elevadas durante a RT1. Entretanto, os níveis de
citocinas circulantes podem não refletir as alterações observadas na pele durante o
episódio de RT1. Todas estas evidências apontam para aumento da resposta imune do
tipo Th1 durante a reação tipo 1 (Walker & Lockwood 2006).
A RT1 manifesta-se clinicamente pelo aparecimento de novas lesões por
exacerbação de lesões pré-existentes com eritema, infiltração,calor local, dore edema,
edema de pés, mãos e facepode ser característico da RT1. Na maioria das vezes a RT1
apresenta evolução gradual, sendo que seu curso natural pode durar várias semanas.
Estes episódios geralmente não cursam com comprometimento sistêmico e nos casos
graves podem ocorrer ulceração e necrose acentuada das lesões (Naafs 1992). Apesar de
apresentar um quadro clínico, geralmente, bem localizado, a RT1 é extremamente
preocupante, pois está frequentemente associada ao envolvimento de um ou mais nervos
periféricos, neurites, e consequentemente paralisias e incapacidades (Scollard 1994, van
Brakel et al. 1994, Talhari & Neves 1997, Sampaio & Rivitti 1998).
Na RT1 não se observam alterações de exames laboratoriais, hematológicas,
função hepática e renal, durante o episódio reacional. As características histopatológicas
da RT1 são: edema, aumento do número de linfócitos na derme e perda da organização
do granuloma. Com o tempo há um aumento do número de células gigantes tipo
Langhans (Job 1994). Foss refere aumento do número de células epitelioides, de células
gigantes e linfócitos e redução do número de bacilos (Foss et al. 2003). Antígenos de M.
leprae foram demonstrados em nervos e pele de pacientes com reação tipo 1 localizados
nas células de Schwann e macrófagos (Lockwood et al. 2002). As células de Schwann
expressam receptores Toll-like-2 (Oliveira et al. 2003). Segundo Scollard RT1 não é um
diagnóstico histopatológico.
Dentre os principais fatores de risco citados para a ocorrência da RT1, são: sexo
feminino, forma clínica multibacilar (doença difusa, mais de 2 áreas corporais
66
acometidas), maior número de lesões, formas borderlines imunologicamente instáveis
da hanseníase (Lienhardt & Fine, 1994); idade mais avançada; índice baciloscópico
mais alto, consideradofator de risco para episódios múltiplos (Ranque et al. 2007), grau
de incapacidade física 1 ou 2 ao diagnóstico; ocorrência de reação após início da PQT,
ou durante o primeiro ano de tratamento (van Brakel et al. 1994), ou durante o puerpério
(Lockwood & Sinha 1999); sorologia positiva para os anticorpos anti-PGL-I(Stefani et
al. 1998); e uso de infliximab para tratamento de outras doenças (ex: Doença de Crohn,
artrite reumatoide e psoríase) (Scollard et al. 2006).
Um estudo identificou que indivíduos comidade de 15 anos ou mais ao
diagnóstico de hanseníase é fator de risco independente para a ocorrência de
RT1(Ranque et al. 2007). Scollard e cols. publicaram relato dos dois primeiros casos de
hanseníase que se manifestaram pós-início de terapia biológica para artrite reumatoide
com Infliximab, droga que se liga ao TNF-α bloqueando sua ação, sendo que ambos
pacientes desenvolveram RT1 após descontinuação desta terapêutica (Scollard et al.
2006).
O infliximab é um inibidor de TNF-α, capaz de ativar infecção latente pelo M.
leprae ou M. tuberculosis em pacientes que desenvolveram tuberculose pulmonar ou
hanseníase. O TNF-α tem papel crítico na granulogenese e no controle da infecção por
micobactéria prevenindo a sua disseminação. Pacientes apresentando co-infecção HIVhanseníase, após a introdução de HAART (Highly Active Anti Retroviral Therapy)
podem apresentar reação reversa devido à Síndrome de Reconstituição Imune que
consiste em uma reorganização da imunidade. Esta síndrome é ocorre da 4ª. à 24ª.
semana após a introdução da terapia anti-retroviral devido ao aumento das células
CD4+ (Pereira et al. 2004; Ustianowski et al. 2006). Em estudo de pacientes com lesão
única de hanseníase tratados com esquema de dose única ROM e acompanhados por 3
anos, o aumento da idade e a positividade ao DNA de M. leprae detectado por PCR em
biópsias de pele, estiveram associados à maior chance de ocorrência de reação
hansênica tipo 1 (Sousa et al. 2007).
1.11.2- Reação Tipo 2 (RT2 ou Eritema Nodoso Hansênico)
A manifestação clínica mais frequente da RT2 é oEritema Nodoso Hansênico
(ENH), que são nódulos inflamatórios, eritematosos, de surgimento súbito, dolorosos,
disseminados, mais palpáveis do que visíveis, subcutâneos, que na histopatologia
mostra uma paniculite. Estes aparecem principalmente nos membros, de etiologia
67
variada, mas se presente nos membros superiores e inferiores a causa mais provável é a
hanseníase (Sampaio & Rivitti 2011). Podem aparecer em áreas do corpo, que não
haviam sido acometidas previamente, pápulas superficiais ou profundas ou ainda por
formas ulceradas, necróticas, pustulares e bolhosase com comprometimento sistêmico,
febre, mal-estar, sudorese, caquexia, ataxia, náuseas, vômitos e mialgia (revisado por
Guerra et al. 2002, Foss et al. 2003).
Na reação tipo 2, pode haver edema periférico, enfartamento ganglionar
generalizado, artralgias, mialgias, iridociclite, fotofobia, lacrimejamento, orquite,
artrites, epididimite, neurite, edema de mãos, pés e face (Guerra et al. 2002, Talhari &
Neves 1997,Sampaio & Rivitti 2011). Nas formas graves, as lesões cutâneas podem
ulcerar caracterizando o ENH necrotizante. O curso natural do ENH é de uma a duas
semanas, entretanto muitos pacientes apresentam recorrências durante vários meses.
Estes episódios acontecem principalmente durante o segundo e o terceiro ano após o
início da MDT, e devido à sua gravidade, são importantes causas de internações
hospitalares, além de gerarem insegurança quanto à cura da doença e muitas vezes
induzir ao re-tratamento, mas podem ocorrer antes, durante e após a MDT (Guerra et al.
2002, Talhari & Neves 1997, Sampaio & Rivitti 2011).
O ENH ocorre principalmente em pacientes multibacilares (BL e LL) e é
considerado
importante
causa
de
morbidade.
Caso
não
seja
pronta
e
adequadamentetratada, a RT2 pode ocasionar em dano neural, paralisias e
deformidades. Antes da introdução da MDT mais de 50% das formas LL e 25% dos BL
tratados com monoterapia com sulfona desenvolviam RT2 durante a evolução da
doença (revisado por Scollard et al 2006, Wlaker e Lockwood 2007). Após a início do
uso da MDT, provavelmente devido ao efeito anti-inflamatório da clofazimina, incluída
ao esquema terapêutico, observou-se declínio da frequência e gravidade de reação tipo
2. A maioria dos pacientes com eritema nodoso hansênico desenvolve múltiplos
episódios durante anos (revisado por Guerra et al. 2002, Scollard et al. 2006). Estudo de
coorte desenvolvido durante 11 anos na Índia mostrou que menos de 10% dos pacientes
tiveram apenas um único episódio de ENH e 62,5% tiveram eritema nodoso crônico
(Pocaterra et al. 2006).
O eritema nodoso hansênico pode ser classificado como leve moderado e grave.
No ENH leve os pacientes apresentam menos de 10 nódulos por segmento corporal
comprometido, localizados mais frequentemente nos membros inferiores, pouco
dolorosos à palpação, sinais e sintomas sistêmicos ausentes ou de leve intensidade. No
68
ENH moderado, os pacientes apresentam de 10 a 20 nódulos por segmento corporal
comprometido, necessariamente mais de um, dolorosos à palpação, associados à febre
de moderada intensidade (<38,4ºC), com discreta sintomatologia sistêmica, podendo
haver comprometimento de cadeia de linfonodos local e/ou regional. Na forma grave de
ENH estão presentes mais de 20 nódulos por segmento corporal comprometido,
dolorosos espontaneamente, podendo haver lesões ulceradas, acometendo geralmente
grande área do tegumento, acompanhado de sintomatologia sistêmica exuberante como
febre alta (>38,5ºC), artralgias, calafrios, cefaleia, anorexia, fadiga e comprometimento
generalizado da cadeia linfonodal (revisado por Guerra et al. 2002).
As alterações nos exames laboratoriais mais frequentemente observadas durante
o ENH são leucocitose com neutrofilia, aumento de proteínas da fase inflamatória
aguda, como a proteína C reativa, aumento de gamaglobulinas (IgM e IgG), aumento
das frações C2 e C3 do complemento e proteinúria. No exame histopatológico, biópsias
cutâneas na RT2 mostram infiltrado inflamatório na derme e no subcutâneo (paniculite).
Em lesões agudas, de até 72 horas de aparecimento, há predomínio de neutrófilos,
podendo também estar presentes eosinófilos e mastócitos (Foss et al 2003). A
histopatologia de lesão cutânea geralmente mostra infiltrado inflamatório neutrofílico
perivascular, compatível com vasculite e numerosos bacilos fragmentados e granulosos
(Job & Chandi 2001, Foss et al. 2003). Biópsias mais tardias apresentam poucos
neutrófilos e aumento do número de linfócitos, plasmócitos e histiócitos, representando
um infiltrado inflamatório crônico. Outras características encontradas no eritema nodoso
incluem o edema da derme e subcutâneo, vasculite e paniculite. O infiltrado na forma
LL pode conter histiócitos com alteração gordurosa e arranjo difuso de células
espumosas. Na forma BL o granuloma pode conter histiócitos e linfócitos (Ridley &
Jopling, 1966). Nas formas LL e BL pode ser encontrada uma grande quantidade de
bacilos, geralmente de aparência granular, “poeira bacilar” (Michalany e Michalany
1988).
Apesar de serem alvo de numerosas investigações clínicas e laboratoriais, a
etiologia e imunopatologia do ENH não são completamente conhecidas. Nas lesões
agudas do ENH há infiltração neutrofílica sobrepondo padrão inflamatório crônico da
hanseníase. Durante muitos anos, acreditou-se que o ENH ocorria em conseqüência de
uma reação mediada por deposição de imunecomplexos circulantes. Entretanto, apesar
das evidências favoráveis a esta teoria, como a deposição de imunoglobulinas e
complemento nas lesões, diminuição do complemento sérico e identificação de alguns
69
constituintes micobacterianos nestes complexos, a presença de imunecomplexos fixos
ou circulantes não foi confirmada por outros estudos (revisado por Guerra et al. 2002,).
A reação tipo 2 parece se originar de uma forte ativação transitória e repentina
da resposta imune Th1, com aumento de IFN-γ, TNF-αe IL-12 circulantes e aumento do
RNA-m destas citocinas nas lesões, com inflamação sistêmica e alterações da
imunidade humoral (Modlin et al. 1985, Scollard et al. 1994, Scollard 2008). Elevados
níveis de TNF-α circulantes têm sido demonstrados em pacientes durante o ENH e
células mononucleares do sangue periférico de indivíduos com ENH secretam elevadas
quantidades de TNF-α após estimulação. Entretanto, estudo recente de Haslett e cols.
demonstrou baixos níveis de TNF-α circulantes em pacientes com forma leve de ENH.
Os autores postulam que quadros de ENH com significativo envolvimento sistêmico
podem produzir níveis circulantes de TNF-α elevados e que isto pode não acontecer nas
formas mais leves desta afecção.Embora ocorra em pacientes com resposta imune do
tipo Th2, vários estudos têm demonstrado altas concentrações das citocinas IFN-γ e
TNF-α (Sarno et al. 1991), IL-2, IL-6 (Moraes et al. 1999; Stefani et al. 2008), IP-10
(Stefani et al. 2008) e baixos níveis das citocinas IL-10 e IL-4 (Moraes et al. 1999,
Teles et al. 2002). A principal subpopulação de células T nas lesões do eritema nodoso
é a célula T CD4+ em contraste com a hanseníase lepromatosa que tem predomínio de
células T CD8+ (Modlin et al. 1986). Contrariamente, foram observadas elevações na
expressão do RNA-m das IL-6, IL-8 e IL-10e expressão mantida do RNA-m das IL-4 e
IL-5 nas lesões de ENH, todas associadas com quimiotaxia de neutrófilos, produção de
anticorpos e redução da imunidade mediada por células (revisado por Guerra et al.
2002,).
Os principais fatores de risco para a ocorrência do ENH são: hanseníase LL,
índice baciloscópico acima de 4 (quatro), idade inferior a 40 (quarenta) anos e sexo
feminino (Manandhar et al. 1999, Foss et al. 2003). Outros fatores como a infiltração
cutânea difusa, gravidez e lactação, ciclo menstrual e primeiro sintoma da doença
durante a adolescência, devido às influências hormonais, também são aventados como
fatores de risco. A relação entre fatores hormonais e genéticos e a incidência de eritema
nodoso não foi ainda elucidada (revisado por Guerra et al. 2002).
Os seguintes fatores desencadeantes para o ENH foram descritos: doenças virais,
outras infecções, febre, vacinação e estresse psicológico, mas não há evidências
científicas convincentes. As reações tipo 2 aparecem mais frequentemente durante o
primeiro ano da PQT e por introdução de drogas como iodetos, brometos, dapsona,
70
rifampicina, claritromicina e ofloxacina (Foss et al 2003, Pocaterra et al. 2006). A
gravidez, lactação, ciclo menstrual, infecções intercorrentes, febre, vacinação e estresse
psicológico podem precipitar o aparecimento de eritema nodoso (Scollard et al. 1994).
1.11.3- O impacto das reações no manejo clínico da hanseníase
As reações hansênicas causam impacto significativo no curso clínico da
hanseníase por vários fatores, dentre os quais se destaca: a evolução flutuante e
espontânea destas reações que leva à deterioração do quadro clínico dos pacientes e,
como ocorre principalmente após o início da MDT, confundem os mesmos, causando
dificuldade na adesão ao tratamento. Além disso, a ocorrência frequente das reações
hansênicas no período pós-alta do tratamento específico confunde os pacientes,
comprometendo a aceitação de cura da doença. Estes episódios reacionais tardios
podem ser consequências da persistência bacilar nos tecidos e devem ser diferenciados
de quadros de recidiva da hanseníase. Adicionalmente, os episódios reacionais
exacerbam a inflamação nos nervos causada pela hanseníase, agravando o dano neural e
potencializando o surgimento de sequelas deformantes e incapacitantes, principais
responsáveis pela manutenção do estigma associado à doença. Como as reações
hansênicas, sobretudo o ENH, apresentam-se frequentemente como emergências
médicas, sendo importantes causas de atendimento médico ambulatorial e internações
hospitalares, esses eventos levam ao afastamento do trabalho e prejuízo na vida social
dos pacientes (Guerra et al. 2002).
1.12- Tratamento: Multidrogaterapia (ou PQT)
A terapia da hanseníase evoluiu do óleo de chalmoogra usado desde a
antiguidade atéa década de 1940, quando surgiu a sulfonoterapia. O tratamento era por
longos tempos, 10, 20 anos, ou até mesmo pela vida inteira e os pacientes eram
confinados em colônias. Em 1977 a OMS recomendou o tratamento com 3 drogas para
evitar resistência, a MDT. Na década de 1990, para fins operacionais, foi instituído pela
OMS, o uso de um sistema declassificação clínica simplificada, baseada na contagem do
número de lesões de pele, em serviços de saúde pública para fim terapêutico (WHO
1994a, WHO 1997, WHO 1998, Scollard 2004, Brasil/Ministério da Saúde 2005, Naafs
2006, Brasil/Ministério da Saúde 2010a). Essa classificação subdivide os pacientes em
duas categorias: PB até 5 (cinco) lesões e MB mais de 5 lesões ou qualquer caso com
bacioloscopia positiva, sendo que o primeiro recebe medicação por 6 (seis) meses ou
71
seis doses e o segundo por 12 (doze) meses ou doze doses. O tratamento é feito com a
distribuição de cartelas padronizadas contendo a medicação (Brasil/Ministério da Saúde
2010a, revisado por Castorina-Silva 2013). Tabela 10 e figura 10.
Tabela 10. Apresentação das cartelas para o esquema padrão da OMS
(Poliquimioterapia/OMS). Brasil/Ministério da Saúde 2009.
Cartela PB
Cartela MB
Cartela MB para criança
Cartela PB para criança
Figura
10.
Cartelas
com
medicamentos
dos
esquemas
padrões
da
PQT
(Poliquimioterapia/OMS) para adultos e crianças, PB e MB. Brasil/Ministério da Saúde
2009.
1.12.1- Tratamento: Multidrogaterapia nos adultos
O tratamento com a MDT para pacientes PB adultos consiste em uma
combinação da rifampicina (uma dose mensal de 600 mg com administração
72
supervisionada) e dapsona, (uma dose mensal de 100mg supervisionada) e uma dose de
100mg auto-administrada, diariamente. A duração do tratamento para pacientes PB é de
seis meses ou tomada de seis doses em 9 (nove) meses (WHO 1994; Brasil/Ministério
da Saúde 2009, Brasil/Ministério da Saúde 2010a). Tabela 11.
O tratamento com a MDT para pacientes MB baseia-se emuma combinação de
rifampicina (uma dose mensal de 600 mg, com administração supervisionada), dapsona
(uma dose mensal de 300 mg com administração supervisionada e uma dose diária de
50mg auto-administrada) e de clofazimina (uma dose mensal de 100mg supervisionada
e uma dose diária de 100mg auto-administrada).A duração do tratamento para pacientes
MB é de um ano ou tomada de doze doses em até 18 (dezoito) meses (WHO 1994;
Brasil/Ministério da Saúde 2009, Brasil/Ministério da Saúde 2010a). Tabela 12.
Tabela 11. Esquema terapêutico utilizado para Paucibacilar: 6 cartelas
73
Tabela 12 – esquema terapêutico utilizado para Multibacilar: 12 cartelas
A alta por cura é dada após a administração do número de doses preconizadas
pelo esquema terapêutico, após exame dermato-neurológico para avaliar incapacidades
da doença (WHO 1994; Brasil/Ministério da Saúde 2009, Brasil/Ministério da Saúde
2010a).
Por ser um esquema terapêutico com associação de drogas poderá algum
paciente apresentar efeitos colaterais, intolerância a um medicamento ou mesmo
contraindicação. Neste caso, a portaria no. 3.125 de 7 de outubro de 2010, que
regulamenta a terapia da hanseníase no Brasil, prevê esquemas terapêuticos
substitutivos (Brasil/Ministério da Saúde 2010a).
1.12.2- Tratamento: Multidrogaterapia nas crianças e adultos com até 30 Kg
As doses devem ser reajustadas de acordo com o peso para crianças e adultos
com peso até 30 Kg. Tabela 13.
74
Tabela 13 – Dosagens dos medicamentos noesquema terapêutico utilizado para
crianças e adultos com peso inferior a 30 Kg.
1.12.3- Tratamento: Multidrogaterapia nas reações
O manejo adequado das reações interfe na incapacidade física que o paciente
poderá vir a ter em função destas. Desde o início, no momento do diagnóstico, o
paciente deverá receber orientações adequadas quanto a estas, para evitar a suspensão
da terapêutica ou geração de dúvidas quanto aos efeitos da mesma. Orientação quanto às
neurites, com imobilização, cuidado com olhos e traumas de extremidades devem ser
bem enfatizados, são os autocuidados para evitar sequelas. Pacientes com neurites
devem ser bem avaliados e monitorados para avaliação da necessidade de intervenção
cirúrgica, em casos de compressão e abscessos neurais (Brasil/Ministério da Saúde
2010a).
O tratamento de escolha para RT1 é a corticoterapia, com a prednisona na dose
de 1 a 1,5 mg/kg/dia e para RT2 consiste na administração de talidomida na dose de
100 a 400 mg/dia para pacientes do sexo masculino ou para mulheres que não estejam
em idade fértil (Brasil/Ministério da Saúde 2010a). Caso contrário, faz-se o uso de
corticosteroides (Talhari & Neves 1997, Guerra et al. 2002, Foss et al. 2003, Sampaio &
Rivitti 2011). Nas formas moderadas e graves do eritema nodoso hansênico, associa-se
a talidomida à corticoterapia sistêmica.
Outras drogas para esquema terapêutico alternativo, com efeito no tratamento da
reação tipo 2, são a clofazimina, pentoxifilina, azatioprina, metotrexate, zinco oral e
anticorpo monoclonal quimérico anti TNF – “Infliximab” (Talhari et al. 1995, Foss et
al. 2003, Scollard et al 2006, Brasil/Ministério da Saúde 2010a).
1.12.4- Tratamento: Métodos profiláticos e vacina
Em vários países do mundo tem sido realizada uma vacinação de rotina com
Mycobacterium bovis (BCG) para prevenir a infecção por M. leprae. A vacina BCG
75
confere proteção cruzada contra a hanseníase (Rodrigues 1992, Setia et al. 2006, WHO
2006, revisado por Richardus et al. 2013). Desde 1973 vem sendo utilizada no Brasil a
vacina BCG intradérmica, principalmente nos contatos intradomiciliares. A aplicação
segue normas da OMS e MS/Brasil, sendo feita em contatos intradomiciliares de PB e
MB, sem sinais ou sintomas da hanseníase (WHO, 1988, Brasil/Ministério da Saúde
2010a). Tabela 14
Tabela 14. Avaliação para aplicação do BCG
Estudos realizados em várias partes do mundo demonstraram que o BCG tem
maior variação na eficácia protetora para a tuberculose (0 a 80%), do que para a
hanseníase (20 a 80%).A vacinação BCG tem sido parcialmente eficaz em evitar a
hanseníase, porém estudos tem mostrado que o grau de proteção varia significativamente
entre os estudos (0-80%) e a proteção conferida pela vacina BCG declina ao longo do
tempo (Fine 1996, revisado por Lockwood 2001, revisado por Setia et al 2006). A
principal explicação para estas variações são fatores genéticos das populações estudadas.
Acredita-se também, que provavelmente esta variação seja atribuída em parte a efeitos
imunológicos de exposição a diferentes tipos de micobactérias ambientais.
No Brasil, em um estudo realizado em Goiás observou-se que a presença de
cicatriz de BCG, estava negativamente associada à hanseníase indicando um risco de 5,3
para aqueles não vacinados e o efeito protetor foi de 81%. A proporção de pacientes
paucibacilares que apresentavam cicatriz de BCG foi significativamente superior aos
pacientes multibacilares, sugerindo também variação da proteção de acordo com
diferentes formas clínicas da hanseníase (Rodrigues et al. 1992).
Em outro estudo brasileiro, os autores estimaram um efeito protetor do BCG para
a hanseníase em 90% para pacientes memores de 18 anos. Na região metropolitana do
Rio de Janeiro, Alvim et al. 1993, em estudo realizado em contatos, cujos casos índices
76
apresentavam as formas clínicas multi e paucibacilares da hanseníase, observou uma
proteção global de 59% (Lombardi et al. 1995).
Devido ao fato da vacinação BCG ter demonstrado eficácia apenas parcial em
evitar a hanseníase, alguns estudos têm pesquisado diferentes regimes de
quimioprofilaxia na tentativa de diminuir a transmissão da hanseníase. Um estudo
contatos domiciliares de uma ilha tomaram uma dose única de ROM enquanto que os
pacientes de outra ilha tomaram comprimidos placebos. Porém, o estudo mostrou, que
após cinco anos, que não havia diferença significativa na prevalência de hanseníase
entre contatos domiciliares que fizeram quimioprofilaxia com ROM e contatos que não
fizeram quimioprofilaxia (Bakker et al. 2006).
Alguns outros estudos relatam o uso da quimioprofilaxia com uma ou duas doses
de Rifampicina como possível proteção de populações com maior risco de adoecer de
hanseníase (Moet et al. 2004). Até o momento, os estudos têm mostrado uma eficácia
parcial em evitar o contágio da hanseníase (Bakker et al. 2006). Na nova estratégia
global de controle da doença proposta pela OMS para o período 2011-2015 é
recomendado que as áreas endêmicas avaliem o uso da quimioprofilaxia, de modo a
possibilitar acúmulo de experiência em diferentes contextos (WHO 2006). Em alguns
países do Mundo, estão sendo realizados estudos quimioprofiláticos para avaliar a
eficácia desta estratégia (Goulart & Goulart 2008, Penna et al. 2011, Richardus et al.
2013).
No Brasil oficialmente a quimioprofilaxia não está prevista, segundo a última
portaria que regulamenta a terapêutica da hanseníase (Brasil/Ministério da Saúde 2010a).
77
Em conclusão
Assim, no momento em que se discute a eliminação da hanseníase, as atenções
se voltam principalmente para as reações hansênicas, devido ao significativo impacto
social, econômico, no manejo clínico dos doentes e na demanda dos serviços de saúde
causado por esses episódios inflamatórios. Apesar dos significativos avanços no
conhecimento do genoma do bacilo, na imunopatologia e na quimioterapia da doença,
houve pouco impacto na conduta clínica das reações hansênicas. Nos últimos anos temse buscado entender melhor o mecanismo imunopatológico das reações hansênicas.
Uma estratégia nova para a identificação de potencias células e seus produtos
envolvidos na imunopatologia dos eventos reacionais, com estudo “in situ”, de painéis
citocinas produzidos por estas células. Esses conhecimentos podem levar a novos testes
laboratoriais ou a novas opções terapêuticas. Assim, a definição de marcadores
imunológicos, moleculares ou endócrinos para o desenvolvimento de reações
hansênicas ou fatores prognósticos poderão contribuir para o manejo clínico desta
doença. A prevenção e o manejo das reações e neuropatias são considerados áreas de
pesquisa prioritárias pela Organização Mundial de Saúde na era da eliminação da
hanseníase.
A hanseníase é uma doença endêmica em nosso país e as reações hansênicas
representam sobrecarga nos serviços de saúde, uma vez que constituem em emergências
médicas que devem ser prontamente atendidas e tratadas, principalmente pelo risco de
acometimento neural e conseqüente desenvolvimento de sequelas incapacitantes
irreversíveis.
Nesse contexto, a presente tese de doutorado discute aspectos clínicoepidemiológicos, histopatológicos e imunológicos das reações, mediante estudos em
pacientes com hanseníase da região metropolitana de Goiânia.
78
2. JUSTIFICATIVA
O objetivo do nosso trabalho foi investigar a expressão ‘in situ” de duas
populações celulares com importantes funções imunorregulatórias: mastócitos e Tregs,
com ênfase na hanseníase e reações hansênicas do tipo 1 e 2, comparando-as com outras
dermatoses e controles saudáveis.
Uma vez que não existe nenhum modelo
experimental para hanseníase e, como o M. leprae nunca foi cultivado “in vitro” em
culturas axênicas, as lesões de pele continuam sendo extensivamente investigadas para
desvendar os complexos mecanismos e células envolvidos na imunopatogênese da
doença.
A justificativa da escolha da hanseníase, como modelo, se deve ao fato de ser
uma doença dermato-neurológica espectral complexa, na qual o sistema imunológico
desempenha papel fundamental determinando a forma clínica. As manifestações clínicas
polares tuberculoide e lepromatosa se apresentam com nítida dicotomia da resposta
imune Th1/Th2, respectivamente, sendo que formas intermediárias (borderline)
imunologicamente instáveis mesclam características imunológicas de ambos os polos.
Além da complexidade das manifestações clínicas, o curso crônico da doença pode ser
interrompido por manifestações imunoinflamatórias agudas que costumam deixar
sequelas neurológicas e motoras irreversíveis, se não forem prontamente diagnosticadas
e tratadas.
A escolha destas duas populações celulares como tema de estudo, se deve a
diversos fatores. Os mastócitos são células amplamente distribuídas no organismo,
sobretudo, na pele, e produzem uma ampla gama de substâncias biologicamente ativas.
Embora os mastócitos tenham sido descritos e conhecidos por sua participação nas
reações alérgicas imediatas, hoje se reconhece que seu papel é bem mais amplo que
inicialmente imaginado. Sabe-se que os mastócitos participam de diversos processos
cutâneos patológicos inflamatórios e não inflamatórios, como infeções, reparo de lesões
traumáticas e neoangiogênese de doenças malignas da pele. Os mastócitos afetam a
resposta imune promovendo inflamação ou suprimindo-a. As lesões de pele da
hanseníase contem todas as células presentes em pele normal incluindo os mastócitos e
diversos estudos mostram resultados conflitantes sobre o possível papel dos mastócitos
na hanseníase e nas reações hansênicas.
As células Treg representam uma população celular com funções supressoras e
quando ativadas, podem ter papel benéfico em doenças autoimunes, rejeição de
79
transplantes e reações alérgicas. Por outro lado, o efeito supressor das células Treg pode
ser deletério se este comprometer a imunidade antitumoral ou imunidade contra
microorganismos. Alguns estudos descrevem resultados controversos sobre o papel de
celulas Treg na hanseníase e nas reações hansênicas.
Desta forma, uma melhor compreensão sobre o papel destas duas populações
celulares imunorregulatórias em dermatoses humanas, incluindo a hanseníase e,
sobretudo, as reações hansênicas, poderão contribuir não só para o melhor entendimento
da imunopatogênese como indicar potenciais alvos ou abordagens terapêuticas para
estes episódios.
80
3. OBJETIVOS
3.1- Objetivo Geral
Investigar a expressão “in situ” dos mastócitos e das células Treg duplo postivas,
CD25 e Foxp3, na hanseníase e nas reações hansênicas, comparando-as com diversas
outras dermatoses e com peles normais.
3.2- Objetivos específicos
3.2.1- Investigar a presença dos mastócitos na hanseníase e suas formas
reacionias, comparando-as com diversas dermatoses com e pele normal;
3.2.2- Quantificar as populações dos mastócitos triptase e quimase positivas em
hanseníase, em diversas dermatoses e em pele normal;
3.2.3- Avaliar as proporções dos mastócitos íntegros e desgranulados nas diversas
manifestações clínicas da hanseníase;
3.2.4- Comparar as populações de mastócitos triptase e quimase positivos nas
diversas manifestações clínicas da hanseníase;
3.2.5- Avaliar os mastócitos nas reações hansênicas tipo 1 e 2;
3.2.6- Estudar populações de mastócitos triptase e quimase positivos nas reações
hansênicas tipo 1 e 2;
3.2.7- Investigar a expressão “in situ” de células Treg duplo positivas para CD25
e Foxp3 em lesões da hanseníase e suas formas reacionias, comparando-as
com diversas dermatoses com e pele normal;
3.2.8- Estimar a frequência de células Treg nas diversas manifestações clínicas da
hanseníase;
3.2.9- Avaliar o impacto das reações hansênicas na expressão das células Treg em
amostras pareadas coletadas na vigência e ausência de reações hansênicas
tipo 1 e 2.
81
4. APRESENTAÇÃO DOS MANUSCRITOS
Este trabalho de conclusão de doutorado esta apresentado em formato de artigos.
O primeiro manuscrito se refere às células T regulatórias (Treg): “In situ
expression of CD25+ Foxp3+ Regulatory T Cells in human skin diseases: leprosy and
leprosy reactions”, realizado em colaboração com o Hospital A. C. Carmargo,
Departamento de Patologia, chefiado pelo Prof. Dr. Fernando Augusto Soares.
O artigo 2 refere-se aos Mastócitos: “Mast cell heterogenity in human
dermatoses: in situ tryptase and chymase positive cells with emphasis on leprosy and
leprosy reactions”, realizado em colaboração com o Laboratório de Imunomorfologia do
Instituto de Biociências, Letras e Ciências Exatas - IBILCE/UNESP de São José Rio
Preto – SP – Brasil, chefiado pela Profa. Dra. Sônia Maria Oliani.
Ambos os artigos já estão preliminarmente formatos para serem submetidos para
publicação. Estamos confiantes de que os resultados são atrativos para aceitação
epublicação em periódico indexado com alto fator de impacto.
82
5. RESULTADOS
5.1 Manuscript 1
IN SITU EXPRESSION OF CD25 + Foxp3+ REGULATORY T CELLS IN
HUMAN SKIN DISEASES: LEPROSY AND LEPROSY REACTIONS
Maurício B. Costa1, Aline A. Freitas1, Emerith M. Hungria1, Ana Lúcia O. M. Sousa1,
Juliano Jampietro2, Fernando A. Soares2, Mariane M. A. Stefani1
1
Tropical Pathology and Public Health Institute, Federal University of Goiás, Goiânia,
Brazil.
2
Hospital A. C. Camargo, CIPE - Centro Internacional de Pesquisa– São Paulo, São
Paulo, Brazil.
Abstract
T regulatory cells (Treg) expressing CD25 and Foxp3 have suppressive activity and have
been implicated in the regulation of a wide variety of pathological conditions including
antimicrobial immunity.Leprosy is a complex chronic, infectious dermato-neurological
disease
that
affects
the
skin
and
peripheral
nerves
especially
during
immunoinflammatory episodes known as type 1/T1R and type 2/T2R reactions. Leprosy
skin lesions have been used to unravel its immunopathological mechanims. This study
investigated in situ expression of double stained CD25 + Foxp3 + Treg cells in 154 skin
biopsies from 114 participants with non-infectious and infectious skin diseases, with
special emphasis on leprosy type 1/T1R and type 2/T2R reactions. Three study groups
were investigated: 1. Leprosy (n=74): 56 T1R (28-paired biopsies reactionfree/reactional, 28 single reactional biopsy), 18 T2R (12 paired-reaction-free/reactional,
6 single reactional biopsy); 2. Dermatoses: (n=29) infectious and non-infectious skin
diseases; 3. Normal controls: (n=11) skin fragment of healthy females that had cosmetic
mammoplasty.Double immunohistochemical detection of T reg cells was performed with
automated platform employing the ultra View Universal DAB detection kit for CD25
staining and the ultraView Universal Alkaline Phosphatase Red Detection Kit for Foxp3
staining. Not one CD25+Foxp3 + Treg cell was seen in any normal skins while variable
numbers were detected in skin diseases; the number of cutaneousTreg cells was higher in
infectious diseases compared to non-infectious diseases. Treg cell counts in reactional
83
lesions were higher than counts in lesions of reaction-free leprosy patients. Paired
biopsies of reactional T1R or T2R and reaction-free lesions showed that difference in
Treg numbers was statistically significant for T1R that expresses higher numbers during
reactional episode. There was a trend in increasing T reg cell numbers from the
tuberculoid to borderline-lepromatous form which showed the highest median value of
Treg, however this difference was not significant. In conclusion higher Treg numbers seen
in T1R suggest Treg role in suppressing the exacerbated cell-mediated phenomenon that
causes T1R
Keywords: human skin diseases, T regulatory cells, CD25 + Foxp3+, leprosy, leprosy
reactions.
Introduction
T regulatory cells, formerly described as T suppressor cells in the late 70’s- early
80’s, returned in the mid to late 90’s as T regulatory cells (Tregs) following the
description of CD4+CD25+ T cells with suppressive activity that specifically expressed
the transcription factor Foxp3 (Gershon 1975; Sakaguchi 2004).Treg cells have been
implicated in the regulation of autoimmunity, transplant rejection, allergic diseases,
antimicrobial and anti-tumor immunity(Sakaguchi and Powrie 2007).Upregulation of
Treg cell function or increase in the numbers of Treg cells might be beneficial for treating
autoimmune diseases and allergies and for preventing allograft rejection. Conversely,
inhibiting Treg cell function or decreasing Treg cell numbers might boost immunity
against tumors and microorganisms. Tregs play a crucial role in the regulation of the
immune response to microbial antigens and may favor the persistence of pathogens
causing chronic granulomatous disease such as leishmaniasis and tuberculosis
(Campanelli et al. 2006; Guyot-Revol et al. 2006; Silva et al. 2009).
Treg cells are characterized by the expression of the transcription factor Foxp3
and the absence of Foxp3 in patients with immune dysregulation, polyendocrinopathy,
enteropathy X-linked (IPEX) syndromeor scurfy mice results in lack of functional Treg
cells (Clark et al. 1999; Torgerson and Ochs 2007). The majority of T reg cells express
high levels of CD25 (interleukin-2 IL-2 receptor α chain),suggesting a major influence
of IL-2 for the long-term maintenance and competitiveness of these cells and STAT5,
which is activated by IL-2, has been shown to be required for the maintenance of Foxp3
expression (Sakaguchi et al. 2006). Treg cells also express TGF, IL-10, cytotoxic T
84
lymphocyte–associated antigen (CTLA4), and glucocorticoid-induced TNF receptor
(GITR), which may play a role in their function (Burchill et al. 2007; Yao Z et al.
2007). Homing of T reg cells to inflammation sites is required for their suppressive
function (Schneider et al. 2007). The importance of cutaneous Treg cells for the
maintenance of immune homeostasis in the skin has been demonstrated in transfer
experiments using Foxp3-deficient scurfy mice in which reduced Treg cell accumulation
in the skin caused severe inflammation without other scurfy-associated symptoms
(Dudda et al. 2008).
Leprosy is a complex chronic, infectious dermato-neurological disease that
affects the skin and peripheral nerves and that can result in significant impairment of
nerve function and permanent deformities, which are the hallmark of the disease
(Scollard et al. 2006a). Although multidrug therapy (MDT) available since the 80’s has
reduced prevalence, incidence remains stable indicating an active transmission chain of
its etiologic agent, Mycobacterium leprae. Leprosy still represents an important public
health problem in many endemic countries, some of them with growing economies such
as India and Brazil (WHO 2013). The disease is characterized by a spectrum of clinical,
immunologic,
microbiologic
and
histopathologic
manisfestations
in
which
paucibacillary patients present low bacillary load and few lesions, and develop Th1 type
cell-mediated immunity (CMI) to M. leprae characterized by INF- production and low
antibody production. Multibacillary patients show multiple skin lesions, high bacillary
load, low or no specific CMI and vigorous antibody production(Scollard et al. 2006).
Some patients can also be immunologically unstable and change to any side of the
spectrum (Kumar et al. 2004).
One of the major complications in the clinical management of leprosy patients is
the development of acute inflammatory episodes during the chronic course of the
disease, either before, during or after the specific treatment. Type 1 reaction (T1R) and
type 2 reaction (T2R) represent the major cause of permanent physical disabilities and
deformities due to irreversible nerve damage they can cause (Scollard et al. 2006a). T1R
is associated with alterations in Th1 type CMI while T2R is associated with Th2 type
immunity with immune complex deposition and transient CMI activation (Walker and
Lockwood 2008).
M. leprae has never been cultivated in vitro in axenic cultures and there is no
experimental model for leprosy, therefore the best approach to investigate immunologic
mechanisms associated with protection and pathology is to use biopsies of human skin
85
lesions. This study aimed to investigate in situ expression of Treg cells in different
human skin diseases including non-infectious and infectious conditions with special
emphasis on leprosy and type 1 and type 2 reactions.
Methods
Study groups: Dermatoses, leprosy and normal controls
1. Dermatoses: This group included 29 patients with diverse skin diseases that were
recruited at a public health reference center (Centro de Referência em Diagnóstico e
Terapêutica, CRDT, Goiânia, Goiás State, central West Brazil) and the final diagnosis
was based on the clinical and histopathological findings. The dermatoses group
comprised: eczema (n=5), pityriasis rosea (n=1), pityriasis alba (n=2), granuloma
annulare (n=2), drug induced skin disorder (n=2), lupus erythematosus (n=2),
necrobiosis lipoidica (n=1), foreign-body granuloma (n=1) and urticaria (n=1), and
individuals with chronic infectious diseases as tinea (n=2), chromomycosis (n=1),
cutaneous leishmaniasis (n=5), paracoccidioidomycosis (n=3) and syphilis (n=1).
2. Leprosy: This group comprised 74 leprosy patients that developed a T1R or T2R
episode. These patients were selected from a cohort of 239 recently diagnosed,
untreated leprosy patients that were followed up during MDT to monitor the occurrence
of leprosy reactions. In this cohort, 74 out of 239 leprosy patients (74/239; 30.96%)
developed a reactional episode and were selected for this study: 56 cases of T1R and 18
cases of T2R. Most patients (n=61) were diagnosed during a reactional episode and 13
developed reaction during or after conclusion of MDT (2-19 months after diagnosis).
Leprosy patients were recruited at a public health reference center (Centro de
Referência em Diagnóstico e Terapêutica, CRDT, Goiânia, Goiás State, central West
Brazil). All patients were submitted to a complete dermato-neurologic examination by
one dermatologist with expertise in leprosy diagnosis (ALOMS) and patients had at
least one biopsy taken from a typical leprosy skin lesion. Leprosy patients were
classified according to Ridley & Jopling criteria taking into account histopathology,
bacilloscopic and clinical data. All leprosy patients classified as tuberculoid (TT) had
negative bacilloscopy and patients classified as borderline-tuberculoid included
individuals with either negative or low bacilloscopic index (BI), while patients
classified as borderline lepromatous (BL) and lepromatous individulas (LL) were BI
86
positive.
Forty reactional leprosy patients had two paired skin biopsies taken: one was collected
during the reactional episode and the other biopsy was collected when the patient was
not undergoing a leprosy reaction (T1R n=28, T2R n=12). Additionally, for another 34
reactional leprosy patients (T1R n=28, T2R n=6) only one biopsy, taken during the
reactional episode was available.
3. Normal controls: For ethical reasons no biopsies could be taken of normal skin from
healthy individuals. Therefore, exceeding fragments of normal skin from 11 healthy
females obtained during elective mammoplasty were used for standardizing the double
immunostaining reaction and as well as normal controls.
The detailed design of Treg study groups is shown in Figure 1. A total of 154
skin biopsies, taken from 114 participants were examined in this study and the main
features of participants are shown in Table 1, including the 40 reactional leprosy
patients (28T1R and 12 T2R) that had paired skin biopsies collected. Among leprosy
patients, male individuals predominated (74/49), while all normal controls were females
that underwent elective mammoplasty. The median age of patients with other skin
diseases and leprosy patients (unreactional and reactional) was similar (p=0.06).
Skin biopsies
Biopsies were taken with a standard dermatologic biopsy punch (4mm) of the
edges of well-characterized and infiltrated skin lesions and fixation was performed with
10% neutral buffered formalin in 4% formaldehyde for 24 hours. For leprosy patients,
3-4 µm sections of skin biopsies were stained by hematoxilin-eosin (HE) and by FiteFaraco for bacilli detection.
Double Immunohistochemical detection of CD25+Foxp3+ Treg cells
For the immunohistochemical study, skin biopsies were deparafinized (EZPrep,
Roche), treated with Cell Conditioner (Roche) and submitted to heat induced antigen
retrieval.Double immunostaining reaction to detect CD25/Foxp3 coexpression was
performed using an automated platform (Ventana BenchMark XT, Roche, Manhein,
Germany). The ultra View Universal DAB detection kit (Roche, Manhein, Germany)
was used for CD25 staining. The primary antibody–HRP labelled antibody complex
87
(anti-human monoclonal antibody, clone 4C9, Ventana, Roche, Tucson, AZ, USA)
visualized using DAB resulting in a brown/black target signal. Kit reagents comprise:
ultraView Universal HRP Multimer, ultraView Universal DAB Chromogen, ultraView
Universal DAB H202 and ultraView Universal DAB Copper. Foxp3 staining
employed anti-Foxp3 + antibodies (mice anti-human monoclonal antibodies, clone
236A/E7, Abcam, Cambridge, UK) and the ultraView Universal Alkaline Phosphatase
Red Detection Kit (Roche, Manhein, Germany) comprising the following reagents:
ultraView Red Alkaline Phosphatase, ultraView Red Enhancer, ultraView Red
Naphthol, ultraView Red Fast Red A and ultraView Red Fast Red B. The primary
antibody–alkaline phosphatase labelled antibody complex was visualised using Fast
Red/Naphthol resulting in a bright red target signal.
Both DAB and alkaline
phosphatase detection kits are biotin-free multimer-based detection systems that
eliminate non-specific staining from endogenous biotin providing a clean background
for the sensitive and specific visualization of the targeted antigen being useful for the
detection of antigens present in low concentrations. Detection systems were optimized
for use on the VENTANA BenchMark XT, the staining procedures were followed
according to vendors’ instructions and all reagents were provided in pre-diluted and
ready-to-use form. Slides were then washed and Hematoxylin II (Roche, Manhein,
Germany) added, incubated, washed and the Bluing Reagent (Roche) was added and
washed. Slides were then processed by the automated Tissue-Tek® Prisma®/Film®
(Sakura, AJ Alphen aan den Rijn, The Netherlands).
Quantification of double immunostained CD25 +Foxp3+ Treg cells was performed
using Nikon Eclipse E400 microscope (8 fields in 400X corresponding to 2mm2; values
were then divided by 2 to give counts in 1mm2). Quantifications of Treg positive cells
were done exclusively by one observer with vast expertise in dermatopathology (MBC.)
blinded to the participants’ clinical status (different forms of leprosy, reactional or
unreactional leprosy, other dermatoses, normal skin). Immunostained cells were
quantified both in areas with and without inflammatory infiltrates and double stained
Treg cells were visualized as brown/golden cytoplasm stained by anti CD25 revealed
with DAB and violet/magent nuclei stained Foxp3 revealed by alkaline phosphatase.
Statistical analyses
88
Exploratory data analysis, including dot plot, box plot, medians were used to
analyze the quantifications of Treg cells/mm2 among different study groups. Statistical
significance was assessed by Kruskall-Wallis one way analysis of variance for
comparison of multiple groups and Mann-Whitney for comparison between two groups.
Results were considered statistically significant when p-values <0.05 were obtained.
Ethical issues
This study was approved by the regional and national review boards (“Comitê
de Ética em Pesquisa Humana e Animal do Hospital das Clínicas da Universidade
Federal de Goiás”, protocol # 119/2005 and “Comissão Nacional de Ética e
Pesquisa/CONEP/Brasil”, protocols # 4862, 12962). All patients signed an informed
consent form.
Results
1. Skin CD25+Foxp3+ Treg cells in skin diseases and normal skin
Treg cell numbers were variable in different skin diseases and Tregcell counts in
lesions of different skin disorders (infectious and non infectious) versus leprosy were
similar (p=0.239) (Figure 2A). Therefore data on Treg cell counts in lesions of leprosy
and other dermatoses were grouped and compared to counts in normal skin. The
difference in Treg cell counts between skin diseases and normal skin was highly
significant (p<0.0001) (Figure 2B) as no CD25+Foxp3+ double stained Treg cell was
seen in any section of the 11 normal breast skins obtained from healthy females that
underwent elective mammoplasty (Figure 2C). Figure 2D depicts Treg cells in pityriasis
rosea
lesion
(67
Treg
cells/mm2)
and
Figure
2D
shows
Treg
cell
in
2
paraccocidioidomycosis lesion (212 T reg cells/mm ). Double stained Treg cells in
different skin disorders are illustrated in supplementary figure 1.
2. CD25 +Foxp3 + Treg cells in infectious and non-infectious skin diseases
Higher median values of Treg cells were seen in infectious skin diseases (n=86)
compared to non-infectious dermatoses (n=17) (Figure 3A) and this difference was
statistically significant (p= 0.008). However, when the infectious dermatoses were
analysed as two groups: leprosy versus other infectious dermatoses, no difference in
median values of Tregs was observed (p=0.157) (Figure 3B). Total Treg cells
89
countsamong infectious diseases were: 40 leprosy patients (mean = 45 Treg cell/mm2) , 2
tinea (mean = 1 Treg cell/mm2), 1 chromomycosis (total = 0Treg cell/mm2), 5 cutaneous
leishmaniasis (mean = 102 Treg cell/mm2), 3 paracoccidioidomycosis (mean = 212 Treg
cell/mm2), 1 syphilis (total = 71 Treg cell/mm2),Treg cell counts in non-infectious
diseases were: 2 granuloma annulare (mean = 3 Treg cell/mm2), 5 eczema (mean =
13Treg cell/mm2), 2 drug induced skin disorders (mean = 14 Treg cell/mm2), 2 lupus
erythematosus (mean = 147 T reg cell/mm2), 1 necrobiosis lipoidica (total = 108 Treg
cell/mm2), 2 pityriasis alba (mean= 0Treg cell/mm2), 1 urticaria (total = 0 Treg cell/mm2),
1 pityriasis rosea (total = 67Treg cell/mm2) and 1 foreign-body granuloma (total = 30
Treg cell/mm2). Double stained Treg cells in different skin disorders are shown in Figures
3 C-E: 3C) eczema, 3D) cutaneous leishmaniasis and 3E) syphilis skin lesion.
3. CD25 +Foxp3 + Treg cells in different infectious-skin diseases and in leprosy
patients with T1R, T2R
Considering Treg cell numbers among leprosy patients, higher median value was
seen in reactional versus reaction-freelesions (p=0.002)(Figure 4A). When Treg cell
counts were stratified according to the type of leprosy reaction (T1R/T2R) and
compared to paired unreactional lesion, higher numbers were seen during T1R
(p=0.001) versus reaction-free lesions (Figure 4B-C). No impact on Treg cell numbers
was seen in paired T2R lesions compared to reaction-free samples (p>0.05) (Figure 4DE). Treg cells in paired biopsies samples from T1R/reaction-free are show in Figure 4FG Figures 4H-I show Treg cells in T2R/reaction-free lesions.
4. Treg numbers developed in naïve patients with reaction at diagnosis or during
MDT
In many cases, the diagnosis of leprosy occurs at the same time as the diagnosis
of a leprosy reaction and leprosy reaction can also occur during MDT or even years
after specific treatment. Previous studies have shown that M. leprae specific humoral
immune response declines after MDT and the same can occur with T cell responses. To
evaluate if MDT influenced Treg cell numbers in patients that developed reaction during
treatment, we have analysed Treg numbers in naïve patients for whom the diagnosis of
leprosy and of reaction coincided (no impact of MDT on immunity) (Figures 5 A and D
for T1R and T2R, respectively) and among patients that developed a leprosy reaction
90
during MDT (Figures 5B and E for T1R and T2R, respectively). These analyses have
shown that for T1R, Treg numbers were slightly higher during reaction developed during
MDT compared to reaction developed in naïve patients (Figure 5 C, p=0.047). For T2R,
Treg numbers were comparable despite treatment status (Figure 5F).
5. Treg cell numbers in different leprosy forms
Leprosy is a complex disease with several clinical manifestations associated with
bacilloscopic, histopathological and clinical features that were classically classified by
Ridley & Jopling. We then investigated if Treg cell expression differs among TT, BT,
BB, BL and LL leprosy lesions. In this regard, there was a trend in increasing Treg cell
numbers from the paucibacillary to the multibacillary pole, more specifically from the
tuberculoid to the borderline-borderline and borderline-lepromatous lesions which
showed the highest median values of Treg cells (Figure 6A, D-H). However, the
difference of Treg cellsamong leprosy forms was not statistically significant (p=0.80).
Since T1R was shown to impact Treg cells increasing cell counts, lesions of different
leprosy forms were analysed taking into account both leprosy form and the occurrence
of leprosy reaction. The same trend of higher number of Tregs from tuberculoid to
borderline-lepromatous form was observed for both reactional and reaction-free lesions,
however without reaching statistical significance (Figure 6B). Additionally when Treg
cell numbers were analysed among paucibacillary (n=16) and multibacillary leprosy
(n=63), similar median values were seen (Figure 6C) (p>0.05).
Discussion
The current study discloses data on CD25+ Foxp3 + double stained Treg cell
expression in 154 skin biopsies from different human dermatoses and normal skin. Our
results showed total absence of Tregs cells in normal skin contrasting with variable
values, sometimes very high, seen in skin diseases. A previous study on normal skin and
inflammatory dermatoses described similar frequencies of CD25+ Foxp3 + cells in
normal human skin as in diseased skin but the absolute numbers were significantly
lower in normal skin (de Boer et al. 2007). Rare CD25 + Foxp3+ cells were identified in
normal skin when compared to other skin diseases as psoriasis and eczematous
dermatitis (Fujimura et al. 2008). Tregs exert their suppressive role by suppressive
cytokine release requiring cell-cell contact, therefore in cutaneous infection or
inflammation Tregs need to be at the site of infection/inflammation to perform their role
91
rather than in the circulation. The preferential location of T regs at the site of infection in
various diseases suggest an active role for T regs, probably by limiting local effector
immunity and local inflammation. Moreover the rise of Tregs in infection sites such as
the skin suggest that Tregs can directly inhibit effector mechanisms used for pathogen
killing leading to persistent infection.
Another interesting finding from our study was the higher numbers of Treg cells
in infectious versus non-infectious lesions suggesting that homing of Treg cells to skin
lesions during infection is more pronounced than in non-infectious inflammatory
diseases that take place in the absence of a pathogen. Treg cells have been isolated from
lesions of different infectious skin diseases such as in leishmaniasis, fungal infections
and leprosy (Modlin RL et al. 1986; Campanelli et al. 2006; Cavassani et al. 2006).
These data indicate that Treg cells are attracted to sites of inflammation or infection
probably to exert their immunosuppressive or immunomodulatory roles. T reg cells are
known to protect against tissue injury in infectious diseases. After clearance of
pathogens they negatively regulate the immune response protecting against chronic
immunopathology related to chronic infections (Sakaguchi 2004; Sakaguchi et al. 2006;
Fujio et al. 2010). The mechanisms by which antigen-specific Treg cells achieve
suppression of effector cells are unknown.
In the 80’s CD4+ and CD8 + Tregs from human lepromatous patients both from
peripheral blood and skin lesions were isolated and cloned (Ottenhoff TH et al. 1896;
Modlin RL et al. 1986). After the revival of Treg cells, recent studies have investigated
Treg cells in leprosy with contradictory results and interpretations. Treg cells have been
identified in the circulation and in leprosy skin lesions. One study has used flow
cytometry to identify the frequency of CD25 + Foxp3+ Treg circulating in 38 leprosy
patients and 38 healthy individuals.Elevated circulating Tregs were seen in TT patients.
Patients with LL leprosy and T2R expressed lower frequency of Tregs suggesting a
detrimental role for Tregs in leprosy (Attia et al. 2011). In the current study we have
investigated 74 leprosy skin biopsies including 28 paired samples from T1R and 12
paired samples from T2R. Although a rising trend of Treg cell medians was seen from
paucibacillary tuberculoid lesions towards borderline lepromatous lesions, this
difference did not reach statistical significance. One possible explanation for the rising
trend in Treg numbers from TT to BL lesions and then a decline seen in multibacillary
LL is the requirement of IL-2 for Treg survival. Multibacillary LL forms are
characterized by weak or absent cell mediated immunity, therefore limited IL-2
92
production in LL is compatible with our findings. Another immunohistochemistry
study in a small group of leprosy cases (1TT, 3BT, 5BL, 5 LL, 1 T1R, 3 T2R) did not
find any difference of Foxp3+ cells among leprosy forms(Massone et al. 2010). Astudy
including lepromatous and tuberculoid leprosy and healthy M. leprae exposed contacts
showed CD4 +CD25+Foxp3 + cells in peripheral blood mononuclear cells stimulated in
vitro with M. leprae and CD25+Foxp3+double stained Treg cells were identified by
immunohistochemistry in leprosy skin lesions. Tregs were more frequent in situ in
lepromatous patients suggesting an association between their increased numbers and a
pathogenic role in multibacillary leprosy (Palermo et al. 2012). Recently, circulating
CD4+CD8+C25+Foxp3+ cells were investigated in 12 patients under 15 years with
multibacillary leprosy and 17 household contacts. Young mutibacillary leprosy patients
had greater CD4+ CD8 + Treg frequencies correlating with disseminated clinical disease
and suggesting their involvement in multibacillary leprosy (Fernandes et al. 2013). In
tuberculosis, Treg populations are mainly associated with active disease, particularly at
the site of infection probably contributing to the persistence of the pathogen (Chen et al.
2007; Guyot-Revol et al. 2006). It is possible that the conflicting results of Treg cells
seen in leprosy may be at least partially associated with the use of different
methodologies and cell markers to detect Treg cells in different compartments
(circulation versus skin lesions).
Our study provides important information about Treg cell participation in leprosy
reactions. The evidence of increased Tregs during T1R is compatible with the
immunopathogenic mechanism of T1R which is considered an exacerbation of cell
mediated immunity. The same trend of higher Treg in T1R was also seen in one patient
with T1R (Massone et al. 2010). However higher Foxp3 expression and lower
frequency of Tregs in the circulation was seen in T2R (Attia et al. 2011). The lack of
association between Tregs and T2R found in our study is also concordant with T2R
immunopathologic mechanism which is based on humoral immunity and lack or only
transient cell mediated immunity. Altogether our results suggest that the higher number
of Tregs during T1R seems to be beneficial rather than detrimental to the host and may
be associated with its immunomodulatory role to limit pathology. This finding raises
the possibility to modulate Tregs for T1R therapy.
Phenotypic identification of human Tregs is difficult because of the lack of
specific markers. Expression of Foxp3 is considered a prerequisite for Treg function, as
93
mutations in Foxp3 gene result in autoimmune diseases due to dysfunctional T regs.
However in humans Foxp3 is expressed on natural Tregs and not all Foxp3+ cells are Tregs
(Morgan et al. 2005). Also, non Tregs can have transient expression of Foxp3 (Wang et
al. 2007). In our study, although we have not included CD4 cell marker, we believe that
the double stained CD25+ Foxp 3 + cells identified are indeed CD4 + Tregs. Although
CD8+ suppressor cells have been identified in lepromatous leprosy in the 80’s, up to
now no report has described CD8 + Tregs in leprosy (Ottenhoff TH et al. 1896; Modlin
RL et al. 1986). Tregs can be either natural CD4+ Tregs or inducible CD4 + or CD8 + Tregs
(induced by specific pathogen or derived antigens), however descriptions of human
CD8+ Tregs are scarce (Joosten and Ottenhoff 2008). We have used the CD25 marker for
Tregs which is the interleukin-2 receptor chain that is expressed at high levels on
activated T cells and Tregs, and previous study has shown that some CD8 + Treg
completely lack CD25 expression (Elrefaei et al. 2007). Moreover, phenotype and
effector molecules of CD8 + Tregs are unknown. In this study, we have used an automated
platform for the detection of double immunostained CD25 + Foxp3 + Treg cells which
provided consistent procedures and results. Another strength of our methodology was
the analysis and Treg counts performed by a single professional with vast expertise in
dermatopathology, therefore eliminating inter-individual differences. We acknowledge
that although we have used Treg counts cell count as an indirect indicator of functional
activity, only functional evaluation can assess Treg activity. Another challenge to
understand Treg cell function is the recent indication that Treg cells show some degree of
plasticity and can lose their suppressive function, especially under autoimmune and
inflammatory conditions (Noack and Miossec 2014). Developmental pro-inflammatory
Th17 and suppressive Treg cell pathways are reciprocally regulated and can influence the
outcome of immune responses in autoimmune and inflammatory conditions (Prakken B
et al. 2013).
Corroborating the assumption of a differential expression of Tregs upon infection,
we have observed that the level of Treg cell expression for infectious skin diseases was
similar, regardless of the etiologic pathogen. When leprosy, which is a dermatoneurological disease, caused by M. leprae was compared to other infectious-dermatoses,
no difference in median Treg cell values was observed.
Chronic infection with
Leishmania major has been shown to depend on antigen specific Tregs present on the site
of infection (Suffia et al. 2006). In the mouse model Leishmania major infection
promoted Treg cell accumulation in the dermis, where they probably regulated the
94
immune response preventing complete eradication of the parasite from the host in part
through IL-10 mediated mechanisms (Belkaid et al. 2002). In our study, leishmaniasis
skin lesions investigated showed variable number of Treg cells ranging from 70 to 223
cells/mm2. Treg cells have the capacity to shape the infection as shown for human
cutaneous leishmaniasis caused by Leishmania guyanensis. Treg cells with suppressive
function accumulated in the early phase of acute lesions, decreased thereafter and
increased again in the chronic phase (Bourreau et al. 2009). The different frequency of
Tregs seen in leishmanisasis lesions from our study may represent lesions collected at
different stages of infection. In Kalazar, human visceral leismanisasis was not
associated with expansion or accumulation of CD4+ Foxp3 + cells in the spleen or blood
(Maurya et al. 2010) while Foxp3+ correlated with parasite burden in post kalazar
dermal leishmaniasis (Katara et al. 2011). The equilibrium established between effector
and regulatory T cells in sites of chronic infection probably reflect both parasite and
host survival strategies.
In conclusion, our study shows differential expression of Tregs in different
human skin diseases, contrasting to their absence in normal skin. The role of Treg cells in
infectious skin diseases was further substantiated by their higher numbers in infectious
compared to non-infectious disease, while among infectious dermatoses, no difference
was observed. The increased numbers of Treg cells seen during T1R is compatible with
its immunopathological mechanism and favors the hypothesis of a beneficial role
controlling exacerbated inflammation and lesion. In human infectious diseases Treg cells
may function like as a “double-edged sword” in which both the host and the pathogen
may benefit from their function: the pathogen because Tregs reduces effector immunity
and leads to disease chronicity and the host because Treg activity limits tissue damage
caused by inflammation and infection. Specific upregulation of Tregs during infection
may increase effector immunity and lead to pathogen clearance. Vaccine studies for
infectious diseases should incorporate knowledge on Treg induction and activity by both
the vaccine and the pathogen (Joosten and Ottenhoff 2008). The immunomodulatory
role of Tregs on skin infectious diseases is complex and multifaceted and certainly
depend on the type of the infection, the pathogen, and the immune response induced.
95
References
Attia, EA, Abdallah, M, Saad, AA, et al. (2011). Circulating CD4+ CD25 high FoxP3+
T cells vary in different clinical forms of leprosy. Int J Dermatol 49: 1152–8.
Belkaid, Y, Piccirillo, C a, Mendez, S (2002). CD4 1 CD25 1 regulatory T cells control
Leishmania major persistence and immunity. Nature 420: 633–7.
De Boer, OJ, van der Loos, CM, Teeling, P, et al. (2007). Immunohistochemical
analysis of regulatory T cell markers FOXP3 and GITR on CD4+CD25+ T cells in
normal skin and inflammatory dermatoses. J Histochem Cytochem 55: 891–8.
Bourreau, E, Ronet, C, Darcissac, E, et al. (2009). Intralesional regulatory T-cell
suppressive function during human acute and chronic cutaneous leishmaniasis due
to Leishmania guyanensis. Infect Immun 77: 1465–74.
Burchill, MA, Yang, J, Vogtenhuber, C, et al. (2007). IL-2 receptor beta-dependent
STAT5 activation is required for the development of Foxp3+ regulatory T cells. J
Immunol 178: 280–90.
Campanelli, AP, Roselino, AM, Cavassani, KA, et al. (2006). CD4+CD25+ T cells in
skin lesions of patients with cutaneous leishmaniasis exhibit phenotypic and
functional characteristics of natural regulatory T cells. J Infect Dis 193: 1313–22.
Cavassani, KA, Campanelli, AP, Moreira, AP, et al.(2006). Systemic and local
characterization of regulatory T cells in a chronic fungal infection in humans. J
Immunol 177: 5811–8.
Chen X, Zhou B, Li M, Deng Q, Wu X, Le X, Wu C, Larmonier N, Zhang W, Zhang H,
Wang H, KE (207AD). CD4(+)CD25(+)FoxP3(+) regulatory T cells suppress
Mycobacterium tuberculosis immunity in patients with active disease. Clin
Immunol 123: 50–9.
Clark, LB, Appleby, MW, Brunkow, ME, et al. (1999). Cellular and molecular
characterization of the scurfy mouse mutant. J Immunol 162: 2546–54.
Dudda, JC, Perdue, N, Bachtanian, E, et al.(2008). Foxp3+ regulatory T cells maintain
immune homeostasis in the skin. J Exp Med 205: 1559–65.
Elrefaei, M, Ventura, FL, Baker, CAR, et al. (2007). HIV-specific IL-10-positive CD8+
T cells suppress cytolysis and IL-2 production by CD8+ T cells.J Immunol.
Fernandes, C, Gonçalves, HS, Cabral, PB, et al.(2013). Increased Frequency of CD4
and CD8 Regulatory T Cells in Individuals under 15 Years with Multibacillary
Leprosy. PLoS One 8: e79072.
Fujimura, T, Okuyama, R, Ito, Y, et al.(2008). Profiles of Foxp3+ regulatory T cells in
eczematous dermatitis, psoriasis vulgaris and mycosis fungoides. Br J Dermatol
158: 1256–63.
96
Fujio, K, Okamura, T, Yamamoto, K (2010). The Family of IL-10-secreting CD4+ T
cells. Adv Immunol 105: 99–130.
Gershon, RK (1975). A disquisition on suppressor T cells. Transplant Rev 26: 170–85.
Guyot-Revol, V, Innes, JA, Hackforth, S, et al. (2006). Regulatory T cells are expanded
in blood and disease sites in patients with tuberculosis. Am J Respir Crit Care Med
173: 803–10.
Joosten, SA, Ottenhoff, THM (2008). Human CD4 and CD8 regulatory T cells in
infectious diseases and vaccination. Hum Immunol 69: 760–70.
Katara, GK, Ansari, NA, Verma, S, et al.(2011). Foxp3 and IL-10 expression correlates
with parasite burden in lesional tissues of post kala azar dermal leishmaniasis
(PKDL) patients. PLoS Negl Trop Dis 5: e1171.
Kumar, B, Dogra, S, Kaur, I (2004). Epidemiological characteristics of leprosy
reactions: 15 years experience from north India. Int J Lepr Other Mycobact Dis 72:
125–33.
Massone, C, Nunzi, E, Ribeiro-Rodrigues, R, et al.(2010). T regulatory cells and
plasmocytoid dentritic cells in hansen disease: a new insight into pathogenesis? Am
J Dermatopathol 32: 251–6.
Maurya, R, Kumar, R, Prajapati, VK, et al.(2010). Human visceral leishmaniasis is not
associated with expansion or accumulation of Foxp3+ CD4 cells in blood or
spleen. Parasite Immunol 32: 479–83.
Modlin RL, Kato H, Mehra V, et al. (1986). Genetically restricted suppressor T-cell
clones derived from lepromatous leprosy lesions. Nature 322: 459–61.
Morgan, ME, van Bilsen, JHM, Bakker, AM, et al. (2005). Expression of FOXP3
mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Hum
Immunol 66: 13–20.
Noack M, Miossec P. (2014). Th17 and regulatory T cell balance in autoimmune and
inflammatory diseases. Autoimmun Rev S1568-9972: 1–8.
Ottenhoff TH, Elferink DG, Klatser PR, et al. (1896). Cloned suppressor T cells from a
lepromatous leprosy patient suppress Mycobacterium leprae reactive helper T cells.
Nature 322: 462–4.
Palermo, ML, Pagliari, C, Trindade, MAB, et al. (2012). Increased Expression of
Regulatory T Cells and Down-Regulatory Molecules in Lepromatous Leprosy 86:
878–83.
Prakken B, Ellen Wehrens, van Wijk F (2013). Editorial: Quality or quantity?
Unraveling the role of Treg cells in rheumatoid arthritis. Arthritis Rheum 65: 552–
4.
97
Sakaguchi, S (2004). Naturally arising CD4+ regulatory t cells for immunologic selftolerance and negative control of immune responses. Annu Rev Immunol 22: 531–
62.
Sakaguchi, S, Ono, M, Setoguchi, R, et al. (2006). Foxp3+ CD25+ CD4+ natural
regulatory T cells in dominant self-tolerance and autoimmune disease. Immunol
Rev 212: 8–27.
Sakaguchi, S, Powrie, F (2007). Emerging challenges in regulatory T cell function and
biology. Science 317: 627–9.
Schneider, MA, Meingassner, JG, Lipp, M, et al. (2007). CCR7 is required for the in
vivo function of CD4+ CD25+ regulatory T cells. J Exp Med 204: 735–45.
Scollard, DM, Adams, LB, Gillis, TP, et al. (2006). The continuing challenges of
leprosy. Clin Microbiol Rev19: 338–81.
Silva LC, Silveira GG, Arnone M, et al.(2009). Decrease in Mycobacterium
tuberculosis specific immune responses in patients with untreated psoriasis living
in a tuberculosis endemic area. Arch Dermatol Res 302: 255–62.
Suffia, IJ, Reckling, SK, Piccirillo, CA, et al. (2006). Infected site-restricted Foxp3+
natural regulatory T cells are specific for microbial antigens. J Exp Med 203: 777–
88.
Torgerson, TR, Ochs, HD (2007). Regulatory T cells in primary immunodeficiency
diseases. Curr Opin Allergy Clin Immunol 7: 515–21.
Walker, SL, Lockwood, DN (2008). Leprosy type 1 (reversal) reactions and their
management. Lepr Rev 79: 372–86.
Wang, J, Ioan-Facsinay, A, van der Voort, EIH, et al. (2007). Transient expression of
FOXP3 in human activated nonregulatory CD4+ T cells. Eur J Immunol 37: 129–
38.
WHO (2013). Weekly Epidemiological Record (WER).
Yao Z, Kanno Y, Kerenyi M, et al. (2007). Nonredundant roles for Stat5a/b in directly
regulating Foxp3. Blood 109: 4368–75.
98
Table 1. Main features of study groups.
Study groups
Dermatoses (n=29)
Normal control (n=11)
Leprosy (n=74)
PB (n=13)
MB (n=61)
T1R (n=56)
T2R (n=18)
Gender (M/F)
15/14
0/11
49/25
06/07
43/18
35/21
14/4
Age Median (years) (range)
51 (6-70)
34 (16-55)
48 (20-75)
41 (20-73)
48 (20-75)
49 (20-75)
42 (20-71)
Figure 1. Design for Treg cell study.
99
Figure 2. A) Treg cell counts in skin biopsies of patients with leprosy and other
dermatoses. B) Treg cell counts in skin disorders (leprosy + dermatoses) and normal
skin. C) Absence of double stained CD25 + Foxp3 + Treg cells in normal skin from a
healthy individual submitted to elective mamoplasty. D) Double CD25 + Foxp3 + Treg
cells inpityriasis rosea skin lesion; E) Double
CD25+ Foxp3 + Treg cells in a
paracoccidioidomycosis. Marks= 50 µm.
100
Figure 3. A) Treg cell counts in skin biopsies of patients with infectious dermatoses and
in patients with non-infectious dermatoses. B) Treg cell counts in skin lesions of
infectious dermatoses and leprosy. C) Double stained CD25 + Foxp3 + Treg cells in
eczema lesion; D) Double CD25 + Foxp3 + Treg cells in a cutaneous leishmaniasis; E)
Double CD25+ Foxp3+ Treg cells in syphilis skin lesion. Marks= 50 µm.
101
Figure 4. A) Treg cell counts in skin biopsies of paired biopsies reaction free/reactional.
B and C) Treg cell counts in biopsies of paired biopsies of patients with T1R and
reaction-free. D and E) T reg cell counts in biopsies of paired biopsies with T2R and
reaction-free. F) Double stained CD25+ Foxp3+ Treg cells in a reaction-freeborderlinetuberculoid lesion; G) T1R lesion of the same patient depicted in Figure F during a
T1R; H) Double CD25+ Foxp3+ Treg cells in a reaction-free borderline-lepromatous
patient. I) T2R lesion of the same patient depicted in Figure I paired samples from
patients. Marks: 50m.
102
Figure 5. A) T reg cell counts in skin biopsies of paired samples from patients with T1R
at diagnosis and post-reactional. B) T reg cell counts in skin biopsies of paired samples
from patients with T1R during MDT and reactional-free at diagnosis. C). Treg cell
counts among T1R at diagnosis and T1R during MDT. D) Treg cell counts in skin
biopsies of paired samples collected during T2R diagnosis and post-reactional lesion.
E) Treg cell counts in skin biopsies of paired samples collected during T2R that occurred
during MDT and reaction-free at diagnosis. F) Treg cell count among T2R at diagnosis
and T2R during MDT.
103
Figure 6. A) Treg cell counts among different leprosy forms: TT, BT, BB, LL. B) Treg
cell counts among different leprosy forms: TT, BT, BB, LL during leprosy reactions
and in reaction-free lesions. C) Treg cell counts among paucibacillary and multibacillary
leprosy. D) CD25+ Foxp3 + Treg cells in tuberculoid leprosy. E) CD25+ Foxp3+ Treg
cells in borderline-tuberculoid leprosy. F) CD25 + Foxp3+ Treg cells in borderlinelepromatous leprosy. G) CD25+ Foxp3+ Treg cells in lepromatous leprosy. Marks:
50m.
104
Figure supplementary 1. Double stained CD25+ Foxp3+ Treg cells in different human
skin diseases investigated: A) Lupus erythematosus. B) Paracoccidioidomycosis. C)
American cutaneous leishmaniasis D) Syphilis. Marks: 50 µm.
105
5.2 Manuscript 2
Mast cell heterogenity in human dermatoses: in situ tryptase and chymase positive
cells with emphasis on leprosy and leprosy reactions
Maurício B. Costa1, Aline A. Freitas1, Emerith M. Hungria1, Ana Lúcia O. M. Sousa1,
Kallyne K. O. Mimura2, Sônia M. Oliani2, Mariane M. A. Stefani1
1
Tropical Pathology and Public Health Institute, Federal University of Goiás, Goiânia,
Brazil.
2
Department of Biology, Institute of Biosciences, Letters and Exact Sciences, São Paulo
State University (UNESP), São José do Rio Preto, São Paulo, Brazil.
Abstract
Background: Mast cells (MCs) have regained interest due to their immunoregulatory
role in several pathophysiological processes including skin inflammation by the
production and secretion of a plethora of biologically active molecules. Tryptase (try)
and chymase (chy) granule serine proteases are phenotypic markers of MCs and
try+chy+ MCs predominate in human skin.This study investigated MCs heterogeneity in
human dermatoses with especial emphasis on leprosy and type 1/T1R and type 2
leprosy reactions/T2R. Methods: Eighty skin biopsies from 3 groups were investigated:
40 newly diagnosed untreated leprosy patients (18 reaction-free, 11 T1R, 11 T2R), 29
patients with other dermatoses and 11 normal skin. Toluidine blue stained intact and
degranulated MC counts/mm2, streptavidin-biotin-peroxidase immunostaining was used
to detect try+and chy+ MCs and their density (median optical density) was evaluated
(Axiovision software, Zeiss Axioskop 2, Carl Zeiss, 63X). Statistical significance of
medians was assessed by Kruskall-Wallis and Mann-Whitney (p<0.05). Results:
Infectious and non-infectious skin lesions showed higher numbers of degranulated than
intact MCs in leprosy and other dermatoses, compared to normal skin. The numbers of
degranulated MCs were higher than intact MCs regardless of the leprosy form (from
tuberculoid/TT to lepromatous/LL), regardless of the occurrence of leprosy reactions
(reactional and reaction-free) and regardless of the type of reaction (T1R/T2R). Try+
MCs numbers and density were higher than chy+ MC in normal skin, in leprosy, in
reaction-free and reactional leprosy particularly in T2R, but not in other dermatoses.
Conclusions: Overall results indicate differential expression/ activation of try+ and
106
chy+MCs subsets in leprosy compared to other skin diseases and to normal skin.
However, neither leprosy form nor leprosy reaction was associated with MCs changes
in lesions suggesting that the Mycobacterium lepraeinfectious process itself dictates
MCs expression in leprosy skin lesions.
Key words: mast cell, tryptase, chymase, leprosy, skin diseases
Introduction
Mast cells (MCs) represent one of the most versatile cells in the body and in the
skin due to their ubiquitous distribution and the plethora of biologically active
molecules they produce[1]. Although MCs have been classically associated with
allergic responses, they have been shown to have a much broader role participating in
diverse pathological processes of cutaneous inflammatory and non-inflammatory
diseasesandthey can affect the immune system, promoting inflammation or even
suppressing it. MCs are typically associated with connective tissues surrounding blood
vessels, lymphatic structures, skin appendages and nerves and they are located at the
upper dermal skin, respiratory tract and bowel mucosa which are sites where the host is
exposed to external antigens, allergens, toxins and microbes[2, 3].
Human tissue MCs can express several neutral granule proteases, which
represent the best phenotypic markers of MCs heterogeneity. Based on the protease
content of their granules at least two subpopulations of cells can be differentiated:
connective tissue mast cells that contain tryptase and chymase (try+chy+ MC), and
mucosal mast cells that contain only tryptase (try+ MC) andalso mast cells positive to
chymase only have been described (chy+ MC) [4, 5]. Almost all MCs in the human skin
belong to the try+chy+ MCpopulation, whereas try+ MC predominate in the lung and
bowel mucosa [6]. Pre-formed mediators stored in MCs secretory granules include
different proteases, histamine, heparin proteoglycan, chondroitin sulphate E, acidic
hydrolases, various cytokines and growth factors. Moreover, after activation, MCs can
secrete newly-synthesized mediators, includingprostaglandin D2, leukotriene C4, and
several cytokines, chemokines and growth factors. In addition, MCs can express cell
membrane receptors and ligands. These molecules can modulate the immune system in
the skin, e.g in psoriasis, atopic dermatitis and epithelialcancers and can regulate
cutaneous wound healing after traumaand neoangiogenesis of malignancies[7–9]. MCs
are known to undergo slow and partial degranulation after activation and other
mechanisms such as exosome secretion and selective degranulation-independent
107
mediator secretion have been described [10–13].
Leprosy is a granulomatous, dermato-neurological disease caused by
Mycobacterium leprae that represents an important public health problem in many
endemic countries, some of them with growing emerging economies as India and Brazil
[14].Leprosy shows a wide spectrum of clinical manifestations which depend on the
immune response to the pathogen ranging from few localized skin lesions in
paucibacillary (PB) diseasewith Th1 type cell mediated immunity (CMI), to
disseminated multibacillary (MB) disease characterized by Th2 humoral immunity[15].
During the chronic course of leprosy, before, during or after treatment, some patients
can develop acute immune inflammatory episodes known as leprosy type 1 and type 2
reactions (T1R, T2R).
Leprosy reactions represent a major challenge for patients
management because if not promptly treated, they can lead to irreversible nerve damage
and consequent paresthesia, hypoesthesia or paresia[15].Leprosy reactions are
characterized by an increase in the immune response with augmented levels of
cytokines such as TNF-α, IL-1β, IFN-γ and IL-12 [16–18].
Leprosy skin lesions contain all the cells that are present in normal skin and also
cells that migrate from the peripheral blood as a consequence of the granulomatous
response, including MCs. The data about MCs in leprosy skin lesions are controversial
however the majority of studies indicate increased number in lepromatous lesions [19–
23]. In order to understand the heterogeneity of MCs in human dermatoses, this study
investigated tryptase and chymasesubsets of MCs in normal skin and several dermatoses
with especial emphasis on leprosy skin lesions and type 1 and type 2 leprosy reactions.
Methods
1. Study groups
This study investigated the expression of MCs in 80 skin biopsies from three
different study groups: leprosy, other skin diseases and normal skin. Forty newly
diagnosed, untreated leprosy patients were recruited at the main regional public health
center for leprosy diagnosis and treatment (Centro de Referência em Diagnóstico e
Terapêutica/CRDT in Goiânia, Goiás, Central Western Brazil) in a highly endemic area
for leprosy. Patients were submitted to complete dermato-neurological examination by
one single physician with expertise in leprosy diagnosis (ALOMS). After signing
108
informed consent, skin biopsies were obtained from the active edges of leprosy skin
lesions.
Leprosy patients were classified according to Ridley & Jopling criteria as
tuberculoid/TT,
borderline-tuberculoid/BT,
borderline-borderline/BB,
borderline
lepromatous/BL, lepromatous/LL, taking into account clinical, bacilloscopic index (BI)
and histopathologic findings [24]. Leprosy group comprised 14 paucibacillary patients
(TT and BT- BI negative) and 26 multibacillary patients (BT, BL and LL- BI positive).
Among 40 leprosy patients 18 were reaction-free patients and 22 had leprosy reactions,
11 had type 1 reaction and 11 had type 2 reactions.
An additional group of 29 patients with other skin diseases was recruited at the
same reference center and were diagnosed according to histopathology findings: eczema
(n=5), pityriasis rosea (n=1), pityriasis alba (n=2), granuloma annulare (n=2), drug
induced skin disorder (n=2), lupus erythematosus (n=2), necrobiosislipoidica (n=1),
foreign-body granuloma (n=1) and urticaria (n=1); individuals with chronic infectious
diseases as tinea (n=2) chromomycosis (n=1), cutaneous leishmaniasis (n=5),
paracoccidioidomycosis (n=3) and syphilis (n=1).
For ethical reasons no biopsies could be taken from normal skin or from healthy
individuals. Normal skin by macroscopic and microscopic criteria was includedas
control (n=11); these skin biopsies were taken from contralateral skin for
histopathologic comparisons of certain skin diseases as scleroderma and vitiligo.
Exclusion criteria used in this study were: patients under 18 years old, pregnant
patients, co-morbidities as AIDS, tuberculosis and diabetes mellitus.
This study was approved by the regional and national review boards (Comitê de
Ética em Pesquisa Humana e Animal do Hospital das Clínicas da Universidade Federal
de
Goiás
–
protocol#
119/2005
and
Comissão
Nacional
de
Ética
e
Pesquisa/CONEP/Brasil – protocols # 4862 e 12962). All patients signed an informed
consent form.
Main features of study participants (Table 1) indicate that males predominated
among leprosy patients and controls but patients with other dermatoses were mainly
females. Age of participants (leprosy patients, other dermatoses and controls) was
similar (p=0.730).
109
2. Histopathological analysis
Skin biopsies were taken with a standard dermatologic biopsy punch (4mm) of
the edges of well-characterized and infiltrated skin lesions and fixation was preformed
with 4% neutral buffered paraformaldehyde for 24 hours. For leprosy patients, 3-4 µm
sections of skin biopsies were stained by hematoxilin-eosin (HE) and by Fite-Faraco for
bacilli detection and used for the Ridley& Jopling classification. Histopathologic
features of different human skin diseases investigated in this study (lupus
erythematosus, american cutaneous leishmaniasis, paracoccidioidomycosis, syphilis and
leprosy) are shown in Figure 1 (A-F).
Toluidine blue stained sections (0.5% in alcohol) were used for quantitative analysis
of intact and degranulated mast cells. Intact mast cells were identified by metachromatic
granules in the cytoplasm and degranulated mast cells were identified by the reduction
of density in cytoplasmatic granules [25]. MCs were identified using ZEISSAXIOSKOP 2 (ZEISS, Jena, Germany). Photographic digital images of 1.0 mm2 (27
fields/section) were obtained by the Software AXIOVISION using a high power
objective (40X, ZEISS,Jena, Germany) and analysed by two independent observers
(KKM and MBC) with expertise in MCs morphology/analysis,blinded to the
participants clinical status (different forms of leprosy, reactional or reaction-free
leprosy, other dermatoses, normal skin) and comparable cell counts were obtained
(p=0.63). For each stain, two separate counts were performed. For the intralesional
count, the entire area of the skin lesion was scanned, and the immunopositive cells as
well as the number of fields were recorded. For the perilesional count, only the fields of
view along the interface between the lesion and its neighbourhood were chosen, and
then the number of positive cells and fields were recorded.
3. Immunohistochemical analysis
All skin biopsies from leprosy patients, other dermatoses and normal controls
were submitted to streptavidin-biotin-peroxidaseimmunostaing method to detect
tryptase and chymase positive MCs. Briefly, deparafinized, rehydrated skin biopsies
were submitted to heat induced antigen retrieval (citrate buffer, pH 6, 96ºC, 20 minutes)
endogenous peroxidase was blocked (3% hidrogen peroxidase, 30 minutes). After
washes the diluted primary antibodies, mouse monoclonal anti-human
tryptase
(AA1;1:1000; Dako, Glostrup, Denmark) or mouse monoclonal anti-human chymase
110
(1:100; Abcam, Cambridge, UK) was incubated (16 hours, 4ºC), washed when the
biotinilated secondary antibody and the peroxidase-streptavidin complex were added,
incubated and revealed by 3,3-diaminobenzidine (DAB). All sections were
counterstained with Harris Hematoxiline. For the negative control, the primary antibody
was not added, while positive controls consisted of sections of normal small intestine
mucosa which are rich in MCs and were used to validate immunostaining techniques.
4. Densitometry analysis
The density of expression of tryptase and chymase in theMCs was calculated
assessing 20 tryptase/chymase positive cells in each sample/section using Axiovision
software (Zeiss Axioskop 2, Carl Zeiss, Jena, Germany, and 63 X)in three different
areas/cell and was expressed as value of the mean optical density (MOD) in
immunoreactive areas.
5. Data analysis
Exploratory data analysis, includingmean, medians and standard deviation (SD)
(GrafhPad Prism 6and MS Excel, 2010) was used to analyze the quantifications of
degranulated and intact MC and try+ and chy+ positive MC/mm2 among different study
groups. Statistical significance was assessed by Kruskall-Wallis one way analysis of
variance for comparison of multiple groups and Mann-Whitney for comparison between
two groups.
Results
1. Mast cells activation
Toluidine blue staining counts of total, intact and degranulated MCs in leprosy,
skin dermatoses and normal skin sections (Figure 2 A-D) showed statistically
significant differences (p=0.001).Higher numbers of total MCs were seen in normal skin
compared to skin disorders (dermatoses and leprosy). Quantification of total MCs was
diferent between all groups:
leprosy vs dermatoses (p=0.007), leprosy vs normal
controls (p<0.0001) and dermatoses vs controls (p=0.015). Differences in numbers of
intact MCs among groups were statistically significant (p<0.0001) and the highest
numbers were observed in normal skin, followed by dermatoses.
Leprosy lesions
111
presented the lowest numbers of intact MCs (leprosy vs controls p<0.0001, leprosy vs
dermatoses p=0.007 and dermatoses vs controls p=0.017). Higher numbers of
degranulated MCs compared to intact cells were seen in dermatoses and in leprosy. The
highest numbers of degranulated MCs were observed in leprosy lesions (p<0.0001),
followed by dermatoses (p=0.001). In normal skin, no statistically significant difference
was found between intact and degranulated MCs.
2. Tryptase and Chymase positive mast cells in leprosy, dermatoses and normal
skin
Heterogeneity of immunostained try+ and chy+MCs was compared in leprosy,
other dermatoses and normal skin (Figure 3 A-H). The numbers of try+ MCs were
similar in all groupswhereas counts of chy+ MCsdiffered (p=0.015) (Figure 3A).In
leprosy lesions, the numbers of try+ MCs were higher than chy+ MC (p<0.0001) and the
same trend was seen in normal skin (p=0.003). In other dermatoses the numbers of try+
and chy+ positive cells were similar. Densitometric analysis of chymase and tryptase
positive cells confirmed differences identified by cell counts among groups (p=0.0001)
(Figura 3B).
Tryptase positive MC differed inleprosy vs dermatoses (p=0.011) and leprosy vs
controls (p=0.009). Densitometric analysis of chymase expression was also different
among groups (p=0.018) and the only statisticallysignificant difference was detected in
leprosy vsnormal controls (p=0.008). Within each group densitometric analyses of
tryptase and chymase were different in leprosy lesions (p=0.010) and controls (p=0.007)
while no difference was observed in the dermatoses group (Figure 3B).
3. Mast cells in leprosy lesions
3.1 TT, BT, BL, LL leprosy forms
Toluidine blue staining in leprosy lesions showed higher numbers of
degranulated than intact MCs in TT, BT, BL and LL (Figure 4A); difference of
degranulated and intact cells was significant in TT, BT and LL forms. Higher numbers
of try+ than chy+ MCs were seen in TT, BT, BL, LL leprosy forms and statistically
significant within TT and LL lesions (Figure 4B). Densitometric analysis of tryptase
and chymase expression was similar in all leprosy forms, in MB (BT, BL,LL) vs PB
(TT,BT) leprosy (data not shown).
112
Within leprosy skin lesions intact mast cells stained by toluidine blue and
tryptase and chymase MCs were seen in the interstice, close to blood vessels; more
often inside the inflammatory infiltrates and perianexial region. In leprosy granulomas
MCs were identified more frequently in the lympho-histiocytic mantle than in the
center.
3.2 LeprosyType 1 and Type 2 reactions
Within reactional and reaction-free lesions (Figure 5A) the numbers of
degranulated MCs were higher than intact cells and in both groups this difference was
significant but the numbers of intact MC were higher in reactional than reaction-free
patients. This trend of higher numbers of degranulated MCs than intact cells was
maintained both in T1R and T2R lesions (p<0.050); intact and degranulated cell counts
were similar between T1R and TR2. Try+ MCs numbers were higher than chy+ MCs
both in reactional and reaction-free lesions (p<0.05). The same pattern was seen in T1R
and T2R with higher numbers of try+ than chy+ MCs (p=0.040 and 0.006 respectively)
however the difference was more pronounced in T2R (Figure 5B).Densitometric
analysis showed that the expression of tryptase positive and chymase positive MCs in
T2R was borderline (p=0.048) (Figure 5C).
Discussion
This study perfomed among 80 participants from three different study groups
(leprosy, dermatoses and normal skin) shows the differential expression of MCs in
diverse human skin diseases including leprosy and reactional episodes. MCs have
recently regained interest as important immunomodulators in a wide variety of
processes, including allergy, infectious and auto-immune diseases, cancers, venom
reactions by insect sting and snake bite and in cutaneous wound healing after
trauma[26–29]. In this study, emphasis was given to leprosy and MCs due to precedent
evidence of cutaneous involvement of MCs in skin protection or pathogenesis in
leprosy and other parasitic and bacterial infections [30–32] . Moreover MCs can recruit
cells of the immune system,like T cells, neutrophils and eosinophils to the inflammatory
site in the skin and they can stimulate maturation of Langerhans cells and dendritic cells
and their migration to lymphnodes [1]. Leprosy is a dermato-neurological disease in
which the clinical manifestations are closely associtated to the type of immune response
113
developed by the host. Moreover, the chronic course of leprosy can be interrupted by
immune-inflammatory episodes known as leprosy reactions, which can lead to
irreversible nerve damage[15]. Given the inflammatory properties of MCs and the
immune-regulated manifestations of leprosy and of reactional episodes, it is expected
that MCs may play an important role in leprosy skin lesions. In fact, results presented in
this study indicate an active role for MCs as indicated by the presence of degranulated
cells and mast cell proteases identified.
MCs exert their physiological and pathological activities by releasing granules
containing histamine, cytokines, chemokines, and proteases, including mast cellspecific chymase and tryptase. Degranulation of MCs contents implies not only
activation but also functional activity [1]. In the current study, as expected, infectious
and non-infectious inflammation in the skin led to higher numbers of degranulated MCs
in leprosy and other dermatoses compared to normal skin. Moreover, taking leprosy as
our study model, the numbers and the density of degranulated MCs were higher than
intact MCs regardless of the leprosy form (from TT to LL), regardless of the occurrence
of leprosy reactions (reactional and reaction-free) and regardless of the type of reaction
T1R/T2R. Therefore leprosy and markers of MCs activation were seen in all forms of
leprosy, paucibacillary (TT,BT) and multibacillary (BT, BL,LL) and no association of
bacillary load and mast cell degranulation was found (data not shown). Moreover,
although leprosy reactions are characterized by exacerbated inflammation in skin
lesions (and nerves), degranulated MCs outnumbered intact cells both in reactional and
reaction-free patients. Altogether these data indicate that MCs degranulation and
functional activity are increased in skin disorders, particularly leprosy, independently of
reactional episodes.
Other studies using different methodologies identified higher numbers of MCs in
lepromatous compared to tuberculoid lesions [20–22]. Reduced MCs stained by HE
were observed in reactional versus reaction-free patients [33]. Several factors may
account for differences in results obtained. MCs are difficult to visualize on routine
stains, and they can be often confounded with other inflammatory cells. The toluidine
blue is considered a classical stain and can differentiate degranulated and intact MCs.
Since MCs maturation is based on heparin content, granule and size of the MCs, mature
MCs are more easily identified in tissues than immature MCs due to their scarcity of
secretory granules [34, 35]. Moreover, different methods of MCs identification and
protocols for quantifications of MCs probably concur to controversial results described
114
in leprosy. Additionally some of the studies have investigated a very small number of
patients.
Serine proteases are the major protein constituents within MC secretory granules
and these proteases are subdivided into chymases and tryptases depending on their
primary cleavage specificity [5]. Proteases released by skin MCshave a specific function
by degrading different proteins and peptides. Therefore, many MCs derived products
such as tryptase and chymase can, through their enzymatic action, have detrimental
effects on tissue structure/ modeling while MC derived mediators such as cytokines and
chemokines can perpetuate inflammation. The role of MCs in skin diseases can be
directly related to their granule content and our results revealed changes in the
expression of some mast cell-specific proteases as chymase and tryptase in leprosy and
reactions indicating that these proteases probably exert their enzymatic function in
leprosy lesions. Tryptase is a neutral tetrameric serine protease of 134 kD composed of
four monomers of 32 to 34 kD, each with one catalytic site [36]. Tryptase is the most
abundant protein component of human MCs, which store it with full enzymatic activity
in the secretory granules of all types of human MCs. MCs degranulate upon activation
and release both histamine and tryptase together because tryptase is present in secretory
granules in a complex with heparin proteoglycan [4]. The half life of tryptase in the
circulation is longer than histamine, therefore tryptase has been used as a precise
clinical marker of mast cell activation in systemic diseases as anaphylaxis and asthma
[37]. Tryptase can have multiple functions stimulating smooth muscle, fibroblasts, and
tissue turnover indicating that its enzymatic activity can be a therapeutic target via a
putative inhibitor as indicated in a sheep model of human asthma [38]. Recent data
indicate that MCs tryptase can have both stimulatory and inhibitory functions in skin
inflammation and inhibitory function has been associated with its capacity to cleave
eotaxin and RANTES, capacity to cleave neuropeptides and cathelicidin LL-37
(reviewed in 1).
In leprosy, the relationship between tryptase MC and nerve fibrosis was
investigated and an association between collagen increase and MC density in the
epineurium, and not in the endoneurium, was observed [39]. These results suggest that
MC contribute to collagenization in leprosy through tryptase secretion. In our study the
numbers and the density of try+ MC were higher than chy+ MC in all leprosy forms
(from TT to LL) and both in reaction-free and reactional lesions, especially in T2R.
These results differed from other dermatoses. A previous double staining study of
115
try+/chy+ MC detected two populations of MC try+/chy+ and try+ chy- in leprosy
biopsies [40]. Although in our study double tryptase, chymase immunostaining was not
performed in skin biopsies, where try+ MC and chy+ MC predominate, our data show
that the higher tryptase count than chymase and density indicates its selective
expression in leprosy lesions.
Try+ MC were significantly elevated in T2R which can be associated with
vasculitis and evidence from cancer biology have revealed that MCs regulate
angiogenesis through the production of vascular endothelial growth factor (VEGF) and
release of proangiogenic proteases. A previous study from our groupsearching for
plasma markers of T1R and T2R used multiplex approach to measure 27 plasma factors
including VEGF. For T2R the difference between reactional cases and reaction-free
controls was marginally significant for VEGF (p=0.06) [41]. An increase of try+ MC in
reactional biopsies compared to pre-reactional lesions has been previously reported
[40]. Our results of higher try+ MC counts and density compared to chy+ MC in all
leprosy forms, differ from the lower numbers of MC detected in LL leprosy [30].
In our study the numbers of chy+ MC were higher in dermatoses than in leprosy
and normal skin and numbers of chy+ MC were similar in leprosy and normal skin.
These results indicate that chy+ MC may have a more relevant participation in other skin
diseases compared to leprosy. In fact chy+MC may be involed in skin lesions by
different mechanisms. Chymase is protease mainly located in MCs granules and it has
previously been demonstrated to be activated in tissue fibrosis, which may be more
pronounced in the other dermatoses compared to leprosy [42–44]. Chymase has also
been shown to be involved in tissue matrix remodeling due to its ability to activate
procollagenase and degrade the extracellular matrix [45, 46]. Leprosy lesions mainly TT
and LL show important differences in dermal collagen content, which may be attributed
to different MCs subpopulations and products released [47]. Moreover, chymase
contributes to the release of anti-inflammatory TGF-β1 from its precursor and it is also
able to convert inactive interleukin-1β, a proinflammatory cytokine, to its active form.
Human chymases can activate matrix metalloproteinases, produce angiotensin II, and
induce endothelial cell and smooth muscle cell apoptosis [48–50]. Besides its
proinflammatory capacity, chymase can regulate inflammation by degrading IL-6 and
IL-13 and also TNF-α (reviewed in 1). A previous experimental study showed that
MCchymase played a role in the normal wound healing process measured by the size of
the burn wounds, the density of the capillaries, collagen accumulation and mast cell
116
number and chymase activity [51]. It is possible that MCchymase may also be
participating in wound healing processes in both leprosy and other dermatoses.
Immunohistochemistry for MC proteases as tryptase and chymase is considered
a specific and sensitive approach for assessing mast cells in tissues. However, chymase
detected in a subset of MCs only and try+ chy+MCs predominates in human skin. The
MC quantifications data in our study has been validated by two independent experts in
dermatopathology
that
have
used
precise
anti-tryptase
and
anti-chymase
immunostaining methods for identification of MC subsets. We acknowledge that we
have used only indirect evidence of mast cell activation such as degranulation and
protease content and that evaluation of functional activity, which was not performed in
this study, may be more important than their overall numbers in skin lesions.
Conclusions
The present study shows differential mast cell expression and try+ and chy+
subsets in leprosy and dermatoses compared to normal skin. The potential role of MC in
these pathologic processes is justified by the multitude of biologically relevant
molecules they produce and secrete. Furthermore, we observed that for leprosy,
evidence of mast cell activation assessed by degranulation and tryptase expression
seems to be triggered by the infectious process and is not influenced by the leprosy form
(form TT to LL), nor the occurrence of leprosy type 1 and type 2 reactions.
List of abbreviations
BB: Borderline-borderline; BL: Borderline-lepromatous; BT: Borderline-tuberculoid;
Chy:
chymase; DE: other dermatoses; F: Female; HE: hematoxilin-eosin; IB:
bacilloscopic index; IFN:interferon gamma; IL: Interleukin; LL: lepromatous; M:
Male; MB: multibacillary; MCs: mast cells; mm2: square millimeter; MOD: mean
optical density;NC: normal controls; PB: paucibacillary; SD: standard deviation; T1R:
type 1 reaction; T2R type 2 reaction; TGF: transforming growth factor; Th1: T helper 1;
Th2: T helper 2; TNF:tumor necrosis factor; Try: Tryptase; TT: tuberculoid; VEGF:
vascular endothelial growth factor.
Competing interests
The authors declare that they have no competing interests.
117
Author’s contributions
MBC participated in the design of the study, carried out the histopathological analysis,
immunohistochemical analysis, densitometry analysis and drafted the manuscript. AAF
and EMH participated in the field work, performed the statistical analysis and drafted
the manuscript. ALOMS participated in the field work in the diagnosis of leprosy
patients. KKOM carried out the histopathological analysis, immunohistochemical
analysis, densitometry analysis and performed the statistical analysis, SMO participated
in the design the study, coordinated the field work and analyzed the data. MMAS
conceived, designed the study, coordinated the field work, analyzed the data and
contributed to write the manuscript. All the authors read and approved the final
manuscript.
Author’s information
1
Tropical Pathology and Public Health Institute, Federal University of Goiás, 235th
Street, Setor Universitário, Goiânia-Goiás, Brazil.
2
Department of Biology, Institute of Biosciences, Letters and Exact Sciences, São Paulo
State University (UNESP), São José do Rio Preto- São Paulo, Brazil.
Acknowledements
This study was supported by American Leprosy Missions.
Dr. Mariane M. A. Stefani is a recipient of a fellowship from CNPq (grant #
304869/2008-2), EMH is supported by a fellowship from CNPq (grant# 141554/2013-4)
and AAF is supported by a fellowship from CAPES (grant# 1054292).
118
References
1. Harvima IT, Nilsson G: Mast cells as regulators of skin inflammation and
immunity.Acta Derm Venereol 2011, 91:644–50.
2. Eady RA, Cowen T, Marshall TF, Plummer V, Greaves MW: Mast cell population
density, blood vessel density and histamine content in normal human skin. Br J
Dermatol 1979, 100:623–633.
3. Galli SJ, Nakae S, Tsai M: Mast cells in the development of adaptive immune
responses.Nat Immunol 2005, 6:135–142.
4. Schwartz LB, Irani AM: Mast cell heterogeneity.Clin Exp allergy 1989, 19:143–
145.
5. Weidner N, Austen KF: Heterogeneity of mast cells at multiple body sites.
Fluorescent determination of avidin binding and immunofluorescent
determination of chymase, tryptase, and carboxypeptidase content.Pathol Res Pract
1993, 189:156–162.
6. Diaconu N-C, Kaminska R, Naukkarinen A, Harvima RJ, Harvima IT: The increase
in tryptase- and chymase-positive mast cells is associated with partial inactivation
of chymase and increase in protease inhibitors in basal cell carcinoma.J Eur Acad
Dermatol Venereol 2007, 21:908–915.
7. Dawicki W, Marshall JS: New and emerging roles for mast cells in host defence.
Curr Opin Immunol 2007, 19:31–38.
8. Juremalm M, Nilsson G: Chemokine receptor expression by mast cells. Chem
Immunol Allergy 2005, 87:130–144.
9. Sayed BA, Brown MA: Mast cells as modulators of T-cell responses.Immunol Rev
2007, 217:53–64.
10. Cao J, Boucher W, Kempuraj D, Donelan JM, Theoharides TC: Acute stress and
intravesical corticotropin-releasing hormone induces mast cell dependent vascular
endothelial growth factor release from mouse bladder explants.J Urol 2006,
176:1208–1213.
11. Fischer M, Harvima IT, Carvalho RFS, Möller C, Naukkarinen A, Enblad G,
Nilsson G: Mast cell CD30 ligand is upregulated in cutaneous inflammation and
mediates degranulation-independent chemokine secretion.J Clin Invest 2006,
116:2748–2756.
12. Dvorak AM, Kissell S: Granule changes of human skin mast cells characteristic
of piecemeal degranulation and associated with recovery during wound healing in
situ.J Leukoc Biol 1991, 49:197–210.
13. Skokos D, Botros HG, Demeure C, Morin J, Peronet R, Birkenmeier G, Boudaly S,
Mécheri S: Mast cell-derived exosomes induce phenotypic and functional
119
maturation of dendritic cells and elicit specific immune responses in vivo.J
Immunol 2003, 170:3037–3045.
14. WHO: Weekly epidemiological record Relevé épidémiologique hebdomadaire.
2013, 88:365–380.
15. Scollard DM, Adams LB, Gillis TP, Krahenbuhl JL, Truman RW, Williams DL:
The Continuing Challenges of Leprosy. Clin Microbiol Rev 2006, 19:338–381.
16. Yamamura M, Wang XH, Ohmen JD, Uyemura K, Rea TH, Bloom BR, Modlin RL:
Cytokine patterns of immunologically mediated tissue damage.J Immunol 1992,
149:1470–1475.
17. Sarno EN, Grau GE, Vieira LM, Nery JA: Serum levels of tumour necrosis
factor-alpha and interleukin-1 beta during leprosy reactional states.Clin Exp
Immunol 1991, 84:103–108.
18. Moraes MO, Sarno EN, Almeida AS, Saraiva BC, Nery JA, Martins RC, Sampaio
EP: Cytokine mRNA expression in leprosy: a possible role for interferon-gamma
and interleukin-12 in reactions (RR and ENL).Scand J Immunol 1999, 50:541–549.
19. Rav SD, Pratap VK, Sharma NK, Dayal SS: Mast cell in leprosy. . Indian J Lepr
1990, 62:467–72.
20. Van Hale HM, Turkel SB, Rea TH: Dermal ultrastructure in leprosy.Arch Pathol
Lab Med 1984, 108:383–386.
21. Aroni K, Kontochristopoulos G, Liossi A, Panteleos D: An investigation of mast
cells in two basic leprosy groups. Int J Lepr other Mycobact Dis 1993, 61:634–635.
22. Mysorekar VV, Dandekar CP, Rao SG: Mast cells in leprosy skin lesions. Lepr
Rev 2001, 72:29–34.
23. Bagwan IN, Khandekar MM, Kadam P, Jadhav MV, Deshmukh SD: A study of
mast cells in granulomatous lesions of skin, with special emphasis on leprosy.
Indian J Lepr 2004, 76:31–37.
24. Ridley DS, Jopling WH: Classification of leprosy according to immunity. A
fivegroup system. Int J Lepr Other Mycobact Dis 1966, 34:255–273.
25. Pimentel TA, Sampaio ALF, D’Acquisto F, Perretti M, Oliani SM: An essential
role for mast cells as modulators of neutrophils influx in collagen-induced arthritis
in the mouse. Lab Invest 2011, 91:33–42.
26. Harvima IT, Nilsson G, Suttle MM, Naukkarinen A: Is there a role for mast cells
in psoriasis?Arch Dermatol Res 2008, 300:461–478.
27. Metz M, Piliponsky AM, Chen C-C, Lammel V, Abrink M, Pejler G, Tsai M, Galli
SJ: Mast cells can enhance resistance to snake and honeybee venoms. Science 2006,
313:526–530.
120
28. Huttunen M, Aalto ML, Harvima RJ, Horsmanheimo M, Harvima IT: Alterations
in mast cells showing tryptase and chymase activity in epithelializating and chronic
wounds. Exp Dermatol 2000, 9:258–265.
29. Weller K, Foitzik K, Paus R, Syska W, Maurer M: Mast cells are required for
normal healing of skin wounds in mice. FASEB J 2006, 20:2366–8.
30. Magalhães G de O, Valentim V da C, Pereira MJDS, Nery JA da C, Illarramendi X,
Antunes SLG: A quantitative and morphometric study of tryptase-positive mast
cells in cutaneous leprosy lesions. Acta Trop 2008, 105:62–66.
31. Siebenhaar F, Syska W, Weller K, Magerl M, Zuberbier T, Metz M, Maurer M:
Control of Pseudomonas aeruginosa skin infections in mice is mast cell-dependent.
Am J Pathol 2007, 170:1910–1916.
32. Metz M, Siebenhaar F, Maurer M: Mast cell functions in the innate skin immune
system. Immunobiology 2008, 213:251–260.
33. Mahaisavariya P, Jiamton S, Manonukul J, Khemngern S: Mast cells in leprosy
and leprosy reaction. Int J Dermatol 2000, 39:274–277.
34. Fawcett DW.: An experimental study of mast cell degranulation and
regeneration. Anat Rec 1955, 121:29–51.
35. Mendonca VO, Vugman I, Jamur MC: Maturation of adult rat peritoneal and
mesenteric mast cells. A morphological and histofluorescence study. Cell Tissue Res
1986, 243:635–639.
36. Payne V, Kam PCA: Mast cell tryptase: a review of its physiology and clinical
significance. Anaesthesia 2004, 59:695–703.
37. Schwartz LB, Kepley C: Development of markers for human basophils and mast
cells. J Allergy Clin Immunol 1994, 94:1231–1240.
38.Tanaka RD, Clark JM, Warne RL, Abraham WM, Moore WR.Mast cell tryptase: a
new target for therapeutic intervention in asthma. Int Arch Allergy Immunol 1995,
107:408–9.
39. Montagna NA, de Oliveira ML, Mandarim-de-Lacerda CA, Chimelli L: Leprosy:
contribution of mast cells to epineurial collagenization. Clin Neuropathol 2005,
24:284–90.
40. Antunes SLG, Liang Y, Neri JA da C, Sarno EN, Haak-Frendscho M, Johansson O:
Mast cell subsets and neuropeptides in leprosy reactions. Arq Neuropsiquiatr 2003,
61:208–219.
41. Stefani MM, Guerra JG, Sousa ALM, Costa MB, Oliveira MLW, Martelli CT,
Scollard DM: Potential plasma markers of type I and type 2 leprosy reactions: a
preliminary report. BMC Infect Dis 2009, 8:1–8.
121
42. Lang YD, Chang SF, Wang LF, Chen CM: Chymase mediates paraquat-induced
collagen production in human lung fibroblasts. Toxicol Lett 2010, 193:19–25.
43. Tomimori Y, Muto T, Saito K, Tanaka T, Maruoka H, Sumida M, Fukami H,
Fukuda Y: Involvement of mast cell chymase in bleomycin-induced pulmonary
fibrosis in mice. Eur J Pharmacol 2003, 478:179–185.
44. Akgul A.: Can cardiac fibrosis be prevented? Mast cell inhibition versus antichymase activity. Eur J Cardiothorac Surg 2009, 35:553–4.
45. Saarinen J, Kalkkinen N, Welgus HG, Kovanen PT: Activation of human
interstitial procollagenase through direct cleavage of the Leu83-Thr84 bond by
mast cell chymase. J Biol Chem 1994, 269:18134–18140.
46. Vartio T, Seppä H, Vaheri A.: Susceptibility of soluble and matrix fibronectins to
degradation by tissue proteinases, mast cell chymase and cathepsin G. J Biol Chem
1981, 256:471–7.
47. Antunes SL, Motta E, Almeida SM, Gallo ME, Nery JA, Lenzi HL: Distinct
patterns of microvasculature in the cutaneous lesions of leprosy. Int J Lepr Other
Mycobact Dis 2000, 68:143–151.
48. Furubayashi K, Takai S,Jin D,Miyazaki M,Katsumata T,Inagaki S,Kimura M,
Tanaka K, Nishimoto M, Fukumoto H:Chymase activates promatrix
metalloproteinase-9 in human abdominal aortic aneurysm. Clin Chim Acta 2008,
388:214–6.
49. Miyazaki M, Takai S, Jin D, Muramatsu M: Pathological roles of angiotensin II
produced by mast cell chymase and the effects of chymase inhibition in animal
models. Pharmacol Ther 2006, 112:668–676.
50. Leskinen MJ, Heikkilä HM, Speer MY, Hakala JK, Laine M, Kovanen PT,
Lindstedt KA: Mast cell chymase induces smooth muscle cell apoptosis by
disrupting NF-kappaB-mediated survival signaling. Exp Cell Res 2006, 312:1289–
1298.
51. Nishikori Y, Kakizoe E, Kobayashi Y, Shimoura K, Okunishi H, Dekio S: Skin
mast cell promotion of matrix remodeling in burn wound healing in mice:
relevance of chymase. Arch Dermatol Res 1998, 290:553–560.
122
Table 1. Main features of study groups
Group
Gender
Age
(M/F)
(median, range years)
29/11
50,0 (20-95)
PB (n=14)
9/5
52,0 (30-95)
MBb (n=26)
20/6
49,0 (20-66)
T1R (n=11)
7/4
50,0 (33-66)
T2R (n=11)
8/3
48,0 (20-95)
NC (n=11)
3/8
42,0 (20-79)
DE (n=29)
15/14
51,0 (6-70)
Leprosy (n=40)
a
PB: paucibacillary leprosy; MB: multibacillary leprosy; T1R: type 1 reaction; T2R:
type 2 reaction; NC: normal controls with normal skin, DE: other dermatoses; F:
Female; M: Male. PBa patients group: 10 TT and 4 BT; MBb patients group: 6 BT, 15
LL and 5 BL.
123
Figure 1. Histopathologic findings in different human skin diseases investigated: A)
Lupus erythematosus (HE) and inset PAS stain demonstrating a thickened and tortuous
basement membrane zone; B) American cutaneous leishmaniasis (HE); C)
Paracoccidioidomycosis (inset shows fungi stained by Grocott silver); D) Syphilis (HE);
E) Borderline-lepromatous leprosy (HE) and inset acid fast bacilli (Fite-Faraco
staining); F) Acid fast bacilli in lepromatous leprosy (Fite-Faraco staining). Marks: 100
µm (A-E) and 50 µm (F).
124
Figure 2. Histopatological features of mast cells in: A) Intact and degranulated mast
cells by toluidine blue staining in leprosy lesions, other dermatoses and normal skin.
Intact MCs are identified by arrowheads and degranulated MC are identified by arrow;
B) Borderline lepromatous leprosy; C) other dermatoses (Eczema) and D) normal skin.
Marks: 20 µm (B-D).
125
Figure 3. A) Tryptase and chymase positive MCs numbers in leprosy lesions, others
dermatoses and normal skin (controls); B) Densitometric analyses of tryptase and
chymase in leprosy lesions, others dermatoses and normal skin (controls); C, E, G:
Tryptase positive mast cells in borderline lepromatous leprosy (C), others dermatoses
(Eczema) (E) and normal skin (G); D,F,H: Chymase positive mast cells in borderline
lepromatous leprosy (D), others dermatoses (Eczema) (F) and normal skin (H). Bars:
20 µm (C-H).
126
Figure 4. A) Toulidine blue stained intact and degranulated MCs among leprosy forms
according Ridley & Jopling (TT, BT, BL and LL). B) Immunohistochemistry analyses
of tryptase and chymase positive MCs among leprosy forms according Ridley &
Jopling (TT, BT, BL and LL).
127
Figure 5: A) Toulidine blue stained intact and degranulated MC among reactional and
reaction-free leprosy patients and among T1R and T2R; B) Tryptase and chymase
positive MC among reactional and reaction-free leprosy patients and among T1R and
T2R. C) Densitometric analyses of trypase and chymase positive MCs among
reactional and reaction-free leprosy patients and among T1R and T2R.
128
6. CONCLUSÕES
Células Tregs em doenças cutâneas
As células Treg estão ausentes em pele normal enquanto números variáveis são
detectadas em doenças cutâneas, infecciosas e não infecciosas, sendo maior nas
infecciosas. Entre asdoenças cutâneas infecciosas de diferentes etiologias, observamos
distribuição semelhante das Tregs. As células Tregs estão aumentadas na RT1 mesmo
quando o paciente desenvolve reação durante MDT, enquanto nenhuma variação de Treg
foi vista na RT2. Na hanseníase não houve associação entre formas de hanseníase e as
células Tregs. Concluímos que as células Treg fazem parte do infiltrado inflamatório da
hanseníase, não sofrem efeito das variações clínicas, microbiológicas, imunológicas da
hanseníase. O aumento das células Tregs, visto na RT1, é compatível com sua
imunopatologia e sugere papel benéfico para o hospedeiro, protegendo contra a
imunopatologia.
Mastócitos em doenças cutâneas
Os mastócitos são células identificadas na pele normal. Lesões cutâneas de origem
infecciosa
e
não-infecciosa
apresentam
números
aumentados
de mastócitos
desgranulados em relação aos intactos, tanto na hanseníase como nas outras dermatoses
quando comparados com pele normal. Os números de MC desgranulados superam os
intactos independente da forma de hanseníase (do polo
tuberculoide/TTao
lepromatoso/LL), independe da ocorrência das reações hansênicas (lesão reacional/sem
reação) e independente do tipo de reação (RT1/RT2). Números e densidade de MC
try+foram maiores que MC chy+ na hanseníase, em pacientes com e sem reação,
particularmente na RT2, mas não nas dermatoses estudadas. Estes dados sugerem que o
processo infeccioso pelo Mycobacterium leprae, per se direciona a expressão de MC
nas lesões cutâneas da hanseníase.
129
7. REFERÊNCIAS BIBLIOGRÁFICAS
Abbas A, Lichtman A, Pillai S. Effector Mechanisms of Cell-Mediated Immunity.
Cellular and Molecular Immunology: Elsevier Saunders, 2012 (a). pp. 225-242.
Abbas A, Lichtman A, Pillai S. IgE-Dependent Immune Responses and Allergic
Disease.In Saunders E, ed. Cellular and Molecular Immunology: Elsevier
Saunders, 2012 (b). pp. 425-444.
Abbas A, Lichtman A, Pillai S. Innate Immunity. Cellular and Molecular Immunology:
Elsevier Saunders, 2012 (c). pp. 55-88.
Akira S 2003. [Acesso em: 16 de janeiro de 2014]. Toll-like receptor signaling.
Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/12893815.
Amon U, Nitschke M, Dieckmann D, Gibbs BF, Wehrhahan C, Wolff HH 1994.
Activation and inhibition of mediator release from skin mast cells: a review of in
vitro experiments. Clin Exp Allergy 24: 1098-1104.
Andrade VLG 1996. Evolução da hanseníase no Brasil e perspectivas para sua
eliminação como um problema de saúde pública, PhD Thesis, Escola Nacional de
Saúde Pública da Fundação Oswaldo Cruz, 198 pp.
Antunes SL, Liang Y, Neri JA, Sarno EN, Haak-Frendscho M, Johansson O 2003.Mast
cell subsets and neuropeptides in leprosy reactions.Arq Neuropsiquiatr 61: 208-19.
Aroni K, Kontochristopoulos G, Liossi A, Panteleos D 1993. An investigation of mast
cells in two basic leprosy groups.Int J Lepr Other Mycobact Dis 61: 634-635.
Aseffa A, Brennan P, Dockrell H, Gillis T, Hussain R, Oskam L, Richardus J H 2005.
Report on the first meeting of the IDEAL (Initiative for Diagnostic and
Epidemiological Assays for Leprosy) consortium held at Armauer Hansen Research
Institute, ALERT, Addis Ababa, Ethiopia on 24-27 October 2004. Lepr.Rev. 76:
147-159.
Attia EA, Abdallah M, Saad AA, Afifi A, El Tabbakh A, El-Shennawy D, Ali HB 2010.
Circulating CD4+ CD25 high FoxP3+ T cells vary in different clinical forms of
leprosy. Int J Dermatol 49: 1152-1158.
Bagwan IN, Khandekar MM, Kadam P, Jadhav MV, Deshmukh SD 2004. A study of
mast cells in granulomatous lesions of skin, with special emphasis on
leprosy.Indian J Lepr 76: 31-37.
Bakker Bakker MI, Hatta M, Kwenang A, Van Mosseveld P, Faber WR, Klatser PR,
Oskam L 2006. Risk factors for developing leprosy--a population-based cohort
study in Indonesia. Lepr Rev 77: 48-61.
Barnes PF, Chatterjee D, Brennan PJ, Rea TH, Modlin RL 1992. Tumor necrosis factor
production in patients with leprosy. Infect Immun 60: 1441-1446.
Bazan-Furini R, Motta AC, Simao JC, Tarquinio DC, Marques W, Jr., Barbosa MH,
Foss NT 2011. Early detection of leprosy by examination of household contacts,
130
determination of serum anti-PGL-1 antibodies and consanguinity. Mem Inst
Oswaldo Cruz 106: 536-40.
Bechelli LM, Martinez Dominguez V 1966. The leprosy problem in the world.Bull
World Health Organ 34: 811-826.
Beissert S, Schwarz A, Schwarz T 2006. Regulatory T cells.J Invest Dermatol 126: 1524.
Blank U, Benhamou M 2013. [Acesso em: 17 de janeiro de 2014]. Deciphering New
Molecular
Mechanisms
of
Mast
Cell
Activation.Disponível
em:
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3635034/.
Blank U, Falcone FH, Nilsson G 2013. The history of mast cell and basophil research some lessons learnt from the last century. Allergy 10.1111/all.12197:
Bochud PY, Hawn TR, Siddiqui MR, Saunderson P, Britton S, Abraham I, Argaw AT,
Janer M, Zhao LP, Kaplan G, Aderem A 2008. Toll-like receptor 2 (TLR2)
polymorphisms are associated with reversal reaction in leprosy. J Infect Dis 197:
253-261.
Brasil. Ministério da Saúde 1993. Guia de Controle da Hanseníase. Brasília, 162 pp.
Brasil. Ministério da Saúde 2002. Guia para o Controle da Hanseníase. Brasília, 89 pp.
Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de
Vigilância Epidemiológica 2009. Hanseníase. In Guia de Vigilância
Epidemiológica | Caderno 7, 7. ed. Brasília, p. 420-447.
Brasil. Ministério da Saúde 2010 (a). Diretrizes para Vigilância, Atenção e Controle da
hanseníase; portaria nº 3.125, de 7 de outubro de 2010. Brasília, DF. [acessado em
06
de
novembro
de
2013].
Disponível
em:
http://portal.saude.gov.br/portal/arquivos/pdf/portaria_n_3125_hanseniase_2010.pd
f.
Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de
Vigilância Epidemiológica 2010 (b). Guia de procedimentos técnicos, Baciloscopia
em Hanseníase, Série A. Normas e Manuais Técnicos. 1a. ed. Brasília, pp. 54.
Brito MFM, Ximenes RAA, Gallo MEN 2005. O retratamento por recidiva em
hanseníase. An Bras Dermatol. 80: 255-260.
Britton WJ, Lockwood DN 2004. Leprosy. Lancet 363: 1209-1219.
Bührer-Sékula S, Cunha MG, Ferreira WA, Klatser PR 1998. The use ofwhole blood in
a dipstick assay for detection of antibodies to Mycobacteriumleprae: a field
evaluation. FEMS Immunol.Med.Microbiol., 21: 197-201.
Bührer-Sékula S, Sarno EN, Oskam L, Koop S, Wichers I, Nery JA, Vieira LM, de
Matos HJ, Faber WR, Klatser PR 2000. Use of MLdipstick as a tool to classify
leprosy patients. Int.J.Lepr.Other Mycobact.Dis., 68:456-463.
131
Bührer-Sékula S, Smits HL, Gussenhoven GC, van Leeuwen J, Amador S, Fujiwara T,
Klatser PR, Oskam L 2003. Simple and fast lateral flow test for classification of
leprosy patients and identification of contacts with high risk of developing leprosy.
J Clin Microbiol 41: 1991-1995.
Bührer-SékulaS, VisschedijkJ, GrossiMA, DhakalKP, NamadiAU,KlatserPR, OskamL
2007. The ML flow test as a point of care test forleprosy control programmes:
potential effects on classification of leprosy patients. Lepr.Rev., 78:70-79.
Bührer-Sékula S 2008. PGL-I leprosy serology. Rev Soc Bras Med Trop 41 Suppl 2: 35.
Cattamanchi A, Smith R, Steingart KR, Metcalfe JZ, Date A, Coleman C, Marston BJ,
Huang L, Hopewell PC, Pai M 2011. Interferon-gamma release assays for the
diagnosis of latent tuberculosis infection in HIV-infected individuals: a systematic
review and meta-analysis. J Acquir Immune Defic Syndr 56: 230-238.
Castorina-Silva R 2013. Tratamento da Hanseníase. In Lyon S, Grossi MAF,
Hanseníase, Medbook, Rio de Janeiro, p. 199-206.
Chatura KR, Sangeetha S 2012. Utility of Fite-Faraco stain for both mast cell count and
bacillary index in skin biopsies of leprosy patients. Indian J Lepr 84: 209-215.
Chen X, Zhou B, Li M, Deng Q, Wu X, Le X, Wu C, Larmonier N, Zhang W, Zhang H,
Wang H, Katsanis E 2007. CD4(+)CD25(+)FoxP3(+) regulatory T cells suppress
Mycobacterium tuberculosis immunity in patients with active disease. Clin
Immunol 123: 50-59.
Chiacchio T, Casetti R, Butera O, Vanini V, Carrara S, Girardi E, Di Mitri D, Battistini
L, Martini F, Borsellino G, Goletti D 2009. Characterization of regulatory T cells
identified as CD4(+)CD25(high)CD39(+) in patients with active tuberculosis. Clin
Exp Immunol 156: 463-470.
Chowdhury SK, Ghosh S 1968. Distribution of tissue mast cells in "reaction in
tuberculoid leprosy".Bull Calcutta Sch Trop Med 16: 13-4.
Coelho MCG 2013. Eletroneuromiografia e Hanseníase. In Lyon S, Grossi MAF,
Hanseníase, Medbook, Rio de Janeiro, p. 117-125.
Cole ST, Brosch R, Parkhill J, Garnier T, Churcher C, Harris D, Gordon SV, Eiglmeier
K, Gas S, Barry CE, 3rd, Tekaia F, Badcock K, Basham D, Brown D,
Chillingworth T, Connor R, Davies R, Devlin K, Feltwell T, Gentles S, Hamlin N,
Holroyd S, Hornsby T, Jagels K, Krogh A, McLean J, Moule S, Murphy L, Oliver
K, Osborne J, Quail MA, Rajandream MA, Rogers J, Rutter S, Seeger K, Skelton J,
Squares R, Squares S, Sulston JE, Taylor K, Whitehead S, Barrell BG 1998.
Deciphering the biology of Mycobacterium tuberculosis from the complete genome
sequence.Nature 393: 537-544.
Cole ST, Eiglmeier K, Parkhill J, James KD, Thomson NR, Wheeler PR, Honore N,
Garnier T, Churcher C, Harris D, Mungall K, Basham D, Brown D, Chillingworth
T, Connor R, Davies RM, Devlin K, Duthoy S, Feltwell T, Fraser A, Hamlin N,
Holroyd S, Hornsby T, Jagels K, Lacroix C, Maclean J, Moule S, Murphy L, Oliver
132
K, Quail MA, Rajandream MA, Rutherford KM, Rutter S, Seeger K, Simon S,
Simmonds M, Skelton J, Squares R, Squares S, Stevens K, Taylor K, Whitehead S,
Woodward JR, Barrell BG 2001. Massive gene decay in the leprosy bacillus.Nature
409: 1007-1011.
Corstjens PL, de Dood CJ, van der Ploeg-van Schip JJ, Wiesmeijer KC, Riuttamaki T,
van Meijgaarden KE, Spencer JS, Tanke HJ, Ottenhoff TH, Geluk A 2011. Lateral
flow assay for simultaneous detection of cellular- and humoral immune responses.
Clin Biochem 44: 1241-6.
Costa MB, Cavalcanti Neto PF, Martelli CM, Stefani MM, Maceira JP, Gomes MK,
Schettini AP, Rebello PF, Pignataro PE, Ueda ES, Narahashi K, Scollard DM 2001.
Distinct histopathological patterns in single lesion leprosy patients treated with
single dose therapy (ROM) in the Brazilian Multicentric Study. Int J Lepr Other
Mycobact Dis 69: 177-186.
Costa RD, Costa MD, Costa AMDD 2013. Imunopatologia da Hanseníase. In Lyon S,
Grossi MAF, Hanseníase, Medbook, Rio de Janeiro, p. 71-79.
Cree IA, Coghill G, Swanson Beck J 1990. Mast cells in leprosy skin lesions. J Clin
Pathol 43: 196-200.
Cruvinel WM, Mesquita Júnior D, Araújo JAP, Salmazi KC, Kállas EG, Andrade LEC
2008. Natural regulatory T cells in rheumatic diseases.Rev. Bras. Reumatol.48:
342-355.
Cunha AZC 1997. Hanseníase: a história de um problema de saúde pública / Hansen's
disease: the history of a public health issue,MsC Thesis, Universidade de Santa
Cruz do Sul, 101pp.
de Boer OJ, van der Loos CM, Teeling P, van der Wal AC, Teunissen MB 2007.
Immunohistochemical analysis of regulatory T cell markers FOXP3 and GITR on
CD4+CD25+ T cells in normal skin and inflammatory dermatoses. J Histochem
Cytochem 55: 891-8.
de Vries RR, Fat RF, Nijenhuis LE, van Rood JJ 1976. HLA-linked genetic control of
host response to Mycobacterium leprae. Lancet 11:1328-1330.
Djelouadji Z, Raoult D, Drancourt M 2011. Palaeogenomics of Mycobacterium
tuberculosis: epidemic bursts with a degrading genome. Lancet Infect Dis 11: 641650.
Duthie MS, Goto W, Ireton GC, Reece ST, Cardoso LP, Martelli CM, Stefani MM,
Nakatani M, de Jesus RC, Netto EM, Balagon MV, Tan EV, Gelber RH, MaedaY,
Makino M, Hoft D, Reed SG 2007. Use of protein antigens for early serological
diagnosis of leprosy. Clin Vaccine Immunol14: 1400-1408.
Duthie MS, Ireton GC, Kanaujia GV, Goto W, Liang H, Bhatia A, Busceti JM,
Macdonald M, Neupane KD, Ranjit C, Sapkota BR, Balagon M, Esfandiari J,
Carter D, Reed SG 2008 (a). Selection of antigens and development of prototype
tests for point-of-care leprosy diagnosis. Clin Vaccine Immunol15: 1590-1597.
133
Duthie MS, Goto W, Ireton GC, Reece ST, Sampaio LHS, Grassi AB, Sousa ALM,
Martelli CMT, Stefani MMA, Reed EG 2008 (b). Antigen-specific T-cell responses
of leprosy patients. Clin Vaccine Immunol 15: 1659- 1665.
Duthie MS, Hay MN, Morales CZ, Carter L, Mohamath R, Ito L, Oyafuso LK, Manini
MI, Balagon MV, Tan EV, Saunderson PR, Reed SG, Carter D 2010. Rational
design and evaluation of a multiepitope chimeric fusion protein with the potential
for leprosy diagnosis. Clin Vaccine Immunol 17: 298-303.
Eidt LM 2004. Breve história da hanseníase: sua expansão do mundo para as Américas,
o Brasil e o Rio Grande do Sul e sua trajetória na saúde pública brasileira/
Trajectory in the brazilian public health. Saúde Soc 13: 76-88.
Facer P, Mann D, Mathur R, Pandya S, Ladiwala U, Singhal B, Hongo J, Sinicropi DV,
Terenghi G, Anand P 2000. Do nerve growth factor-related mechanisms contribute
to loss of cutaneous nociception in leprosy? Pain 85: 231-238.
Fava V, Orlova M, Cobat A, Alcais A, Mira M, Schurr E 2012. Genetics of leprosy
reactions: an overview. Mem Inst Oswaldo Cruz 107 Suppl 1: 132-142.
Fernandes C, Gonçalves HS, Cabral PC, Pinto HC, Pinto MIM, Camara LMC 2013.
[Acesso em: 16-01-2014]. Increased Frequency of CD4 and CD8 Regulatory T
Cells in Individuals under 15 Years with Multibacillary Leprosy. Disponível em:
http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0079072.
Fine PE, Sterne JA, Ponnighaus JM, Bliss L, Saui J, Chihana A, Munthali M, Warndorff
DK 1997. Household and dwelling contact as risk factors for leprosy in northern
Malawi.Am J Epidemiol 146: 91-102.
Finiasz MR, Franco MC, de la Barrera S, Rutitzky L, Pizzariello G, del Carmen Sasiain
M, Renauld JC, Van Snick J, Fink S 2007. IL-9 promotes anti-Mycobacterium
leprae cytotoxicity: involvement of IFNgamma. Clin Exp Immunol 147: 139-147.
Fischer MK, Myer KA, Que SK, Harris JA, Martiniuk FT, Meehan SA, Levis WR
2012. Pseudoepitheliomatous hyperplasia and transepidermal elimination in
lepromatous leprosy: does T-cell plasticity play a role? J Drugs Dermatol 11: 12325.
Fitness J, Floyd S, Warndorff DK, Sichali L, Mwaungulu L, Crampin AC, Fine PE, Hill
AV 2004. Large-scale candidate gene study of leprosy susceptibility in the Karonga
district of northern Malawi. Am J Trop Med Hyg 71: 330-340.
Fleury RN 1997. Manifestações sistêmicas. In Talhari S, Neves RG. Hanseníase. 3ª
edição, Manaus, 1997.p. 77-81.
Fleury RN 2006. Critérios para o emprego da classificação de Ridley e Jopling na rotina
dos laboratórios de anatomia patológica - segunda parte.Hansen Int 31:.47-51.
Fontenot JD, Gavin MA, Rudensky AY 2003. Foxp3 programs the development and
function of CD4+CD25+ regulatory T cells. Nat Immunol 4: 330-336.
134
Fontenot JD, Rasmussen JP, Williams LM, Dooley JL, Farr AG, Rudensky AY
2005.Regulatory T cell lineage specification by the forkhead transcription factor
foxp3.Immunity 22: 329-41.
Foss NT 1997. Imunopatologia. In Talhari S, Neves RG, Hanseníase. Hanseníase. 3ª
edição, Manaus, 1997.p. 97-102.
Foss NT, Souza CS, Goulart IMB, Gonçalves HS, Virmond M2003. [Acesso em: 17 de
janeiro de 2014]. Sociedade Brasileira de Hansenologia e Sociedade Brasileira de
Dermatologia Imunopatologia. Hanseníase: Episódios Reacionais. Projeto
Diretrizes da Associação Médica Brasileira e Conselho Federal de
Medicina.http://www.projetodiretrizes.org.br/projeto_diretrizes/056.pdf
Fujimura T, Okuyama R, Ito Y, Aiba S 2008. Profiles of Foxp3+ regulatory T cells in
eczematous dermatitis, psoriasis vulgaris and mycosis fungoides.Br J Dermatol
158: 1256-1263.
Gershon RK, Kondo K 1970. Cell interactions in the induction of tolerance: the role of
thymic lymphocytes. Immunology 18: 723-737.
Geluk A, Klein MR, Franken KL, van Meijgaarden KE, Wieles B, Pereira KC, BührerSékula S, Klatser PR, Brennan PJ, Spencer JS, Williams DL, Pessolani MC,
Sampaio EP, Ottenhoff TH 2005. Postgenomic approach to identify novel
Mycobacterium leprae antigens with potential to improve immunodiagnosis of
infection. Infect Immun 73: 5636-5644.
Geluk A, Spencer JS, Bobosha K, Pessolani MC, Pereira GM, Banu S, Honore N, Reece
ST, Macdonald M, Sapkota BR, Ranjit C, Franken KL, Zewdie M, Aseffa A,
Hussain R, Stefani MM, Cho SN, Oskam L, Brennan PJ, Dockrell HM 2009. From
genome-based in silico predictions to ex vivo verification of leprosy diagnosis. Clin
Vaccine Immunol 16: 352-359.
Geluk A, van der Ploeg-van Schip JJ, van Meijgaarden KE, Commandeur S, Drijfhout
JW, Benckhuijsen WE, Franken KL, Naafs B, Ottenhoff TH 2010. Enhancing
sensitivity of detection of immune responses to Mycobacterium leprae peptides in
whole-blood assays. Clin Vaccine Immunol 17: 993-1004.
Geluk A, Duthie MS, Spencer JS 2011. Postgenomic Mycobacterium leprae antigens
for cellular and serological diagnosis of M. leprae exposure, infection and leprosy
disease. Lepr Rev 82: 402-421.
Geluk A, Bobosha K, van der Ploeg-van Schip JJ, Spencer JS, Banu S, Martins MV,
Cho SN, Franken KL, Kim HJ, Bekele Y, Uddin MK, Hadi SA, Aseffa A,
Pessolani MC, Pereira GM, Dockrell HM, Ottenhoff TH 2012. New biomarkers
with relevance to leprosy diagnosis applicable in areas hyperendemic for
leprosy. J Immunol 188: 4782-4791.
Geluk A 2013. Challenges in immunodiagnostic tests for leprosy. Expert Opin Med
Diagn 7: 265-274.
135
Gibbs L, Carollo MG, Damazo AS, Oliani SM, Perretti M 2002. Time-dependent
expression of annexin 1 in a model of chronic granulomatous
inflammation.Inflamm Res 51: 300-306.
Goulart IM, Bernardes Souza DO, Marques CR, Pimenta VL, Goncalves MA, Goulart
LR 2008. Risk and protective factors for leprosy development determined by
epidemiological surveillance of household contacts.Clin Vaccine Immunol 15: 101105.
Goulart IM, GoulartLR2008. Leprosy: diagnostic and control challenges for a
worldwide disease. Arch. Dermatol. Res. 300: 269-290.
Grossi MAF 2013. Episódios reacionais. In Lyon S, Grossi MAF, Hanseníase. Rio de
Janeiro, p. 191-196.
Guerra JG, Castro LCM, Stefani MM, Martelli CM, Penna GO 2002. Erythema
Nodosum Leprosum: clinical and therapeutic up-date. An. bras Dermatol 77:
389-407.
Guinto RS, Abalos RM, Cellona RV, Fajardo TT 1986. An Atlas of Leprosy. Sasakawa
Memorial Health Foundation, i, 57 pp.
Han XY, Seo YH, Sizer KC, Schoberle T, May GS, Spencer JS, Li W, Nair RG 2008. A
new Mycobacterium species causing diffuse lepromatous leprosy. Am J Clin Pathol
130: 856-864.
Hart BE, Tapping RI 2012. Genetic Diversity of Toll-Like Receptors and Immunity to
M. leprae Infection. J Trop Med 2012: 415057.
Hori S, Sakaguchi S 2004. Foxp3: a critical regulator of the development and function
of regulatory T cells. Microbes Infect 6: 745-51.
Hunger R, Sieling P, Ochoa M, ugaya M, Burdick A, Rea T, Brennan P, Belisle J,
Blauvelt A, Porcelli S, Modlin R 2004. Langerhans cells utilize CD1a and langerin
to efficiently present nonpeptide antigens to T cells. The Journal of Clinical
Investigation 113: 701-708.
Hunter SW, Brennan PJ 1981. A novel phenolic glycolipid from Mycobacterium leprae
possibly involved in immunogenicity and pathogenicity. J Bacteriol 147: 728-35.
Jacobson RR, Krahenbuhl JL 1999. Leprosy.Lancet 353: 655-660.
Jadhav R, Suneetha L, Kamble R, Shinde V, Devi K, Chaduvula MV, Raju R, Suneetha
S, Nicholls PG, van Brakel WH, Lockwood DN 2011. Analysis of antibody and
cytokine markers for leprosy nerve damage and reactions in the INFIR cohort in
India. PLoS Negl Trop Dis 5: e977.
Jayalakshmi P 1995. Mast cells in lepromatous leprosy.Int J Lepr Other Mycobact Dis
63: 291-293.
Jimenez-Heffernan JA, Bajo MA, Perna C, del Peso G, Larrubia JR, Gamallo C,
Sanchez-Tomero JA, Lopez-Cabrera M, Selgas R 2006. Mast cell quantification in
136
normal peritoneum and during peritoneal dialysis treatment.Arch Pathol Lab Med
130: 1188-1192.
Job CK, Kahkonen ME, Jacobson RR, Hastings RC1989. Single lesion subpolar
lepromatous leprosy and its possible mode of origin. Int. J. Lepr., 57(1): 12-19.
Job CK 1994. Pathology of leprosy. In: Hastings RC, editor. Leprosy. 2nd ed.
Edinburgh: Churchill Livingstone; p. 193-234.
Job CK, Chandi SM 2001. Diferencial Diagnosis of Leprosy. A guide book for
histopathologists. First edition, Tamil Nadu, Índia, 126 pp.
Jopling WH 1965. Pure neural tuberculoid leprosy. Brit. Med. J., 2: 799-800.
Jopling WH 1978. Handbook of Leprosy.William Heinemann Medical Books Ltd., 2nd
ed., London – UK, 154 pp.
Joosten SA, van Meijgaarden KE, Savage ND, de Boer T, Triebel F, van der Wal A, de
Heer E, Klein MR, Geluk A, Ottenhoff TH 2007. Identification of a human CD8+
regulatory T cell subset that mediates suppression through the chemokine CC
chemokine ligand 4.Proc Natl Acad Sci U S A 104: 8029-34.
Joosten SA, Ottenhoff TH 2008. Human CD4 and CD8 regulatory T cells in infectious
diseases and vaccination.Hum Immunol 69: 760-70.
Kang T, Lee G, Kim S, Jin S, Chae G 2010. [Acesso em: 17 de janeiro de 2014].
Comparison of Two Mice Strains, A/J and C57BL/6, in Caspase-1 Activity and IL1βSecretion of Macrophage to Mycobacterium leprae Infection.Disponível em:
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2910506/.
Kim J, Uyemura K, Van Dyke M, Legaspi A, Rea T, Shuai K, Modlin R 2001. A Role
for IL-12 Receptor Expression and Signal Transduction in Host Defense in
Leprosy.J Immunol 167: 779-786.
Kitagawa Y, Ohkura N, Sakaguchi S 2013. Molecular determinants of regulatory T cell
development: the essential roles of epigenetic changes. Front Immunol 4: 106.
Krutzik SR, Tan B, Li H, Ochoa MT, Liu PT, Sharfstein SE, Graeber TG, Sieling PA,
Liu YJ, Rea TH, Bloom BR, Modlin RL 2005. TLR activation triggers the rapid
differentiation of monocytes into macrophages and dendritic cells. Nat Med 11:
653-660.
Kumar G, Kiernan J. Eds. Education Guide Special Stains and H & E: Dako, Second ed.
2010.
Kumar R, Vaidya MC 1982. Mast cell and Mycobacterium leprae in experimental
leprosy.Hansenol Int 7: 1-7.
Lahiri R, Randhawa B, Krahenbuhl J 2010. Infection of mouse macrophages with viable
Mycobacterium leprae does not induce apoptosis. J Infect Dis 201: 1736-1742.
Leavy O 2006. [Acesso em: 16 de janeiro de 2014]. Mast cells and TReg cells join
forces. Disponível em: http://www.readcube.com/articles/10.1038/nri1942.
137
Leiker DL, McDougall. Guia Técnico Baciloscopia da Hanseníase. 2ª. Edição.
TALMILEP, Wurzburg. 1987. pp. 33.
Libraty DH, Airan LE, Uyemura K, Jullien D, Spellberg B, Rea TH, Modlin RL 1997.
Interferon-gamma differentially regulates interleukin-12 and interleukin-10
production in leprosy. J Clin Invest 99: 336-341.
Lockwood DNJ, Vinayakumar S, Stanley JNA et al, 1993. The clinical features and
outcome of reversal (type 1) reactions in Hyderabad, India. Int J Lepr 61:8-15.
Lockwood DN, Sinha HH 1999. Pregnancy and leprosy: a comprehensive literature
review. Int J Lepr Other Mycobact Dis 67:6-12.
Lockwood DN 2001. Leprosy.Search date November. Infectuous Disease. 709-720.
Lockwood DN 2002. Leprosy elimination-a virtual phenomenon or a reality? BMJ 324:
1516-1518.
Lombardi C 1989. Evaluation of leprosy epidemiology in 12 countries of the Americas,
1980-1983.Bull Pan Am Health Organ 23: 284-94.
Lombardi C, Pedrazzani ES, Pedrazzani J C, Ferreira F P, Zicker F 1995. The protective
efficacy of BCG against leprosy in Sao Paulo, Brazil. Bol. Oficina Sanit.
Panam.119: 415-421.
Lu LF, Lind EF, Gondek DC, Bennett KA, Gleeson MW, Pino-Lagos K, Scott ZA,
Coyle AJ, Reed JL, Van Snick J, Strom TB, Zheng XX, Noelle RJ 2006. Mast cells
are essential intermediaries in regulatory T-cell tolerance. Nature 442: 997-1002.
Lyon DT, Lyon-Freire F 2013. Manifestações oftalmológicas na Hanseníase. In Lyon S,
Grossi MAF, Hanseníase, Medbook, Rio de Janeiro, p. 183-189.
Lyon M 2013. Manifestações bucais na hanseníase. In Lyon S, Grossi MAF,
Hanseníase. Rio de Janeiro, p. 167-177.
LyonS 2013. Manifestações cutâneas na hanseníase. In Lyon S, Grossi MAF,
Hanseníase. Rio de Janeiro, p. 139-141.
Lyon S, Castorina da Silva R, Lyon AC, Grossi MA, Lyon SH, Azevedo Mde L,
Bührer-Sékula S, Rocha MO 2008. Association of the ML Flow serologic test to
slit skin smear. Rev Soc Bras Med Trop 41 Suppl 2: 23-6.
Lyon S, Lyon AT 2013. História da Hanseníase. In Lyon S, Grossi MAF, Hanseníase,
Medbook, Rio de Janeiro, p. 13-16.
Lyon S, Oliveira JA 2013. Manifestações otorrinolaringológicas na Hanseníase. In Lyon
S, Grossi MAF, Hanseníase. Rio de Janeiro, p. 179-182.
Lyon-Moura AC, Pedrosa MS 2013. Histopatologia da Hanseníase. In Lyon S, Grossi
MAF, Hanseníase, Medbook, Rio de Janeiro, p. 95-103.
138
Magalhaes GO, Valentim VC, Pereira MJ, Nery JA, Illarramendi X, Antunes SL 2008.
A quantitative and morphometric study of tryptase-positive mast cells in cutaneous
leprosy lesions. Acta Trop 105: 62-66.
Magnago AGP 2013. Manifestações sistêmicas da Hanseníase. In Lyon S, Grossi MAF,
Hanseníase, Medbook, Rio de Janeiro, p. 159-165.
Maluf L, Barros J, Machado Filho C 2009. Mastocitose. An. Bras. Dermatol. 84: 213223.
Manandhar R, Shrestha N, Butlin CR, Roche PW 2002. High levels of inflammatory
cytokines are associated with poor clinical response to steroid treatment and
recurrent episodes of type 1 reactions in leprosy. Clin Exp Immunol 128: 333-8.
Manifold R, Marshman G 2009. Leprosy: not always an easy diagnosis and often a
management challenge. Australas J Dermatol 50: 36-40.
Martiniuk F, Giovinazzo J, Tan A, Shahidullah R, Haslett P, Kaplan G, Levis W 2012.
Lessons of leprosy: The emergence of TH17 cytokines during type II reactions
(ENL) is teaching us about T-cell plasticity. J Drugs Dermatol. 11: 626-630.
Massone C, Nunzi E, Ribeiro-Rodrigues R, Talhari C, Talhari S, Schettini AP, Parente
JN, Brunasso AM, Puntoni M, Clapasson A, Noto S, Cerroni L 2010. T regulatory
cells and plasmocytoid dentritic cells in hansen disease: a new insight into
pathogenesis? Am J Dermatopathol 32: 251-6.
Metcalfe DD 2008. Mast cells and mastocytosis.Blood 112: 946-956.
Metcalfe DD, Baram D, Mekori YA 1997. Mast cells.Physiol Rev 77: 1033-1079.
Metcalfe DD, Boyce JA 2006. Mast cell biology in evolution.J Allergy Clin Immunol
117: 1227-1229.
Michalany J, Michalany NS 1988. Patologia da hanseníase com especial referência à
contribuição dos pioneiros hansenologistas de São Paulo. Gráfica Platina Ltda, São
Paulo, 37 pp.
Mira MT 2006.Genetic host resistance and susceptibility to leprosy.Microbes
Infect8:1124-31.
Mira MT, Alcais A, Van Thuc N Thai VH, Huong NT, Ba NN et al. 2003. Chromosome
6q25 is linked to susceptibility to leprosy in a Vietnamese population. Nat Genet
33:412-415.
Mira MT, Alcais A, Nguyen VT, Moraes MO, Di Flumeri C, Vu HT, Mai CP, Nguyen
TH, Nguyen NB, Pham XK, Sarno EN, Alter A, Montpetit A, Moraes ME, Moraes
JR, Dore C, Gallant CJ, Lepage P, Verner A, Van De Vosse E, Hudson TJ, Abel L,
Schurr E 2004. Susceptibility to leprosy is associated with PARK2 and PACRG.
Nature 427: 636-640.
Misch EA, Macdonald M, Ranjit C, Sapkota BR, Wells RD, Siddiqui MR, Kaplan G,
Hawn TR 2008. Human TLR1 deficiency is associated with impaired
139
mycobacterial signaling and protection from leprosy reversal reaction. PLoS
Negl Trop Dis 2: e231.
Misra N, Murtaza A, Walker B, Narayan N, Misra R, Ramesh V, Singh S, Colston M,
Nath I 1995. Cytokine profile of circulating T cells of leprosy patients reflects both
indiscriminate and polarized T-helper subsets: T-helper phenotype is stable and
uninfluenced by related antigens of Mycobacterium leprae. Immunology 86: 97103.
Modlin RL 1994. Th1-Th2 Pardigm: Insights from Leprosy. The Society for
Investigative Dermatology, Inc. 102: 828-832.
Modlin RL 2010. The innate immune response in leprosy.Curr Opin Immunol 22: 4854.
Modlin RL, Hofman FM, Taylor CR, Rea TH 1983.T lymphocyte subsets in the skin
lesions of patients with leprosy.J Am Acad Dermatol 8: 182-189.
Modlin RL, Mehra V, Wong L, Fujimiya Y, Chang WC, Horwitz DA, Bloom BR, Rea
TH, Pattengale PK 1986. Suppressor T lymphocytes from lepromatous leprosy skin
lesions. J Immunol 137: 2831-2834.
Modlin RL, Rea TH 1987. Leprosy: new insight into an ancient disease. J Am Acad
Dermatol 17: 1-13.
Monot M, Honore N, Garnier T, Araoz R, Coppee JY, Lacroix C, Sow S, Spencer JS,
Truman RW, Williams DL, Gelber R, Virmond M, Flageul B, Cho SN, Ji B, PanizMondolfi A, Convit J, Young S, Fine PE, Rasolofo V, Brennan PJ, Cole ST 2005.
On the origin of leprosy.Science 308: 1040-1042.
Monot M, Honore N, Garnier T, Zidane N, Sherafi D, Paniz-Mondolfi A, Matsuoka M,
Taylor GM, Donoghue HD, Bouwman A, Mays S, Watson C, Lockwood D,
Khamesipour A, Dowlati Y, Jianping S, Rea TH, Vera-Cabrera L, Stefani MM,
Banu S, Macdonald M, Sapkota BR, Spencer JS, Thomas J, Harshman K, Singh P,
Busso P, Gattiker A, Rougemont J, Brennan PJ, Cole ST 2009. Comparative
genomic and phylogeographic analysis of Mycobacterium leprae.Nat Genet 41:
1282-1289.
Montagna NA, de Oliveira ML, Mandarim-de-Lacerda CA, Chimelli L 2005. Leprosy:
contribution of mast cells to epineurial collagenization. Clin Neuropathol 24: 28490.
Montoya D, Cruz D, Teles RM, Lee DJ, Ochoa MT, Krutzik SR, Chun R, Schenk M,
Zhang X, Ferguson BG, Burdick AE, Sarno EN, Rea TH, Hewison M, Adams JS,
Cheng G, Modlin RL 2009. Divergence of macrophage phagocytic and
antimicrobial programs in leprosy.Cell Host Microbe 6: 343-53.
Montoya D, Modlin RL. Learning from leprosy: insight into the human innate immune
response. Adv Immunol, Vol. 105, 2010. pp. 1-24.
Moonot P, Ashwood N, Lockwood D 2005. Orthopaedic complications of leprosy. The
Journal of Bone and Joint Surgery, 87: 1328-1332.
140
Moraes MO, Cardoso CC, Vanderborght PR, Pacheco AG 2006. Genetics of host
response in leprosy.Lepr Rev 77: 189-202.
Moraes MO, Sampaio EP, Nery JA, Saraiva BC, Alvarenga FB, Sarno EN 2001.
Sequential erythema nodosum leprosum and reversal reaction with similar lesional
cytokine mRNA patterns in a borderline leprosy patient. Br J Dermatol 144: 175181.
Moraes MO, Sarno EN, Almeida AS, Saraiva BC, Nery JA, Martins RC, Sampaio EP
1999. Cytokine mRNA expression in leprosy: a possible role for interferon-gamma
and interleukin-12 in reactions (RR and ENL). Scand J Immunol 50: 541-549.
Moubasher AD, Kamel NA, Zedan H, Raheem DD 1998. Cytokines in leprosy, I.
Serum cytokine profile in leprosy. Int J Dermatol 37: 733-740.
Mysorekar VV, Dandekar CP, Rao SG 2001. Mast cells in leprosy skin lesions. Lepr
Rev 72: 29-34.
Naafs, B 1992. Reactions in leprosy: immunopatology. The proceedings of the 18th
World Congress of Dermatology, 890-892.
Naafs B 2006. Treatment of leprosy: science or politics? Trop Med Int Health 11: 26878.
Naik R, Pai MR, Bantwal PB, Shankarnarayana, Nayak KS, Gandhi A 2003. Study of
mast cells in non-neoplastic skin lesions.Indian J Pathol Microbiol 46: 173-175.
Nery JAC, Sales AM, Illarramendi X, Duppre NC, Jardim MR, Machado AM 2006.
Contribution to diagnosis and management of reactionalstates: a practical approach.
An Bras Dermatol. 81: 367-375.
Nery JAC, Vieira LM, de Matos HJ, Gallo ME, Sarno EM 1998. Reactional states in
multibacillary Hansen disease patients during multidrug therapy. Rev Inst Med
Trop. 40:363-370.
Neves R, Talhari S, Oliveira SG 1997. Manifestações nervosas e diagnóstico. In Talhari
S, Neves RG, Hanseníase. 3ª edição, Manaus, 1997. 41-61.
Neves R, Talhari S 1997. Manifestações cutâneas e diagnóstico diferencial. In Talhari S,
Neves RG, Hanseníase. 3ª edição, Manaus, 1997.p. 5-40.
Nouri-Aria KT. Foxp3 expressing regulatory T-cells in allergic disease.Adv Exp Med
Biol, Vol. 665, 2009. pp. 180-194.
Ochoa M, Teles R, Haas B, Zaghi D, Li H, Sarno E, Rea T, Modlin R, Lee D 2010. A
role for interleukin-5 in promoting increased immunoglobulin M at the site of
disease in leprosy. Immunology 131: 405-414.
Ochs HD, Oukka M, Torgerson TR 2009. TH17 cells and regulatory T cells in primary
immunodeficiency diseases.J Allergy Clin Immunol 123: 977-983.
O'Garra A, Vieira P 2003. Twenty-first century Foxp3.Nat Immunol 4: 304-6.
141
Oliani SM, Christian HC, Manston J, Flower RJ, Perretti M 2000. An
immunocytochemical and in situ hybridization analysis of annexin 1 expression
in rat mast cells: modulation by inflammation and dexamethasone. Lab Invest
80: 1429-38.
Oliani SM, Gil CD 2006. Proteína anti-inflamatória anexina 1: mecanismos celulares e
relevância clínica. Arq Ciênc Saúde 13: 186-191.
Oliveira RB, Ochoa MT, Sieling PA, Rea TH, Rambukkana A, Sarno EN, Modlin RL
2003. Expression of Toll-like receptor 2 on human Schwann cells: a mechanism
of nerve damage in leprosy. Infect Immun 71: 1427-1433.
Opromolla DVA, Ura S 2002. Atlas de Hanseníase. Instituto Lauro de Souza Lima,
Bauru, 79 pp.
Oskam L, Slim E, Bührer-Sékula S 2003. Serology: recent developments, strengths,
limitations and prospects: a state of the art overview. Lepr Rev 74: 196-205.
Otsuka A, Ozaki M, Horiguchi Y, Murata Y, Kumano K, Nogami R, Goto M, Walls
AF, Ishii N, Miyachi Y, Kabashima K 2012. Basophils Infiltrate the Skin Lesions
in Lepromatous Leprosy. Acta Derm Venereol 93: 88-89.
Palermo ML, Pagliari C, Trindade MA, Yamashitafuji TM, Duarte AJ, Cacere CR,
Benard G 2012. Increased expression of regulatory T cells and down-regulatory
molecules in lepromatous leprosy.Am J Trop Med Hyg 86: 878-83.
Pandiyan P, Zheng L, J. LM 2011. [Acesso em: 16-01-2014]. The Molecular
Mechanisms of Regulatory T Cell Immunosuppression Disponível em:
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3342245/.
Pardillo FE, Fajardo TT, Abalos RM, Scollard D, Gelber RH 2007. Methods for the
classification of leprosy for treatment purposes. Clin Infect Dis 44: 1096-9.
Payne V, Kam PC 2004. Mast cell tryptase: a review of its physiology and clinical
significance. Anaesthesia 59: 695-703.
Penna ML, Temporao JG, Grossi MA, Penna GO 2011. Leprosy control: knowledge
shall not be neglected. J Epidemiol Community Health 65: 473-474.
Pereira AC, Brito-de-Souza VN, Cardoso CC, Dias-Baptista IM, Parelli FP, Venturini J,
Villani-Moreno FR, Pacheco AG, Moraes MO 2009. Genetic, epidemiological and
biological analysis of interleukin-10 promoter single-nucleotide polymorphisms
suggests a definitive role for -819C/T in leprosy susceptibility. Genes Immun 10:
174-180.
Pilli GS, Davanageri R, Dhaded AV 2005.Distribution and density of mast cells in
tuberculoid leprosy.Indian J Lepr 77: 58-59.
Pocaterra L, Jain S, Reddy R, Muzaffarullah S, Torres O, Suneetha S, Lockwood DN
2006. Clinical course of erythema nodosum leprosum: an 11-year cohort study in
Hyderabad, India. Am J Trop Med Hyg 74: 868-879.
142
Ponninghaus JM, Fine PEM, Bliss L 1987. Certainty levels in the diagnosis of leprosy.
Int. J. Lepr. Other Mycobact. Dis., 55:454-462.
Prevedello FC, Mira MT 2007. Hanseníase: uma doença genética? An Bras Dermatol
82: 451-9.
Rambukkana A, Salzer JL, Yurchenco PD, Tuomanen EI 1997. Neural targeting of
Mycobacterium leprae mediated by the G domain of the laminin-alpha2 chain. Cell
88: 811-821.
Rambukkana A 2001. Molecular basis for the peripheral nerve predilection of
Mycobacterium leprae. Curr Opin Microbiol 4: 21-7.
Ranque B, Nguyen VT, Vu HT, Nguyen TH, Nguyen NB, Pham XK, Schurr E, Abel L,
Alcais A 2007. Age is an important risk factor for onset and sequelae of reversal
reactions in Vietnamese patients with leprosy. Clin Infect Dis 44: 33-40.
Rav SD, Pratap VK, Sharma NK, Dayal SS 1990.Mast cell in leprosy.Indian J Lepr 62:
467-472.
Richardus RA, Alam K, Pahan D, Feenstra SG, Geluk A, Richardus JH 2013. The
combined effect of chemoprophylaxis with single dose rifampicin and
immunoprophylaxis with BCG to prevent leprosy in contacts of newly diagnosed
leprosy cases: a cluster randomized controlled trial (MALTALEP study). BMC
Infect Dis 13: 456.
Ridley DS 1955.The bacteriological interpretation of skin smears and biopsies in
leprosy.Trans. R. Soc. Trop. Med. Hyg. 49, 449-452.
Ridley DS 1974. Histological classification and the immunological spectrum of leprosy.
Bull. World Health Organ 51: 451-465.
Ridley DS 1977. La biopsia de piel en la lepra. 2.ed. Ciba-Geigy; 987, 63 pp.
Ridley DS, Jopling WH 1966.Classification of leprosy according to immunity.A fivegroup system.Int J Lepr Other Mycobact Dis 34: 255-273.
Rodrigues Júnior IA, Gresta LT 2013. Testes de sensibilidade cutânea. In Lyon S,
Grossi MAF, Hanseníase. Rio de Janeiro, p. 83-93.
Rodrigues LC, Lockwood D 2011. Leprosy now: epidemiology, progress, challenges,
and research gaps. Lancet Infect Dis 11: 464-70.
Rodrigues ML, Silva SA, Neto JC, de Andrade AL, Martelli CM, Zicker F 1992.
Protective effect of intradermal BCG against leprosy; a case-control study in central
Brazil. Int J Lepr Other Mycobact Dis 60: 335-339.
Sakaguchi S 2005. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells
in immunological tolerance to self and non-self. Nat Immunol 6: 345-352.
Sakaguchi S, Miyara M, Costantino CM, Hafler DA 2010. FOXP3+ regulatory T cells
in the human immune system.Nat Rev Immunol 10: 490-500.
143
Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M 1995. Immunologic selftolerance maintained by activated T cells expressing IL-2 receptor alpha-chains
(CD25). Breakdown of a single mechanism of self-tolerance causes various
autoimmune diseases. J Immunol. 155: 1151-1164.
Sakaguchi S, Yamaguchi T, Nomura T, Ono M 2008. Regulatory T cells and immune
tolerance.Cell 133: 775-787.
Sampaio LH, Sousa AL, Barcelos MC, Reed SG, Stefani MM, Duthie MS 2012.
Evaluation of various cytokines elicited during antigen-specific recall as potential
risk indicators for the differential development of leprosy. Eur J Clin Microbiol
Infect Dis 31: 1443-51.
Sampaio LH, Stefani MM, Oliveira RM, Sousa AL, Ireton GC, Reed SG, Duthie MS
2011. Immunologically reactive M. leprae antigens with relevance to diagnosis and
vaccine development. BMC Infect Dis 11: 26.
Sampaio SAP, Rivitti EA 2011. Dermatologia. Artes Médicas, 3ª edição, São Paulo,
xiv, 1585 pp.
Santos AR, de Miranda AB, Sarno EN, Suffys PN, Degrave WM 1993. Use of PCRmediated amplification of Mycobacterium leprae DNA in different types of clinical
samples for the diagnosis of leprosy. J Med Microbiol 39: 298-304.
Santos AR, Suffys PN, Vanderborght PR, Moraes MO, Vieira LM, Cabello PH, Bakker
AM, Matos HJ, Huizinga TW, Ottenhoff TH, Sampaio EP, Sarno EN 2002. Role of
tumor necrosis factor-alpha and interleukin-10 promoter gene polymorphisms in
leprosy. J Infect Dis 186: 1687-1691.
Sapkota BR, Macdonald M, Berrington WR, Misch EA, Ranjit C, Sidenius N, Kaplan
G, Hawn TR 2010. Association of TNF, MBL, and VDR Polymorphisms with
Leprosy Phenotypes.Hum Immunol 71: 992-998.
Sarno EN, Grau GE, Vieira LM, Nery JA 1991. Serum levels of tumour necrosis factoralpha and interleukin-1 beta during leprosy reactional states. Clin Exp Immunol 84:
103-108.
Sarno EN, Santos AR, Jardim MR, Suffys PN, Almeida AS, Nery JA, Vieira LM,
Sampaio EP 2000. Pathogenesis of nerve damage in leprosy: genetic polymorphism
regulates the production of TNF alpha. Lepr Rev 71 Suppl: S154-158; discussion
S158-160.
Sarubi JC, Shibuya MD LT 2013. Neuropatia na hanseníase. In Lyon S, Grossi MAF,
Hanseníase. Rio de Janeiro, p. 143-158.
Schurr E, Morgan K, Gros P, Skamene E 1991. Genetics of leprosy.Am J Trop Med Hyg
44: 4-11.
Schwartz RH 2005. Natural regulatory T cells and self-tolerance.Nat Immunol 6: 327330.
Scollard DM 2004. Classification of leprosy: a full color spectrum, or black and white?
Int J Lepr Other Mycobact Dis 72: 166-168.
144
Scollard DM, Gillis TP, Williams DL 1998. Polymerase chain reaction assay for the
detection and identification of Mycobacterium leprae in patients in the United
States. Am J Clin Pathol 109: 642-646.
Scollard DM, Smith T, Bhoopat L, Theetranont C, Rangdaeng S, Morens DM 1994
Epidemiologic characteristics of leprosy reactions. Int J Lepr 62: 559-567.
Scollard DM, Adams LB, Gillis TP, Krahenbuhl JL, Truman RW, Williams DL 2006.
The continuing challenges of leprosy. Clin Microbiol Rev 19: 338-381.
Scollard DM 2008.The biology of nerve injury in leprosy.Lepr Rev 79: 242-53.
Schuenemann VJ, Singh P, Mendum TA, Krause-Kyora B, Jager G, Bos KI, Herbig A,
Economou C, Benjak A, Busso P, Nebel A, Boldsen JL, Kjellstrom A, Wu H,
Stewart GR, Taylor GM, Bauer P, Lee OY, Wu HH, Minnikin DE, Besra GS,
Tucker K, Roffey S, Sow SO, Cole ST, Nieselt K, Krause J 2013. Genome-Wide
Comparison of Medieval and Modern Mycobacterium leprae.Science
Setia MS, Steinmaus C, Ho CS, Rutherford GW 2006. The role of BCG in prevention of
leprosy: a meta-analysis. Lancet Infect Dis 6: 162-70.
Shevach EM 2009.Mechanisms of
suppression.Immunity 30: 636-645.
foxp3+
T
regulatory
cell-mediated
Shevach E, Davidson T 2010. [Acesso em: 17 de janeiro de 2014]. Regulatory T cells.
Disponível em: http://www.nature.com/nri/posters/tregcells/index.html.
Siddiqui M, Meisner S, Tosh K, Balakrishman K, Ghei S, Fischer S, Golding M,
Narayan N, Sitaraman T, Sengupta U, Pitchappan R, Hill A 2001. A major
susceptibility locus for leprosy in India maps to chromosome 10p13. Nature
Genetics 27: 439-441.
Silva PS, Girol AP, Oliani SM 2011. Mast cells modulate the inflammatory process in
endotoxin-induced uveitis. Mol Vis 17: 1310-9.
Silver R, Curley JP 2013. Mast cells on the mind: new insights and opportunities.
Trends Neurosci 36: 513-521.
SINAN/SVS/MS 2012. [acessado em 22 de agosto de 2013]. Disponível em:
http://portal.saude.gov.br/portal/saude/profissional/visualizar_texto.cfm?idtxt=3120
0.
SINAN/SVS/MS 2013. [acessado em 22 de agosto de 2013]. Disponível
em:http://dtr2004.saude.gov.br/sinanweb/tabnet/tabnet?sinannet/hanseniase/bases/
Hansbrnet.def
Single-lesion Multicentric Trial Group 1997. Efficacy of single dose multidrug therapy
for the treatment of single lesion paucibacillary leprosy. Indian J. Lepr: 69:121129.
Sousa AL, Fava VN, Sampaio LH, Martelli CMT, Costa MB, Mira MT e Stefani MMA
2012.Genetic and immunological evidence implicates interleukin 6 as a
susceptibility gene for leprosy type 2 reaction. J Infect Dis 205: 1417-1424.
145
Sousa AL, Stefani MM, Pereira GA, Costa MB, Rebello PF, Gomes MK, Narahashi K,
Gillis TP, Krahenbuhl JL, Martelli CM 2007. Mycobacterium leprae DNA
associated with type 1 reactions in single lesion paucibacillary leprosy treated with
single dose rifampin, ofloxacin, and minocycline. Am J Trop Med Hyg 77: 829-833.
Souza RT, Talhari S 1997. Manifestações otorrinolaringológicas. In Talhari S, Neves
RG.Hanseníase.3ª edição, Manaus, 1997. p. 63-65.
Spencer JS, Dockrell HM, Kim HJ, Marques MA, Williams DL, Martins MV, Martins
ML, Lima MC, Sarno EN, Pereira GM, Matos H, Fonseca LS, Sampaio EP,
Ottenhoff TH, Geluk A, Cho SN, Stoker NG, Cole ST, Brennan PJ, Pessolani MC
2005. Identification of specific proteins and peptides in Mycobacterium leprae
suitable for the selective diagnosis of leprosy. J Immunol 175: 7930-7938.
Sreenivasan P, Misra RS, Wilfred D, Nath I 1998. Lepromatous leprosy patients show T
helper 1-like cytokine profile with differential expression of interleukin-10 during
type 1 and 2 reactions. Immunology 95: 529-36.
Sridharan G, Shankar AA 2012. Toluidine blue: A review of its chemistry and clinical
utility. J Oral Maxillofac Pathol 16: 251-255.
Stefani MM, Martelli CM, Gillis TP, Krahenbuhl JL 2003. In situ type 1 cytokine gene
expression and mechanisms associated with early leprosy progression. J Infect Dis
188: 1024-1031.
Stefani MM 2008. Challenges in the post genomic era for the development of tests for
leprosy diagnosis.Rev Soc Bras Med Trop 41 Suppl 2: 89-94.
Stefani MM, Martelli CM, Morais-Neto OL, Martelli P, Costa MB, de Andrade AL
1998. Assessment of anti-PGL-I as a prognostic marker of leprosy reaction. Int J
Lepr Other Mycobact Dis 66: 356-64.
Stefani MM, Grassi AB, Sampaio LH, Sousa AL, Costa MB, Scheelbeek P, Neupane
KD, Hagge DA, Macdonald M, Cho SN, Oskam L, Buhrer-Sekula S 2012.
Comparison of two rapid tests for anti-phenolic glycolipid-I serology in Brazil and
Nepal. Mem Inst Oswaldo Cruz 107 Suppl 1: 124-131.
Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, Belkaid Y 2007. Small
intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg
cells via retinoic acid. J Exp Med 204: 1775-1785.
Suzuki K, Takeshita F, Nakata n, N I, Makino M 2006. Localization of CORO1A in the
Macrophages Containing Mycobacterium leprae.Acta Histochem. Cytochem. 39:
107-112.
Talhari S, Neves RG 1997. Dermatologia Tropical - Hanseníase. 3ª edição, Manaus, 167
pp.
Tanigawa K, Suzuki K, Kimura H, Takeshita F, Wu H, Akama T, Kawashima A, Ishii
N 2009. Tryptophan aspartate-containing coat protein (CORO1A) suppresses Toll-
146
like receptor signalling in Mycobacterium leprae infection. Clinical and
Experimental Immunology 156: 491-501.
Taylor GM, Widdison S, Brown IN, Young D 2000.A Mediaeval Case of Lepromatous
Leprosy from 13–14th Century Orkney, Scotland.Journal of Archaeological
Science 27: 1133-1138.
Teixeira AC, Cruvinel DL, Roma FR, Luppino LF, Resende LH, Sousa T, BührerSékula S, Goulart IM 2008. Evaluation of the agreement between clinical and
laboratorial exams in the diagnosis of leprosy. Rev Soc Bras Med Trop 41 Suppl 2:
48-55.
Teles RM, Graeber TG, Krutzik SR, Montoya D, Schenk M, Lee DJ, Komisopoulou E,
Kelly-Scumpia K, Chun R, Iyer SS, Sarno EN, Rea TH, Hewison M, Adams JS,
Popper SJ, Relman DA, Stenger S, Bloom BR, Cheng G, Modlin RL 2013. Type I
interferon suppresses type II interferon-triggered human anti-mycobacterial
responses. Science 339: 1448-1453.
Teles RM, Krutzik SR, Ochoa MT, Oliveira RB, Sarno EN, Modlin RL 2010.
Interleukin-4 Regulates the Expression of CD209 and Subsequent Uptake of
Mycobacterium leprae by Schwann Cells in Human Leprosy. Infection and
Immunity 78: 4634-4643.
Teles RM, Moraes MO, Geraldo NT, Salles AM, Sarno EM, Sampaio EP 2002.
Differential TNFalpha mRNA regulation detected in the epidermis of leprosy
patients. Arch Dermatol Res 294:355-362.
Thompson C, Powrie F 2004. Regulatory T cells.Curr Opin Pharmacol 4: 408-414.
Tran DQ, Ramsey H, Shevach EM 2007. Induction of FOXP3 expression in naive
human CD4+FOXP3 T cells by T-cell receptor stimulation is transforming growth
factor-beta dependent but does not confer a regulatory phenotype. Blood 110: 29832990.
Truman, R. W., Andrews, P. K., Robbins, N. Y., Adams, L. B., Krahenbuhl, J. L., and
Gillis, T. P. (2008). Enumeration of Mycobacterium leprae Using Real-Time PCR.
PLoS. Negl. Trop. Dis.2(11), e328.
Truman RW, Singh P, Sharma R, Busso P, Rougemont J, Paniz-Mondolfi A,
Kapopoulou A, Brisse S, Scollard DM, Gillis TP, Cole ST 2011. Probable zoonotic
leprosy in the southern United States.N Engl J Med 364: 1626-1633.
Turkel SB, Van Hale HM, Rea TH 1982. Ultrastructure of the dermal microvasculature
in leprosy.Int J Lepr Other Mycobact Dis 50: 164-171.
Van Hale HM, Turkel SB, Rea TH 1984. Dermal ultrastructure in leprosy.Arch Pathol
Lab Med 108: 383-386.
Visentainer JE, Tsuneto LT, Serra MF, Peixoto PR, Petzl-Erler ML 1997. Association
of leprosy with HLA-DR2 in a Southern Brazilian population. Braz J Med Biol Res
30: 51-59.
147
van Brakel WH, Khawas IB, Lucas SB 1994. Reactions in leprosy: an epidemiological
study of 386 patients in west Nepal. Lepr Rev 65:190-203.
van Brakel WH, Nicholls PG, Das L, Barkataki P, Suneetha SK, Jadhav RS, et al 2005.
The INFIR Cohort Study: investigating prediction, detection and pathogenesis of
neuropathy and reactions in leprosy. Methods and baseline results of a cohort of
multibacillary leprosy patients in north India. Lepr Rev 76:14-34.
van Brakel WH, Nicholls PG, Wilder-Smith EP, Das L, Barkataki P, Lockwood DN
2008. Early diagnosis of neuropathy in leprosy--comparing diagnostic tests in a
large prospective study (the INFIR cohort study). PLoS Negl Trop Dis 2: e212.
Vissa VD, Brennan PJ 2001. The genome of Mycobacterium leprae: a minimal
mycobacterial gene set. Genome Biol 2: REVIEWS1023.
Walker SL, Lockwood DN 2006. The clinical and immunological features of leprosy.
Br Med Bull 77-78: 103-121.
Walker SL, Lockwood DN 2007. Leprosy. Clin Dermatol 25: 165-172.
Walker SL, Nicholls PG, Butlin CR, Nery JA, Roy HK, Rangel E, Sales AM,
Lockwood DN 2008. Development and validation of a severity scale for leprosy
type 1 reactions. PLoS Negl Trop Dis 2: e351.
Warren G 1971. Tarsal bone disintegration in leprosy.J Bone Joint Surg Br 53: 688-95.
WHO - World Health Organization 1988 (a).A guide to leprosy control, 2nded.,
Geneva, viii + 121 pp.
WHO - World Health Organization 1988 (b).Expert Committee on Leprosy.Sixth
Report.WHO Technical Report Seriesno.768: 1-50.
WHO - World Health Assembly (WHA) resolutin to eliminate leprosy. 1991. [acesso
em 09 de fevereiro de 2013], http://www.who.int/lep/strategy/wha/en/index.html.
WHO - World Health Organization 1994.WHO Study Group on Chemoterapy of
leprosy.Technical Report Series; 847.Geneva, 32 pp.
WHO - World Health Organization 1998. WHO Expert Committee on Leprosy: seventh
report, Geneva, 52 pp.
WHO - World Health Organization 2004.Multidrug therapy against
leprosy.Development and implementationover the past 25 years.Geneva, 190 pp.
WHO - World Health Organization 2012 (a).Global leprosy situation, 2012.Wkly
Epidemiol Recno. 34, 87: 317-328.
WHO - World Health Organization 2012 (b).The 17 neglected tropical diseases. [acesso
em
01
de
agosto
de
2013].
Disponível
em:http://www.who.int/neglected_diseases/diseases/en/
WHO - World Health Organization 2012 (c). WHO Expert Committee on Leprosy:
eighth report, Geneva, 61 pp.
148
WHO - World Health Organization 2013.Global leprosy: update on the 2012
situation.Wkly Epidemiol Recno. 35, 88: 365-380.
Williams D, Gillis T, Booth R, Looker D, Watson J, 1990. The use of a specific DNA
probe and polymerase chain reaction for the detection of Mycobacterium leprae. J
Inf Dis 162: 193-200.
Wohlfert E, Belkaid Y 2010. [Acesso em: 16 de janeiro de 2014]. Plasticity of Treg at
infected
sites.
Disponível
em:
http://www.nature.com/mi/journal/v3/n3/full/mi201011a.html.
Woods WJ 1997. Manifestações oftalmológicas. In Talhari S, Neves RG. Hanseníase. 3ª
edição, Manaus, 1997.p. 67-75.
Yamamura M, Uyemura K, Deans RJ, Weinberg K, Rea TH, Bloom BR, Modlin RL
1991. Defining protective responses to pathogens: cytokine profiles in leprosy
lesions. Science 254: 277-279.
Zhang FR, Huang W, Chen SM, Sun LD, Liu H, Li Y, Cui Y, Yan XX, Yang HT, Yang
RD, Chu TS, Zhang C, Zhang L, Han JW, Yu GQ, Quan C, Yu YX, Zhang Z, Shi
BQ, Zhang LH, Cheng H, Wang CY, Lin Y, Zheng HF, Fu XA, Zuo XB, Wang Q,
Long H, Sun YP, Cheng YL, Tian HQ, Zhou FS, Liu HX, Lu WS, He SM, Du WL,
Shen M, Jin QY, Wang Y, Low HQ, Erwin T, Yang NH, Li JY, Zhao X, Jiao YL,
Mao LG, Yin G, Jiang ZX, Wang XD, Yu JP, Hu ZH, Gong CH, Liu YQ, Liu RY,
Wang DM, Wei D, Liu JX, Cao WK, Cao HZ, Li YP, Yan WG, Wei SY, Wang KJ,
Hibberd ML, Yang S, Zhang XJ, Liu JJ 2009. Genomewide association study of
leprosy. N Engl J Med 361: 2609-2618.
149
8.ANEXOS
Anexo 1– Parecer do Comitê de Ética em Pesquisa Médica Humana e animal
Anexo 2 – Parecer da Comissão de Ética em Pesquisa - CONEP
Anexo 3 - Ficha de dados clínicos
Anexo 4 – Termo de consentimento livre e esclarecido
Anexo 5 – Comprovantes de submissão dos artigos/ aceite para publicação para
artigos ainda não publicados/ DOI dos artigos publicados
150
ANEXO 1 - Parecer do Comitê de Ética em Pesquisa Médica Humana e animal
151
ANEXO 2 - Parecer da Comissão de Ética em Pesquisa - CONEP
152
ANEXO 3 - Ficha de dados clínicos
153
ANEXO 4 - Termo de consentimento livre e esclarecido
154
155
ANEXO 5 - Comprovantes de submissão dos artigos/aceite para publicação para
artigos ainda não publicados/ DOI dos artigos publicados
Artigos em processos de submissão.
156