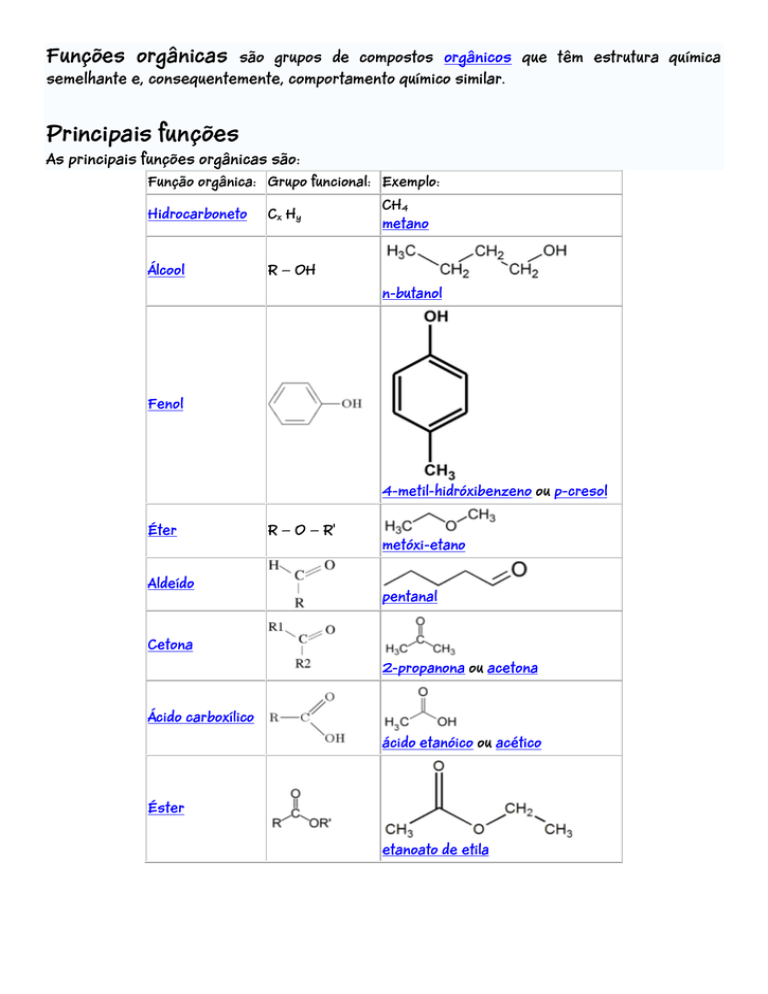
Funções orgânicas
são grupos de compostos orgânicos que têm estrutura química
semelhante e, consequentemente, comportamento químico similar.
Principais funções
As principais funções orgânicas são:
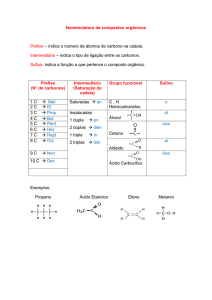
Função orgânica: Grupo funcional: Exemplo:
Hidrocarboneto
Cx Hy
Álcool
R — OH
CH4
metano
n-butanol
Fenol
4-metil-hidróxibenzeno ou p-cresol
Éter
Aldeído
R — O — R'
metóxi-etano
pentanal
Cetona
2-propanona ou acetona
Ácido carboxílico
ácido etanóico ou acético
Éster
etanoato de etila
Álcool
Os álcoois possuem o grupo funcional hidroxila (-OH) ligados a um ou mais carbonos saturados.
A denominação é realizada trocando-se o final o do nome do hidrocarboneto correspondente pelo sufixo ol. A posição do
grupo hidroxila (-OH) deve ser indicada pelo menor número possível.
Classificação dos alcoóis
Depende da posição da hidroxila
-Alcoóis primários – apresentam sua hidroxila ligada a carbono na extremidade da cadeia. Possuindo um grupo
característico – CH2OH.
-Alcoóis secundários – apresentam sua hidroxila unida a carbono secundário da cadeia. Possuindo o grupo característico –
CHOH.
- Alcoóis terciários – apresentam sua hidroxila ligada a carbono terciário. Possuindo o grupo – COH.
Os alcoóis são definidos como compostos orgânicos que apresentam o grupo funcional hidroxila (OH) preso a um ou mais
carbonos saturados. Eles podem se classificar de acordo com muitos critérios, é o que veremos agora:
Posição da hidroxila
Álcool primário: Quando a hidroxila estiver localizada na extremidade da cadeia, o álcool se classifica como sendo primário.
Exemplo:
CH3 ─ OH
Metanol
Repare que a OH se encontra no extremo da cadeia e se liga apenas a um átomo de carbono.
Álcool secundário: possui a hidroxila ligada a carbono secundário.
Exemplo:
Penten-3-ol-2
Dizemos que o carbono é secundário quando está entre dois átomos de carbono.
Álcool terciário: para receber esta classificação a hidroxila precisa estar ligada a carbono terciário.
Exemplo:
Metil-propanol-2
O carbono terciário se liga a outros três átomos de carbono.
Número de hidroxilas
Monoálcool: classificação dada a alcoóis que possuem apenas uma hidroxila ligada.
Exemplo:
Propanol – 1
Diálcool: álcool que possui duas hidroxilas ligadas à cadeia carbônica.
Exemplo:
Propanodiol – 1,2
Triálcool: este álcool conta com três hidroxilas em sua cadeia.
Exemplo:
Propanotriol
Tipo de cadeia
Álcool de cadeia aberta: a cadeia que forma este álcool é linear, ou seja, não forma ângulos.
Exemplo:
Propanol-2
Álcool de cadeia cíclica: a presença de uma figura geométrica caracteriza este tipo de álcool.
Exemplo:
Ciclopentanol
Neste caso, a figura pentágono forma a estrutura carbônica.
Álcool de cadeia aromática: O álcool aromático possui um anel benzeno em sua estrutura.
Exemplo:
Fenol
Veja mais!
Mentol – Conheça este álcool.
Aldeídos
Os aldeídos são compostos orgânicos que se apresentam pela presença do grupo funcional carbonila (–COH).
A denominação é constituída a partir do nome dos hidrocarbonetos, finalizando com a terminação al.
Exemplo:
Nomenclatura dos aldeídos ramificados
1º - Assinalar a cadeia principal com uma moldura
2º - Numerar a cadeia a partir do carbono do grupo aldoxila que irá adquirir o número 1.
3º - Começar o nome indicando a ramificação ou ramificações.
Exemplo:
Aldeídos de cadeias cíclicas
Amidas
As amidas são compostos orgânicos, ou seja, possuem átomos de carbono em sua estrutura. Todas as amidas possuem
em sua fórmula geral, além de carbonos, o grupo carbonila (C=O) e o grupo amino (NH2), veja a estrutura:
O
║
─ C ─ NH2
Vamos então analisar as propriedades deste composto:
- Uma das propriedades químicas das amidas é a polaridade, elas são polares devido à presença do grupo C=O;
- Propriedades físicas: em condições ambientes podem ser encontradas no estado sólido ou líquido. No estado líquido
encontramos as amidas de fórmula estrutural menor, como a metanamida ou a formamida, esses dois compostos são
líquidos incolores. As amidas primárias e secundárias possuem ponto de fusão e ponto de ebulição mais elevados que
outras amidas de mesma massa molecular.
As amidas não ocorrem na natureza e por isso é preciso prepará-las em laboratório, o processo se baseia no
aquecimento de sais de amônio e seguido de desidratação, veja a equação:
R- COONH4 → R – COONH2 + H2O
As amidas são empregadas em sínteses orgânicas e representam compostos importantes como náilon. O náilon é uma
poliamida que se destaca entre os polímeros.
Nomenclatura: prefixo + AMIDA.
Exemplo:
O
║
H3C ─ C ─ NH2
etanamida
Prefixo: etan + AMIDA.
Aminas
Aminas são produzidas na decomposição de peixes.
As aminas são consideradas bases orgânicas, elas são obtidas através da substituição de um ou mais hidrogênio
da amônia (NH3) por demais grupos orgânicos. Elas possuem em sua fórmula geral o elemento Nitrogênio.
As aminas podem se apresentar em condições ambientes na forma sólida, líquida ou gasosa, dependendo de sua
estrutura. Aminas alifáticas com até doze carbonos são líquidas, e as com mais de doze carbonos são sólidas, e todas
elas são incolores. As líquidas são tóxicas e apresentam cheiro desagradável, e as sólidas são inodoras.
Aminas podem ser produzidas na decomposição de peixes (trimetilamina), e na decomposição das proteínas de
organismos humanos putrefatos (cadáveres) são formadas a putrescina e cadaverina, essas são diaminas alifáticas
saturadas. Alguns compostos extraídos de vegetais, tais como os alcalóides contêm amina em sua fórmula.
Em muitas sínteses orgânicas são utilizadas aminas, como por exemplo, na vulcanização da borracha, na
preparação de corantes, na fabricação de sabões, na produção de medicamentos, etc
Veja como pode ser feito o processo de caracterização de aminas:
As aminas primárias, secundárias e terciárias se comportam de modos distintos frente à reação com ácido
nitroso, sendo assim, essas reações podem ser usadas para distingui-las.
No frasco que contém a amina, adicione o ácido nitroso e observe o resultado:
Amina terciária: quando não há reação alguma entre os componentes.
Amina secundária: se houver formação de um precipitado de coloração amarela.
Amina primária: há a liberação de gás nitrogênio durante a reação.
A Anilina também é denominada de fenilamina, e pode ser considerada como um dos compostos aromáticos mais
simples. É um composto orgânico que em seu estado puro, se apresenta como um líquido oleoso incolor, com um odor
característico, tornando-se castanho em contato com o ar. É pouco solúvel em água e solúvel em álcool e éter.
A Anilina é uma substância muito venenosa, ocorre no alcatrão mineral, sendo utilizada na indústria da borracha e
na síntese de fármacos e corantes. Esses corantes possuem cores intensas, um exemplo é o azul-de-metileno que é
usado no coramento de células para serem vistas ao microscópio. A Anilina é também usada na produção de sais de
diazônio e de medicamentos, possui fórmula C6H5NH2 :
Anilina
A anilina pertence à classe orgânica das amidas e foi descoberta em 1826 por Otto Unverdorben (1806-1873) e foi
inicialmente preparada a partir da destilação seca do anil ou do índigo.
Corante azul de metileno destaca células para observação.
As aminas são compostos orgânicos que possuem em sua fórmula geral o elemento Nitrogênio, existe uma
variedade de substâncias pertencentes a essa classe orgânica, como por exemplo: Fenilamina, Anfetamina, Cafeína e
Cocaína. Veja onde são encontradas tais substâncias e para que são empregadas.
A Fenilamina pertence à classe de compostos orgânicos das aminas. As características físicas deste composto
são: líquido oleoso, incolor e com cheiro característico. As fenilaminas são pouco solúveis em água, mas em álcool e éter
apresentam solubilidade. Onde se encontra e qual a aplicação desta amina? É encontrada no alcatrão da hulha e é
aplicada na produção de corantes. As fenilaminas possuem esta propriedade em razão da capacidade de oxidação, que
origina colorações intensas.
Exemplo: o azul de metileno é um corante usado para corar células animais para observação. Esta técnica é
utilizada nos laboratórios de biologia para facilitar o processo de estudo de répteis ao microscópio. A fenilamina ainda é
usada para produzir medicamentos e sais de diazônio.
As Anfetaminas são as aminas estimulantes, veja as propriedades dessa substância quando entram em
contato com nosso organismo:
Eleva o ânimo em razão do aumento da atividade do sistema nervoso;
Proporciona uma diminuição da sensação de fadiga;
Reduz o apetite.
A Cafeína está presente em bebidas como o café, o pó de guaraná e alguns refrigerantes, possui em sua
estrutura o grupo amino, essa substância estimulante é muito usada no dia-a-dia de várias pessoas, inclusive pode causar
dependência quando usada em grandes quantidades.
A cocaína é uma amina que é considerada droga em face do grande poder estimulante. Essa substância provoca o
aumento da atividade motora, causa euforia e loquacidade, mas é seguida de intensa depressão e dependência. É muito
perigosa e pode levar à morte por overdose do indivíduo que a usa.
Cetonas
Acetona: usada para extrair óleo de soja.
Cetonas são substâncias orgânicas onde o grupo funcional carbonila se encontra ligado a dois átomos de carbono. Uma
cetona bastante conhecida é a Propanona. Cuja estrutura é a seguinte:
O
║
H3C ─ C ─ CH3
Esse composto é conhecido popularmente como Acetona, e se apresenta como um líquido de odor irritante e se dissolve
tanto em água como em solventes orgânicos. Essa característica permite sua utilização como solvente de tintas, vernizes
e esmaltes. Na indústria alimentícia, possui uma importante utilização: extração de óleos e gorduras de sementes de
plantas. Essas plantas são em geral a soja, girassol e amendoim.
As cetonas podem ser encontradas até em nossos organismos, em pequena quantidade, fazendo parte dos corpos
cetônicos na corrente sanguínea.
As cetonas mostram o grupo carbonila (C = O), sendo esse carbono secundário. O sufixo -ona é usado para indicar a
função:
A numeração da cadeia deve começar depois da extremidade mais próxima do grupo C = O.
A denominação das cetonas ramificadas e/ou insaturadas segue as regras já vistas.
Existe uma nomenclatura usual em que o grupo >C = O é denominado cetona, e seus ligamentos são considerados grupos
orgânicos.
Cetonas dão aroma às pipocas.
A Cetona mais conhecida é a Propanona (dimetil-cetona ou acetona comum). Essa forma mais simples de cetona é também
a mais popular, uma vez que se faz presente nos salões de beleza (usada como solvente de esmaltes).
Fórmula estrutural da Acetona.
Para um composto se classificar como Cetona, ele precisa possuir o grupo funcional carbonila
átomos de carbono.
(C= O) ligado a dois
Fórmula geral das cetonas: C3H6O. Os compostos orgânicos pertencentes a essa classe são miscíveis com água e por
isso têm várias aplicações.
Molécula representativa das Cetonas:
As acetonas (propanonas) ficaram reconhecidas como substâncias tóxicas, uma vez que sua comercialização é fiscalizada
pelo Departamento de Entorpecentes da Polícia Federal. Mas outras cetonas são usadas até em alimentos. Sabe aquele
cheirinho de queijo das pipocas de micro-ondas? A substância responsável pelo agradável aroma nada mais é do que uma
cetona, de fórmula molecular C4H6O2, e conhecida como Butanodiona. As cetonas são usadas também para extração de
óleo em sementes de soja, girassol, amendoim.
Ésteres
A cera de abelha é um éster.
Os Ésteres são compostos orgânicos que apresentam fórmula geral R − COO − R1, são caracterizados pelo grupo
funcional:
O
║
−C−O−
R e R1 são radicais orgânicos, veja o exemplo:
O
║
H3C − C − O − CH3
Etanoato de metila ou
acetato de metila
Os ésteres, nas condições ambientes, se apresentam como líquidos ou sólidos, dependendo da quantidade de carbono. Os
primeiros membros da série, os que apresentam baixa massa molecular, são líquidos incolores, de cheiro agradável. No
entanto, à medida que se aumenta a massa molecular, vão se tornando líquidos xaroposos, viscosos e gordurosos, até se
tornarem sólidos (aspecto de cera), daí ocorre a perda de cheiro agradável. São compostos insolúveis em água, porém são
solúveis em álcool, éter e clorofórmio. Como não apresentam pontes de hidrogênio, os ésteres têm ponto de ebulição
menor que o dos álcoois e ácidos de mesma massa molecular.
Os ésteres são utilizados na preparação de extratos artificiais que imitam o odor e o gosto de frutas, por isso são usados
na fabricação de xaropes, doces, pastilhas, refrescos, etc. Os ésteres ocorrem naturalmente na natureza na forma de
essências de frutas, nos óleos e gorduras (glicéridos), nas ceras e nos fosfátides (lecitina do ovo e cefalina do cérebro).
Vejamos para que são utilizadas cada uma dessas formas:
Essências: são usadas para imitar o sabor e o aroma de algumas frutas, são também chamadas de flavorizantes ou
aromatizantes e muito usadas em indústria de alimentos para dar cheiro e sabor aos produtos. Exemplo: o flavorizante
acetato de pentila é um ingrediente do grupo dos ésteres, e é usado para dar sabor artificial de banana em alimentos.
Óleos e gorduras: são os ésteres mais usados em nosso dia-a-dia, são encontrados em produtos como óleo de soja,
margarina e azeite de oliva.
Ceras: usadas na fabricação de graxas para sapatos, cera para dar brilho a pisos, papel manteiga, velas, etc. A cera de
abelha e a cera de carnaúba também fazem parte da classe de ésteres.
Alguns ésteres são usados como medicamentos, os de cadeia carbônica mais longa e que existem nos óleos e gorduras
são aproveitados na produção de sabões.
Éteres são compostos orgânicos caracterizados pela presença de um átomo de oxigênio (O) ligado a dois radicais
monovalentes alquila, ou seja, hidrocarbonetos (grupos orgânicos).
Exemplo:
H3C ─ O ─ CH3
éter metílico ou
metóxi-metano
Éter
Os éteres são compostos incolores, de cheiro agradável e pouco solúvel em água, em condições ambientes podem
se apresentar na fase sólida, líquida ou gasosa. Os de massa molecular mais elevada estão no estado sólido, os que
apresentam dois e três carbonos na molécula são gasosos e os seguintes são líquidos que são extremamente voláteis.
Éteres são usados como solventes de óleos, gorduras, resinas e na fabricação de seda artificial. Dentre as
variadas aplicações dos éteres se destaca sua utilização na medicina que é muito importante, sendo usado como
anestésico e na preparação de medicamentos.
O éter etílico (éter comum) pertence à classe de éteres, é um líquido incolor muito volátil (ferve a 35° C), produz
frio intenso ao evaporar em contato com a pele e seus vapores são três vezes mais pesados que o ar. Sua utilização é
feita em pacientes, é um poderoso anestésico inalatório porque relaxa os músculos, mas possui as desvantagens de
causar irritação no trato respiratório e a possibilidade de provocar explosões em ambientes fechados. Sendo assim, ele
está em desuso, apesar de ter sido usado durante quase um século.
O éter etílico dissolve graxas, óleos e resinas, por isso é usado na indústria como solvente de óleos e tintas.
A nomenclatura oficial para os Éteres segue uma regra fixa estabelecida pela União Internacional de Química
Pura e Aplicada (IUPAC). Observe o funcionamento das normas:
1. Inicie o nome dos éteres pelo prefixo de menor número de carbonos, conforme abaixo:
Prefixos:
1 carbono 2 carbonos 3 carbonos 4 carbonos 5 carbonos -
MET
ET
PROP
BUT
PENT
6 carbonos 7 carbonos 8 carbonos 9 carbonos 10 carbonos -
HEX
HEPT
OCT
NON
DEC
2. Use o termo intermediário: oxi.
3. Encerre pelo nome do hidrocarboneto com maior número de carbonos.
Exemplos:
H3C ─ CH2 ─ O ─ CH3
Metoxi-etano
Repare que a nomenclatura começou com o prefixo de menor número de carbonos.
Os éteres podem ser caracterizados pela presença do átomo de oxigênio ligado a dois grupos orgânicos, o éter
etílico faz parte desta classe de compostos e possui outras denominações como: éter sulfúrico, éter dietílico ou
etoxietano. Fórmula molecular C4H10O e fórmula estrutural CH3CH2-O-CH2CH3. É um líquido incolor, de cheiro
característico que foi descoberto por Valerius Cordus, no século XVI. Este cientista realizava experimentos e ao
submeter o álcool etílico à ação do ácido sulfúrico, percebeu o aparecimento da nova substância. Veja o processo de
obtenção usado até nos dias atuais:
- aquecimento da mistura de álcool etílico com ácido sulfúrico até 140ºC, essa mistura é concentrada na proporção de 5:9,
ou seja, a concentração de ácido sulfúrico na mistura é bem maior que de álcool etílico, daí o porquê da denominação de
éter
sulfúrico.
O éter etílico possui como propriedade característica a extrema volatilidade. A periculosidade do éter etílico é explicada
por seus vapores, estes são mais densos que o ar e se o recipiente que o contém estiver aberto, os vapores se acumulam
em pisos e mesas, e a aproximação de uma chama, por exemplo, gera uma explosão. Os produtos da combustão de éter
etílico são água e gás carbônico.
A indústria utiliza éter etílico como solvente de resinas e óleos, como também no preparo de pólvora e seda artificial. Na
medicina esse composto é usado como anestésico local, mas possui desvantagens de afetar a pressão arterial e irritar o
trato respiratório, além do risco de provocar incêndios.
A comercialização de éter é fiscalizada, esse composto é usado para sintetizar a cocaína e também, como já foi dito,
apresenta riscos de utilização.
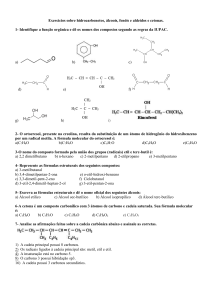
Ácidos Carboxílicos
Os ácidos carboxílicos são compostos que apresentam o grupo carboxila – COOH. O grupo carboxila, geralmente está nas
extremidades da cadeia. Podendo estar ligada a radicais auila (R), arila (Ar) e H.
A denominação começa com a palavra ácido e sufixo óico.
Principais ácidos carboxílicos
- Ácido metanoico - conhecido como ácido fórmico. Está presente nas formigas, em um líquido incolor, de cheiro irritante.
-Ácido etanóico – é um ácido importante na produção de polímeros e nas essências artificiais. É um líquido incolor, tem
sabor azedo. Esse ácido é um dos principais componentes do vinagre que é usado como tempero nas alimentações.
-Ácido benzóico – é um líquido usado na medicina, é branco, transparente e solúvel em água.
Fenóis
Os fenóis ou benzenóis são compostos orgânicos que apresentam o grupo hidroxila (O – H) ligado de forma direta a um
carbono do núcleo benzênico. Exemplo:
Fenol
O grupo OH também é denominado Hidróxi, por isso os fenóis são chamados de Hidroxibenzenos, e devido à capacidade
de reagirem com bases, recebem a denominação de ácidos fênicos.
O fenol é extraído da natureza, do alcatrão da hulha. Os compostos fenólicos são pouco solúveis em água, sólidos,
incolores, apresentam caráter ácido e são tóxicos. Essa característica ácida é devido à presença do hidrogênio na
hidroxila, o grupo se desprende por ionização quando entra em contato com a água, e torna a solução mais ácida.
Os fenóis são muito usados na indústria, na fabricação de perfumes, resinas, vernizes, tintas, adesivos, cosméticos,
corantes e explosivos. Eles possuem ação bactericida devido ao mecanismo de coagularem proteínas de microorganismos
como as bactérias e fungos. Nas fazendas, usa-se uma mistura dos fenóis orto, meta e paracresol para a desinfecção do
local de ordenha das vacas, para não haver contaminação do leite. Essa mistura de fenóis é conhecida popularmente como
Creolina.
Esta propriedade bactericida e fungicida dos fenóis foi descoberta por volta de 1870. Nesta época era comercializado
como anti-séptico na forma de solução aquosa, e foi fundamental para diminuir o número de mortes causadas por infecção
pós-operatória.
Mas o uso do fenol para assepsia foi proibido após a descoberta que este composto causa queimaduras quando em
contato com a pele, por ser corrosivo, e ainda é venenoso quando ingerido por via oral.
Fórmula molecular do THC.
O THC (tetra-hidro-canabinol) pertence à classe orgânica de fenóis, esta substância está presente em uma
droga muito conhecida pelos brasileiros e que causa grandes problemas para a sociedade. A droga marijuana, mais
conhecida como maconha, possui em sua estrutura molecular o grupo THC. O THC leva aproximadamente 8 dias para ser
eliminado do organismo, sendo possível verificar a presença através do exame de sangue. Como se vê, essa substância é
mais forte do que o álcool, uma vez que os níveis de álcool desaparecem do organismo por algumas horas, o THC leva,
como já foi dito, mais de uma semana.
Sendo assim, quanto maior a freqüência de consumo da maconha, maior será a taxa de concentração de THC no sangue,
principalmente em intervalos menores que oito dias.
Veja algumas aplicações benéficas de THC na medicina:
- Em pessoas com câncer que estão em tratamento através de radiação, o THC produz a propriedade de diminuir os
sintomas de vômito e amenizar o quadro.
- Pacientes com glaucoma evitam a cegueira através do THC, que diminui a pressão do globo ocular evitando a perda da
visão.
É claro que para esses casos a administração de THC é controlada, e corresponde a períodos curtos de uso.
Efeitos negativos do THC. Os sintomas causados no corpo por essa substância química variam, vejam alguns deles:
- Os usuários da substância sentem distorções visuais e auditivas, sentem desânimo a ponto de abandonar o trabalho, os
estudos, o próprio lar e até hábitos de higiene pessoal.
- Estudos realizados relatam que o THC pode diminuir o desejo sexual, causa ansiedade intensa e distúrbios psicológicos.