Química Orgânica
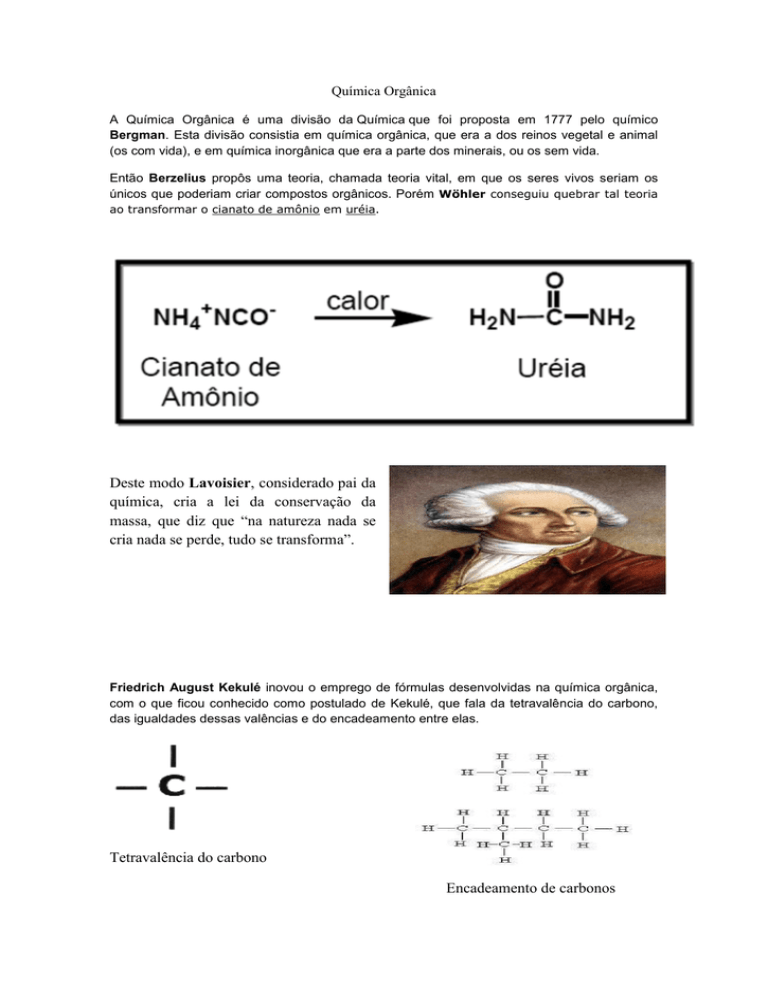
A Química Orgânica é uma divisão da Química que foi proposta em 1777 pelo químico
Bergman. Esta divisão consistia em química orgânica, que era a dos reinos vegetal e animal
(os com vida), e em química inorgânica que era a parte dos minerais, ou os sem vida.
Então Berzelius propôs uma teoria, chamada teoria vital, em que os seres vivos seriam os
únicos que poderiam criar compostos orgânicos. Porém Wöhler conseguiu quebrar tal teoria
ao transformar o cianato de amônio em uréia.
Deste modo Lavoisier, considerado pai da
química, cria a lei da conservação da
massa, que diz que “na natureza nada se
cria nada se perde, tudo se transforma”.
Friedrich August Kekulé inovou o emprego de fórmulas desenvolvidas na química orgânica,
com o que ficou conhecido como postulado de Kekulé, que fala da tetravalência do carbono,
das igualdades dessas valências e do encadeamento entre elas.
Tetravalência do carbono
Encadeamento de carbonos
Depois da quebra da teoria vital, a definição de compostos orgânicos e inorgânicos ficou
da seguinte forma:
Compostos orgânicos: quando apresentam necessariamente carbono e hidrogênio em
sua composição.
Exemplos: CH4, C2HSO4, C12H22O11.
Compostos inorgânicos: compostos que não apresentam carbono.
Exemplos: H2O, H2SO4, NaCl.
Compostos de transição: compostos que apresentam carbono e Geralmente não
apresentam hidrogênio.
Exemplos: CO2, CaCO3, CaC2.
Exceções
NH4CNO – inorgânico
H2CO3 - inorgânico
HCN – transição
HNC – transição
Dentro da química orgânica existem muitas funções orgânicas, em que os compostos
possuem semelhança química e física, as mais comuns são:
Hidrocarbonetos
Álcool
Haletos
Enol
Fenol
Éter
Éster
Cetona
Aldeído
Aminas
Amidas
Nitrilas
Nitrocomposto
Ácidos carboxílicos
As razões para que haja muitos compostos orgânicos são:
A capacidade do carbono de formar ligações covalentes com ele mesmo. São solventes
dos compostos orgânicos: o éter e o álcool, por exemplo.
O raio atômico relativamente pequeno do Carbono em relação aos outros elementos da
família 4A.
Sua eletronegatividade não é muito forte, podendo reagir sem precisar de grandes somas
de energia.
Elemento muito abundante.
Diego Souza
Publicado em: Educagenius
Link: http://educagenius.blogspot.com/