ESCOLA BÁSICA 2 3 / S DA GUIA
FÍSICA e QUÍMICA A
Ficha de síntese
10º ANO
Assunto: Modelo Quântico
Evolução do modelo atómico:
Modelo Quântico
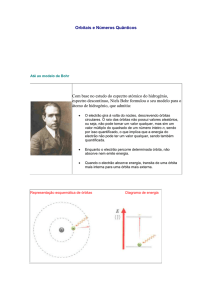
No modelo atómico de Bohr eram admitidas órbitas para os electrões, ou seja, de acordo
com esse modelo seria possível conhecer, simultaneamente e com exactidão, a posição e
a energia do electrão. Ora, é impossível determinar, simultaneamente e com exactidão, a
posição e a energia de um electrão (Principio da incerteza de Heisenberg). O modelo
atómico actual é um modelo matemático (o comportamento do electrão é descrito por
uma equação matemática) em que se abandonou o conceito de órbita e se passou a falar
em orbital.
Orbital – representa uma região do espaço atómico onde há uma grande
probabilidade de encontrar um electrão.
1
Segundo a Mecânica Quântica, um electrão só pode assumir determinados valores de
energia no átomo, aos quais corresponde um número quântico principal, n, que está
relacionado com a energia do electrão e com o tamanho da orbital.
A cada nível de energia corresponde um ou mais subníveis de energia. Estes
identificam-se pelo número quântico secundário, , também designado número
quântico azimutal ou de momento angular. Este número pode assumir valores entre 0
e n-1 e indica a forma da orbital.
Assim, para = 0, 1, 2, 3... correspondem orbitais do tipo s, p, d, f... respectivamente.
As orbitais s são esféricas e as orbitais p são lobulares
A orientação espacial de uma orbital é dada pelo número quântico magnético, m,
que assume valores inteiros compreendidos entre – e +.
Os quadros seguintes sintetizam algumas informações sobres estes três números
quânticos e sobre o que eles nos podem fornecer:
2
Para caracterizar uma orbital, necessitamos de três números quânticos:
n,e m.
Para caracterizar um electrão, é necessário um quarto número quântico – número
quântico de spin, ms. Este está relacionado com o movimento de rotação do electrão,
podendo assumir apenas dois valores:
ms = + 1/2
e
ms = -1/2
Para caracterizar um electrão são, portanto, necessários quatro números
quânticos:
n,, me ms.
3
A distribuição dos electrões pelas diferentes orbitais tem de satisfazer:
O Princípio da energia mínima.
Primeiro é ocupada a orbital de menor energia, só depois é ocupada a orbital de
energia superior, e assim sucessivamente.
O Princípio da exclusão de Pauli
Não podem existir dois electrões num átomo com o mesmo conjunto de números
quânticos
A Regra de Hund.
Quando preenchemos orbitais da mesma energia devemos fazer primeiro o
semipreenchimento de cada uma, mantendo os electrões com o mesmo spin, e só depois
proceder ao emparelhamento de sins.
O quadro seguinte permite visualizar a distribuição electrónica em vários elementos:
4
5