Aula: 09
Temática: Metais Alcalinos
Estamos iniciando um nova unidade e iremos conhecer, nesta aula,
os metais alcalinos. Boa aula!
METAIS
Ocorrência, Estrutura e Métodos de Obtenção, Aplicações e Propriedades
Metais Alcalinos
Os Alcalinos são os elementos do Grupo 1 (1A) da Tabela Periódica. Constitui
uma família ou uma série química formada pelos seguintes metais: lítio (Li),
sódio (Na), potássio (K) , rubídio (Rb), césio (Cs) e frâncio (Fr).
Possui este nome, porque reage muito facilmente com a água e, quando isso
ocorre, formam-se hidróxidos (substâncias básicas ou alcalinas) que libertam
hidrogênio. Estes metais também reagem facilmente com o oxigênio
produzindo óxidos.
Equação química da reação de um metal alcalino (exemplo: lítio) com a água:
2Li(s) + 2H2O(l) → 2LiOH(aq) + H2(g)
Equação química da reação de um metal alcalino (exemplo: potássio)
com o oxigênio:
4K(s) + O2(g) →
2K2O(s)
São de baixa densidade, coloridos, moles, altamente eletropositivos e reativos.
A eletropositividade e a reatividade destes elementos tende a crescer no grupo
de cima para baixo. Apresentam um único elétron nos seus níveis de energia
mais externos (em subnível s),no qual tende a perder esse elétron e
transformá-lo em íons monopositivos: M+. Em temperatura ambiente, todos os
QUÍMICA INORGÂNICA
metais do grupo 1 adotam a estrutura cúbica de corpo centrado com número de
coordenação 8. Contudo, em temperaturas baixas, o lítio forma uma estrutura
hexagonal de empacotamento compacto com número de coordenação 12.
O hidrogênio, com um único elétron, está situado normalmente na tabela
periódica no mesmo grupo dos metais alcalinos (ainda que às vezes apareça
separado destes em outra posição), porém, a energia necessária para retirar o
elétron do hidrogênio é muito mais elevada do que a qualquer alcalino. Como
nos halogênios, o hidrogênio necessita receber um único elétron para
completar o seu nível mais externo. Na sua forma elementar, é encontrado
como uma molécula diatômica, H2. Pode formar sais denominados hidretos
com os alcalinos de forma que o metal cede um elétron ao hidrogênio, como se
o hidrogênio fosse um halogênio. Devido à peculiaridade do hidrogênio preferese não classificá-lo em nenhuma série química.
Apesar de sua grande semelhança química, os elementos alcalinos não
ocorrem juntos, principalmente por causa dos diferentes tamanhos de seus
íons. Os metais desse grupo são reativos demais para serem encontrados
livres na natureza. Todavia, seus compostos estão entre os mais estáveis ao
calor. A obtenção desses metais por reações de deslocamento seria
impraticável em solução aquosa. Os metais alcalinos são os agentes redutores
mais fortes conhecidos, razão pela qual não é possível obtê-los por redução de
seus óxidos. A eletrólise de soluções aquosa de seus compostos também não
seria bem sucedida, exceto, se cátodos de mercúrio forem utilizados. Nesse
caso, obtêm-se amálgamas, mas a obtenção dos metais puros a partir das
mesmas é difícil.
Os metais alcalinos podem ser obtidos por eletrólise de um sal fundido,
geralmente, dos haletos fundidos. Geralmente, impurezas são adicionadas
para abaixar o ponto de fusão. O lítio é o trigésimo quinto elemento mais
abundante, em peso, e é obtido principalmente a partir de minerais do grupo
dos
silicatos,
como
o
espodumênio
LiAl(SiO3)2
Li2Al2(SiO3)3(FOH)2.
QUÍMICA INORGÂNICA
e
a
lepidolita
O sódio e o potássio são o sétimo e oitavo elementos mais abundantes da
crosta terrestre, em peso, respectivamente. NaCl e KCl ocorrem em grande
quantidade na água do mar . A principal fonte de sódio é o sal-gema (NaCl).
Outros saís, que incluem NaCl, Na2B4O7.10H2O (bórax), Na2CO3 (soda),
NaHCO3.2H2O, NaNO3 (salitre) e Na2SO4 (mirabilita), são obtidos a partir de
depósitos formados pela evaporação das águas de antigos mares, com o Mar
Morto e o Grande Lago Salgado em Utah, EUA. O cloreto de sódio é
extremamente importante, e é usado em maiores quantidades do que qualquer
outro composto. O potássio ocorre principalmente como depósitos de KCl
(silvita), de uma mistura de KCl e NaCl (silvinita), e do sal duplo
KCl.MgCl2.6H2O (carnalita). Sais solúveis de potássio são denominados
coletivamente de “potassa”. O rubídio não possui nenhuma fonte para sua
obtenção de modo conveniente e há somente uma para o césio. Esses
elementos são obtidos como subprodutos do processamento do lítio.
Os elementos mais pesados que o
83
Bi (bismuto) são radioativos. Sendo
assim, o frâncio (número atômico 87) é radioativo, e, como este tem um
período de meia-vida de 21 minutos, ele não ocorre em quantidade apreciável
na natureza.
Todo o frâncio existente nos primórdios da evolução da Terra já estará
desintegrado e aquele produzido agora a partir do actínio terá uma existência
transitória. Os metais alcalinos podem ser obtidos a partir de eletrólise de uma
mistura fundida de 40% de NaCl e 60% de CaCl2 numa célula de Downs. Uma
célula semelhante pode ser usada para obter potássio a partir de KCl fundido.
No entanto, a célula deverá ser operada a temperaturas mais elevadas, porque
o ponto de fusão do KCl é mais elevado e isto provoca vaporização do potássio
liberado. O método moderno de obtenção do potássio consiste na redão de KCl
fundido com vapor de sódio a 850°C numa torre de fracionamento:
Na + KCl → NaCl + K
O Rubídio e Césio são produzidos de maneira semelhante e reduzem seus
cloretos com Ca a 750°C, sob pressão reduzida.
QUÍMICA INORGÂNICA
O lítio está no composto chamado estereato de lítio C17H35COOLi, que é usado
na fabricação de graxas lubrificantes para automóveis. Já o carbonato de lítio
Li2CO3 é adicionado à bauxita na produção eletrolítica de alumínio para reduzir
o ponto de fusão. O carbonato de lítio é também usado para endurecer o vidro.
O lítio pode também ser utilizado na medicina , pois afeta o equilíbrio entre Na+
e K+ e entre Mg2+ e Ca2+ no organismo. O metal lítio é usado na fabricação de
ligas, por exemplo, uma liga com chumbo para mancais de "metal branco" em
motores e máquinas ou uma liga com alumínio para a fabricação de peças
leves, resistentes na indústria aeronáutica e uma liga com magnésio para
fabricar chapas blindadas.
Substâncias que contêm sódio possuem variadas utilizações como segue:
NaOH - hidróxido de sódio (conhecida como soda cáustica) é usada na
indústria, sendo empregada numa grande variedade de finalidades, que inclui a
fabricação de vários outros compostos inorgânicos e orgânicos: na produção
de papel, em neutralizações e na obtenção de alumina, sabões e também na
fabricação de vidro, fosfatos, silicatos, produtos de limpeza e também como
agente que remove o SO2 dos gases poluentes de usinas termelétricas
alimentadas a carvão.
Na2CO3 - carbonato de sódio - é utilizado em grandes quantidades no lugar de
NaOH em muitas aplicações, como a fabricação de papel, sabão e
detergentes.
Na2SO4 - o sulfato de sódio é empregado na indústria de papel, detergente e
vidro.
NaOCl - hipoclorito de sódio é usado como agente alvejante e como
desinfetante.
NaHCO3 - bicarbonato de sódio é usado em fermentos químicos.
Na - sódio metálico é empregado numa liga de Na/Pb (sódio/chumbo) usada
QUÍMICA INORGÂNICA
para
fabricar
chumbo
tetraetila
e
chumbo
tetrametila.
São
agentes
antidetonantes nos combustíveis para automóveis (há uma crescente
diminuição do uso destes compostos com a introdução de gasolina isente de
chumbo). O sódio metálico líquido é refrigerante em um tipo de reator nuclear.
É usado para transferir calor do reator às turbinas em que é obtido o vapor
usado para gerar eletricidade. Pequenas quantidades de sódio metálico são
empregadas também em síntese orgânica e para secar solventes orgânicos.
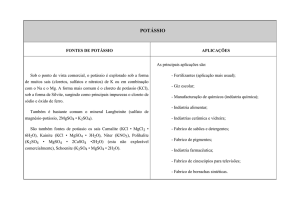
O potássio é um elemento essencial à vida. Cerca de 95% dos compostos de
potássio são usados como fertilizantes para plantas. KCl, K2SO4, KNO3 cloreto de potássio, sulfato de potássio e nitrato de potássio são utilizados
como fertilizantes.
KNO3 - nitrato de potássio é utilizado também em explosivos. KOH - hidróxido
de potássio usado na fabricação de fosfatos de potássio e de sabões moles
como o estearato de potássio, ambos constituintes de detergentes líquidos.
KMnO4 - permanganato de potássio é usado na fabricação de sacarina, como
agente oxidante e em titulações.
K2CO3 - carbonato de potássio usado em cerâmica, tubos de TV em cores e
lâmpadas fluorescentes. KO2 - superóxido de potássio é empregado em
aparelhos de respiração e em submarinos. KBr - brometo de potássio usado
em fotografia.
K – potássio metálico só se produz em pequenas quantidades, principalmente
para fabricar KO2.
O rubídio tem poucas aplicações, resume-se praticamente à utilização
do metal em tubos de vácuo e células fotoelétricas. O carbonato de rubídio
utiliza-se, por vezes, na indústria do vidro. É, no entanto, objeto de investigação
intensa, no que se refere ao seu potencial uso como meio de transmissão de
calor em veículos espaciais (usado como fontes de íons em foguetes
espaciais), como combustível em motores de propulsão iônica, como eletrólito
em baterias alcalinas para baixas temperaturas etc. Alguns compostos de
QUÍMICA INORGÂNICA
rubídio são utilizados na preparação de soporíferos, sedativos e no tratamento
de epilepsia.
O Césio apresenta forte efeito fotoelétrico, parcialmente por causa de
sua energia de ionização muito baixa, e por isso é aplicado em fotocelas de
fotocondutividade. Cada uma dessas celas contém um par de eletrodos em
cargas opostas e um bulbo ou cela evacuado. O eletrodo negativo é pintado
com césio ou uma liga de césio e emite elétrons para a região entre os
eletrodos, quando é atingido pela luz. Esses elétrons completam o circuito e
permite a passagem de corrente por meio de um circuito externo. Essa corrente
pode ser aproveitada para abrir portas, tocar campainhas e etc.
Quantidades de metais dos grupos I e II são necessárias nos organismos vivos
principalmente
para
equilibrar
as
cargas
elétricas
associadas
com
macromoléculas orgânicas de carga negativa existentes na célula, e também
para conservar a pressão osmótica dentro da célula, mantê-la dilatada e
impedindo o seu colapso.
A diferença de concentração entre íons, sódio e potássio dentro e fora da
célula produz um potencial elétrico através da membrana celular, essencial
para o funcionamento de células nervosas e musculares. A entrada de glicose
na célula está associada ao íon sódio. Eles penetram juntos na célula. Isso é
favorecido por uma grande variação de concentração. Os íons sódio que
penetram na célula desse modo serão expulsos. O movimento de aminoácidos
é semelhante. Íons de potássio do interior da célula são essenciais para o
metabolismo da glicose, a síntese de proteínas e a ativação de algumas
enzimas.
Conhecemos um grupo extenso e bastante interessante. Na próxima
aula continuaremos com os metais. Não esqueça de entrar em contado com o
nosso ambiente virtual de aprendizagem.
QUÍMICA INORGÂNICA